第五章 微专题一 SO2的制备 SO2、CO2的鉴别与除杂(共19张PPT)
文档属性
| 名称 | 第五章 微专题一 SO2的制备 SO2、CO2的鉴别与除杂(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-10 17:19:40 | ||
图片预览





文档简介
(共19张PPT)
第五章
微专题一 SO2的制备 SO2、CO2
的鉴别与除杂
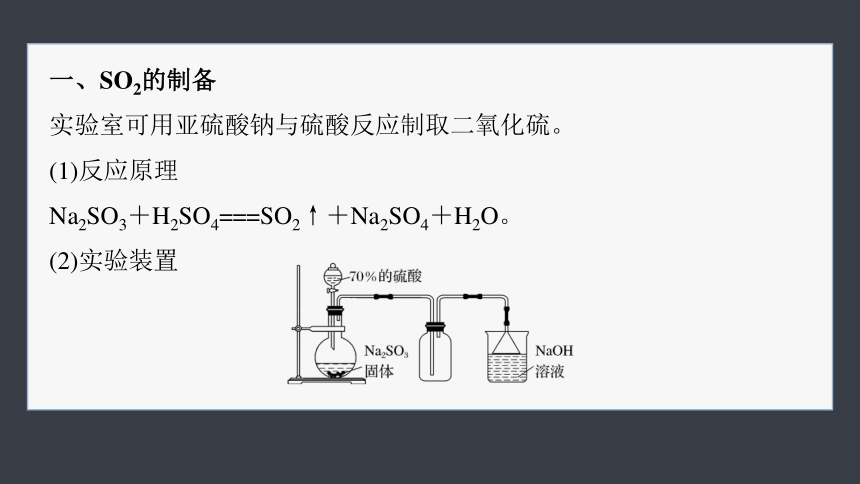
一、SO2的制备
实验室可用亚硫酸钠与硫酸反应制取二氧化硫。
(1)反应原理
Na2SO3+H2SO4===SO2↑+Na2SO4+H2O。
(2)实验装置
(3)注意:①硫酸的浓度不宜过大也不宜过小。
②用NaOH溶液吸收尾气时应防倒吸。
二、SO2和CO2的鉴别与除杂
1.SO2与CO2的鉴别
(1)单一气体的鉴别
SO2和CO2都能使澄清石灰水变浑浊,继续通入过量的气体,沉淀都会消失,故不能用Ca(OH)2鉴别。
可以用以下方法鉴别:
①SO2的漂白性:使品红溶液褪色的是SO2,不褪色的是CO2。
②SO2的氧化性:通入H2S溶液变浑浊的是SO2,无明显现象的是CO2。
③SO2的还原性:通入酸性KMnO4溶液或溴水等有色氧化性物质中,使溶液褪色的是SO2,不褪色的是CO2。
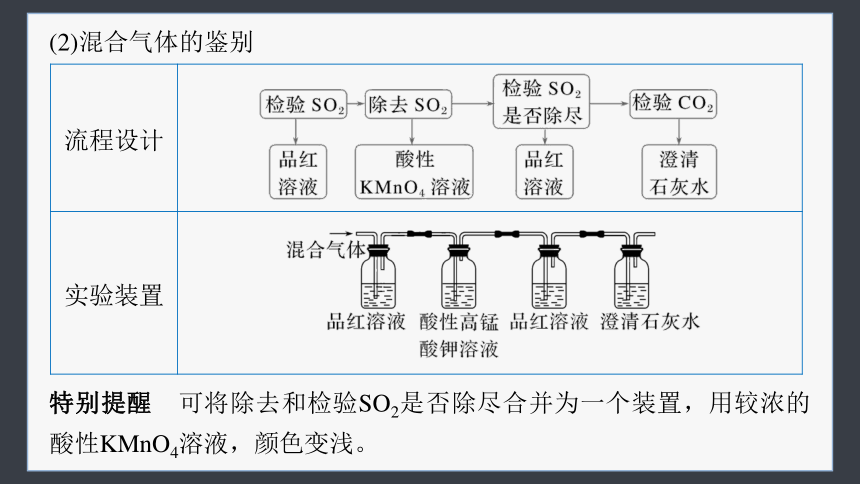
(2)混合气体的鉴别
流程设计
实验装置
特别提醒 可将除去和检验SO2是否除尽合并为一个装置,用较浓的酸性KMnO4溶液,颜色变浅。
2.除去CO2中SO2的两种方法
(1)利用二氧化硫的还原性,用酸性高锰酸钾溶液、氯水、溴水等除去。
(2)利用亚硫酸的酸性比碳酸强,用饱和碳酸氢钠溶液除去。
1
2
3
4
5
1.(2023·四川广安二中高一期中)下列溶液中,能够区分CO2和SO2气体的是
①澄清石灰水溶液 ②氢硫酸 ③酸性高锰酸钾溶液 ④氯水
⑤品红溶液
A.①②④ B.②③④
C.除①外 D.全部
√
跟踪训练
1
2
3
4
5
跟踪训练
①SO2和CO2均能与石灰水反应生成白色沉淀,则澄清石灰水不能鉴别SO2和CO2;
②二氧化硫与氢硫酸反应生成单质硫和水,二氧化碳与氢硫酸不反应,可以鉴别;
③因二氧化硫与高锰酸钾溶液发生氧化还原反应,观察到溶液褪色,而二氧化碳与高锰酸钾溶液不反应,则能鉴别;
④因二氧化硫与氯水发生氧化还原反应,氯水褪色,而二氧化碳与氯水不反应,则能鉴别;
⑤因二氧化硫具有漂白性,能使品红褪色,而二氧化碳不能,则能鉴别。
1
3
4
5
2.除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是
A.饱和食盐水 B.氢氧化钠溶液
C.足量澄清石灰水 D.饱和碳酸氢钠溶液
√
2
跟踪训练
二氧化碳和二氧化硫都能与氢氧化钠溶液、澄清石灰水反应,都不能与饱和食盐水反应。因为亚硫酸的酸性强于碳酸,可用饱和碳酸氢钠溶液除去二氧化碳中的二氧化硫气体。
3.吸烟有害健康,因为香烟烟雾中含有CO、CO2、SO2、H2O等气体,用①无水硫酸铜、②澄清石灰水、③红热氧化铜、④碱石灰、⑤品红溶液、⑥足量酸性高锰酸钾溶液等可将其一一检出,检出的正确顺序是
A.混合气→①→⑤→②→①→④→③
B.混合气→③→④→②→⑥→⑤→①
C.混合气→①→⑤→⑥→②→④→③
D.混合气→②→⑤→①→④→③→⑥
1
3
4
5
√
2
跟踪训练
1
3
4
5
2
跟踪训练
利用红热氧化铜检验CO,利用品红溶液检验SO2,利用澄清石灰水检验CO2,利用无水硫酸铜检验H2O(g),利用高锰酸钾除去多余的SO2,考虑排除干扰因素,正确的操作顺序为检验H2O(g)→检验SO2→除去多余SO2→检验CO2→干燥气体→检验CO。
4.(2023·河南商丘高一期末)某化学兴趣小组制取SO2并探究SO2与FeCl3溶液的反应,所用装置如图所示。下列说法错误的是
A.甲中浓硫酸浓度不宜过大,以防止氧化亚硫酸钠
B.乙中反应的氧化剂与还原剂物质的量之比为2∶1
C.甲中发生的反应为复分解反应
D.丙装置的作用是吸收剩余的SO2,防止污染空气
1
3
4
5
√
2
跟踪训练
1
3
4
5
2
跟踪训练
浓硫酸不能氧化亚硫酸钠,A项错误;
SO2+2Fe3++2H2O=== +2Fe2++4H+,反应中二氧化硫为还原剂,铁离子为氧化剂,氧化剂与还原剂的物质的量之比为2∶1,B项正确;
二氧化硫污染空气,可用NaOH溶液吸收以避免污染环境,D项正确。
1
3
4
5
5.现有混有少量SO2杂质的CO2气体,请选用适当的实验装置,收集纯净干燥的CO2气体。
(1)要达到实验目的,按气流从左到右,各接口连接顺序正确的是____ (填字母,下同)。
A.dcabh B.efabg C.feabg
2
跟踪训练
B
1
3
4
5
(2)本实验除去SO2的原理是利用SO2的___。
A.氧化性 B.漂白性
C.还原性 D.酸性
(3)SO2与酸性高锰酸钾溶液反应的离子方程式是_____________________
______________________。
2
跟踪训练
C
根据题中所给装置,应将混有少量SO2杂质的CO2气体通过酸性高锰酸钾溶液除去二氧化硫,然后用浓硫酸干燥,最后用向上排空气法收集干燥的二氧化碳。
1
3
4
5
2
跟踪训练
SO2虽有漂白性,但并不是所有与SO2有关的褪色都是因为SO2的漂白性。如①SO2能使滴有酚酞的NaOH溶液褪色是因为SO2能与碱发生反应;②SO2能使溴水或酸性KMnO4溶液褪色是因为SO2的还原性。
易错警示
本课结束
第五章
微专题一 SO2的制备 SO2、CO2
的鉴别与除杂
一、SO2的制备
实验室可用亚硫酸钠与硫酸反应制取二氧化硫。
(1)反应原理
Na2SO3+H2SO4===SO2↑+Na2SO4+H2O。
(2)实验装置
(3)注意:①硫酸的浓度不宜过大也不宜过小。
②用NaOH溶液吸收尾气时应防倒吸。
二、SO2和CO2的鉴别与除杂
1.SO2与CO2的鉴别
(1)单一气体的鉴别
SO2和CO2都能使澄清石灰水变浑浊,继续通入过量的气体,沉淀都会消失,故不能用Ca(OH)2鉴别。
可以用以下方法鉴别:
①SO2的漂白性:使品红溶液褪色的是SO2,不褪色的是CO2。
②SO2的氧化性:通入H2S溶液变浑浊的是SO2,无明显现象的是CO2。
③SO2的还原性:通入酸性KMnO4溶液或溴水等有色氧化性物质中,使溶液褪色的是SO2,不褪色的是CO2。
(2)混合气体的鉴别
流程设计
实验装置
特别提醒 可将除去和检验SO2是否除尽合并为一个装置,用较浓的酸性KMnO4溶液,颜色变浅。
2.除去CO2中SO2的两种方法
(1)利用二氧化硫的还原性,用酸性高锰酸钾溶液、氯水、溴水等除去。
(2)利用亚硫酸的酸性比碳酸强,用饱和碳酸氢钠溶液除去。
1
2
3
4
5
1.(2023·四川广安二中高一期中)下列溶液中,能够区分CO2和SO2气体的是
①澄清石灰水溶液 ②氢硫酸 ③酸性高锰酸钾溶液 ④氯水
⑤品红溶液
A.①②④ B.②③④
C.除①外 D.全部
√
跟踪训练
1
2
3
4
5
跟踪训练
①SO2和CO2均能与石灰水反应生成白色沉淀,则澄清石灰水不能鉴别SO2和CO2;
②二氧化硫与氢硫酸反应生成单质硫和水,二氧化碳与氢硫酸不反应,可以鉴别;
③因二氧化硫与高锰酸钾溶液发生氧化还原反应,观察到溶液褪色,而二氧化碳与高锰酸钾溶液不反应,则能鉴别;
④因二氧化硫与氯水发生氧化还原反应,氯水褪色,而二氧化碳与氯水不反应,则能鉴别;
⑤因二氧化硫具有漂白性,能使品红褪色,而二氧化碳不能,则能鉴别。
1
3
4
5
2.除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是
A.饱和食盐水 B.氢氧化钠溶液
C.足量澄清石灰水 D.饱和碳酸氢钠溶液
√
2
跟踪训练
二氧化碳和二氧化硫都能与氢氧化钠溶液、澄清石灰水反应,都不能与饱和食盐水反应。因为亚硫酸的酸性强于碳酸,可用饱和碳酸氢钠溶液除去二氧化碳中的二氧化硫气体。
3.吸烟有害健康,因为香烟烟雾中含有CO、CO2、SO2、H2O等气体,用①无水硫酸铜、②澄清石灰水、③红热氧化铜、④碱石灰、⑤品红溶液、⑥足量酸性高锰酸钾溶液等可将其一一检出,检出的正确顺序是
A.混合气→①→⑤→②→①→④→③
B.混合气→③→④→②→⑥→⑤→①
C.混合气→①→⑤→⑥→②→④→③
D.混合气→②→⑤→①→④→③→⑥
1
3
4
5
√
2
跟踪训练
1
3
4
5
2
跟踪训练
利用红热氧化铜检验CO,利用品红溶液检验SO2,利用澄清石灰水检验CO2,利用无水硫酸铜检验H2O(g),利用高锰酸钾除去多余的SO2,考虑排除干扰因素,正确的操作顺序为检验H2O(g)→检验SO2→除去多余SO2→检验CO2→干燥气体→检验CO。
4.(2023·河南商丘高一期末)某化学兴趣小组制取SO2并探究SO2与FeCl3溶液的反应,所用装置如图所示。下列说法错误的是
A.甲中浓硫酸浓度不宜过大,以防止氧化亚硫酸钠
B.乙中反应的氧化剂与还原剂物质的量之比为2∶1
C.甲中发生的反应为复分解反应
D.丙装置的作用是吸收剩余的SO2,防止污染空气
1
3
4
5
√
2
跟踪训练
1
3
4
5
2
跟踪训练
浓硫酸不能氧化亚硫酸钠,A项错误;
SO2+2Fe3++2H2O=== +2Fe2++4H+,反应中二氧化硫为还原剂,铁离子为氧化剂,氧化剂与还原剂的物质的量之比为2∶1,B项正确;
二氧化硫污染空气,可用NaOH溶液吸收以避免污染环境,D项正确。
1
3
4
5
5.现有混有少量SO2杂质的CO2气体,请选用适当的实验装置,收集纯净干燥的CO2气体。
(1)要达到实验目的,按气流从左到右,各接口连接顺序正确的是____ (填字母,下同)。
A.dcabh B.efabg C.feabg
2
跟踪训练
B
1
3
4
5
(2)本实验除去SO2的原理是利用SO2的___。
A.氧化性 B.漂白性
C.还原性 D.酸性
(3)SO2与酸性高锰酸钾溶液反应的离子方程式是_____________________
______________________。
2
跟踪训练
C
根据题中所给装置,应将混有少量SO2杂质的CO2气体通过酸性高锰酸钾溶液除去二氧化硫,然后用浓硫酸干燥,最后用向上排空气法收集干燥的二氧化碳。
1
3
4
5
2
跟踪训练
SO2虽有漂白性,但并不是所有与SO2有关的褪色都是因为SO2的漂白性。如①SO2能使滴有酚酞的NaOH溶液褪色是因为SO2能与碱发生反应;②SO2能使溴水或酸性KMnO4溶液褪色是因为SO2的还原性。
易错警示
本课结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
