河南省洛阳市2023-2024学年高二上学期期末考试化学试卷(含答案)
文档属性
| 名称 | 河南省洛阳市2023-2024学年高二上学期期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 945.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-12 11:03:49 | ||
图片预览



文档简介
洛阳市2023——2024学年第一学期期末考试
高二化学试卷
本试卷共8页,共100分,考试时间为75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、考号填写在答题卡上。
2.考试结束,将答题卡交回。
本试卷可能用到的相对原子质量:H:1 N:14 O:16
一、选择题(本题共15小题,每小题只有一个选项符合题意,每小题3分,共45分)
1.化学与生产生活密切相关,下列叙述中错误的是
A.铅酸蓄电池正极板上覆盖有,负极板上覆盖有Pb
B.纯铁制作的铁锅比生铁制作的铁锅更容易生锈
C.判断电池的优劣主要看这种电池的比能量或比功率,以及电池可储存时间的长短
D.在铁器表面镀铜时,铁器要与电源负极相连
2.乙烯是一种重要的化工原料,下列关于乙烯分子结构的表述中,错误的是
A.乙烯分子是平面结构 B.碳原子的杂化方式为杂化
C.分子中有4个键1个键 D.碳碳双键的键能小于二倍的碳碳单键的键能
3.下列说法中正确的是
A.不同元素原子的电子发生跃迁时会吸收或释放不同的光
B.的核外电子排布式为:
C.基态Na原子核外电子所占据的最高能级是3p
D.基态的价电子轨道表示式:
4.下列对有关原子或分子性质的叙述中,错误的是
A.N、O、F的电负性依次增大
B.溶剂和溶质之间的氢键作用力越大,溶解性越好
C.的VSEPR模型为平面三角形
D.、的空间结构相似
5.用如图所示装置电解硫酸铜溶液,下列表述中错误的是
A.c极发生氧化反应
B.若两极均为惰性电极,d极电极反应式为:
C.溶液中阳离子往d极移动
D.若c极电极材料为Cu,电解开始后,溶液中浓度持续减小
6.下列说法中错误的是
A.增大反应物浓度,可增大单位体积内活化分子数目,从而使单位时间内有效碰撞次数增多
B.改变条件,电离平衡正向移动,电离常数不一定增大
C.HCl和中共价键的电子云图形分别是轴对称和镜面对称
D.与的空间结构不相同
7.2023年10月8日第19届亚运会在杭州圆满闭幕,本届亚运会秉持“绿色、智能、节俭、文明”的办会理念,首次使用废碳再生的绿色甲醇作为主火炬塔燃料。下列说法中正确的是
A.甲醇中O-H是键
B.甲醇分子中的碳原子为手性碳原子
C.甲醇的沸点高于乙醇
D.用轨道表示式表示甲醇中C原子的杂化:
8.金属钛具有良好的耐高低温、抗酸碱、高强度和低密度等优良特性,广泛应用于航空航天、医疗等领域。是工业上制备金属钛的重要原料,它的一种制备方法为 。下列说法中错误的是
A.该反应在任何温度下都可以自发进行
B.恒温恒容条件下,混合气体的密度保持不变能说明该反应达到平衡状态
C.该反应在工业生产中的适宜条件是低温、低压
D.恒温恒容条件下,向平衡体系中再加入少量,的体积分数将减小
9.利用活性石墨电极电解饱和食盐水,进行如图所示实验,M为直流电源。闭合,一段时间后b处出现了蓝色,下列说法正确的是
A.a处布条褪色,说明具有漂白性
B.c处应该使用浸有浓NaOH溶液的棉花
C.U型管右侧电势高于左侧电势
D.一段时间后断开,立刻闭合,电流表不发生偏转
10.根据下列实验操作及现象,能得出相关结论的是
实验操作及现象 实验结论
A 向盛有1mL的溶液的试管中加入1mLKI浓溶液,振荡,层溶液紫色变浅 (无色)
B 向溶液中加入5mL1mol/L溶液,产生白色沉淀和气体 与发生双水解
C 相同pH的HCl溶液和溶液分别与NaOH溶液中和时,消耗NaOH的物质的量大 酸性:
D 在10mL0.1mol/L的溶液中依次滴入几滴0.1mol/LNaCl溶液和0.1mol/LKI溶液。溶液先产生白色沉淀,后又产生黄色沉淀
11.雄黄(,)与雌黄(,)是古代重要的药物和染料,二者可发生如图转化:雄黄(三元弱酸)雄黄。下列说法错误的是
A.1mol雄黄中含有极性共价键的数目为
B.基态As原子最高能级有3个未成对电子
C.溶液中的离子浓度存在如下关系:
D.雄黄和雌黄分子中各原子最外层均满足8电子稳定结构
12.前四周期元素W、X、Y、Z的原子序数依次增大,且互相不同周期不同族。其中W是宇宙中含量最多的元素;X元素基态原子最高能级的不同轨道都有电子,并且自旋方向相同;Y元素基态原子最外层电子数等于其能层数;Z元素基态原子核外未成对电子数同周期最多。下列说法正确的是
A.W和X形成的共价化合物,其分子的空间结构一定为三角锥形
B.基态X原子核外电子有7种空间运动状态
C.基态原子中未成对电子数WD.Z形成的两种含氧酸根在溶液中存在着化学平衡
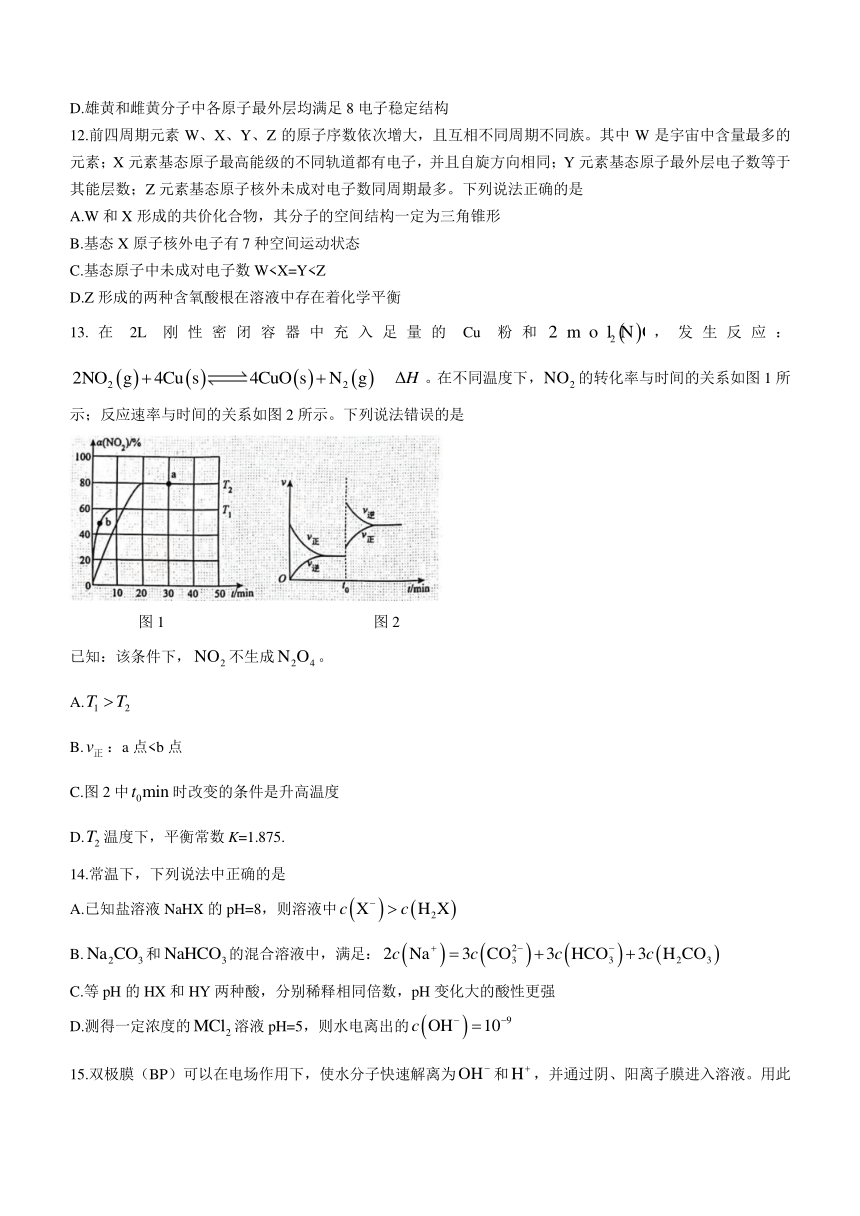
13.在2L刚性密闭容器中充入足量的Cu粉和,发生反应: 。在不同温度下,的转化率与时间的关系如图1所示;反应速率与时间的关系如图2所示。下列说法错误的是
图1 图2
已知:该条件下,不生成。
A.
B.:a点C.图2中时改变的条件是升高温度
D.温度下,平衡常数K=1.875.
14.常温下,下列说法中正确的是
A.已知盐溶液NaHX的pH=8,则溶液中
B.和的混合溶液中,满足:
C.等pH的HX和HY两种酸,分别稀释相同倍数,pH变化大的酸性更强
D.测得一定浓度的溶液pH=5,则水电离出的
15.双极膜(BP)可以在电场作用下,使水分子快速解离为和,并通过阴、阳离子膜进入溶液。用此工艺捕获烟道气中的过程如图所示,已知盐室中生成实现捕获。下列说法中正确的是
A.电路中每转移2mol电子,双极膜上共有2mol水发生解离
B.交换膜A、C均为阴离子交换膜
C.溶液中的X为
D.随着电解的进行,酸室中pH增大
二、非选择题(本小题包括4小题,共55分)
16.(14分)己二腈是制造“尼龙-66”(聚己二酰己二胺)的原料,工业需求量大,其制备工艺很多,发展前景较好的是利用丙烯腈电合成己二腈。如图是用甲醇燃料电池作为电源电合成己二腈的示意图,所有电极均为惰性电极。
回答下列问题:
(1)电极b为_______极(填“正”或“负”);A口通入的是_______,a电极的电极反应式为_______。
(2)乙池中离子交换膜为_______离子交换膜(填“阴”或“阳”),随着反应的进行,电极c附近溶液pH_______(填“变大”、“变小”或“不变”),电路中每转移阳极室溶液质量减少_______g(不考虑气体溶解)。
(3)当B口通入11.2L气体时(标准状况下),甲池中有_______mol通过质子交换膜,理论上乙池能合成己二腈_______mol。
17.(14分)四钼酸铵是钼深加工的重要中间产品。一种以钼精矿(主要含),还有Cu、Fe的化合物及等)为原料制备四钼酸铵同时得到副产品绿矾的流程如下:
回答下列问题:
(1)钼元素位于第五周期,与铬同族,则其价电子排布式为_______。
(2)焙烧渣中的在“碱浸”时转化为,反应的离子方程式为_______。
(3)“净化”时加入溶液,是为了除去残留的和。研究表明,该溶液中和pH的关系为:,若控制溶液的pH=3.9,此时溶液中的浓度为_______(已知FeS的)。
(4)“沉淀”时生成的离子方程式为_______。
(5)从溶液到晶体的“一系列操作”为_______、_______、过滤、洗涤、干燥。
(6)该流程中产生的工业废气和可以回收利用,实验原理如图。装置a中溶液的作用是_______,装置b电解过程的阴极反应式为_______。
18.(13分)雾霾主要成分为灰尘、、、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
Ⅰ.以氨为脱硝剂时,可将还原为,副产物为。
(1)已知:①
②
写出氨与NO(g)脱硝反应的热化学反应方程式:_______。
(2)分子中心原子的杂化方式是_______,其中氮原子和氢原子的价电子排布图分别为_______、_______(填标号)。
a.b.c.d.
(3)可与形成,中H-O-H键角比中的_______(填“大”或“小”),原因为_______。
Ⅱ.臭氧也是理想的烟气脱硝剂,其脱硝反应之一为 。某温度时,在固定体积为1L的刚性密闭容器中充入和发生反应,25min达到平衡时的浓度为0.5mol/L。
(4)该温度下,0~25分钟的平均反应速率为_______。
(5)下列说法正确的是_______(填标号)。
a.25min后,充入氦气,平衡转化率增大
b.25min时,的平衡转化率为25%
c.0,是含有极性键的极性分子
d.再充入和,达到新平衡时,混合气体的平均相对分子质量增大
(6)已知:通常状况下呈无色柱状晶体,它由两种离子构成,其中阴离子为,则阳离子的空间结构为_______。
19.(14分)铜是人类发现最早并广泛使用的一种金属,、和等铜盐在生产、生活和科研中应用广泛,回答下列问题:
(1)Cu原子位于元素周期表的_______区,此区元素的价电子层结构特点是_______。
(2)S、O、N三种元素的第一电离能由大到小为_______。
(3)的中心原子杂化类型是_______,的空间结构为_______。
(4)已知在的催化下,可与反应得到。酸性:_______(填“>”或“<”),原因为____________________________。
(5)同学们对的性质进行了探究,已知:
现取20.00mL一定浓度的溶液,向其中加入足量的KI溶液,得到含有碘元素的沉淀,且反应后所得溶液加入淀粉呈蓝色,则发生反应的离子方程式为_______,再用标准溶液滴定至溶液蓝色褪去,消耗溶液25.00mL,则该溶液的浓度为_______mol/L。
洛阳市2023——2024学年第一学期期末考试
高二化学参考答案
一、选择题(本题共10小题,每小题只有一个选项符合题意,每小题3分,共45分)
1-5.BCACD 6-10.CDCBA 11-15.CDDCB
二、非选择题(本小题包括4小题,共55分)
16.(除标注外,每空2分,共14分)
(1)正(1分)
(2)阳(1分) 变小 9
(3)2 1
17.(除标注外,每空2分,共14分)
(1)
(2)
(3)
(4)
(5)蒸发浓缩(1分) 冷却结晶(1分)
(6)吸收废气中的,将其转化为
18.(除标注外,每空2分,共13分)
(1)
(2)(1分) b(1分) c(1分)
(3)大(1分) 孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力,的中心原子上的孤电子对数为1,的中心原子上的孤电子对数为2
(4)
(5)cd
(6)直线形(1分)
19.(除标注外,每空2分,共14分)
(1)ds(1分)价层电子排布通式为(或次外层d轨道全充满,最外层电子数不超过2)
(2)N>O>S
(3)(1分) 平面三角形(1分)
(4)>(1分) 氯原子电负性大,吸电子能力强,羟基极性增大,酸性增强
(5)
高二化学试卷
本试卷共8页,共100分,考试时间为75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、考号填写在答题卡上。
2.考试结束,将答题卡交回。
本试卷可能用到的相对原子质量:H:1 N:14 O:16
一、选择题(本题共15小题,每小题只有一个选项符合题意,每小题3分,共45分)
1.化学与生产生活密切相关,下列叙述中错误的是
A.铅酸蓄电池正极板上覆盖有,负极板上覆盖有Pb
B.纯铁制作的铁锅比生铁制作的铁锅更容易生锈
C.判断电池的优劣主要看这种电池的比能量或比功率,以及电池可储存时间的长短
D.在铁器表面镀铜时,铁器要与电源负极相连
2.乙烯是一种重要的化工原料,下列关于乙烯分子结构的表述中,错误的是
A.乙烯分子是平面结构 B.碳原子的杂化方式为杂化
C.分子中有4个键1个键 D.碳碳双键的键能小于二倍的碳碳单键的键能
3.下列说法中正确的是
A.不同元素原子的电子发生跃迁时会吸收或释放不同的光
B.的核外电子排布式为:
C.基态Na原子核外电子所占据的最高能级是3p
D.基态的价电子轨道表示式:
4.下列对有关原子或分子性质的叙述中,错误的是
A.N、O、F的电负性依次增大
B.溶剂和溶质之间的氢键作用力越大,溶解性越好
C.的VSEPR模型为平面三角形
D.、的空间结构相似
5.用如图所示装置电解硫酸铜溶液,下列表述中错误的是
A.c极发生氧化反应
B.若两极均为惰性电极,d极电极反应式为:
C.溶液中阳离子往d极移动
D.若c极电极材料为Cu,电解开始后,溶液中浓度持续减小
6.下列说法中错误的是
A.增大反应物浓度,可增大单位体积内活化分子数目,从而使单位时间内有效碰撞次数增多
B.改变条件,电离平衡正向移动,电离常数不一定增大
C.HCl和中共价键的电子云图形分别是轴对称和镜面对称
D.与的空间结构不相同
7.2023年10月8日第19届亚运会在杭州圆满闭幕,本届亚运会秉持“绿色、智能、节俭、文明”的办会理念,首次使用废碳再生的绿色甲醇作为主火炬塔燃料。下列说法中正确的是
A.甲醇中O-H是键
B.甲醇分子中的碳原子为手性碳原子
C.甲醇的沸点高于乙醇
D.用轨道表示式表示甲醇中C原子的杂化:
8.金属钛具有良好的耐高低温、抗酸碱、高强度和低密度等优良特性,广泛应用于航空航天、医疗等领域。是工业上制备金属钛的重要原料,它的一种制备方法为 。下列说法中错误的是
A.该反应在任何温度下都可以自发进行
B.恒温恒容条件下,混合气体的密度保持不变能说明该反应达到平衡状态
C.该反应在工业生产中的适宜条件是低温、低压
D.恒温恒容条件下,向平衡体系中再加入少量,的体积分数将减小
9.利用活性石墨电极电解饱和食盐水,进行如图所示实验,M为直流电源。闭合,一段时间后b处出现了蓝色,下列说法正确的是
A.a处布条褪色,说明具有漂白性
B.c处应该使用浸有浓NaOH溶液的棉花
C.U型管右侧电势高于左侧电势
D.一段时间后断开,立刻闭合,电流表不发生偏转
10.根据下列实验操作及现象,能得出相关结论的是
实验操作及现象 实验结论
A 向盛有1mL的溶液的试管中加入1mLKI浓溶液,振荡,层溶液紫色变浅 (无色)
B 向溶液中加入5mL1mol/L溶液,产生白色沉淀和气体 与发生双水解
C 相同pH的HCl溶液和溶液分别与NaOH溶液中和时,消耗NaOH的物质的量大 酸性:
D 在10mL0.1mol/L的溶液中依次滴入几滴0.1mol/LNaCl溶液和0.1mol/LKI溶液。溶液先产生白色沉淀,后又产生黄色沉淀
11.雄黄(,)与雌黄(,)是古代重要的药物和染料,二者可发生如图转化:雄黄(三元弱酸)雄黄。下列说法错误的是
A.1mol雄黄中含有极性共价键的数目为
B.基态As原子最高能级有3个未成对电子
C.溶液中的离子浓度存在如下关系:
D.雄黄和雌黄分子中各原子最外层均满足8电子稳定结构
12.前四周期元素W、X、Y、Z的原子序数依次增大,且互相不同周期不同族。其中W是宇宙中含量最多的元素;X元素基态原子最高能级的不同轨道都有电子,并且自旋方向相同;Y元素基态原子最外层电子数等于其能层数;Z元素基态原子核外未成对电子数同周期最多。下列说法正确的是
A.W和X形成的共价化合物,其分子的空间结构一定为三角锥形
B.基态X原子核外电子有7种空间运动状态
C.基态原子中未成对电子数W
13.在2L刚性密闭容器中充入足量的Cu粉和,发生反应: 。在不同温度下,的转化率与时间的关系如图1所示;反应速率与时间的关系如图2所示。下列说法错误的是
图1 图2
已知:该条件下,不生成。
A.
B.:a点
D.温度下,平衡常数K=1.875.
14.常温下,下列说法中正确的是
A.已知盐溶液NaHX的pH=8,则溶液中
B.和的混合溶液中,满足:
C.等pH的HX和HY两种酸,分别稀释相同倍数,pH变化大的酸性更强
D.测得一定浓度的溶液pH=5,则水电离出的
15.双极膜(BP)可以在电场作用下,使水分子快速解离为和,并通过阴、阳离子膜进入溶液。用此工艺捕获烟道气中的过程如图所示,已知盐室中生成实现捕获。下列说法中正确的是
A.电路中每转移2mol电子,双极膜上共有2mol水发生解离
B.交换膜A、C均为阴离子交换膜
C.溶液中的X为
D.随着电解的进行,酸室中pH增大
二、非选择题(本小题包括4小题,共55分)
16.(14分)己二腈是制造“尼龙-66”(聚己二酰己二胺)的原料,工业需求量大,其制备工艺很多,发展前景较好的是利用丙烯腈电合成己二腈。如图是用甲醇燃料电池作为电源电合成己二腈的示意图,所有电极均为惰性电极。
回答下列问题:
(1)电极b为_______极(填“正”或“负”);A口通入的是_______,a电极的电极反应式为_______。
(2)乙池中离子交换膜为_______离子交换膜(填“阴”或“阳”),随着反应的进行,电极c附近溶液pH_______(填“变大”、“变小”或“不变”),电路中每转移阳极室溶液质量减少_______g(不考虑气体溶解)。
(3)当B口通入11.2L气体时(标准状况下),甲池中有_______mol通过质子交换膜,理论上乙池能合成己二腈_______mol。
17.(14分)四钼酸铵是钼深加工的重要中间产品。一种以钼精矿(主要含),还有Cu、Fe的化合物及等)为原料制备四钼酸铵同时得到副产品绿矾的流程如下:
回答下列问题:
(1)钼元素位于第五周期,与铬同族,则其价电子排布式为_______。
(2)焙烧渣中的在“碱浸”时转化为,反应的离子方程式为_______。
(3)“净化”时加入溶液,是为了除去残留的和。研究表明,该溶液中和pH的关系为:,若控制溶液的pH=3.9,此时溶液中的浓度为_______(已知FeS的)。
(4)“沉淀”时生成的离子方程式为_______。
(5)从溶液到晶体的“一系列操作”为_______、_______、过滤、洗涤、干燥。
(6)该流程中产生的工业废气和可以回收利用,实验原理如图。装置a中溶液的作用是_______,装置b电解过程的阴极反应式为_______。
18.(13分)雾霾主要成分为灰尘、、、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
Ⅰ.以氨为脱硝剂时,可将还原为,副产物为。
(1)已知:①
②
写出氨与NO(g)脱硝反应的热化学反应方程式:_______。
(2)分子中心原子的杂化方式是_______,其中氮原子和氢原子的价电子排布图分别为_______、_______(填标号)。
a.b.c.d.
(3)可与形成,中H-O-H键角比中的_______(填“大”或“小”),原因为_______。
Ⅱ.臭氧也是理想的烟气脱硝剂,其脱硝反应之一为 。某温度时,在固定体积为1L的刚性密闭容器中充入和发生反应,25min达到平衡时的浓度为0.5mol/L。
(4)该温度下,0~25分钟的平均反应速率为_______。
(5)下列说法正确的是_______(填标号)。
a.25min后,充入氦气,平衡转化率增大
b.25min时,的平衡转化率为25%
c.0,是含有极性键的极性分子
d.再充入和,达到新平衡时,混合气体的平均相对分子质量增大
(6)已知:通常状况下呈无色柱状晶体,它由两种离子构成,其中阴离子为,则阳离子的空间结构为_______。
19.(14分)铜是人类发现最早并广泛使用的一种金属,、和等铜盐在生产、生活和科研中应用广泛,回答下列问题:
(1)Cu原子位于元素周期表的_______区,此区元素的价电子层结构特点是_______。
(2)S、O、N三种元素的第一电离能由大到小为_______。
(3)的中心原子杂化类型是_______,的空间结构为_______。
(4)已知在的催化下,可与反应得到。酸性:_______(填“>”或“<”),原因为____________________________。
(5)同学们对的性质进行了探究,已知:
现取20.00mL一定浓度的溶液,向其中加入足量的KI溶液,得到含有碘元素的沉淀,且反应后所得溶液加入淀粉呈蓝色,则发生反应的离子方程式为_______,再用标准溶液滴定至溶液蓝色褪去,消耗溶液25.00mL,则该溶液的浓度为_______mol/L。
洛阳市2023——2024学年第一学期期末考试
高二化学参考答案
一、选择题(本题共10小题,每小题只有一个选项符合题意,每小题3分,共45分)
1-5.BCACD 6-10.CDCBA 11-15.CDDCB
二、非选择题(本小题包括4小题,共55分)
16.(除标注外,每空2分,共14分)
(1)正(1分)
(2)阳(1分) 变小 9
(3)2 1
17.(除标注外,每空2分,共14分)
(1)
(2)
(3)
(4)
(5)蒸发浓缩(1分) 冷却结晶(1分)
(6)吸收废气中的,将其转化为
18.(除标注外,每空2分,共13分)
(1)
(2)(1分) b(1分) c(1分)
(3)大(1分) 孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力,的中心原子上的孤电子对数为1,的中心原子上的孤电子对数为2
(4)
(5)cd
(6)直线形(1分)
19.(除标注外,每空2分,共14分)
(1)ds(1分)价层电子排布通式为(或次外层d轨道全充满,最外层电子数不超过2)
(2)N>O>S
(3)(1分) 平面三角形(1分)
(4)>(1分) 氯原子电负性大,吸电子能力强,羟基极性增大,酸性增强
(5)
同课章节目录
