第六章 第二节 第1课时 化学反应的速率(共76张PPT)
文档属性
| 名称 | 第六章 第二节 第1课时 化学反应的速率(共76张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-12 19:02:11 | ||
图片预览









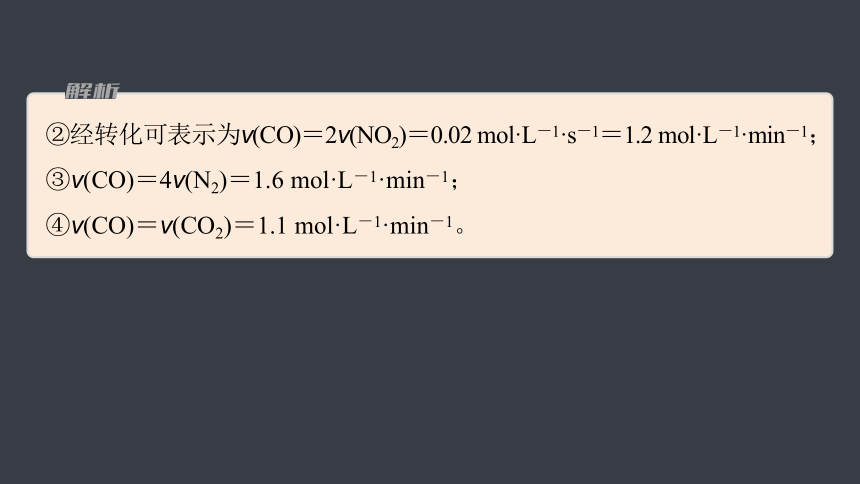
文档简介
(共76张PPT)
第1课时 化学反应的速率
第六章 第二节
1.了解化学反应速率的概念和表示方法,并能进行简单计算。
2.理解影响化学反应速率的因素及规律,并能合理解释生产、生活中的相关化
学现象。
3.学会运用变量控制研究影响化学反应速率的方法。
核心素养
发展目标
内容索引
一、化学反应速率及其表示方法
二、影响化学反应速率的因素
随堂演练 知识落实
课时对点练
化学反应速率及其表示方法
一
化学反应速率
化学反应过程进行快慢程度
反应物浓度
生成物浓度
mol·L-1·s-1
mol·L-1·min-1
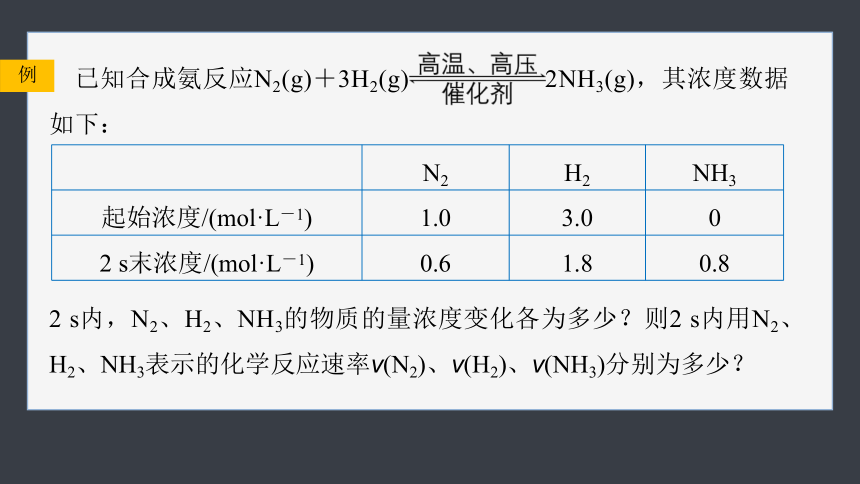
已知合成氨反应N2(g)+3H2(g) 2NH3(g),其浓度数据如下:
例
N2 H2 NH3
起始浓度/(mol·L-1) 1.0 3.0 0
2 s末浓度/(mol·L-1) 0.6 1.8 0.8
2 s内,N2、H2、NH3的物质的量浓度变化各为多少?则2 s内用N2、H2、NH3表示的化学反应速率v(N2)、v(H2)、v(NH3)分别为多少?
提示 2 s内,Δc(N2)=(1.0-0.6) mol·L-1=0.4 mol·L-1,
Δc(H2)=(3.0-1.8) mol·L-1=1.2 mol·L-1,
Δc(NH3)=(0.8-0) mol·L-1=0.8 mol·L-1,
【思考】 根据上述计算,同一反应在相同时间内,用不同物质表示的反应速率,其数值是否相同?表示的反应快慢是否相同?用不同物质表示同一反应的反应速率其数值有什么规律?
提示 同一反应在相同时间内,用不同物质表示的反应速率,其数值可能不同,但都表示该反应的反应速率,意义相同;用不同物质表示化学反应速率时,化学反应速率之比等于其化学计量数之比。
1.判断正误
(1)对于任何化学反应来说,反应速率越大,反应现象就越明显
(2)对有固体参加的化学反应,可用单位时间内固体浓度的改变量表示化学反应速率
(3)化学反应速率的单位通常为mol·s-1或mol·min-1
(4)反应速率是指某反应在某时刻的瞬时速率
应用体验
×
×
×
×
2.已知反应4CO(g)+2NO2(g) N2(g)+4CO2(g)在不同条件下的化学反应速率如下:
①v(CO)=1.5 mol·L-1·min-1
②v(NO2)=0.01 mol·L-1·s-1
③v(N2)=0.4 mol·L-1·min-1
④v(CO2)=1.1 mol·L-1·min-1
请比较上述4种情况反应的快慢:___________(由大到小的顺序)。
应用体验
③①②④
②经转化可表示为v(CO)=2v(NO2)=0.02 mol·L-1·s-1=1.2 mol·L-1·min-1;
③v(CO)=4v(N2)=1.6 mol·L-1·min-1;
④v(CO)=v(CO2)=1.1 mol·L-1·min-1。
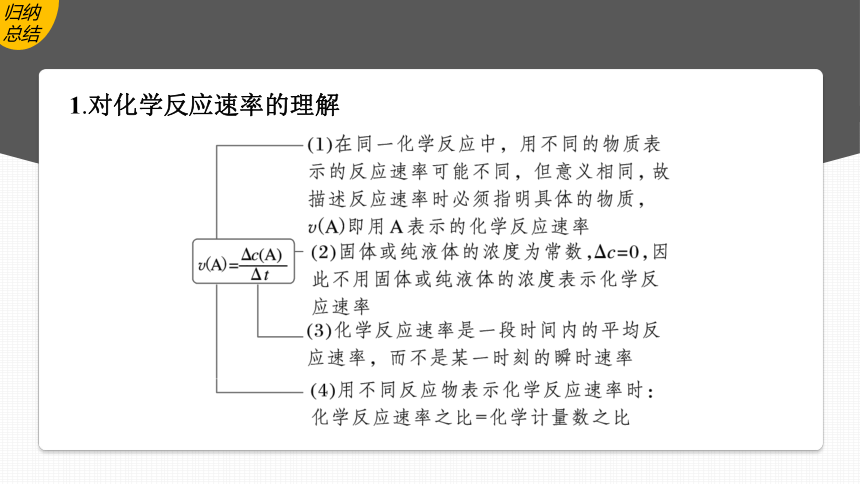
1.对化学反应速率的理解
归纳总结
2.化学反应速率大小的比较方法
(1)归一法:若单位不统一,则要换算成相同的单位;若为不同物质表示的反应速率,则要换算成同一物质来表示反应速率,再比较数值的大小。
归纳总结
返回
影响化学反应速率的因素
二
1.实验探究——外界条件对化学反应速率的影响
探究温度、浓度、催化剂对化学反应速率的影响
实验操作 实验现象 实验结论
①产生气泡 速率______ ②产生气泡速率______ 对于反应2H2O2 2H2O+O2↑来说,温度升高,H2O2的分解速率______
较慢
较快
加快
滴加1 mol·L-1盐酸的试管产生气泡速率_____ 增大反应物盐酸的浓度,生成CO2的速率______
①无明显现象 ②能产生________ MnO2可以使H2O2的分解速率______
更快
加快
大量气泡
加快
【思考1】 在 1 L密闭容器中充入一定量的N2和H2,在一定的温度和压强下反应生成氨气。当使容器的体积缩小时,化学反应的速率会发生如何变化?
提示 有气体参加的反应,增大压强,容器的体积缩小,浓度增大,化学反应速率加快。
2.影响化学反应速率的因素
(1)内因
反应物本身的性质是
影响化学反应速率的
主要因素。
(2)外因(变量控制法:
其他条件不变,只改
变一个条件)
增大
减小
增大
减小
增大
减小
改变
表面积
【思考2】 下列现象体现了哪些影响化学反应速率的因素?
(1)向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺。
鼓风:_____________;煤粉代替煤块:_____________________。
(2)把食品存放到冰箱内,糕点包装内放除氧剂可以延长食品保质期。
冰箱:_____;除氧剂:_________________。
(3)利用H2O2分解制氧气时加入固体MnO2 。
固体MnO2:_______。
(4)铁在空气中和在纯氧中反应的剧烈程度明显不同。
纯氧:___________________。
增大氧气浓度
增大反应物的接触面积
降温
降低反应物的浓度
催化剂
纯氧的氧气浓度更大
1.判断正误
(1)无论是吸热反应还是放热反应,温度升高,反应速率一定增大
(2)对一定条件下发生的反应:C(s)+O2(g)===CO2(g),增加C的量,化学反应速率加快
(3)改变压强,化学反应速率一定改变
(4)铁和硫酸反应时,硫酸浓度越大,产生H2的速率越大
(5)增加水的量,能使Mg与H2O的反应速率大于Na与H2O的反应速率
(6)Fe与盐酸反应时,加入NaCl固体,由于c(Cl-)增大而使反应速率加快
应用体验
×
×
×
√
×
×
应用体验
2.在带有活塞的密闭容器中发生如下反应:3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g),分析改变下列条件,化学反应速率如何改变(填“变大”“变小”或“不变”),阐述理由:
(1)增加铁片的质量(不考虑表面积的变化):_____,理由:__________
__________________________________________。
(2)保持容器的体积不变,增加水蒸气的通入量:_____,理由:_____
_____________________________。
不变
纯固体的
浓度视为常数,改变用量不影响化学反应速率
变大
增大
反应物浓度,化学反应速率变大
应用体验
(3)保持容器内压强不变,充入一定量的氩气:_____,理由:_______
_________________________________________________________________________。
(4)保持容器的容积不变,充入一定量的氩气:_____,理由:_______
_________________________________________________________________________。
变小
保持压
强不变,充入氩气,容器体积增大,水蒸气的浓度变小,因而化学反应速率变小
不变
容积不变,充入氩气,反应物和生成物的浓度均不改变,因而化学反应速率不变
容器的
对于有气体物质参加的反应,改变反应体系的压强,对化学反应速率的影响常有以下几种情况:
归纳总结
说明:“惰性气体”是指不参与反应的气体。
归纳总结
返回
随堂演练 知识落实
1.下列关于化学反应速率的说法中,不正确的是
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.在容积不变的反应容器中,化学反应速率通常用单位时间内反应物浓
度的减小或生成物浓度的增大来表示
C.若某化学反应在某段时间内的反应速率为0.5 mol·L-1·s-1,就是指在
该段时间内反应物和生成物的浓度变化量都为0.5 mol·L-1
D.化学反应速率是可以通过实验测定的
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
若某化学反应的反应速率为0.5 mol·L-1·s-1,是指用某一物质表示的平均反应速率,与其他物质的反应速率不一定相等,并且未告诉时间范围,无法计算浓度变化量,故C项错误。
2.为了探究温度对化学反应速率的影响,下列实验方案可行的是
√
随堂演练
1
2
3
4
随堂演练
没有对比实验,A错误;
催化剂不同,温度不同,无法比较,B错误;
前者没有催化剂,后者有催化剂,无法比较,C错误;
只有温度不同,其他条件都相同,该方案可行,D正确。
1
2
3
4
3.容积可变的密闭容器中加入WO3和H2进行反应:WO3(s)+3H2(g)
W(s)+3H2O(g),下列说法不正确的是
A.将容器的体积缩小一半,其反应速率增大
B.保持体积不变,充入氩气,其反应速率不变
C.保持压强不变,充入氖气,H2O(g)的生成速率增大
D.保持压强不变,充入氖气,H2O(g)的生成速率减小
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
将容器的体积缩小一半,导致压强增大,气体浓度增大,则反应速率增大,故A正确;
保持体积不变,充入氩气,参加反应气体的浓度不变,则其反应速率不变,故B正确;
保持压强不变,充入氖气,则容器体积增大,参加反应气体的浓度减小,H2O(g)的生成速率减小,故C错误、D正确。
4.(1)在反应A(g)+3B(g)===2C(g)中,若以物质A表示该反应的化学反应速率为0.2 mol·L-1·min-1,则以物质B表示此反应的化学反应速率为_____ mol·L-1·min-1。
随堂演练
1
2
3
4
0.6
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2的物质的量为1.9 mol,则以H2的浓度变化表示的反应速率为________________。
随堂演练
1
2
3
4
0.05 mol·L-1·s-1
随堂演练
1
2
3
4
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g) 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·
L-1·s-1,则在2 s 时,容器中有____ mol A,此时C的物质的量浓度为____________。
随堂演练
1
2
3
4
8.8
0.08 mol·L-1
随堂演练
1
2
3
4
3A(g) + B(g) 2C(g)
起始浓度/(mol·L-1 ) 1.0 0.5 0
转化浓度/(mol·L-1) 0.06×2=0.12 0.04 0.08
2 s时浓度/(mol·L-1 ) 1.0-0.12=0.88 0.5-0.04 =0.46 0.08
则2 s时,n(A)=0.88 mol·L-1×10 L=8.8 mol,c(C)=0.08 mol·L-1。
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 化学反应速率的概念及表示方法
1.(2023·长春高一期中)下列关于化学反应速率的说法正确的是
A.根据化学反应速率的大小可以知道化学反应进行的快慢
B.1 mol·L-1·s-1的反应速率一定比0.5 mol·L-1·s-1的反应速率大
C.化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1
D.当速率的单位是mol·L-1·s-1时,任何反应物或生成物均可以表示化学
反应速率
10
11
12
13
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
化学反应速率是用于衡量一段时间内化学反应进行快慢的物理量,A正确;
化学反应速率一般以某物质单位时间内的浓度变化量来表示,而固体或纯液体的浓度视为常数,不能表示化学反应速率,D错误。
2.(2023·南京高一检测)不同温度下,在两个密闭容器中同时进行化学反应:2A(g)+3B(g) 2C(g)+D(g),1 min内甲容器中消耗掉2 mol A物质,乙容器内消耗6 mol A物质,则两容器内的反应速率大小关系为
A.甲容器内反应速率快
B.乙容器内反应速率快
C.甲乙两容器内反应速率相等
D.无法比较
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
化学反应速率是用单位时间内反应物或生成物的浓度变化来表示的,本题中未指明两容器容积的大小,故无法知道浓度大小,不能确定反应速率的相对大小。
3.(2023·吉林延边二中高一期中)在2A(g)+B(g) 3C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A)=1.5 mol·L-1·min-1
B.v(B)=1.8 mol·L-1·min-1
C.v(C)=0.08 mol·L-1·s-1
D.v(D)=0.1 mol·L-1·s-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
因同一反应用不同物质表示时,速率可能不同,所以比较反应速率时,应使用同一种物质。我们以B物质为参照物,将其他选项都转化为用B表示的反应速率。A项,v(A)=1.5 mol·L-1·min-1,则v(B)=0.75 mol·L-1·min-1;
B项,v(B)=1.8 mol·L-1·min-1;
C项,v(C)=0.08 mol·L-1·s-1=4.8 mol·L-1·min-1,则v(B)=1.6 mol·
L-1·min-1;
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
D项,v(D)=0.1 mol·L-1·s-1=6 mol·L-1·min-1,则v(B)=1.5 mol·L-1·
min-1,故B项速率最快。
4.(2023·山西朔州怀仁第一中学高一期中)在密闭容器中W与X反应生成Y和Z,其反应速率分别为v(W)、v(X)、v(Y)、v(Z),已知存在如下关系:v(W)=2v(X),v(Y)=2v(X),v(Z)=2v(W),则此反应可表示为
A.W+2X===Y+4Z B.W+2X===Y+2Z
C.2W+X===2Y+4Z D.2W+X===2Y+2Z
√
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
题组二 化学反应速率的影响因素
5.(2022·重庆市育才中学高一期中)下列做法增大了化学反应速率的是
A.将糕点存放在冰箱里,并在其包装袋中放入脱氧剂,以延长保质期
B.足量锌粒与稀硫酸反应制氢气时,加入少量硫酸铜溶液
C.合成氨工业中,将氨气及时液化分离
D.鲜花店内放置高锰酸钾溶液,降低空气中乙烯浓度,便于鲜花保鲜
√
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
将糕点存放在冰箱里,并在其包装袋中放入脱氧剂,是通过降低温度、减小氧气浓度,从而减慢糕点腐败的速率,以延长保质期,故A不符合;
足量锌粒与稀硫酸反应制氢气时,加入少量硫酸铜溶液,会形成锌铜原电池,从而加快锌与稀硫酸的反应速率,故B符合;
合成氨工业中,将氨气及时液化分离,减小了生成物的浓度,不能加快反应速率,故C不符合;
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
乙烯是催熟剂,高锰酸钾能氧化乙烯,鲜花店内放置高锰酸钾溶液,降低空气中乙烯浓度,从而减慢鲜花的成熟速度,便于鲜花保鲜,故D不符合。
6.已知反应Fe+2FeCl3===3FeCl2,下列措施不能增大该反应速率的是
A.将Fe片换成Fe-Cu合金 B.增大FeCl3溶液的浓度
C.增大压强 D.升高温度
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
√
将Fe片换成Fe-Cu合金,可形成原电池,化学反应速率增大,A不符合题意;
增大FeCl3溶液的浓度,反应速率增大,B不符合题意;
该反应在溶液中进行,增大压强,对反应速率几乎无影响,C符合题意;
升高温度,粒子的运动速率加快,反应速率增大,D不符合题意。
选项 温度 金属 酸
A 25 ℃ Zn粒 0.1 mol·L-1盐酸
B 25 ℃ Zn粒 0.1 mol·L-1硫酸
C 50 ℃ Zn粉 0.1 mol·L-1硫酸
D 50 ℃ Zn粉 0.1 mol·L-1盐酸
7.(2022·厦门湖滨中学高一检测)金属Zn与酸反应产生H2的反应速率最大的是
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
金属Zn与酸反应的离子方程式为Zn+2H+===Zn2++H2↑,盐酸为一元强酸,硫酸为二元强酸,温度越高,H+浓度越大反应速率越快,答案选C。
8.(2023·青岛高一月考)在温度不变的条件下,恒定的容器中进行下列反应:N2O4 2NO2,若N2O4的浓度由0.1 mol·L-1降到0.07 mol·L-1要用10 s,那么N2O4的浓度从0.07 mol·L-1降到0.04 mol·L-1时,所用时间
A.等于10 s B.等于5 s
C.大于10 s D.小于10 s
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
√
N2O4的浓度由0.1 mol·L-1降到0.07 mol·L-1,浓度变化为0.03 mol·L-1,需要用10 s;由于c(N2O4)减小,反应速率减慢,故N2O4的浓度从0.07 mol·L-1降到0.04 mol·L-1所需时间大于10 s。
9.(2023·杭州高一检测)CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论不正确的是
A.反应开始4 min内温度对反应速率的影响比浓度大
B.一段时间后,反应速率减小的原因是c(H+)减小
C.反应在2~4 min内平均反应速率最大
D.反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.06 mol·L-1·s-1
1
2
3
4
5
6
7
8
9
10
11
12
13
√
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
随着反应的进行,c(H+)减小,而前4 min内反应速率变大,根据反应是放热反应,可推出前4 min内温度对反应速率的影响比浓度大,A、B项正确;
在2~4 min内 n(CO2)的变化量最大(或曲线的斜率最大),可判断出平均反应速率最大,C项正确;
由题意及图像可知,该题不知道容器体积,故不能计算出用浓度变化表示的反应速率,D项错误。
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
10.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法一定不正确的是
组别 对应曲线 c(HCl)/ (mol·L-1) 反应温度/℃ 铁的状态
1 a 30 粉末状
2 b 30 粉末状
3 c 2.5 块状
4 d 2.5 30 块状
A.第4组实验的反应速率最慢
B.第1组实验中盐酸的浓度大于2.5 mol·L-1
C.第2组实验中盐酸的浓度等于2.5 mol·L-1
D.第3组实验的反应温度低于30 ℃
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
组别 对应曲线 c(HCl)/ (mol·L-1) 反应温度/℃ 铁的状态
1 a 30 粉末状
2 b 30 粉末状
3 c 2.5 块状
4 d 2.5 30 块状
√
由图像可知,1、2、3、4四组实验产生的氢气一样多,只是反应速率有快慢之分。第4组实验反应所用时间最长,故反应速率最慢,A正确;
第1组实验反应所用时间最短,故反应速率最快,根据变量控制法原则知盐酸浓度应大于2.5 mol·L-1,B正确;
第2组实验,铁是粉末状,与3、4组块状铁相区别,根据变量控制法原则知盐酸的浓度应等于2.5 mol·L-1,C正确;
由3、4组实验并结合图像知第3组实验中反应温度应高于30 ℃,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
11.(2023·天津高一检测)将4 mol A和2 mol B在2 L的密闭容器内混合,并在一定条件下发生如下反应:2A(s)+B(g) 2C(g),若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1;②用物质B表示的反应的平均速率为0.6 mol·L-1·
s-1;③2 s时物质A的转化率(是指已被转化的反应物的物质的量与其初始的物质的量之比)为30%;④2 s时物质B的浓度为0.7 mol·L-1。其中正确的是
A.①③ B.①④
C.②③ D.③④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
利用三段式法计算:
2A(s)+B(g) 2C(g)
起始/(mol·L-1) 1 0
变化/(mol·L-1) 0.3 0.6
2 s时/(mol·L-1) 0.7 0.6
A为固体,固体的浓度视为常数,不能用来表示反应速率,故①错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
2 s时物质B的浓度为0.7 mol·L-1,故④正确。
12.(2022·西安高一期中)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有____________________________
__________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
CuSO4+Zn===ZnSO4+Cu、
Zn+H2SO4===ZnSO4+H2↑
在稀硫酸中加入硫酸铜后发生了两个反应:CuSO4+Zn===ZnSO4+Cu、Zn+H2SO4===ZnSO4+H2↑。
(2)硫酸铜溶液可以加快氢气生成速率的原因是______________________
__________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
CuSO4与Zn反应产生的Cu和Zn以及稀硫酸形成原电池,加快了氢气产生的速率
由于Zn与CuSO4反应生成的Cu和Zn以及稀硫酸构成了原电池,大大加快了生成H2的反应速率。
(3)要加快上述实验中气体产生的速率,还可采取的措施有_____________
________________________________________________________(答两种)。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
升高反应温度、适当增大稀硫酸的浓度、增加锌的比表面积等(答两种即可)
要加快生成H2的反应速率,还可以采取如下措施:升高反应温度、适当增大稀硫酸的浓度、增加锌的比表面积等。
(4)为了进一步探究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
混合溶液 A B C D E F
4 mol·L-1H2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
①请完成此实验设计,其中V1=____,V6=____,V9=_____。
30
10
17.5
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
因为要探究CuSO4的量对反应速率的影响,所以应保持硫酸的浓度在各组实验中相同,则硫酸的体积均取30 mL,即V1=30,根据F中增加的水与硫酸铜溶液的体积之和为20 mL,可以求得V6=10,V7=20,V8=19.5,V9=17.5,V10=15。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
混合溶液 A B C D E F
4 mol·L-1H2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析生成氢气速率下降的主要原因:________________
_______________________________________________________________________________。
当加入过量的CuSO4溶液后,生成的单质Cu会沉积在Zn的表面,减小了Zn与稀H2SO4的接触面积
13.Ⅰ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察
________的快慢,定性比较得出
结论。有同学提出将0.1 mol·L-1
FeCl3改为____mol·L-1 Fe2(SO4)3
更为合理,其理由是_____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
产生气泡
0.05
排除阴离子差异的干扰
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
甲中加入催化剂的现象是有气
泡生成,催化剂的作用是加快
反应速率,所以可以通过观察
产生气泡的快慢来判断两种催
化剂的效果;Cl-本身具有很弱的还原性,H2O2具有强氧化性,更重要的是, 和Cl-是否有催化效果也未知,所以为了排除阴离子差异的干扰,需要将0.1 mol·L-1 FeCl3换为0.05 mol·L-1Fe2(SO4)3,以确保Fe3+的量和Cu2+的量相同。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是______
_____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
产生
40 mL气体需要的时间
题中已告知两个实验都生成40 mL的气体,其他影响因素已忽略,说明影响催化剂效果的数据只能是反应速率,故需要测量生成40 mL气体所需要的时间。
(3)查阅资料得知:将作为催化剂的Fe2(SO4)3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是2Fe3++H2O2===2Fe2++O2↑+2H+和__________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
2Fe2++H2O2+2H+===2Fe3++2H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
催化剂在整个化学反应中,可以看成是先参加了反应,再被生成了,这两个反应相加就是一个总反应,催化剂刚好被抵消了,表现为不参加反应;总反应为2H2O2===2H2O+O2↑,用总反应减去给出的离子方程式就可以得到另一个离子方程式:2Fe2++H2O2+2H+===2Fe3++2H2O。
Ⅱ.欲用如图所示实验来证明MnO2是H2O2分解反应的催化剂。
(1)该实验不能达到目的,若想证明MnO2是催化剂还需要确认__________
_______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
化学反应前
后MnO2的质量和化学性质是否改变
化学反应前后,催化剂的质量和化学性质不变;要想证明MnO2是催化剂,还要验证这两点都不变才行。
(2)加入0.10 mol MnO2粉末于50 mL H2O2
溶液中,在标准状况下放出气体的体积和
时间的关系如图所示。
①写出H2O2在二氧化锰作用下发生反应的
化学方程式:_______________________。
②前3 min,H2O2的反应速率为_____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
0.026 7 mol·L-1·min-1
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
返回
本课结束
第1课时 化学反应的速率
第六章 第二节
1.了解化学反应速率的概念和表示方法,并能进行简单计算。
2.理解影响化学反应速率的因素及规律,并能合理解释生产、生活中的相关化
学现象。
3.学会运用变量控制研究影响化学反应速率的方法。
核心素养
发展目标
内容索引
一、化学反应速率及其表示方法
二、影响化学反应速率的因素
随堂演练 知识落实
课时对点练
化学反应速率及其表示方法
一
化学反应速率
化学反应过程进行快慢程度
反应物浓度
生成物浓度
mol·L-1·s-1
mol·L-1·min-1
已知合成氨反应N2(g)+3H2(g) 2NH3(g),其浓度数据如下:
例
N2 H2 NH3
起始浓度/(mol·L-1) 1.0 3.0 0
2 s末浓度/(mol·L-1) 0.6 1.8 0.8
2 s内,N2、H2、NH3的物质的量浓度变化各为多少?则2 s内用N2、H2、NH3表示的化学反应速率v(N2)、v(H2)、v(NH3)分别为多少?
提示 2 s内,Δc(N2)=(1.0-0.6) mol·L-1=0.4 mol·L-1,
Δc(H2)=(3.0-1.8) mol·L-1=1.2 mol·L-1,
Δc(NH3)=(0.8-0) mol·L-1=0.8 mol·L-1,
【思考】 根据上述计算,同一反应在相同时间内,用不同物质表示的反应速率,其数值是否相同?表示的反应快慢是否相同?用不同物质表示同一反应的反应速率其数值有什么规律?
提示 同一反应在相同时间内,用不同物质表示的反应速率,其数值可能不同,但都表示该反应的反应速率,意义相同;用不同物质表示化学反应速率时,化学反应速率之比等于其化学计量数之比。
1.判断正误
(1)对于任何化学反应来说,反应速率越大,反应现象就越明显
(2)对有固体参加的化学反应,可用单位时间内固体浓度的改变量表示化学反应速率
(3)化学反应速率的单位通常为mol·s-1或mol·min-1
(4)反应速率是指某反应在某时刻的瞬时速率
应用体验
×
×
×
×
2.已知反应4CO(g)+2NO2(g) N2(g)+4CO2(g)在不同条件下的化学反应速率如下:
①v(CO)=1.5 mol·L-1·min-1
②v(NO2)=0.01 mol·L-1·s-1
③v(N2)=0.4 mol·L-1·min-1
④v(CO2)=1.1 mol·L-1·min-1
请比较上述4种情况反应的快慢:___________(由大到小的顺序)。
应用体验
③①②④
②经转化可表示为v(CO)=2v(NO2)=0.02 mol·L-1·s-1=1.2 mol·L-1·min-1;
③v(CO)=4v(N2)=1.6 mol·L-1·min-1;
④v(CO)=v(CO2)=1.1 mol·L-1·min-1。
1.对化学反应速率的理解
归纳总结
2.化学反应速率大小的比较方法
(1)归一法:若单位不统一,则要换算成相同的单位;若为不同物质表示的反应速率,则要换算成同一物质来表示反应速率,再比较数值的大小。
归纳总结
返回
影响化学反应速率的因素
二
1.实验探究——外界条件对化学反应速率的影响
探究温度、浓度、催化剂对化学反应速率的影响
实验操作 实验现象 实验结论
①产生气泡 速率______ ②产生气泡速率______ 对于反应2H2O2 2H2O+O2↑来说,温度升高,H2O2的分解速率______
较慢
较快
加快
滴加1 mol·L-1盐酸的试管产生气泡速率_____ 增大反应物盐酸的浓度,生成CO2的速率______
①无明显现象 ②能产生________ MnO2可以使H2O2的分解速率______
更快
加快
大量气泡
加快
【思考1】 在 1 L密闭容器中充入一定量的N2和H2,在一定的温度和压强下反应生成氨气。当使容器的体积缩小时,化学反应的速率会发生如何变化?
提示 有气体参加的反应,增大压强,容器的体积缩小,浓度增大,化学反应速率加快。
2.影响化学反应速率的因素
(1)内因
反应物本身的性质是
影响化学反应速率的
主要因素。
(2)外因(变量控制法:
其他条件不变,只改
变一个条件)
增大
减小
增大
减小
增大
减小
改变
表面积
【思考2】 下列现象体现了哪些影响化学反应速率的因素?
(1)向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺。
鼓风:_____________;煤粉代替煤块:_____________________。
(2)把食品存放到冰箱内,糕点包装内放除氧剂可以延长食品保质期。
冰箱:_____;除氧剂:_________________。
(3)利用H2O2分解制氧气时加入固体MnO2 。
固体MnO2:_______。
(4)铁在空气中和在纯氧中反应的剧烈程度明显不同。
纯氧:___________________。
增大氧气浓度
增大反应物的接触面积
降温
降低反应物的浓度
催化剂
纯氧的氧气浓度更大
1.判断正误
(1)无论是吸热反应还是放热反应,温度升高,反应速率一定增大
(2)对一定条件下发生的反应:C(s)+O2(g)===CO2(g),增加C的量,化学反应速率加快
(3)改变压强,化学反应速率一定改变
(4)铁和硫酸反应时,硫酸浓度越大,产生H2的速率越大
(5)增加水的量,能使Mg与H2O的反应速率大于Na与H2O的反应速率
(6)Fe与盐酸反应时,加入NaCl固体,由于c(Cl-)增大而使反应速率加快
应用体验
×
×
×
√
×
×
应用体验
2.在带有活塞的密闭容器中发生如下反应:3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g),分析改变下列条件,化学反应速率如何改变(填“变大”“变小”或“不变”),阐述理由:
(1)增加铁片的质量(不考虑表面积的变化):_____,理由:__________
__________________________________________。
(2)保持容器的体积不变,增加水蒸气的通入量:_____,理由:_____
_____________________________。
不变
纯固体的
浓度视为常数,改变用量不影响化学反应速率
变大
增大
反应物浓度,化学反应速率变大
应用体验
(3)保持容器内压强不变,充入一定量的氩气:_____,理由:_______
_________________________________________________________________________。
(4)保持容器的容积不变,充入一定量的氩气:_____,理由:_______
_________________________________________________________________________。
变小
保持压
强不变,充入氩气,容器体积增大,水蒸气的浓度变小,因而化学反应速率变小
不变
容积不变,充入氩气,反应物和生成物的浓度均不改变,因而化学反应速率不变
容器的
对于有气体物质参加的反应,改变反应体系的压强,对化学反应速率的影响常有以下几种情况:
归纳总结
说明:“惰性气体”是指不参与反应的气体。
归纳总结
返回
随堂演练 知识落实
1.下列关于化学反应速率的说法中,不正确的是
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.在容积不变的反应容器中,化学反应速率通常用单位时间内反应物浓
度的减小或生成物浓度的增大来表示
C.若某化学反应在某段时间内的反应速率为0.5 mol·L-1·s-1,就是指在
该段时间内反应物和生成物的浓度变化量都为0.5 mol·L-1
D.化学反应速率是可以通过实验测定的
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
若某化学反应的反应速率为0.5 mol·L-1·s-1,是指用某一物质表示的平均反应速率,与其他物质的反应速率不一定相等,并且未告诉时间范围,无法计算浓度变化量,故C项错误。
2.为了探究温度对化学反应速率的影响,下列实验方案可行的是
√
随堂演练
1
2
3
4
随堂演练
没有对比实验,A错误;
催化剂不同,温度不同,无法比较,B错误;
前者没有催化剂,后者有催化剂,无法比较,C错误;
只有温度不同,其他条件都相同,该方案可行,D正确。
1
2
3
4
3.容积可变的密闭容器中加入WO3和H2进行反应:WO3(s)+3H2(g)
W(s)+3H2O(g),下列说法不正确的是
A.将容器的体积缩小一半,其反应速率增大
B.保持体积不变,充入氩气,其反应速率不变
C.保持压强不变,充入氖气,H2O(g)的生成速率增大
D.保持压强不变,充入氖气,H2O(g)的生成速率减小
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
将容器的体积缩小一半,导致压强增大,气体浓度增大,则反应速率增大,故A正确;
保持体积不变,充入氩气,参加反应气体的浓度不变,则其反应速率不变,故B正确;
保持压强不变,充入氖气,则容器体积增大,参加反应气体的浓度减小,H2O(g)的生成速率减小,故C错误、D正确。
4.(1)在反应A(g)+3B(g)===2C(g)中,若以物质A表示该反应的化学反应速率为0.2 mol·L-1·min-1,则以物质B表示此反应的化学反应速率为_____ mol·L-1·min-1。
随堂演练
1
2
3
4
0.6
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2的物质的量为1.9 mol,则以H2的浓度变化表示的反应速率为________________。
随堂演练
1
2
3
4
0.05 mol·L-1·s-1
随堂演练
1
2
3
4
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g) 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·
L-1·s-1,则在2 s 时,容器中有____ mol A,此时C的物质的量浓度为____________。
随堂演练
1
2
3
4
8.8
0.08 mol·L-1
随堂演练
1
2
3
4
3A(g) + B(g) 2C(g)
起始浓度/(mol·L-1 ) 1.0 0.5 0
转化浓度/(mol·L-1) 0.06×2=0.12 0.04 0.08
2 s时浓度/(mol·L-1 ) 1.0-0.12=0.88 0.5-0.04 =0.46 0.08
则2 s时,n(A)=0.88 mol·L-1×10 L=8.8 mol,c(C)=0.08 mol·L-1。
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 化学反应速率的概念及表示方法
1.(2023·长春高一期中)下列关于化学反应速率的说法正确的是
A.根据化学反应速率的大小可以知道化学反应进行的快慢
B.1 mol·L-1·s-1的反应速率一定比0.5 mol·L-1·s-1的反应速率大
C.化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1
D.当速率的单位是mol·L-1·s-1时,任何反应物或生成物均可以表示化学
反应速率
10
11
12
13
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
化学反应速率是用于衡量一段时间内化学反应进行快慢的物理量,A正确;
化学反应速率一般以某物质单位时间内的浓度变化量来表示,而固体或纯液体的浓度视为常数,不能表示化学反应速率,D错误。
2.(2023·南京高一检测)不同温度下,在两个密闭容器中同时进行化学反应:2A(g)+3B(g) 2C(g)+D(g),1 min内甲容器中消耗掉2 mol A物质,乙容器内消耗6 mol A物质,则两容器内的反应速率大小关系为
A.甲容器内反应速率快
B.乙容器内反应速率快
C.甲乙两容器内反应速率相等
D.无法比较
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
化学反应速率是用单位时间内反应物或生成物的浓度变化来表示的,本题中未指明两容器容积的大小,故无法知道浓度大小,不能确定反应速率的相对大小。
3.(2023·吉林延边二中高一期中)在2A(g)+B(g) 3C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A)=1.5 mol·L-1·min-1
B.v(B)=1.8 mol·L-1·min-1
C.v(C)=0.08 mol·L-1·s-1
D.v(D)=0.1 mol·L-1·s-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
因同一反应用不同物质表示时,速率可能不同,所以比较反应速率时,应使用同一种物质。我们以B物质为参照物,将其他选项都转化为用B表示的反应速率。A项,v(A)=1.5 mol·L-1·min-1,则v(B)=0.75 mol·L-1·min-1;
B项,v(B)=1.8 mol·L-1·min-1;
C项,v(C)=0.08 mol·L-1·s-1=4.8 mol·L-1·min-1,则v(B)=1.6 mol·
L-1·min-1;
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
D项,v(D)=0.1 mol·L-1·s-1=6 mol·L-1·min-1,则v(B)=1.5 mol·L-1·
min-1,故B项速率最快。
4.(2023·山西朔州怀仁第一中学高一期中)在密闭容器中W与X反应生成Y和Z,其反应速率分别为v(W)、v(X)、v(Y)、v(Z),已知存在如下关系:v(W)=2v(X),v(Y)=2v(X),v(Z)=2v(W),则此反应可表示为
A.W+2X===Y+4Z B.W+2X===Y+2Z
C.2W+X===2Y+4Z D.2W+X===2Y+2Z
√
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
题组二 化学反应速率的影响因素
5.(2022·重庆市育才中学高一期中)下列做法增大了化学反应速率的是
A.将糕点存放在冰箱里,并在其包装袋中放入脱氧剂,以延长保质期
B.足量锌粒与稀硫酸反应制氢气时,加入少量硫酸铜溶液
C.合成氨工业中,将氨气及时液化分离
D.鲜花店内放置高锰酸钾溶液,降低空气中乙烯浓度,便于鲜花保鲜
√
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
将糕点存放在冰箱里,并在其包装袋中放入脱氧剂,是通过降低温度、减小氧气浓度,从而减慢糕点腐败的速率,以延长保质期,故A不符合;
足量锌粒与稀硫酸反应制氢气时,加入少量硫酸铜溶液,会形成锌铜原电池,从而加快锌与稀硫酸的反应速率,故B符合;
合成氨工业中,将氨气及时液化分离,减小了生成物的浓度,不能加快反应速率,故C不符合;
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
乙烯是催熟剂,高锰酸钾能氧化乙烯,鲜花店内放置高锰酸钾溶液,降低空气中乙烯浓度,从而减慢鲜花的成熟速度,便于鲜花保鲜,故D不符合。
6.已知反应Fe+2FeCl3===3FeCl2,下列措施不能增大该反应速率的是
A.将Fe片换成Fe-Cu合金 B.增大FeCl3溶液的浓度
C.增大压强 D.升高温度
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
√
将Fe片换成Fe-Cu合金,可形成原电池,化学反应速率增大,A不符合题意;
增大FeCl3溶液的浓度,反应速率增大,B不符合题意;
该反应在溶液中进行,增大压强,对反应速率几乎无影响,C符合题意;
升高温度,粒子的运动速率加快,反应速率增大,D不符合题意。
选项 温度 金属 酸
A 25 ℃ Zn粒 0.1 mol·L-1盐酸
B 25 ℃ Zn粒 0.1 mol·L-1硫酸
C 50 ℃ Zn粉 0.1 mol·L-1硫酸
D 50 ℃ Zn粉 0.1 mol·L-1盐酸
7.(2022·厦门湖滨中学高一检测)金属Zn与酸反应产生H2的反应速率最大的是
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
对点训练
金属Zn与酸反应的离子方程式为Zn+2H+===Zn2++H2↑,盐酸为一元强酸,硫酸为二元强酸,温度越高,H+浓度越大反应速率越快,答案选C。
8.(2023·青岛高一月考)在温度不变的条件下,恒定的容器中进行下列反应:N2O4 2NO2,若N2O4的浓度由0.1 mol·L-1降到0.07 mol·L-1要用10 s,那么N2O4的浓度从0.07 mol·L-1降到0.04 mol·L-1时,所用时间
A.等于10 s B.等于5 s
C.大于10 s D.小于10 s
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
√
N2O4的浓度由0.1 mol·L-1降到0.07 mol·L-1,浓度变化为0.03 mol·L-1,需要用10 s;由于c(N2O4)减小,反应速率减慢,故N2O4的浓度从0.07 mol·L-1降到0.04 mol·L-1所需时间大于10 s。
9.(2023·杭州高一检测)CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论不正确的是
A.反应开始4 min内温度对反应速率的影响比浓度大
B.一段时间后,反应速率减小的原因是c(H+)减小
C.反应在2~4 min内平均反应速率最大
D.反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.06 mol·L-1·s-1
1
2
3
4
5
6
7
8
9
10
11
12
13
√
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
随着反应的进行,c(H+)减小,而前4 min内反应速率变大,根据反应是放热反应,可推出前4 min内温度对反应速率的影响比浓度大,A、B项正确;
在2~4 min内 n(CO2)的变化量最大(或曲线的斜率最大),可判断出平均反应速率最大,C项正确;
由题意及图像可知,该题不知道容器体积,故不能计算出用浓度变化表示的反应速率,D项错误。
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
10.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法一定不正确的是
组别 对应曲线 c(HCl)/ (mol·L-1) 反应温度/℃ 铁的状态
1 a 30 粉末状
2 b 30 粉末状
3 c 2.5 块状
4 d 2.5 30 块状
A.第4组实验的反应速率最慢
B.第1组实验中盐酸的浓度大于2.5 mol·L-1
C.第2组实验中盐酸的浓度等于2.5 mol·L-1
D.第3组实验的反应温度低于30 ℃
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
组别 对应曲线 c(HCl)/ (mol·L-1) 反应温度/℃ 铁的状态
1 a 30 粉末状
2 b 30 粉末状
3 c 2.5 块状
4 d 2.5 30 块状
√
由图像可知,1、2、3、4四组实验产生的氢气一样多,只是反应速率有快慢之分。第4组实验反应所用时间最长,故反应速率最慢,A正确;
第1组实验反应所用时间最短,故反应速率最快,根据变量控制法原则知盐酸浓度应大于2.5 mol·L-1,B正确;
第2组实验,铁是粉末状,与3、4组块状铁相区别,根据变量控制法原则知盐酸的浓度应等于2.5 mol·L-1,C正确;
由3、4组实验并结合图像知第3组实验中反应温度应高于30 ℃,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
11.(2023·天津高一检测)将4 mol A和2 mol B在2 L的密闭容器内混合,并在一定条件下发生如下反应:2A(s)+B(g) 2C(g),若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1;②用物质B表示的反应的平均速率为0.6 mol·L-1·
s-1;③2 s时物质A的转化率(是指已被转化的反应物的物质的量与其初始的物质的量之比)为30%;④2 s时物质B的浓度为0.7 mol·L-1。其中正确的是
A.①③ B.①④
C.②③ D.③④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
利用三段式法计算:
2A(s)+B(g) 2C(g)
起始/(mol·L-1) 1 0
变化/(mol·L-1) 0.3 0.6
2 s时/(mol·L-1) 0.7 0.6
A为固体,固体的浓度视为常数,不能用来表示反应速率,故①错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
2 s时物质B的浓度为0.7 mol·L-1,故④正确。
12.(2022·西安高一期中)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有____________________________
__________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
CuSO4+Zn===ZnSO4+Cu、
Zn+H2SO4===ZnSO4+H2↑
在稀硫酸中加入硫酸铜后发生了两个反应:CuSO4+Zn===ZnSO4+Cu、Zn+H2SO4===ZnSO4+H2↑。
(2)硫酸铜溶液可以加快氢气生成速率的原因是______________________
__________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
CuSO4与Zn反应产生的Cu和Zn以及稀硫酸形成原电池,加快了氢气产生的速率
由于Zn与CuSO4反应生成的Cu和Zn以及稀硫酸构成了原电池,大大加快了生成H2的反应速率。
(3)要加快上述实验中气体产生的速率,还可采取的措施有_____________
________________________________________________________(答两种)。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
升高反应温度、适当增大稀硫酸的浓度、增加锌的比表面积等(答两种即可)
要加快生成H2的反应速率,还可以采取如下措施:升高反应温度、适当增大稀硫酸的浓度、增加锌的比表面积等。
(4)为了进一步探究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
混合溶液 A B C D E F
4 mol·L-1H2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
①请完成此实验设计,其中V1=____,V6=____,V9=_____。
30
10
17.5
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
因为要探究CuSO4的量对反应速率的影响,所以应保持硫酸的浓度在各组实验中相同,则硫酸的体积均取30 mL,即V1=30,根据F中增加的水与硫酸铜溶液的体积之和为20 mL,可以求得V6=10,V7=20,V8=19.5,V9=17.5,V10=15。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
混合溶液 A B C D E F
4 mol·L-1H2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析生成氢气速率下降的主要原因:________________
_______________________________________________________________________________。
当加入过量的CuSO4溶液后,生成的单质Cu会沉积在Zn的表面,减小了Zn与稀H2SO4的接触面积
13.Ⅰ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察
________的快慢,定性比较得出
结论。有同学提出将0.1 mol·L-1
FeCl3改为____mol·L-1 Fe2(SO4)3
更为合理,其理由是_____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
产生气泡
0.05
排除阴离子差异的干扰
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
甲中加入催化剂的现象是有气
泡生成,催化剂的作用是加快
反应速率,所以可以通过观察
产生气泡的快慢来判断两种催
化剂的效果;Cl-本身具有很弱的还原性,H2O2具有强氧化性,更重要的是, 和Cl-是否有催化效果也未知,所以为了排除阴离子差异的干扰,需要将0.1 mol·L-1 FeCl3换为0.05 mol·L-1Fe2(SO4)3,以确保Fe3+的量和Cu2+的量相同。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是______
_____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
产生
40 mL气体需要的时间
题中已告知两个实验都生成40 mL的气体,其他影响因素已忽略,说明影响催化剂效果的数据只能是反应速率,故需要测量生成40 mL气体所需要的时间。
(3)查阅资料得知:将作为催化剂的Fe2(SO4)3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是2Fe3++H2O2===2Fe2++O2↑+2H+和__________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
2Fe2++H2O2+2H+===2Fe3++2H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
催化剂在整个化学反应中,可以看成是先参加了反应,再被生成了,这两个反应相加就是一个总反应,催化剂刚好被抵消了,表现为不参加反应;总反应为2H2O2===2H2O+O2↑,用总反应减去给出的离子方程式就可以得到另一个离子方程式:2Fe2++H2O2+2H+===2Fe3++2H2O。
Ⅱ.欲用如图所示实验来证明MnO2是H2O2分解反应的催化剂。
(1)该实验不能达到目的,若想证明MnO2是催化剂还需要确认__________
_______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
化学反应前
后MnO2的质量和化学性质是否改变
化学反应前后,催化剂的质量和化学性质不变;要想证明MnO2是催化剂,还要验证这两点都不变才行。
(2)加入0.10 mol MnO2粉末于50 mL H2O2
溶液中,在标准状况下放出气体的体积和
时间的关系如图所示。
①写出H2O2在二氧化锰作用下发生反应的
化学方程式:_______________________。
②前3 min,H2O2的反应速率为_____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
0.026 7 mol·L-1·min-1
1
2
3
4
5
6
7
8
9
10
11
12
13
综合强化
返回
本课结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
