第六章 化学反应与能量 章末整合 重点突破(共55张PPT)
文档属性
| 名称 | 第六章 化学反应与能量 章末整合 重点突破(共55张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-12 19:06:38 | ||
图片预览









文档简介
(共55张PPT)
第六章
章末整合 重点突破
体系构建 理清脉络
重点突破 素养提升
内容索引
体系构建 理清脉络
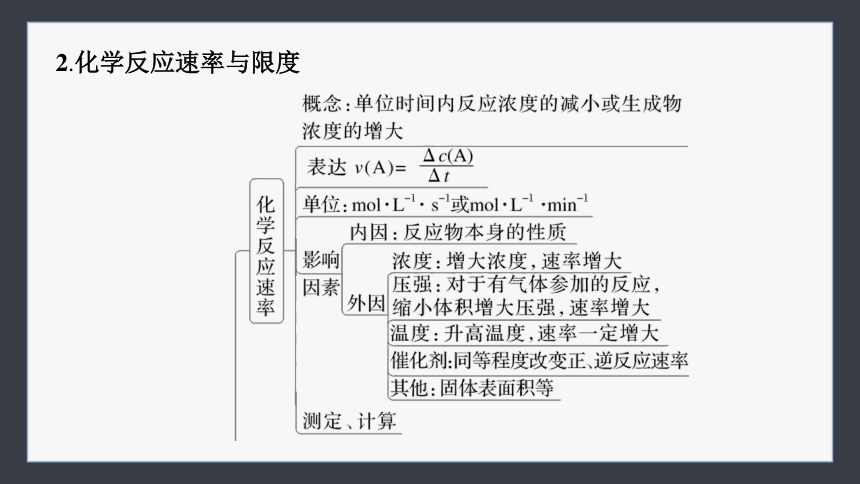
1.化学反应与能量变化
(1)化学反应与热能
(2)化学反应与电能——原电池
原电池
定义:把化学能转化为电能的装置
形成条件
两个活泼性不同的电极
形成闭合回路
电解质溶液(或熔融电解质)
自发进行的氧化还原反应
原理
正、负极的判断:活泼金属或参与反应的金属为负极
电子的流向:负极→正极
电流的流向:正极→负极
离子的移动方向:阳离子→正极
阴离子→负极
原电池
分类
一次电池
二次电池
燃料电池
应用
判断金属活动性强弱
加快氧化还原反应速率
设计原电池
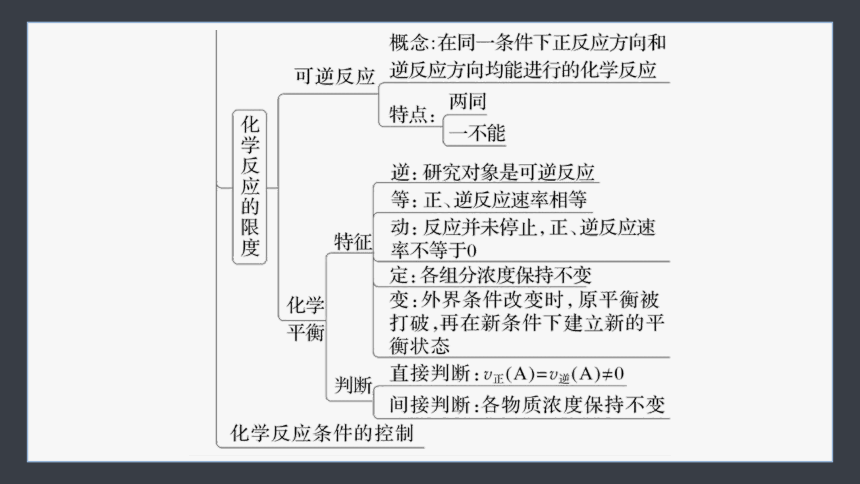
2.化学反应速率与限度
体验高考
1.(2023·广东,6)负载有Pt和Ag的活性炭,可选择性去除Cl-实现废酸的纯化,其工作原理如图。下列说法正确的是
A.Ag作原电池正极
B.电子由Ag经活性炭流向Pt
C.Pt表面发生的电极反应:
O2+2H2O+4e-===4OH-
D.每消耗标准状况下11.2 L的O2,最多去除1 mol Cl-
√
由题图分析可知,Cl-在Ag极失去电子
发生氧化反应,Ag为负极,A错误;
电子由负极Ag经活性炭流向正极Pt,B
正确;
溶液为酸性,故Pt表面发生的电极反应为O2+4H++4e-===2H2O,C错误;
每消耗标准状况下11.2 L的O2,转移2 mol电子,最多去除2 mol Cl-,D错误。
体验高考
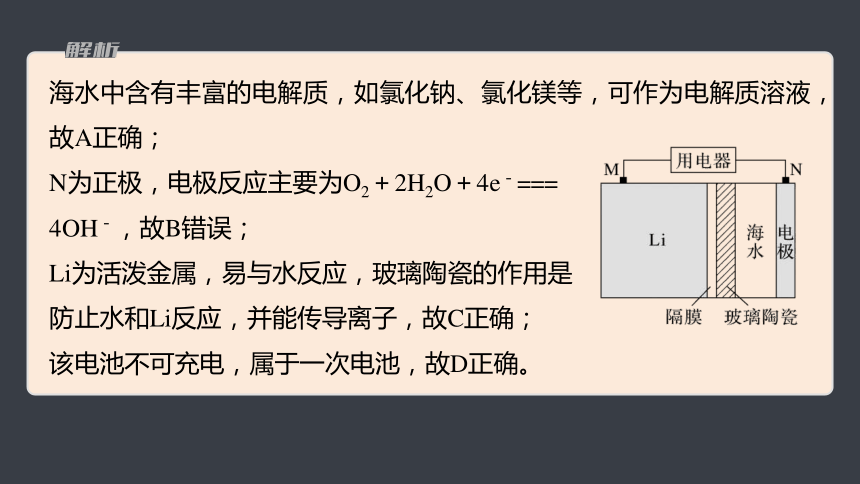
2.(2022·湖南,8)海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e-
===2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂-海水电池属于一次电池
√
海水中含有丰富的电解质,如氯化钠、氯化镁等,可作为电解质溶液,故A正确;
N为正极,电极反应主要为O2+2H2O+4e-===
4OH-,故B错误;
Li为活泼金属,易与水反应,玻璃陶瓷的作用是
防止水和Li反应,并能传导离子,故C正确;
该电池不可充电,属于一次电池,故D正确。
体验高考
3.(2022·全国甲卷,10)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中,Zn2+以 存在]。电池放电时,下列叙述错误的是
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
√
C.MnO2电极反应:MnO2+2e-+4H+
===Mn2++2H2O
MnO2电极的电极反应式为MnO2+2e-+4H+===Mn2++2H2O,C正确;
体验高考
4.(2022·浙江1月选考,19)在恒温恒容条件下,发生反应A(s)+2B(g)
3X(g),c(B)随时间的变化如图中曲线甲所示。下列说法不正确的是
A.从a、c两点坐标可求得从a到c时间间隔内该化学
反应的平均速率
B.从b点切线的斜率可求得该化学反应在反应开始
时的瞬时速率
C.在不同时刻都存在关系:2v(B)=3v(X)
D.维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,
c(B)随时间变化关系如图中曲线乙所示
√
图像中可以得到单位时间内的浓度变化,反应速率是单位时间内物质的浓度变化计算得到,从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率,A正确;
b点处切线的斜率是此时刻物质浓度除以此时刻时
间,为反应物B的瞬时速率,B正确;
由化学反应速率之比等于化学方程式中化学计量数
之比分析,3v(B)=2v(X),C不正确;
维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,反应速率增大,D正确。
体验高考
5.(2019·浙江4月选考,17改编)下列说法正确的是
A.H2(g)+I2(g) 2HI(g),其他条件不变,缩小反应容器体积,正逆反
应速率不变
B.C(s)+H2O(g) H2(g)+CO(g),碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应2A(?)+B(g) 2C(?)已达平衡,
则A、C不能同时是气体
D.恒压条件下发生反应N2(g)+3H2(g) 2NH3(g),当气体压强不再改
变时,反应达到平衡状态
√
对于反应H2(g)+I2(g) 2HI(g),反应前后气体分子数相等,缩小反应容器体积,压强增大,正逆反应速率增大相同的倍数,A项错误;
碳的质量不变,说明正、逆反应速率相等,反应已达到平衡状态,B项正确;
恒温恒容条件下,若A、C同时为气体,当压强不变时,也能说明反应达到平衡状态,C项错误;
反应N2(g)+3H2(g) 2NH3(g)在恒压条件下进行,则气体的压强始终不变,D项错误。
体验高考
6.(2017·江苏,10)H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
√
A项,浓度对反应速率的影响是浓度越大,反应速率越快,错误;
B项,NaOH浓度越大,即pH越大,H2O2分解速率越快,错误;
C项,由图可知,Mn2+存在时,0.1 mol·L-1 NaOH溶液中H2O2的分解速率比1.0 mol·L-1 NaOH中的快,错误;
D项,由图可知,碱性条件下,Mn2+存在时,对H2O2分解速率影响大,正确。
返回
重点突破 素养提升
突破一 化学反应中的能量变化计算公式
(1)反应的能量变化=_______能量之和-_______能量之和。
(2)反应的能量变化=_______断键吸收的能量之和-_______成键放出的能量之和。
生成物
反应物
反应物
生成物
跟踪训练
1.已知反应A+B===C+D的能量变化如图所示,下列叙述正确的是
A.该反应为放热反应
B.该反应吸收的能量为E1-E2
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
√
由图像可知反应物的总能量低于生成物的总能
量,该反应是吸热反应,A、C项错误;
该反应吸收的总能量=断键吸收的总能量-成
键放出的总能量=E1-E2,B项正确;
某些吸热反应不需要加热也可能发生,如Ba(OH)2·8H2O和NH4Cl发生的吸热反应,D项错误。
跟踪训练
2.氮的固定一直是科学家研究的重要课题,合成氨是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g) 2NH3(g)。已知破坏1 mol有关化学键需要的能量如表所示:
H—H N—H N—N N≡N
436 kJ 390.8 kJ 192.8 kJ 945.8 kJ
则反应生成1 mol NH3(g)所释放出的热量为______ kJ。
45.5
根据表中数据可计算出破坏3 mol H—H吸收的能量为1 308 kJ,破坏1 mol N≡N吸收的能量为945.8 kJ,化学键被破坏吸收的总能量为2 253.8 kJ,形成6 mol N—H放出能量2 344.8 kJ,反应生成2 mol NH3(g)释放出的热量为2 344.8 kJ-2 253.8 kJ=91 kJ,则反应生成1 mol NH3(g)释放出的热量为45.5 kJ。
H—H N—H N—N N≡N
436 kJ 390.8 kJ 192.8 kJ 945.8 kJ
突破二 电极反应式的书写及正误判断
1.电极反应式的书写
(1)书写电极反应式的原则
电极反应式遵循质量守恒、得失电子守恒及电荷守恒。
(2)电极反应式的书写思路
列物质标得失
列出正(负)极上的反应物及电极产物,标出化合价,找出得失电子数目
看环境配守恒
溶液中的电池反应,根据溶液的酸碱性,选择H+或OH-调平电荷,再用H2O配平H原子和O原子
↓
↓
两式加验总式
两电极反应式相加,与总反应式对照验证
特别提醒 给出原电池总反应式书写电极反应式时,可以先写出比较简单的某一电极的电极反应式,复杂的电极反应式=总反应式-较简单的电极反应式,利用此式计算时,须保证总式与分式中得失电子数相等。
2.电极反应式的正误判断
在选择题选项中出现电极反应式时,一般从以下方面判断其正误。
(1)注意电子转移的方向与数目是否正确。如O2-4e-+2H2O===4OH-
(2)注意电极反应式与正负极是否对应。如某电池正极反应式为Zn-2e-+2OH-===Zn(OH)2
(3)注意电极反应式是否符合溶液的酸碱性。如碱性条件下:CH4-8e-+2H2O===CO2+8H+
(4)注意电极产物与电解质溶液是否反应。如铅酸蓄电池负极:Pb-2e-===Pb2+
×
×
×
×
跟踪训练
1.(2023·湖北宜昌高一检测)具有高能量密度的锌-空气蓄电池是锂离子电池的理想替代品。如图是一种新型可充电锌-空气蓄电池放电时的工作原理示意图,下列说法正确的是
A.放电时,锌板为正极
B.放电时,正极的电极反应式为Zn+
4OH--2e-===[Zn(OH)4]2-
C.放电时,OH-由过渡金属碳化物通
过离子交换膜向锌板移动
D.放电时,每消耗22.4 mL O2,外电路转移电子数约为2.408×1021
√
据图可知放电时,锌板上Zn被氧化,为负极,A错误;
放电时,正极上是氧气得电子的还原反
应,电极反应式为O2+4e-+2H2O===
4OH-,B错误;
此电池中阴离子移向负极,故OH-由过
渡金属碳化物通过离子交换膜向锌板移
动,C正确;
由正极的电极反应式O2+4e-+2H2O===4OH-可知,每消耗标准状况下22.4 mL O2,外电路中转移电子数约为2.408×1021,但由于未指明是否在标准状况下,故不能计算外电路中转移的电子数,D错误。
跟踪训练
2.(2023·邯郸高一月考)肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。
(1)试写出肼的电子式:____________。
(2)目前正在研发的一种肼燃料电池的结构如图
甲所示,___(填“a”或“b”)电极为电池的负
极,负极的电极反应式为______________________________。
a
N2H4-4e-+4OH-===N2+4H2O
负极肼失电子发生氧化反应,所以a电极为电池的负极,又由于是碱性溶液,所以负极电极反应式为N2H4-4e-+4OH-===N2+4H2O。
跟踪训练
0.012 5 mol·L-1·min-1
突破三 化学平衡状态的判断依据
(1)直接特征,直接判断
①同一物质的正反应速率和逆反应速率相等,即v正=v逆。
②由反应混合物中各组分的质量、物质的量、浓度、百分含量和体系的温度、颜色等特征不变可直接判断反应达到平衡状态。
(2)间接特征,变量不变
跟踪训练
1.在一定温度下,向2 L固定容积的密闭容器中通入1 mol CO2、3 mol H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。能说明该反应已达到平衡状态的是
A.混合气体的平均相对分子质量不变
B.体系中 ,且保持不变
C.混合气体的密度不随时间变化
D.单位时间内有n mol H—H断裂,同时有n mol O—H生成
√
因反应前后的气体体积不同,混合气体的平均相对分子质量不变,能说明反应已达到平衡,A正确;
二者均表示v正,不能说明反应是否达到平衡,D错误。
跟踪训练
2.(2022·上海嘉定区第一中学高一检测)一定温度下,在容积恒定的密闭容器中进行反应:A(s)+2B(g) C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
①混合气体的密度不变 ②容器内气体的压强不变
③混合气体的总物质的量不变 ④B的物质的量浓度不变
⑤v正(C)=v逆(D)
A.②③ B.①③⑤
C.②④⑤ D.①④⑤
√
混合气体的密度等于混合气体的总质量除以容器容积,A是固体,所以混合气体的总质量是一个变量,容器容积是定值,所以混合气体密度不变时,反应达到平衡状态,①正确;
该反应是气体体积不变的反应,在温度和容积一定时,压强和气体的总物质的量成正比,所以容器内气体的压强一直不变,则压强不变不能判断该反应是否达到平衡,②错误;
该反应的混合气体的总物质的量一直不变,故不能用总的物质的量不变判断反应是否平衡,③错误;
B的物质的量浓度不再变化,说明反应达到了平衡状态,④正确;
用C表示的正反应速率等于用D表示的逆反应速率,说明正、逆反应速率相等,反应达到了平衡状态,⑤正确。
突破四 化学反应速率及平衡的相关计算
1.列出一个模型——“三段式”思维模型
解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、变化量及平衡量,再根据题设其他条件和定律列方程求解。如mA(g)+nB(g) pC(g)+qD(g),令A、B起始物质的量分别为a mol、b mol,达到平衡后消耗A的物质的量为mx mol。
mA(g)+nB(g) pC(g)+qD(g)
起始量/mol a b 0 0
变化量/mol mx nx px qx
平衡量/mol a-mx b-nx px qx
注意 (1)a、b也可指浓度或气体的体积、压强等。
(2)明确三个量的关系
①同一反应物:起始量-变化量=平衡量。
②同一生成物:起始量+变化量=平衡量。
③各变化量之比=各物质的化学计量数之比。
2.掌握四个公式——“三段式”应用
跟踪训练
1.(2020·浙江1月选考,21)一定温度下,在2 L的恒容密闭容器中发生反应A(g)+2B(g) 3C(g)。反应过程中的部分数据如表所示:
n/mol t/min n(A) n(B) n(C)
0 2.0 2.4 0
5 0.9
10 1.6
15 1.6
跟踪训练
下列说法正确的是
A.0~5 min用A表示的平均反应速率为0.09 mol·L-1·min-1
B.该反应在10 min后才达到平衡
C.平衡状态时,c(C)=0.6 mol·L-1
D.物质B的平衡转化率为20%
√
根据化学方程式及题表中数据可知,达到平衡时消耗0.4 mol A,消耗0.8 mol B,生成1.2 mol C,则平衡时C的物质的量为1.2 mol,其物质的量浓度为0.6 mol·L-1,C正确;
由反应的化学方程式及题表中数据可算出0~5 min内,消耗0.3 mol A,用A表示的平均反应速率为0.03 mol·L-1·min-1,A错误;
根据题表中数据知,0~10 min内消耗0.8 mol B,此时剩余1.6 mol B,则在10 min时反应已达到平衡,B错误;
跟踪训练
2.恒温恒容下,将2 mol A气体和4 mol B气体通入体积为2 L的密闭容器中发生反应:2A(g)+B(g) xC(g)+2D(s),2 min达到平衡,测得平衡时A的物质的量为1.2 mol,C的浓度为0.8 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_________________。
0.4 mol·L-1·min-1
跟踪训练
(2)x=___。
4
根据三段式: 2A(g)+B(g) xC(g)+2D(s)
起始/mol 2 4 0
转化/mol 0.8 0.4 2×0.8
平衡/mol 1.2 3.6 1.6
即Δn(A)∶Δn(C)=0.8 mol∶1.6 mol=2∶x,解得x=4。
跟踪训练
(3)A的转化率与B的转化率之比为______。
4∶1
跟踪训练
(4)下列各项可作为该反应达到平衡状态的标志的是_____(填字母)。
A.压强不再变化
B.气体密度不再变化
C.气体的平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2∶1
ABC
反应前后气体总体积不同,当压强不再变化时,达到平衡状态,A正确;
反应有固体生成,当气体密度不变时达到平衡状态,B正确;
反应前后气体体积不同,当气体的平均相对分子质量不再变化时,达到平衡状态,C正确;
A和B的消耗速率均表示正反应速率,不能由此判断反应达到平衡状态,D错误。
返回
本课结束
第六章
章末整合 重点突破
体系构建 理清脉络
重点突破 素养提升
内容索引
体系构建 理清脉络
1.化学反应与能量变化
(1)化学反应与热能
(2)化学反应与电能——原电池
原电池
定义:把化学能转化为电能的装置
形成条件
两个活泼性不同的电极
形成闭合回路
电解质溶液(或熔融电解质)
自发进行的氧化还原反应
原理
正、负极的判断:活泼金属或参与反应的金属为负极
电子的流向:负极→正极
电流的流向:正极→负极
离子的移动方向:阳离子→正极
阴离子→负极
原电池
分类
一次电池
二次电池
燃料电池
应用
判断金属活动性强弱
加快氧化还原反应速率
设计原电池
2.化学反应速率与限度
体验高考
1.(2023·广东,6)负载有Pt和Ag的活性炭,可选择性去除Cl-实现废酸的纯化,其工作原理如图。下列说法正确的是
A.Ag作原电池正极
B.电子由Ag经活性炭流向Pt
C.Pt表面发生的电极反应:
O2+2H2O+4e-===4OH-
D.每消耗标准状况下11.2 L的O2,最多去除1 mol Cl-
√
由题图分析可知,Cl-在Ag极失去电子
发生氧化反应,Ag为负极,A错误;
电子由负极Ag经活性炭流向正极Pt,B
正确;
溶液为酸性,故Pt表面发生的电极反应为O2+4H++4e-===2H2O,C错误;
每消耗标准状况下11.2 L的O2,转移2 mol电子,最多去除2 mol Cl-,D错误。
体验高考
2.(2022·湖南,8)海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e-
===2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂-海水电池属于一次电池
√
海水中含有丰富的电解质,如氯化钠、氯化镁等,可作为电解质溶液,故A正确;
N为正极,电极反应主要为O2+2H2O+4e-===
4OH-,故B错误;
Li为活泼金属,易与水反应,玻璃陶瓷的作用是
防止水和Li反应,并能传导离子,故C正确;
该电池不可充电,属于一次电池,故D正确。
体验高考
3.(2022·全国甲卷,10)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中,Zn2+以 存在]。电池放电时,下列叙述错误的是
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
√
C.MnO2电极反应:MnO2+2e-+4H+
===Mn2++2H2O
MnO2电极的电极反应式为MnO2+2e-+4H+===Mn2++2H2O,C正确;
体验高考
4.(2022·浙江1月选考,19)在恒温恒容条件下,发生反应A(s)+2B(g)
3X(g),c(B)随时间的变化如图中曲线甲所示。下列说法不正确的是
A.从a、c两点坐标可求得从a到c时间间隔内该化学
反应的平均速率
B.从b点切线的斜率可求得该化学反应在反应开始
时的瞬时速率
C.在不同时刻都存在关系:2v(B)=3v(X)
D.维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,
c(B)随时间变化关系如图中曲线乙所示
√
图像中可以得到单位时间内的浓度变化,反应速率是单位时间内物质的浓度变化计算得到,从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率,A正确;
b点处切线的斜率是此时刻物质浓度除以此时刻时
间,为反应物B的瞬时速率,B正确;
由化学反应速率之比等于化学方程式中化学计量数
之比分析,3v(B)=2v(X),C不正确;
维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,反应速率增大,D正确。
体验高考
5.(2019·浙江4月选考,17改编)下列说法正确的是
A.H2(g)+I2(g) 2HI(g),其他条件不变,缩小反应容器体积,正逆反
应速率不变
B.C(s)+H2O(g) H2(g)+CO(g),碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应2A(?)+B(g) 2C(?)已达平衡,
则A、C不能同时是气体
D.恒压条件下发生反应N2(g)+3H2(g) 2NH3(g),当气体压强不再改
变时,反应达到平衡状态
√
对于反应H2(g)+I2(g) 2HI(g),反应前后气体分子数相等,缩小反应容器体积,压强增大,正逆反应速率增大相同的倍数,A项错误;
碳的质量不变,说明正、逆反应速率相等,反应已达到平衡状态,B项正确;
恒温恒容条件下,若A、C同时为气体,当压强不变时,也能说明反应达到平衡状态,C项错误;
反应N2(g)+3H2(g) 2NH3(g)在恒压条件下进行,则气体的压强始终不变,D项错误。
体验高考
6.(2017·江苏,10)H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
√
A项,浓度对反应速率的影响是浓度越大,反应速率越快,错误;
B项,NaOH浓度越大,即pH越大,H2O2分解速率越快,错误;
C项,由图可知,Mn2+存在时,0.1 mol·L-1 NaOH溶液中H2O2的分解速率比1.0 mol·L-1 NaOH中的快,错误;
D项,由图可知,碱性条件下,Mn2+存在时,对H2O2分解速率影响大,正确。
返回
重点突破 素养提升
突破一 化学反应中的能量变化计算公式
(1)反应的能量变化=_______能量之和-_______能量之和。
(2)反应的能量变化=_______断键吸收的能量之和-_______成键放出的能量之和。
生成物
反应物
反应物
生成物
跟踪训练
1.已知反应A+B===C+D的能量变化如图所示,下列叙述正确的是
A.该反应为放热反应
B.该反应吸收的能量为E1-E2
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
√
由图像可知反应物的总能量低于生成物的总能
量,该反应是吸热反应,A、C项错误;
该反应吸收的总能量=断键吸收的总能量-成
键放出的总能量=E1-E2,B项正确;
某些吸热反应不需要加热也可能发生,如Ba(OH)2·8H2O和NH4Cl发生的吸热反应,D项错误。
跟踪训练
2.氮的固定一直是科学家研究的重要课题,合成氨是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g) 2NH3(g)。已知破坏1 mol有关化学键需要的能量如表所示:
H—H N—H N—N N≡N
436 kJ 390.8 kJ 192.8 kJ 945.8 kJ
则反应生成1 mol NH3(g)所释放出的热量为______ kJ。
45.5
根据表中数据可计算出破坏3 mol H—H吸收的能量为1 308 kJ,破坏1 mol N≡N吸收的能量为945.8 kJ,化学键被破坏吸收的总能量为2 253.8 kJ,形成6 mol N—H放出能量2 344.8 kJ,反应生成2 mol NH3(g)释放出的热量为2 344.8 kJ-2 253.8 kJ=91 kJ,则反应生成1 mol NH3(g)释放出的热量为45.5 kJ。
H—H N—H N—N N≡N
436 kJ 390.8 kJ 192.8 kJ 945.8 kJ
突破二 电极反应式的书写及正误判断
1.电极反应式的书写
(1)书写电极反应式的原则
电极反应式遵循质量守恒、得失电子守恒及电荷守恒。
(2)电极反应式的书写思路
列物质标得失
列出正(负)极上的反应物及电极产物,标出化合价,找出得失电子数目
看环境配守恒
溶液中的电池反应,根据溶液的酸碱性,选择H+或OH-调平电荷,再用H2O配平H原子和O原子
↓
↓
两式加验总式
两电极反应式相加,与总反应式对照验证
特别提醒 给出原电池总反应式书写电极反应式时,可以先写出比较简单的某一电极的电极反应式,复杂的电极反应式=总反应式-较简单的电极反应式,利用此式计算时,须保证总式与分式中得失电子数相等。
2.电极反应式的正误判断
在选择题选项中出现电极反应式时,一般从以下方面判断其正误。
(1)注意电子转移的方向与数目是否正确。如O2-4e-+2H2O===4OH-
(2)注意电极反应式与正负极是否对应。如某电池正极反应式为Zn-2e-+2OH-===Zn(OH)2
(3)注意电极反应式是否符合溶液的酸碱性。如碱性条件下:CH4-8e-+2H2O===CO2+8H+
(4)注意电极产物与电解质溶液是否反应。如铅酸蓄电池负极:Pb-2e-===Pb2+
×
×
×
×
跟踪训练
1.(2023·湖北宜昌高一检测)具有高能量密度的锌-空气蓄电池是锂离子电池的理想替代品。如图是一种新型可充电锌-空气蓄电池放电时的工作原理示意图,下列说法正确的是
A.放电时,锌板为正极
B.放电时,正极的电极反应式为Zn+
4OH--2e-===[Zn(OH)4]2-
C.放电时,OH-由过渡金属碳化物通
过离子交换膜向锌板移动
D.放电时,每消耗22.4 mL O2,外电路转移电子数约为2.408×1021
√
据图可知放电时,锌板上Zn被氧化,为负极,A错误;
放电时,正极上是氧气得电子的还原反
应,电极反应式为O2+4e-+2H2O===
4OH-,B错误;
此电池中阴离子移向负极,故OH-由过
渡金属碳化物通过离子交换膜向锌板移
动,C正确;
由正极的电极反应式O2+4e-+2H2O===4OH-可知,每消耗标准状况下22.4 mL O2,外电路中转移电子数约为2.408×1021,但由于未指明是否在标准状况下,故不能计算外电路中转移的电子数,D错误。
跟踪训练
2.(2023·邯郸高一月考)肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。
(1)试写出肼的电子式:____________。
(2)目前正在研发的一种肼燃料电池的结构如图
甲所示,___(填“a”或“b”)电极为电池的负
极,负极的电极反应式为______________________________。
a
N2H4-4e-+4OH-===N2+4H2O
负极肼失电子发生氧化反应,所以a电极为电池的负极,又由于是碱性溶液,所以负极电极反应式为N2H4-4e-+4OH-===N2+4H2O。
跟踪训练
0.012 5 mol·L-1·min-1
突破三 化学平衡状态的判断依据
(1)直接特征,直接判断
①同一物质的正反应速率和逆反应速率相等,即v正=v逆。
②由反应混合物中各组分的质量、物质的量、浓度、百分含量和体系的温度、颜色等特征不变可直接判断反应达到平衡状态。
(2)间接特征,变量不变
跟踪训练
1.在一定温度下,向2 L固定容积的密闭容器中通入1 mol CO2、3 mol H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。能说明该反应已达到平衡状态的是
A.混合气体的平均相对分子质量不变
B.体系中 ,且保持不变
C.混合气体的密度不随时间变化
D.单位时间内有n mol H—H断裂,同时有n mol O—H生成
√
因反应前后的气体体积不同,混合气体的平均相对分子质量不变,能说明反应已达到平衡,A正确;
二者均表示v正,不能说明反应是否达到平衡,D错误。
跟踪训练
2.(2022·上海嘉定区第一中学高一检测)一定温度下,在容积恒定的密闭容器中进行反应:A(s)+2B(g) C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
①混合气体的密度不变 ②容器内气体的压强不变
③混合气体的总物质的量不变 ④B的物质的量浓度不变
⑤v正(C)=v逆(D)
A.②③ B.①③⑤
C.②④⑤ D.①④⑤
√
混合气体的密度等于混合气体的总质量除以容器容积,A是固体,所以混合气体的总质量是一个变量,容器容积是定值,所以混合气体密度不变时,反应达到平衡状态,①正确;
该反应是气体体积不变的反应,在温度和容积一定时,压强和气体的总物质的量成正比,所以容器内气体的压强一直不变,则压强不变不能判断该反应是否达到平衡,②错误;
该反应的混合气体的总物质的量一直不变,故不能用总的物质的量不变判断反应是否平衡,③错误;
B的物质的量浓度不再变化,说明反应达到了平衡状态,④正确;
用C表示的正反应速率等于用D表示的逆反应速率,说明正、逆反应速率相等,反应达到了平衡状态,⑤正确。
突破四 化学反应速率及平衡的相关计算
1.列出一个模型——“三段式”思维模型
解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、变化量及平衡量,再根据题设其他条件和定律列方程求解。如mA(g)+nB(g) pC(g)+qD(g),令A、B起始物质的量分别为a mol、b mol,达到平衡后消耗A的物质的量为mx mol。
mA(g)+nB(g) pC(g)+qD(g)
起始量/mol a b 0 0
变化量/mol mx nx px qx
平衡量/mol a-mx b-nx px qx
注意 (1)a、b也可指浓度或气体的体积、压强等。
(2)明确三个量的关系
①同一反应物:起始量-变化量=平衡量。
②同一生成物:起始量+变化量=平衡量。
③各变化量之比=各物质的化学计量数之比。
2.掌握四个公式——“三段式”应用
跟踪训练
1.(2020·浙江1月选考,21)一定温度下,在2 L的恒容密闭容器中发生反应A(g)+2B(g) 3C(g)。反应过程中的部分数据如表所示:
n/mol t/min n(A) n(B) n(C)
0 2.0 2.4 0
5 0.9
10 1.6
15 1.6
跟踪训练
下列说法正确的是
A.0~5 min用A表示的平均反应速率为0.09 mol·L-1·min-1
B.该反应在10 min后才达到平衡
C.平衡状态时,c(C)=0.6 mol·L-1
D.物质B的平衡转化率为20%
√
根据化学方程式及题表中数据可知,达到平衡时消耗0.4 mol A,消耗0.8 mol B,生成1.2 mol C,则平衡时C的物质的量为1.2 mol,其物质的量浓度为0.6 mol·L-1,C正确;
由反应的化学方程式及题表中数据可算出0~5 min内,消耗0.3 mol A,用A表示的平均反应速率为0.03 mol·L-1·min-1,A错误;
根据题表中数据知,0~10 min内消耗0.8 mol B,此时剩余1.6 mol B,则在10 min时反应已达到平衡,B错误;
跟踪训练
2.恒温恒容下,将2 mol A气体和4 mol B气体通入体积为2 L的密闭容器中发生反应:2A(g)+B(g) xC(g)+2D(s),2 min达到平衡,测得平衡时A的物质的量为1.2 mol,C的浓度为0.8 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_________________。
0.4 mol·L-1·min-1
跟踪训练
(2)x=___。
4
根据三段式: 2A(g)+B(g) xC(g)+2D(s)
起始/mol 2 4 0
转化/mol 0.8 0.4 2×0.8
平衡/mol 1.2 3.6 1.6
即Δn(A)∶Δn(C)=0.8 mol∶1.6 mol=2∶x,解得x=4。
跟踪训练
(3)A的转化率与B的转化率之比为______。
4∶1
跟踪训练
(4)下列各项可作为该反应达到平衡状态的标志的是_____(填字母)。
A.压强不再变化
B.气体密度不再变化
C.气体的平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2∶1
ABC
反应前后气体总体积不同,当压强不再变化时,达到平衡状态,A正确;
反应有固体生成,当气体密度不变时达到平衡状态,B正确;
反应前后气体体积不同,当气体的平均相对分子质量不再变化时,达到平衡状态,C正确;
A和B的消耗速率均表示正反应速率,不能由此判断反应达到平衡状态,D错误。
返回
本课结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
