第六章 第一节 第2课时 化学反应与电能(共76张PPT)
文档属性
| 名称 | 第六章 第一节 第2课时 化学反应与电能(共76张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-12 19:51:35 | ||
图片预览









文档简介
(共76张PPT)
第2课时 化学反应与电能
第六章 第一节
1.设计实验认识构成原电池的条件。
2.理解原电池的概念及工作原理,能正确判断原电池的正、负极。
3.了解原电池工作原理的应用。
核心素养
发展目标
内容索引
一、原电池构成条件及工作原理
二、原电池工作原理的应用
随堂演练 知识落实
课时对点练
原电池构成条件及工作原理
一
1.火力发电——化学能间接转化为电能
热
机械
化学能
____能
______能
其中能量转换的关键环节是______(氧化还原反应)。
燃烧
【思考1】 火力发电的缺点是什么?
提示 ①煤炭是不可再生能源,会造成能源危机;
②煤炭燃烧会产生污染性气体;
③经多次转换,能量损耗大,燃料的利用率低。
2.原电池——化学能直接转化为电能
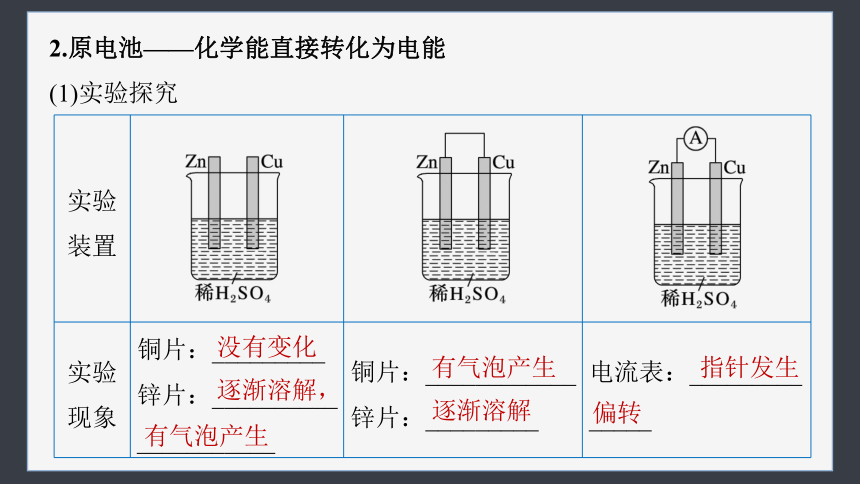
(1)实验探究
实验装置
实验现象 铜片:_________ 锌片:__________ ___________ 铜片:____________ 锌片:_________ 电流表:_________
_____
没有变化
逐渐溶解,
有气泡产生
有气泡产生
逐渐溶解
指针发生
偏转
实验结论 锌与稀硫酸反应产生氢气,而铜不反应 锌______电子,经导线流向_____,H+在铜片上______电子被还原生成H2 导线中有_____通过,反应过程中产生了______
失去
铜片
得到
电流
电能
(2)原电池
①概念:将_____能转化为___能的装置。
②本质:发生_________反应。
③电极:负极:电子_____的一极,发生_____反应;
正极:电子______的一极,发生_____反应。
化学
电
氧化还原
流出
氧化
流入
还原
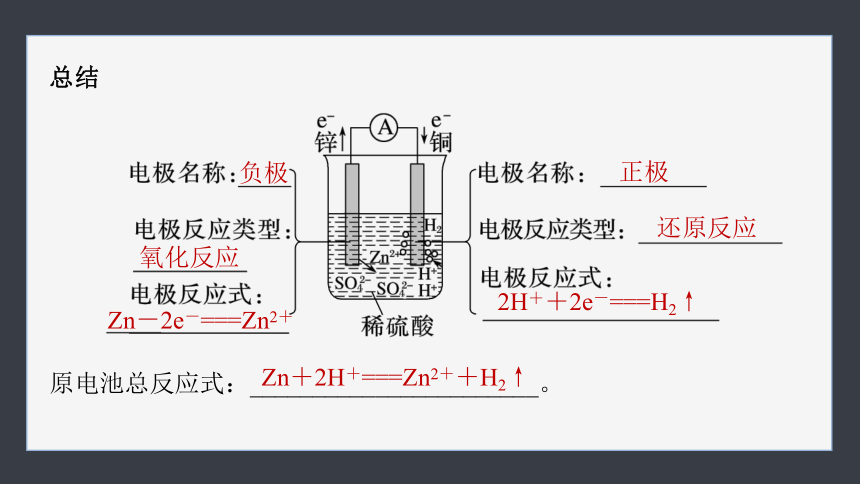
(3)原电池工作原理
【思考2】 结合上述实验和课本原电池原理示意图,分析说明该原电池的电极和导线、电解质溶液中的导电微粒分别是什么,并说明其移动方向。
总结
负极
氧化反应
Zn-2e-===Zn2+
正极
还原反应
2H++2e-===H2↑
原电池总反应式:_______________________。
Zn+2H+===Zn2++H2↑
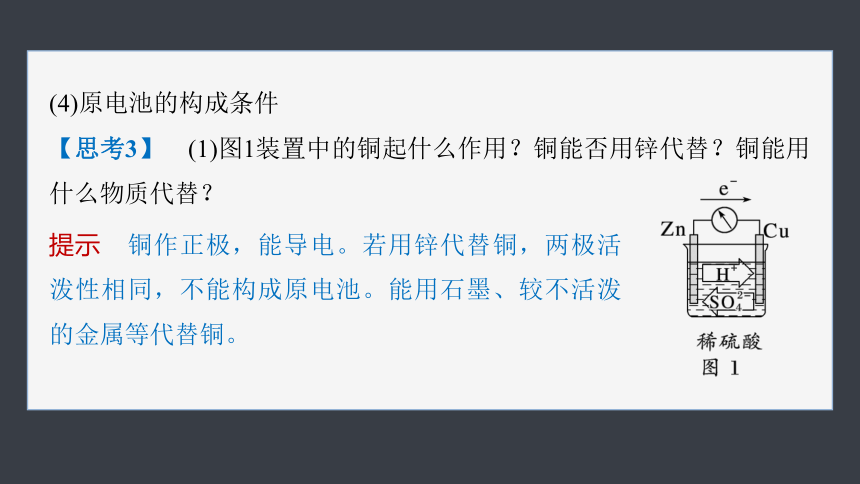
(4)原电池的构成条件
【思考3】 (1)图1装置中的铜起什么作用?铜能否用锌代替?铜能用什么物质代替?
提示 铜作正极,能导电。若用锌代替铜,两极活泼性相同,不能构成原电池。能用石墨、较不活泼的金属等代替铜。
(2)图2中将锌片换成铜,能形成原电池吗?
提示 不能,无自发进行的氧化还原反应。
(3)图2中用酒精代替稀硫酸能形成原电池吗?
提示 不能,酒精是非电解质,不导电。
总结
活泼性不同
电解质
闭合回路
氧化还原
1.判断正误
(1)火力发电过程中,机械能转化为电能是整个能量转化的关键
(2)原电池的电极材料必须是金属
(3)原电池工作时,正极与负极转移电子数相同
(4)在锌铜原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液流回锌
(5)原电池中阳离子向正极移动
应用体验
×
√
×
×
√
2.根据原电池原理,结合装置图,按要求解答问题:
(1)若X为Zn,Y为硫酸铜溶液,则X为_____(填电极
名称),判断依据:____________________________
__________;铜电极的名称是_____,溶液中的Cu2+
移向___(填“Cu”或“X”)电极。
(2)若X为银,Y为硝酸银溶液,则X为_____(填电极名称),判断依据:_____________________________________;铜电极的名称是_____,溶液中的Ag+移向___(填“Cu”或“X”)电极。X电极上的电极反应式为________________。
应用体验
负极
锌的活泼性比铜强(或Zn的还原
性比Cu强)
正极
Cu
正极
铜的活泼性比银强(或Cu的还原性比Ag强)
负极
X
Ag++e-===Ag
电极名称的判断方法
归纳总结
返回
原电池工作原理的应用
二
【思考】 用Zn和稀硫酸反应制氢气时,为了使反应加快,常常加入少量CuSO4溶液,请问这是为什么?
提示 锌和置换出的铜、稀硫酸构成了原电池,可以加快反应进行。
1.加快氧化还原反应的进行
在原电池中,氧化反应和还原反应分别在两极进行,使溶液中粒子运动相互间的干扰减小,使反应加快。
2.比较金属的活动性
一般,若两种金属A、B与电解质溶液构成原电池,若金属A作负极,则金属活动性:______。
A>B
3.设计原电池
(1)给定氧化还原反应设计原电池
一般给定氧化还原反应的还原剂作负极,氧化剂作电解质溶液,比负极活动性弱的金属或石墨等能导电的非金属作正极。
如:利用Cu+2AgNO3===Cu(NO3)2+2Ag的氧化还原反应可设计原电池。
该电池负极为Cu,电极反应式为_________________,正极为石墨(C),电极反应式为____________________。
Cu-2e-===Cu2+
2Ag++2e- ===2Ag
(2)简易电池的设计与制作
根据原电池原理,设计水果电池和制作简易电池,体会原电池的构成要素。
同学们在“简易电池的设计与制作”的实验中,对影响自制电池效果的因素进行了实验探究。
[提出问题] 影响自制电池效果的因素有哪些?
[查阅资源] 电极材料,电极间距,水果种类对自制水果电池的效果可能有影响。
[实验探究] Ⅰ.按如图连接水果电池。
例
Ⅱ.实验记录如下:
序号 电极 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
[解释与结论]
(1)实验①②③的目的是______________________________。
对比实验①②③得出的结论是__________________________________
________________________。
(2)欲得出“水果种类对电池效果有影响”的结论,需要对比实验______(填序号)。
对比④⑤得出的结论是________________________________________
_________________。
探究电极材料对电池效果的影响
在其他条件相同时,电极材料活泼性
差别越大,电池效果越好
①④
在其他条件相同时,电极间距越小,电流越
大,电池效果越好
[反思与探讨]
(3)水果电池中,水果的作用是_____________。
(4)对比实验①②③可知构成水果电池的电极必须具备的条件为______
_____________,构成水果电池的其他要素还有___________________
_______、_____________、_____________。
作电解质溶液
两极金
属活动性不同
能发生自发的氧化还
原反应
形成闭合回路
有电解质溶液
1.判断正误
(1)原电池中,负极材料的活动性一定强于正极材料的活动性
(2)只要是自发的放热的化学反应就可以设计为原电池
(3)原电池的负极上一定发生氧化反应,故负极本身质量一定减轻
(4)向Zn和稀H2SO4反应的溶液中,滴加几滴CuSO4溶液,产生气泡速率加快,是因为构成了原电池
(5)原电池中正极材料必须与电解质溶液的某种离子反应
应用体验
×
×
×
√
×
应用体验
2.现有如下两个反应:
A:H2SO4+2KOH===K2SO4+2H2O
B:Cu+2FeCl3===CuCl2+2FeCl2
(1)根据上述两反应的本质,___(填字母)反应能设计成原电池,其原因是__________________________________________________________
______。
B
A为非氧化还原反应,没有电子转移;B为氧化还原反应,有电子
转移
应用体验
(2)将上述反应中能设计成原电池的反应设计成原电池。
①写出电极反应式及反应类型:
负极:________________,_________;
正极:____________________,_________。
②画出装置图并标明电极材料、电解质溶液和电子流向。
③若导线上通过2 mol电子,则负极质量减轻___g。
返回
Cu-2e-===Cu2+
氧化反应
2Fe3++2e-===2Fe2+
还原反应
答案
64
随堂演练 知识落实
选项 A B C D
M 石墨 Zn Fe Al
N Ag Ag Cu Al
P 稀硫酸 蔗糖溶液 FeCl3溶液 NaOH溶液
1.(2023·辽宁抚顺高一校联考期中)下列各组材料组成如图装置,电流表指针能发生偏转的是
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
Ag、石墨与稀硫酸都不反应,不能构成原电池,
电流表指针不能发生偏转,故不选A;
蔗糖是非电解质,蔗糖溶液不导电,不能构成
原电池,电流表指针不能发生偏转,故不选B;
铁的活泼性大于铜,铁与氯化铁反应生成氯化亚铁,Fe、Cu、FeCl3溶液构成原电池,电流表指针能发生偏转,故选C;
M、N两个电极相同,不能构成原电池,电流表指针不能发生偏转,故不选D。
2.如图所示,a的金属活动性在氢之前,b为碳棒。下列关于该装置的说法正确的是
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出,溶液中c(H+)增大
C.导线上有电流,电流方向a→b
D.反应后a极质量减小
√
随堂演练
1
2
3
4
随堂演练
金属a可与稀硫酸反应,a为原电池的负极,a极失电子发生氧化反应,b为正极,发生还原反应,A不正确,D正确;
溶液中的H+在b极上得电子生成氢气,c(H+)减小,B不正确;
导线中电子流向为a→b,电流方向为b→a,C不正确。
1
2
3
4
3.(2023·安徽芜湖一中高一质检)a、b、c、d四种金属片浸入稀硫酸中,用导线两两组成原电池。若a、b相连时,电流由a经导线流向b;c、d相连时,d极质量减少;a、c相连时,c极上产生大量气泡;a、d相连时,H+移向d极,则四种金属的活动性顺序由强到弱的顺序为
A.b>a>d>c B.b>d>a>c
C.b>a>c>d D.b>d>a>c
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
若a、b相连,电流由a经导线流向b,a为正极,则活泼性:b>a;若c、d相连,d极质量减小,d为负极,则活泼性:d>c;a、c相连,c极上产生大量气泡,c为正极,则活泼性:a>c;a、d相连,H+移向d极,d为正极,则活泼性:a>d;所以金属活动性顺序由强到弱:b>a>d>c,A项正确。
4.(2023·陕西宝鸡高一统考期中)锌锰干电池是应用最普遍的电池之一,其基本反应:
随堂演练
1
2
3
4
(1)X是电池的___(填“正”或“负”,下同)极,Zn2+向___极移动。
负
正
X极Zn失电子,X作负极,Zn2+移向正极。
(2)该电池总反应的离子方程式为_________________________________
_____________。
该反应中MnO2是________(填“还原剂”或“氧化剂”)。
随堂演练
1
2
3
4
Zn+2MnO2+ ===Mn2O3+2NH3
+H2O +Zn2+
氧化剂
(3)若反应消耗16.25 g Zn,则电池中转移电子的物质的量为________。
随堂演练
1
2
3
4
因为1 mol Zn失2 mol电子,反应消耗16.25 g即0.25 mol Zn,所以电池中转移电子的物质的量为0.25 mol×2=0.5 mol。
0.5 mol
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 原电池工作原理
1.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是
A.Zn+Ag2O+H2O===Zn(OH)2+2Ag
B.Pb+PbO2+2H2SO4===2PbSO4+2H2O
C.Zn+CuSO4===Cu+ZnSO4
10
11
12
13
14
15
对点训练
√
D是吸热的氧化还原反应,反应过程中吸收能量,不能设计为原电池。
2.(2023·云南玉溪第一中学高一期中)下列关于原电池的叙述正确的是
A.原电池是将化学能转变为电能的装置
B.构成原电池的正极和负极材料必须是两种活动性不同的金属
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,在电解质溶液中阳离子移向负极
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
原电池是将化学能转变为电能的装置,A正确;
构成原电池的正极和负极的材料必须是能导电的材料,电极材料可以是金属,也可以是非金属,如石墨等,B错误;
在原电池中,负极失电子,被氧化,电子从负极流出,C错误;
原电池放电时,在电解质溶液中阳离子移向正极,D错误。
3.(2022·洛阳高一期末)下列各个装置中能持续形成原电池的是
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
原电池的形成条件为电极材料由两种活动性不同的金属或能导电的材料组成,两电极在电解质溶液中形成闭合回路。未形成闭合回路,A项错误;
酒精是非电解质,不导电,B项错误;
电极直接接触也可以形成原电池,C项正确;
浓硫酸使金属铝钝化,反应无法继续进行,故无法持续形成原电池,D项错误。
4.原电池原理的发现和各种电池装置的发明,改变了人们的生活方式。对如图所示的甲、乙两装置,下列分析正确的是
A.甲、乙均能将化学能转化为电能
B.甲、乙中铜片上均有气泡产生
C.甲、乙中铜片上均发生氧化反应
D.甲、乙中均能发生的反应是Zn+2H+===Zn2++H2↑
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
甲中Zn、Cu没有形成闭合回路,不是原电池装置,不能将化学能转化为电能,故A错误;
乙是原电池装置,Zn作负极, Cu作正极,H+在正极上得电子生成H2,甲不是原电池装置,甲中铜片上没有气泡产生,故B、C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.(2023·深圳高一校联考期中)海水电池为探索深海提供了能源保障。一种锂—海水电池以金属锂为负极,石墨为正极,下列关于该电池的描述正确的是
A.正极上发生氧化反应
B.电流由Li流向石墨
C.Li+由正极向负极迁移
D.电池的总反应为2Li+2H2O===2LiOH+H2↑
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
锂—海水电池以金属锂为负极,石墨为正极。电池的正极上发生还原反应,A错误;
电池中电流由正极流向负极,故电流由石墨流向Li,B错误;
电池中阳离子移向正极,故Li+由负极向正极迁移,C错误;
负极Li失电子生成Li+,正极水得电子生成氢氧根离子和氢气,故电池的总反应为2Li+2H2O===2LiOH+H2↑,D正确。
实验装置
部分实验现象 电子从a极流向b极 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极
题组二 原电池工作原理的应用
6.(2023·云南大理高一期中)有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如表:
A.a>b>c>d
B.b>c>d>a
C.d>a>b>c
D.a>b>d>c
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
装置一:原电池中,电子从a极流向b极,a极
为负极,b极为正极,所以金属的活动性顺序:
a>b;
装置二:未构成原电池,b极有气体产生,c极
无变化,所以金属的活动性顺序:b>c;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
装置三:原电池中,d极溶解,所以d是负极,
c极有气体产生,所以c是正极,所以金属的
活动性顺序:d>c;
装置四:原电池中,电流从a极流向d极,a极
为正极,d极为负极,所以金属的活动性顺序:
d>a;所以这四种金属的活动性顺序:d>a>b>c,故选C。
选项 A B C D
正极 Ag C Fe Cu
负极 Fe Fe Zn Fe
电解质溶液 FeCl3 FeCl2 Fe2(SO4)3 CuSO4
7.某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,能实现该反应的原电池是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
A中原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,正确;
B中没有自发的氧化还原反应,不能构成原电池,错误;
C中锌比铁活泼,锌作负极,发生氧化反应,总反应为Zn+2Fe3+===2Fe2++Zn2+,错误;
D中原电池总反应的离子方程式为Fe+Cu2+===Fe2++Cu,错误。
8.下列有关原电池的说法正确的是
A.将反应2Fe3++Fe===3Fe2+设计为原电池,则可用Zn为负极,Fe为正
极,FeCl3为电解质
B.铜片和铝片用导线连接后插入浓硝酸中,铜作负极
C.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
D.铝片和镁片用导线连接后插入NaOH溶液中,Mg较活泼作负极
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
Fe作负极,活泼性比Fe弱的作正极,所以不能用Zn作负极,故A错误;
Al遇到浓硝酸会钝化,Cu与浓硝酸反应,Cu作负极,故B正确;
电子由负极(锌)流向正极(铜),故C错误;
由Al、Mg、NaOH溶液组成的原电池,Al作负极失电子,故D错误。
D.X极上发生的是还原反应,Y极上发生的是氧化反应
9.(2022·温州高一检测)如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是
A.外电路的电流方向:X→外电路→Y
B.若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由外电路中的电子流向可知,X为负极,Y为正极,由图可知电子的流动方向是X→外电路→Y,则电流的方向应该是Y→外电路→X,故A错误;
X为原电池的负极,Y为正极,则X应为Zn,故B错误;
X极上发生的是氧化反应,Y极上发生的是还原反应,
故D错误。
综合强化
10.(2023·广东肇庆高一质检)某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,部分实验结果记录如下:
根据表中记录的实验现象,推
断下列说法不正确的是
A.实验2、3中Al均作电池的负极,
提供电子
B.实验2中H+在Cu极上发生还原
反应,电流表的指针偏向Cu
C.实验3中的Al电极反应式为Al-3e-+4OH-===[Al(OH)4]-
D.通过实验3可说明金属性:Mg>Al
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀硫酸 偏向Al
2 Cu、Al 稀硫酸 ……
3 Mg、Al NaOH溶液 偏向Mg
实验2、3中,自发进行的氧化还原反应分别是Al与稀硫酸、NaOH溶液的反应,所以Al作电池的负极,故A正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀硫酸 偏向Al
2 Cu、Al 稀硫酸 ……
3 Mg、Al NaOH溶液 偏向Mg
实验2中,Al作负极,Cu作正极,H+在Cu极上得电子发生还原反应生成H2,外电路电流由Cu电极流向Al电极,电流表的指针偏向Cu,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀硫酸 偏向Al
2 Cu、Al 稀硫酸 ……
3 Mg、Al NaOH溶液 偏向Mg
实验3中的Al电极作负极,失电子发生氧化反应,在碱性条件下电极反应式为Al-3e-+4OH-===[Al(OH)4]-,故C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀硫酸 偏向Al
2 Cu、Al 稀硫酸 ……
3 Mg、Al NaOH溶液 偏向Mg
一般情况,原电池中作负极的电极活泼性更强,金属性更强,因电解质溶液为NaOH溶液,只有Al才能与之反应,所以Al作负极,则不能说明金属性:Mg>Al,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀硫酸 偏向Al
2 Cu、Al 稀硫酸 ……
3 Mg、Al NaOH溶液 偏向Mg
11.(2022·黑龙江铁人中学高一期末)按图1所示装置进行实验,若图2中x轴表示流入正极的电子的物质的量,则y轴可以表示
①c(Ag+) ②c( ) ③a棒的质量
④b棒的质量 ⑤溶液的质量
A.①③ B.②④
C.①③⑤ D.②④⑤
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
负极反应式为Fe-2e-===Fe2+,正极
反应式为Ag++e-===Ag,则a棒的质
量逐渐减少,b棒的质量逐渐增加,
c(Ag+)逐渐减小,①③符合图像变化,
④不符合图像变化;
由电极反应式可知,每溶解56 g铁转移2 mol电子,有216 g银从溶液中析出,故随着反应的进行,溶液的质量减少,⑤符合图像变化。
12.由U形管、质量为m g的铁棒、质量为m g的碳棒和1 L 0.2 mol·L-1 CuCl2溶液组成的装置如图所示,下列说法正确的是
A.闭合K,电子通过电解质溶液移到碳棒上
B.闭合K,铁棒上有紫红色固体析出
C.闭合K,当电路中有0.3NA个电子通过时,理论上碳
棒与铁棒的质量差为18 g
D.闭合K,铁棒表面发生的电极反应为Cu2++2e-===Cu
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
15
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
闭合K,电子由铁棒通过导线流向碳棒,故A错误;
闭合K,碳棒为正极,溶液中铜离子在正极得到电子发生还原反应生成铜,碳棒上有紫红色固体析出,故B错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
闭合K,铁棒作原电池的负极,铁失去电子发生氧化反应生成亚铁离子,电极反应式为Fe-2e-===Fe2+,故D错误。
13.原电池是化学电源的雏形。
(1)如图连接好装置后,负极材料是____(填“Zn”或“Cu”)。
(2)相应原电池的总反应化学方程式为__________________________。
(3)下列化学反应可通过原电池装置,实现化学能直接转化为电能的是______(填序号)。
①2NaOH+H2SO4===Na2SO4 +2H2O
②Ag+Fe3+===Ag++Fe2+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
Zn
Zn+H2SO4===ZnSO4+H2↑
②③
14.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为_______________________。
(2)B中锡极为____极,电极反应式为
_________________,锡极附近溶液
的酸性______(填“增强”“减弱”
或“不变”)。B中Fe极为____极,电极反应式为_______________。
(3)C中被氧化的金属是____,总反应的化学方程式为_________________
_____________。
(4)A、B、C中铁被氧化由快到慢的顺序是__________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
Fe+2H+===Fe2++H2↑
正
2H++2e-===H2↑
减弱
负
Fe-2e-===Fe2+
Zn
Zn+H2SO4===
ZnSO4+H2↑
B>A>C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
A中不能形成原电池,铁与稀硫酸发生置换反应。
B中能形成原电池,铁比锡活泼,锡为正
极,铁为负极,铁被氧化的速率加快。
C能形成原电池,锌比铁活泼,锌为负极,
不断被氧化,铁为正极,保持不变。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15.如图为某化学兴趣小组探究不同条件下化学能转变为电能
的装置。根据原电池原理回答下列问题:
(1)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,该装置
工作时,Cu电极上可以看到的现象为____________, 向
___(填“a”或“b”)极移动,正极的电极反应式为_________________。
15
综合强化
有气体产生
a
2H++2e-===H2↑
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
由题中图示可知,Zn、Cu、稀硫酸构成的原电池,Zn为负极,Cu为正极,正极上发生得电子的还原反应,电极反应为2H++2e-===H2↑,Cu电极上可以看到的现象是有气体产生,根据原电池工作时阴离子向负极移动,即溶液中硫酸根离子移向负极a(Zn)电极。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)若电极a为Fe、电极b为Ag、电解质溶液为硝酸银溶液,该原电池工作时,原电池的负极材料为____,电子沿导线向___(填“a”或“b”)移动。
15
综合强化
Fe
b
若电极a为Fe、电极b为Ag、电解质溶液为硝酸银溶液,金属活动性:Fe>Ag,所以Fe为负极,Ag为正极,电子从负极经导线流向正极,即电子向b极移动。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(3)①FeCl3常用于腐蚀印刷电路铜板(2FeCl3+Cu===2FeCl2+CuCl2)。请将此反应设计成原电池,该原电池负极的电极材料为____,正极的电极材料为_______________________________________,电解质溶液为__________,负极的电极反应式为_________________。
②一段时间后负极质量减轻m g,则下列说法正确的是_____(填字母)。
A.电路中通过的电子为 mol
B.正极质量增加 g
C.原电池工作过程中电子由正极经导线流向负极
D.原电池工作过程中Cl-向负极移动
15
综合强化
Cu
Pt或石墨棒等比Cu不活泼的金属或惰性电极
FeCl3溶液
Cu-2e-===Cu2+
AD
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
由题中化学方程式Cu+2FeCl3===CuCl2+2FeCl2可知,Cu失电子发生氧化反应,所以Cu为负极,电极反应式为Cu-2e-===Cu2+,正极上铁离子得电子生成亚铁离子,发生还原反应,电极反应式为2Fe3++2e-===2Fe2+,正极材料是Pt、石墨棒等比Cu不活泼的金属或惰性电极,电解质溶液为FeCl3溶液。
返回
本课结束
第2课时 化学反应与电能
第六章 第一节
1.设计实验认识构成原电池的条件。
2.理解原电池的概念及工作原理,能正确判断原电池的正、负极。
3.了解原电池工作原理的应用。
核心素养
发展目标
内容索引
一、原电池构成条件及工作原理
二、原电池工作原理的应用
随堂演练 知识落实
课时对点练
原电池构成条件及工作原理
一
1.火力发电——化学能间接转化为电能
热
机械
化学能
____能
______能
其中能量转换的关键环节是______(氧化还原反应)。
燃烧
【思考1】 火力发电的缺点是什么?
提示 ①煤炭是不可再生能源,会造成能源危机;
②煤炭燃烧会产生污染性气体;
③经多次转换,能量损耗大,燃料的利用率低。
2.原电池——化学能直接转化为电能
(1)实验探究
实验装置
实验现象 铜片:_________ 锌片:__________ ___________ 铜片:____________ 锌片:_________ 电流表:_________
_____
没有变化
逐渐溶解,
有气泡产生
有气泡产生
逐渐溶解
指针发生
偏转
实验结论 锌与稀硫酸反应产生氢气,而铜不反应 锌______电子,经导线流向_____,H+在铜片上______电子被还原生成H2 导线中有_____通过,反应过程中产生了______
失去
铜片
得到
电流
电能
(2)原电池
①概念:将_____能转化为___能的装置。
②本质:发生_________反应。
③电极:负极:电子_____的一极,发生_____反应;
正极:电子______的一极,发生_____反应。
化学
电
氧化还原
流出
氧化
流入
还原
(3)原电池工作原理
【思考2】 结合上述实验和课本原电池原理示意图,分析说明该原电池的电极和导线、电解质溶液中的导电微粒分别是什么,并说明其移动方向。
总结
负极
氧化反应
Zn-2e-===Zn2+
正极
还原反应
2H++2e-===H2↑
原电池总反应式:_______________________。
Zn+2H+===Zn2++H2↑
(4)原电池的构成条件
【思考3】 (1)图1装置中的铜起什么作用?铜能否用锌代替?铜能用什么物质代替?
提示 铜作正极,能导电。若用锌代替铜,两极活泼性相同,不能构成原电池。能用石墨、较不活泼的金属等代替铜。
(2)图2中将锌片换成铜,能形成原电池吗?
提示 不能,无自发进行的氧化还原反应。
(3)图2中用酒精代替稀硫酸能形成原电池吗?
提示 不能,酒精是非电解质,不导电。
总结
活泼性不同
电解质
闭合回路
氧化还原
1.判断正误
(1)火力发电过程中,机械能转化为电能是整个能量转化的关键
(2)原电池的电极材料必须是金属
(3)原电池工作时,正极与负极转移电子数相同
(4)在锌铜原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液流回锌
(5)原电池中阳离子向正极移动
应用体验
×
√
×
×
√
2.根据原电池原理,结合装置图,按要求解答问题:
(1)若X为Zn,Y为硫酸铜溶液,则X为_____(填电极
名称),判断依据:____________________________
__________;铜电极的名称是_____,溶液中的Cu2+
移向___(填“Cu”或“X”)电极。
(2)若X为银,Y为硝酸银溶液,则X为_____(填电极名称),判断依据:_____________________________________;铜电极的名称是_____,溶液中的Ag+移向___(填“Cu”或“X”)电极。X电极上的电极反应式为________________。
应用体验
负极
锌的活泼性比铜强(或Zn的还原
性比Cu强)
正极
Cu
正极
铜的活泼性比银强(或Cu的还原性比Ag强)
负极
X
Ag++e-===Ag
电极名称的判断方法
归纳总结
返回
原电池工作原理的应用
二
【思考】 用Zn和稀硫酸反应制氢气时,为了使反应加快,常常加入少量CuSO4溶液,请问这是为什么?
提示 锌和置换出的铜、稀硫酸构成了原电池,可以加快反应进行。
1.加快氧化还原反应的进行
在原电池中,氧化反应和还原反应分别在两极进行,使溶液中粒子运动相互间的干扰减小,使反应加快。
2.比较金属的活动性
一般,若两种金属A、B与电解质溶液构成原电池,若金属A作负极,则金属活动性:______。
A>B
3.设计原电池
(1)给定氧化还原反应设计原电池
一般给定氧化还原反应的还原剂作负极,氧化剂作电解质溶液,比负极活动性弱的金属或石墨等能导电的非金属作正极。
如:利用Cu+2AgNO3===Cu(NO3)2+2Ag的氧化还原反应可设计原电池。
该电池负极为Cu,电极反应式为_________________,正极为石墨(C),电极反应式为____________________。
Cu-2e-===Cu2+
2Ag++2e- ===2Ag
(2)简易电池的设计与制作
根据原电池原理,设计水果电池和制作简易电池,体会原电池的构成要素。
同学们在“简易电池的设计与制作”的实验中,对影响自制电池效果的因素进行了实验探究。
[提出问题] 影响自制电池效果的因素有哪些?
[查阅资源] 电极材料,电极间距,水果种类对自制水果电池的效果可能有影响。
[实验探究] Ⅰ.按如图连接水果电池。
例
Ⅱ.实验记录如下:
序号 电极 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
[解释与结论]
(1)实验①②③的目的是______________________________。
对比实验①②③得出的结论是__________________________________
________________________。
(2)欲得出“水果种类对电池效果有影响”的结论,需要对比实验______(填序号)。
对比④⑤得出的结论是________________________________________
_________________。
探究电极材料对电池效果的影响
在其他条件相同时,电极材料活泼性
差别越大,电池效果越好
①④
在其他条件相同时,电极间距越小,电流越
大,电池效果越好
[反思与探讨]
(3)水果电池中,水果的作用是_____________。
(4)对比实验①②③可知构成水果电池的电极必须具备的条件为______
_____________,构成水果电池的其他要素还有___________________
_______、_____________、_____________。
作电解质溶液
两极金
属活动性不同
能发生自发的氧化还
原反应
形成闭合回路
有电解质溶液
1.判断正误
(1)原电池中,负极材料的活动性一定强于正极材料的活动性
(2)只要是自发的放热的化学反应就可以设计为原电池
(3)原电池的负极上一定发生氧化反应,故负极本身质量一定减轻
(4)向Zn和稀H2SO4反应的溶液中,滴加几滴CuSO4溶液,产生气泡速率加快,是因为构成了原电池
(5)原电池中正极材料必须与电解质溶液的某种离子反应
应用体验
×
×
×
√
×
应用体验
2.现有如下两个反应:
A:H2SO4+2KOH===K2SO4+2H2O
B:Cu+2FeCl3===CuCl2+2FeCl2
(1)根据上述两反应的本质,___(填字母)反应能设计成原电池,其原因是__________________________________________________________
______。
B
A为非氧化还原反应,没有电子转移;B为氧化还原反应,有电子
转移
应用体验
(2)将上述反应中能设计成原电池的反应设计成原电池。
①写出电极反应式及反应类型:
负极:________________,_________;
正极:____________________,_________。
②画出装置图并标明电极材料、电解质溶液和电子流向。
③若导线上通过2 mol电子,则负极质量减轻___g。
返回
Cu-2e-===Cu2+
氧化反应
2Fe3++2e-===2Fe2+
还原反应
答案
64
随堂演练 知识落实
选项 A B C D
M 石墨 Zn Fe Al
N Ag Ag Cu Al
P 稀硫酸 蔗糖溶液 FeCl3溶液 NaOH溶液
1.(2023·辽宁抚顺高一校联考期中)下列各组材料组成如图装置,电流表指针能发生偏转的是
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
Ag、石墨与稀硫酸都不反应,不能构成原电池,
电流表指针不能发生偏转,故不选A;
蔗糖是非电解质,蔗糖溶液不导电,不能构成
原电池,电流表指针不能发生偏转,故不选B;
铁的活泼性大于铜,铁与氯化铁反应生成氯化亚铁,Fe、Cu、FeCl3溶液构成原电池,电流表指针能发生偏转,故选C;
M、N两个电极相同,不能构成原电池,电流表指针不能发生偏转,故不选D。
2.如图所示,a的金属活动性在氢之前,b为碳棒。下列关于该装置的说法正确的是
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出,溶液中c(H+)增大
C.导线上有电流,电流方向a→b
D.反应后a极质量减小
√
随堂演练
1
2
3
4
随堂演练
金属a可与稀硫酸反应,a为原电池的负极,a极失电子发生氧化反应,b为正极,发生还原反应,A不正确,D正确;
溶液中的H+在b极上得电子生成氢气,c(H+)减小,B不正确;
导线中电子流向为a→b,电流方向为b→a,C不正确。
1
2
3
4
3.(2023·安徽芜湖一中高一质检)a、b、c、d四种金属片浸入稀硫酸中,用导线两两组成原电池。若a、b相连时,电流由a经导线流向b;c、d相连时,d极质量减少;a、c相连时,c极上产生大量气泡;a、d相连时,H+移向d极,则四种金属的活动性顺序由强到弱的顺序为
A.b>a>d>c B.b>d>a>c
C.b>a>c>d D.b>d>a>c
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
若a、b相连,电流由a经导线流向b,a为正极,则活泼性:b>a;若c、d相连,d极质量减小,d为负极,则活泼性:d>c;a、c相连,c极上产生大量气泡,c为正极,则活泼性:a>c;a、d相连,H+移向d极,d为正极,则活泼性:a>d;所以金属活动性顺序由强到弱:b>a>d>c,A项正确。
4.(2023·陕西宝鸡高一统考期中)锌锰干电池是应用最普遍的电池之一,其基本反应:
随堂演练
1
2
3
4
(1)X是电池的___(填“正”或“负”,下同)极,Zn2+向___极移动。
负
正
X极Zn失电子,X作负极,Zn2+移向正极。
(2)该电池总反应的离子方程式为_________________________________
_____________。
该反应中MnO2是________(填“还原剂”或“氧化剂”)。
随堂演练
1
2
3
4
Zn+2MnO2+ ===Mn2O3+2NH3
+H2O +Zn2+
氧化剂
(3)若反应消耗16.25 g Zn,则电池中转移电子的物质的量为________。
随堂演练
1
2
3
4
因为1 mol Zn失2 mol电子,反应消耗16.25 g即0.25 mol Zn,所以电池中转移电子的物质的量为0.25 mol×2=0.5 mol。
0.5 mol
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 原电池工作原理
1.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是
A.Zn+Ag2O+H2O===Zn(OH)2+2Ag
B.Pb+PbO2+2H2SO4===2PbSO4+2H2O
C.Zn+CuSO4===Cu+ZnSO4
10
11
12
13
14
15
对点训练
√
D是吸热的氧化还原反应,反应过程中吸收能量,不能设计为原电池。
2.(2023·云南玉溪第一中学高一期中)下列关于原电池的叙述正确的是
A.原电池是将化学能转变为电能的装置
B.构成原电池的正极和负极材料必须是两种活动性不同的金属
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,在电解质溶液中阳离子移向负极
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
原电池是将化学能转变为电能的装置,A正确;
构成原电池的正极和负极的材料必须是能导电的材料,电极材料可以是金属,也可以是非金属,如石墨等,B错误;
在原电池中,负极失电子,被氧化,电子从负极流出,C错误;
原电池放电时,在电解质溶液中阳离子移向正极,D错误。
3.(2022·洛阳高一期末)下列各个装置中能持续形成原电池的是
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
原电池的形成条件为电极材料由两种活动性不同的金属或能导电的材料组成,两电极在电解质溶液中形成闭合回路。未形成闭合回路,A项错误;
酒精是非电解质,不导电,B项错误;
电极直接接触也可以形成原电池,C项正确;
浓硫酸使金属铝钝化,反应无法继续进行,故无法持续形成原电池,D项错误。
4.原电池原理的发现和各种电池装置的发明,改变了人们的生活方式。对如图所示的甲、乙两装置,下列分析正确的是
A.甲、乙均能将化学能转化为电能
B.甲、乙中铜片上均有气泡产生
C.甲、乙中铜片上均发生氧化反应
D.甲、乙中均能发生的反应是Zn+2H+===Zn2++H2↑
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
甲中Zn、Cu没有形成闭合回路,不是原电池装置,不能将化学能转化为电能,故A错误;
乙是原电池装置,Zn作负极, Cu作正极,H+在正极上得电子生成H2,甲不是原电池装置,甲中铜片上没有气泡产生,故B、C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.(2023·深圳高一校联考期中)海水电池为探索深海提供了能源保障。一种锂—海水电池以金属锂为负极,石墨为正极,下列关于该电池的描述正确的是
A.正极上发生氧化反应
B.电流由Li流向石墨
C.Li+由正极向负极迁移
D.电池的总反应为2Li+2H2O===2LiOH+H2↑
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
锂—海水电池以金属锂为负极,石墨为正极。电池的正极上发生还原反应,A错误;
电池中电流由正极流向负极,故电流由石墨流向Li,B错误;
电池中阳离子移向正极,故Li+由负极向正极迁移,C错误;
负极Li失电子生成Li+,正极水得电子生成氢氧根离子和氢气,故电池的总反应为2Li+2H2O===2LiOH+H2↑,D正确。
实验装置
部分实验现象 电子从a极流向b极 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极
题组二 原电池工作原理的应用
6.(2023·云南大理高一期中)有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如表:
A.a>b>c>d
B.b>c>d>a
C.d>a>b>c
D.a>b>d>c
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
装置一:原电池中,电子从a极流向b极,a极
为负极,b极为正极,所以金属的活动性顺序:
a>b;
装置二:未构成原电池,b极有气体产生,c极
无变化,所以金属的活动性顺序:b>c;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
装置三:原电池中,d极溶解,所以d是负极,
c极有气体产生,所以c是正极,所以金属的
活动性顺序:d>c;
装置四:原电池中,电流从a极流向d极,a极
为正极,d极为负极,所以金属的活动性顺序:
d>a;所以这四种金属的活动性顺序:d>a>b>c,故选C。
选项 A B C D
正极 Ag C Fe Cu
负极 Fe Fe Zn Fe
电解质溶液 FeCl3 FeCl2 Fe2(SO4)3 CuSO4
7.某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,能实现该反应的原电池是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
A中原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,正确;
B中没有自发的氧化还原反应,不能构成原电池,错误;
C中锌比铁活泼,锌作负极,发生氧化反应,总反应为Zn+2Fe3+===2Fe2++Zn2+,错误;
D中原电池总反应的离子方程式为Fe+Cu2+===Fe2++Cu,错误。
8.下列有关原电池的说法正确的是
A.将反应2Fe3++Fe===3Fe2+设计为原电池,则可用Zn为负极,Fe为正
极,FeCl3为电解质
B.铜片和铝片用导线连接后插入浓硝酸中,铜作负极
C.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
D.铝片和镁片用导线连接后插入NaOH溶液中,Mg较活泼作负极
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
Fe作负极,活泼性比Fe弱的作正极,所以不能用Zn作负极,故A错误;
Al遇到浓硝酸会钝化,Cu与浓硝酸反应,Cu作负极,故B正确;
电子由负极(锌)流向正极(铜),故C错误;
由Al、Mg、NaOH溶液组成的原电池,Al作负极失电子,故D错误。
D.X极上发生的是还原反应,Y极上发生的是氧化反应
9.(2022·温州高一检测)如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是
A.外电路的电流方向:X→外电路→Y
B.若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由外电路中的电子流向可知,X为负极,Y为正极,由图可知电子的流动方向是X→外电路→Y,则电流的方向应该是Y→外电路→X,故A错误;
X为原电池的负极,Y为正极,则X应为Zn,故B错误;
X极上发生的是氧化反应,Y极上发生的是还原反应,
故D错误。
综合强化
10.(2023·广东肇庆高一质检)某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,部分实验结果记录如下:
根据表中记录的实验现象,推
断下列说法不正确的是
A.实验2、3中Al均作电池的负极,
提供电子
B.实验2中H+在Cu极上发生还原
反应,电流表的指针偏向Cu
C.实验3中的Al电极反应式为Al-3e-+4OH-===[Al(OH)4]-
D.通过实验3可说明金属性:Mg>Al
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀硫酸 偏向Al
2 Cu、Al 稀硫酸 ……
3 Mg、Al NaOH溶液 偏向Mg
实验2、3中,自发进行的氧化还原反应分别是Al与稀硫酸、NaOH溶液的反应,所以Al作电池的负极,故A正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀硫酸 偏向Al
2 Cu、Al 稀硫酸 ……
3 Mg、Al NaOH溶液 偏向Mg
实验2中,Al作负极,Cu作正极,H+在Cu极上得电子发生还原反应生成H2,外电路电流由Cu电极流向Al电极,电流表的指针偏向Cu,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀硫酸 偏向Al
2 Cu、Al 稀硫酸 ……
3 Mg、Al NaOH溶液 偏向Mg
实验3中的Al电极作负极,失电子发生氧化反应,在碱性条件下电极反应式为Al-3e-+4OH-===[Al(OH)4]-,故C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀硫酸 偏向Al
2 Cu、Al 稀硫酸 ……
3 Mg、Al NaOH溶液 偏向Mg
一般情况,原电池中作负极的电极活泼性更强,金属性更强,因电解质溶液为NaOH溶液,只有Al才能与之反应,所以Al作负极,则不能说明金属性:Mg>Al,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀硫酸 偏向Al
2 Cu、Al 稀硫酸 ……
3 Mg、Al NaOH溶液 偏向Mg
11.(2022·黑龙江铁人中学高一期末)按图1所示装置进行实验,若图2中x轴表示流入正极的电子的物质的量,则y轴可以表示
①c(Ag+) ②c( ) ③a棒的质量
④b棒的质量 ⑤溶液的质量
A.①③ B.②④
C.①③⑤ D.②④⑤
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
负极反应式为Fe-2e-===Fe2+,正极
反应式为Ag++e-===Ag,则a棒的质
量逐渐减少,b棒的质量逐渐增加,
c(Ag+)逐渐减小,①③符合图像变化,
④不符合图像变化;
由电极反应式可知,每溶解56 g铁转移2 mol电子,有216 g银从溶液中析出,故随着反应的进行,溶液的质量减少,⑤符合图像变化。
12.由U形管、质量为m g的铁棒、质量为m g的碳棒和1 L 0.2 mol·L-1 CuCl2溶液组成的装置如图所示,下列说法正确的是
A.闭合K,电子通过电解质溶液移到碳棒上
B.闭合K,铁棒上有紫红色固体析出
C.闭合K,当电路中有0.3NA个电子通过时,理论上碳
棒与铁棒的质量差为18 g
D.闭合K,铁棒表面发生的电极反应为Cu2++2e-===Cu
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
15
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
闭合K,电子由铁棒通过导线流向碳棒,故A错误;
闭合K,碳棒为正极,溶液中铜离子在正极得到电子发生还原反应生成铜,碳棒上有紫红色固体析出,故B错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
闭合K,铁棒作原电池的负极,铁失去电子发生氧化反应生成亚铁离子,电极反应式为Fe-2e-===Fe2+,故D错误。
13.原电池是化学电源的雏形。
(1)如图连接好装置后,负极材料是____(填“Zn”或“Cu”)。
(2)相应原电池的总反应化学方程式为__________________________。
(3)下列化学反应可通过原电池装置,实现化学能直接转化为电能的是______(填序号)。
①2NaOH+H2SO4===Na2SO4 +2H2O
②Ag+Fe3+===Ag++Fe2+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
Zn
Zn+H2SO4===ZnSO4+H2↑
②③
14.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为_______________________。
(2)B中锡极为____极,电极反应式为
_________________,锡极附近溶液
的酸性______(填“增强”“减弱”
或“不变”)。B中Fe极为____极,电极反应式为_______________。
(3)C中被氧化的金属是____,总反应的化学方程式为_________________
_____________。
(4)A、B、C中铁被氧化由快到慢的顺序是__________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
Fe+2H+===Fe2++H2↑
正
2H++2e-===H2↑
减弱
负
Fe-2e-===Fe2+
Zn
Zn+H2SO4===
ZnSO4+H2↑
B>A>C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
A中不能形成原电池,铁与稀硫酸发生置换反应。
B中能形成原电池,铁比锡活泼,锡为正
极,铁为负极,铁被氧化的速率加快。
C能形成原电池,锌比铁活泼,锌为负极,
不断被氧化,铁为正极,保持不变。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15.如图为某化学兴趣小组探究不同条件下化学能转变为电能
的装置。根据原电池原理回答下列问题:
(1)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,该装置
工作时,Cu电极上可以看到的现象为____________, 向
___(填“a”或“b”)极移动,正极的电极反应式为_________________。
15
综合强化
有气体产生
a
2H++2e-===H2↑
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
由题中图示可知,Zn、Cu、稀硫酸构成的原电池,Zn为负极,Cu为正极,正极上发生得电子的还原反应,电极反应为2H++2e-===H2↑,Cu电极上可以看到的现象是有气体产生,根据原电池工作时阴离子向负极移动,即溶液中硫酸根离子移向负极a(Zn)电极。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)若电极a为Fe、电极b为Ag、电解质溶液为硝酸银溶液,该原电池工作时,原电池的负极材料为____,电子沿导线向___(填“a”或“b”)移动。
15
综合强化
Fe
b
若电极a为Fe、电极b为Ag、电解质溶液为硝酸银溶液,金属活动性:Fe>Ag,所以Fe为负极,Ag为正极,电子从负极经导线流向正极,即电子向b极移动。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(3)①FeCl3常用于腐蚀印刷电路铜板(2FeCl3+Cu===2FeCl2+CuCl2)。请将此反应设计成原电池,该原电池负极的电极材料为____,正极的电极材料为_______________________________________,电解质溶液为__________,负极的电极反应式为_________________。
②一段时间后负极质量减轻m g,则下列说法正确的是_____(填字母)。
A.电路中通过的电子为 mol
B.正极质量增加 g
C.原电池工作过程中电子由正极经导线流向负极
D.原电池工作过程中Cl-向负极移动
15
综合强化
Cu
Pt或石墨棒等比Cu不活泼的金属或惰性电极
FeCl3溶液
Cu-2e-===Cu2+
AD
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
由题中化学方程式Cu+2FeCl3===CuCl2+2FeCl2可知,Cu失电子发生氧化反应,所以Cu为负极,电极反应式为Cu-2e-===Cu2+,正极上铁离子得电子生成亚铁离子,发生还原反应,电极反应式为2Fe3++2e-===2Fe2+,正极材料是Pt、石墨棒等比Cu不活泼的金属或惰性电极,电解质溶液为FeCl3溶液。
返回
本课结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
