第八单元金属和金属材料 达标训练题---2023-2024学年九年级化学人教版下册(含答案)
文档属性
| 名称 | 第八单元金属和金属材料 达标训练题---2023-2024学年九年级化学人教版下册(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 124.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-13 00:00:00 | ||
图片预览



文档简介
第八单元金属和金属材料 达标训练题
一、选择题
1.下列有关能源和资源说法错误的是()
A.在金属资源中,铝的年产量已超过铜,位于铁之后,居第二位
B.作为高能燃料,液氢已应用于航天等领域
C.陆地储水中也有咸水,淡水只约占全球水储量的0.97%、
D.地壳中氧元素的含量最多,它的质量分数接近50%
2.下列说法错误的是( )
A.地壳中含量最多的元素是氧元素
B.空气中含量最多的元素是氮元素
C.人体中含量最多的金属元素是钙元素
D.海水中含量最多的元素是钠元素
3.无论在地壳里或生物细胞里,其质量含量都最高的是( )
A.O B.H C.Al D.C
4.下列做法正确的是( )
A.要经常用钢刷擦洗铝锅上的污垢,保持铝锅的光亮洁净
B.用铁制容器配制波尔多液
C.被雨水淋湿的自行车须先用带油的布擦,再用干布擦
D.给自行车的链条涂油以防生锈
5.下列物质的用途与性质对应正确的( )
A.金属钨用于制作灯丝——熔点高
B.一氧化碳用于冶炼金属——可燃性
C.氦气用于填充探空气球——通电时能发光
D.氮气用作食品保护气——没有颜色和气味
6.下图所示反应,有关说法的不正确的是()
A.铝丝需要砂纸打磨
B.溶液由蓝色变为无色
C.金属活动性强弱:Al>Cu
D.反应的化学方程式为:Al+CuSO4=Cu+AlSO4
7.为验证Zn、Cu和Ag三种金属的活动性顺序,设计的下列实验方案能达到目的是( )
A.将Zn、Cu分别加入AgNO3溶液中
B.将Zn、Cu和Ag分别加入稀盐酸中
C.将Zn、Ag分别加入CuSO4溶液中
D.将Zn分别加入CuSO4、AgNO3溶液中
8.元素在自然界里分布不均匀,在地壳里含量最多的金属元素是( )
A.Fe B.Si C.O D.Al
9.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理方案的个数是( )
①比较硬度,硬度小的是“愚人金”
②灼烧,表面变色的是“愚人金”
③浸没在稀碗酸中,表面有气海产生的是“愚人金”
④浸没在硫酸镁溶液中,表面附着白色物质的是“愚人金”
A.1个 B.2个 C.3个 D.4个
10.硅(Si)是信息技术的关键材料,工业制硅的反应之一是 。下列说法正确的是( )
A.Si是地壳中含量最多的元素
B.X的化学式为H4Cl4
C.SiCl4中硅元素的化合价是-4价
D.该反应中只有氯元素的化合价未发生改变
11.小明为探究金属与盐的反应,将一定质量的某种金属M的粉末放入AgNO3与Cu(NO3)2的混合溶液中,充分反应后发现,溶液呈现无色,溶液底部有少量固体粉末;过滤后在滤渣和滤液中分别加入适量稀盐酸,滤渣中有无色气体产生,滤液中无沉淀产生。结合实际现象判断,小明得出的以下结论正确的是( )
A.滤液中一定没有银离子, 可能含有铜离子
B.滤渣中一定含有金属银和铜
C.滤渣中一定不含有金属M
D.加入的金属M 可能是单质铁
12.一包Fe粉样品中含有两种杂质,取56g样品跟足量稀硫酸反应,得到5g氢气,则此样品中的杂质可能是( )
A.Cu和Zn B.Al和Zn C.Mg和Cu D.Mg和Zn
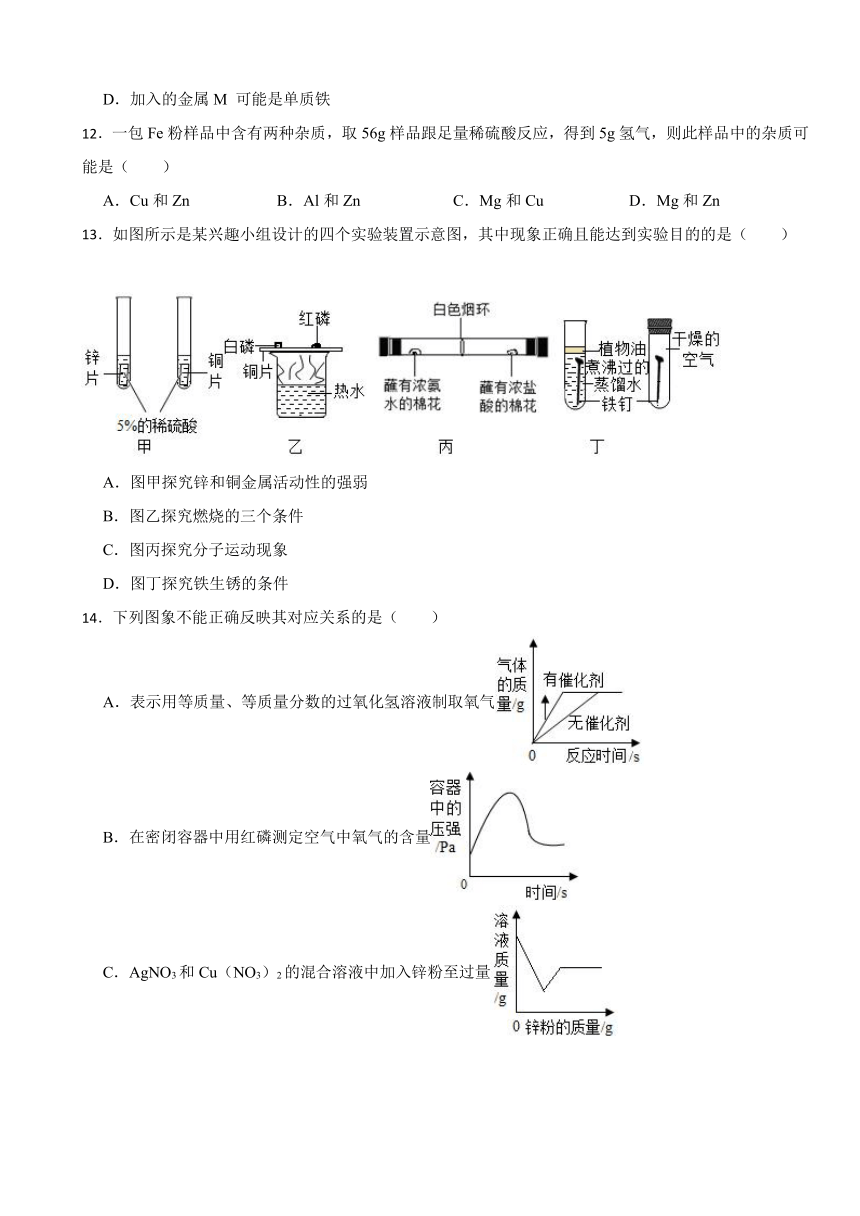
13.如图所示是某兴趣小组设计的四个实验装置示意图,其中现象正确且能达到实验目的的是( )
A.图甲探究锌和铜金属活动性的强弱
B.图乙探究燃烧的三个条件
C.图丙探究分子运动现象
D.图丁探究铁生锈的条件
14.下列图象不能正确反映其对应关系的是( )
A.表示用等质量、等质量分数的过氧化氢溶液制取氧气
B.在密闭容器中用红磷测定空气中氧气的含量
C.AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
D.分别向等质量的锌粉和铁粉中,加入足量等质量分数的稀盐酸
二、非选择题
15. 用化学用语填空:空气中含量最多且常用作保护气的是 ;人体含量最高的金属元素与地壳含量最多的元素形成的化合物是 ;金刚石和石墨都是碳元素组成的单质,两者物理性质差别较大的原因是 。
16.请回答下列问题。
(1)人类文明与金属材料的发展应用关系十分密切。
①三星堆遗址的重大考古发现,向世界展示了中华传统文化所蕴含的丰富宝藏和巨大魅力。三星堆遗址现己出土了青铜面具、青铜神树、象牙等重要文物。青铜的硬度比纯铜要 (选填“大”或“小”)。
②西汉刘安所著《淮南万毕术》中有关于“曾青(硫酸铜溶液)得铁则化为铜”的记载,湿法炼铜这类化学反应属于 反应。(选填“分解“化合“置换“复分解”之一)
③近现代,钢铁工业的发展状况是世界各国工业化水平的重要标志之一,利用一氧化碳和氧化铁在高温条件下发生反应,是目前工业炼铁的主要原理,请你写出该反应的化学方程式: 。
(2)为测定某赤铁矿石中所含氧化铁的质量分数,实验小组的同学称取10.0g赤铁矿石样品倒入烧杯中,然后向其中逐滴加入溶质质量分数为10.95%的稀盐酸。加入稀盐酸的质量与反应后剩余固体的质量关系如下图所示(赤铁矿石中所含杂质不溶于水,也不与稀盐酸反应),试回答:
①当滴入稀盐酸200g时(即图中。B点时),烧杯内溶液中的溶质是 (填化学式)。
②请读取图中信息,计算该赤铁矿石中含氧化铁的质量分数 。
③若要处理实验后B点的废液,应向废液中加入 g氢氧化钠。
17.学习金属活动性顺序后,老师安排同学们开展系列实验探究金属间的置换反应规律。小明做完铝条和氯化铜溶液反应的实验后,将反应后的无色溶液(以下简称:待测溶液)倒入有水的废液缸中时,发现有白色沉淀析出的“异常现象”。小明设计实验开展了如下探究。请根据要求回答有关问题:
(发现问题)
小明取一滴管未倒完的待测溶液,将其注入盛有约三分之二试管体积的水中,依然产生大量白色沉淀(像牛奶一样)。
(提出问题)
待测溶液注入水中为什么有白色沉淀产生?白色沉淀是什么物质?
(1)(查阅资料)
①AlCl3是一种无色透明晶体,极易与水反应生成难溶于水的Al(OH)3而产生白色沉淀;
②CuCl是一种不溶于水的白色固体,易溶于一定浓度的KCl、NaCl等含Cl-的溶液中;CuCl中Cu的化合价为 。
(2)(提出猜想)
猜想Ⅰ:白色沉淀是Al(OH)3
猜想Ⅱ:白色沉淀是CuCl
猜想Ⅲ:白色沉淀是Al(OH)3和CuCl的混合物
(实验探究)
序号 实验操作 实验现象 实验结论
① 取一滴管待测溶液,将其注入盛有约三分之二试管体积一定浓度的NaCl溶液中 无明显实验现象 猜想 正确
② 取约2mL待测溶液于试管中,向溶液中插入足量洁净的Al条,充分反应 有红色固体析出
③ 取一滴管实验②后的溶液,将其注入盛有约三分之二试管体积的水中 无明显实验现象
(3)(结论与反思)
①上述实验表明,Al和CuCl2溶液的反应是分步进行的。第一步反应生成CuCl,第二步CuCl继续和Al反应生成Cu。请分别写出上述两步反应的化学方程式:第一步: ,第二步: 。
②待测溶液中含有大量CuCl,为什么它没有以白色沉淀的形式存在?请说明原因: 。
③设计实验③的目的是 。
(4)(启示与拓展)
通过对Al和CuCl2溶液反应的实验探究,使我们认识到,我们不少的传统认识远没有做到细致入微,特别是当观察到有红色固体析出,于是就贸然断定这个反应是个简单的、一步完成的置换反应。实际上还要关注物质变化的过程,通过比较和分析,得出可靠的结论。经过无数次实验证明,有些化学反应看似一步完成,实际上是分步进行的。请根据你所学知识,任举一例反应可能分步进行的实例: 。
18.现有A,B两种银白色的金属,某同学想要探究这两种金属的活动性
(设计实验)
取大小相同的两块金属,用砂纸打磨光亮,分别放入两支试管中再加入等量的同种稀盐酸,操作与现象如表:
实验 试管1 试管2
操作
现象 金属表面产生气泡较慢 金属表面产生气泡较快
(思考结论)
(1)通过上述实验,判断出两种金属的活动性顺序是A B(填“>”或“<”)。
(2)假设金属B是铝,写出其中发生反应的化学方程式 。
(3)实验前用砂纸打磨金属片的目的是 。
19.利用化学研发新材料,改善人们生活。
(1)北京冬奥会火炬“飞扬”选用氢气做燃料,优点是 ;领奖礼仪服内胆添加石墨烯(单层的石墨片)发热材料,石墨烯属于 (填“单质”或“化合物”)。
(2)重庆白居寺长江大桥是目前世界最大跨度公轨两用钢桁梁斜拉索桥,采用高强度抗拉钢丝(含Fe、Si、Mn、Cr、Ti等),该钢的硬度和强度比纯铁更 ,能拉成丝体现了金属的 性。
(3)稀土储氢合金材料在较低温度下能可逆地吸收和释放氢气,写出LaNi5与氢气在加压条件下生成LaNi5H6的化学方程式 。
20.金属材料广泛应用于生产生活中。
(1)由于铜具有良好的 性,所以铜常用于制作导线。
(2)铝在空气中表现出良好的抗腐蚀性能,用化学方程式表示其原因 。
(3)用化学方程式表示以赤铁矿石(主要成分为 )为原料冶炼生铁的反应原理: 。
(4)向 、 、 的混合溶液中,加入一定量的铁粉,充分反应后过滤,滤液呈蓝色。下列判断正确的是 (填序号)。
A 向滤渣中加入稀盐酸,可能有气泡产生
B 滤液中一定含有 、 和
C 与原溶液相比,滤液的质量可能增大
D 向滤液中滴入稀盐酸,可能会有白色沉淀出现
(5)现有碳酸氢钠样品 (杂质不含钠元素,受热不变化),其中钠元素的质量分数为23%,180℃时,将样品加热一段时间后称得固体质量为 ,则分解的碳酸氢钠占原碳酸氢钠的质量分数为 。(已知: )
答案解析部分
1.【答案】C
2.【答案】D
3.【答案】A
4.【答案】D
5.【答案】A
6.【答案】D
7.【答案】C
8.【答案】D
9.【答案】B
10.【答案】D
11.【答案】B
12.【答案】B
13.【答案】A
14.【答案】B
15.【答案】N2;CaO;原子排列方式不同
16.【答案】(1)大;置换;
(2)FeCl3、HCl;80%;12
17.【答案】(1)+1
(2)Ⅱ
(3);;待测溶液中氯离子过高;证明溶液中氯化铝没有生成氢氧化铝沉淀
(4)碳燃烧生成二氧化碳可能是碳首先和氧气反应生成一氧化碳、一氧化碳再和氧气生成二氧化碳(合理即可)
18.【答案】(1)<
(2)2Al+6HCl═2AlCl3+3H2↑
(3)除去金属表面的氧化膜或污物,利于反应进行
19.【答案】(1)热值大;单质
(2)大;延展
(3)
20.【答案】(1)导电
(2)
(3)
(4)BD
(5)40%
一、选择题
1.下列有关能源和资源说法错误的是()
A.在金属资源中,铝的年产量已超过铜,位于铁之后,居第二位
B.作为高能燃料,液氢已应用于航天等领域
C.陆地储水中也有咸水,淡水只约占全球水储量的0.97%、
D.地壳中氧元素的含量最多,它的质量分数接近50%
2.下列说法错误的是( )
A.地壳中含量最多的元素是氧元素
B.空气中含量最多的元素是氮元素
C.人体中含量最多的金属元素是钙元素
D.海水中含量最多的元素是钠元素
3.无论在地壳里或生物细胞里,其质量含量都最高的是( )
A.O B.H C.Al D.C
4.下列做法正确的是( )
A.要经常用钢刷擦洗铝锅上的污垢,保持铝锅的光亮洁净
B.用铁制容器配制波尔多液
C.被雨水淋湿的自行车须先用带油的布擦,再用干布擦
D.给自行车的链条涂油以防生锈
5.下列物质的用途与性质对应正确的( )
A.金属钨用于制作灯丝——熔点高
B.一氧化碳用于冶炼金属——可燃性
C.氦气用于填充探空气球——通电时能发光
D.氮气用作食品保护气——没有颜色和气味
6.下图所示反应,有关说法的不正确的是()
A.铝丝需要砂纸打磨
B.溶液由蓝色变为无色
C.金属活动性强弱:Al>Cu
D.反应的化学方程式为:Al+CuSO4=Cu+AlSO4
7.为验证Zn、Cu和Ag三种金属的活动性顺序,设计的下列实验方案能达到目的是( )
A.将Zn、Cu分别加入AgNO3溶液中
B.将Zn、Cu和Ag分别加入稀盐酸中
C.将Zn、Ag分别加入CuSO4溶液中
D.将Zn分别加入CuSO4、AgNO3溶液中
8.元素在自然界里分布不均匀,在地壳里含量最多的金属元素是( )
A.Fe B.Si C.O D.Al
9.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理方案的个数是( )
①比较硬度,硬度小的是“愚人金”
②灼烧,表面变色的是“愚人金”
③浸没在稀碗酸中,表面有气海产生的是“愚人金”
④浸没在硫酸镁溶液中,表面附着白色物质的是“愚人金”
A.1个 B.2个 C.3个 D.4个
10.硅(Si)是信息技术的关键材料,工业制硅的反应之一是 。下列说法正确的是( )
A.Si是地壳中含量最多的元素
B.X的化学式为H4Cl4
C.SiCl4中硅元素的化合价是-4价
D.该反应中只有氯元素的化合价未发生改变
11.小明为探究金属与盐的反应,将一定质量的某种金属M的粉末放入AgNO3与Cu(NO3)2的混合溶液中,充分反应后发现,溶液呈现无色,溶液底部有少量固体粉末;过滤后在滤渣和滤液中分别加入适量稀盐酸,滤渣中有无色气体产生,滤液中无沉淀产生。结合实际现象判断,小明得出的以下结论正确的是( )
A.滤液中一定没有银离子, 可能含有铜离子
B.滤渣中一定含有金属银和铜
C.滤渣中一定不含有金属M
D.加入的金属M 可能是单质铁
12.一包Fe粉样品中含有两种杂质,取56g样品跟足量稀硫酸反应,得到5g氢气,则此样品中的杂质可能是( )
A.Cu和Zn B.Al和Zn C.Mg和Cu D.Mg和Zn
13.如图所示是某兴趣小组设计的四个实验装置示意图,其中现象正确且能达到实验目的的是( )
A.图甲探究锌和铜金属活动性的强弱
B.图乙探究燃烧的三个条件
C.图丙探究分子运动现象
D.图丁探究铁生锈的条件
14.下列图象不能正确反映其对应关系的是( )
A.表示用等质量、等质量分数的过氧化氢溶液制取氧气
B.在密闭容器中用红磷测定空气中氧气的含量
C.AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
D.分别向等质量的锌粉和铁粉中,加入足量等质量分数的稀盐酸
二、非选择题
15. 用化学用语填空:空气中含量最多且常用作保护气的是 ;人体含量最高的金属元素与地壳含量最多的元素形成的化合物是 ;金刚石和石墨都是碳元素组成的单质,两者物理性质差别较大的原因是 。
16.请回答下列问题。
(1)人类文明与金属材料的发展应用关系十分密切。
①三星堆遗址的重大考古发现,向世界展示了中华传统文化所蕴含的丰富宝藏和巨大魅力。三星堆遗址现己出土了青铜面具、青铜神树、象牙等重要文物。青铜的硬度比纯铜要 (选填“大”或“小”)。
②西汉刘安所著《淮南万毕术》中有关于“曾青(硫酸铜溶液)得铁则化为铜”的记载,湿法炼铜这类化学反应属于 反应。(选填“分解“化合“置换“复分解”之一)
③近现代,钢铁工业的发展状况是世界各国工业化水平的重要标志之一,利用一氧化碳和氧化铁在高温条件下发生反应,是目前工业炼铁的主要原理,请你写出该反应的化学方程式: 。
(2)为测定某赤铁矿石中所含氧化铁的质量分数,实验小组的同学称取10.0g赤铁矿石样品倒入烧杯中,然后向其中逐滴加入溶质质量分数为10.95%的稀盐酸。加入稀盐酸的质量与反应后剩余固体的质量关系如下图所示(赤铁矿石中所含杂质不溶于水,也不与稀盐酸反应),试回答:
①当滴入稀盐酸200g时(即图中。B点时),烧杯内溶液中的溶质是 (填化学式)。
②请读取图中信息,计算该赤铁矿石中含氧化铁的质量分数 。
③若要处理实验后B点的废液,应向废液中加入 g氢氧化钠。
17.学习金属活动性顺序后,老师安排同学们开展系列实验探究金属间的置换反应规律。小明做完铝条和氯化铜溶液反应的实验后,将反应后的无色溶液(以下简称:待测溶液)倒入有水的废液缸中时,发现有白色沉淀析出的“异常现象”。小明设计实验开展了如下探究。请根据要求回答有关问题:
(发现问题)
小明取一滴管未倒完的待测溶液,将其注入盛有约三分之二试管体积的水中,依然产生大量白色沉淀(像牛奶一样)。
(提出问题)
待测溶液注入水中为什么有白色沉淀产生?白色沉淀是什么物质?
(1)(查阅资料)
①AlCl3是一种无色透明晶体,极易与水反应生成难溶于水的Al(OH)3而产生白色沉淀;
②CuCl是一种不溶于水的白色固体,易溶于一定浓度的KCl、NaCl等含Cl-的溶液中;CuCl中Cu的化合价为 。
(2)(提出猜想)
猜想Ⅰ:白色沉淀是Al(OH)3
猜想Ⅱ:白色沉淀是CuCl
猜想Ⅲ:白色沉淀是Al(OH)3和CuCl的混合物
(实验探究)
序号 实验操作 实验现象 实验结论
① 取一滴管待测溶液,将其注入盛有约三分之二试管体积一定浓度的NaCl溶液中 无明显实验现象 猜想 正确
② 取约2mL待测溶液于试管中,向溶液中插入足量洁净的Al条,充分反应 有红色固体析出
③ 取一滴管实验②后的溶液,将其注入盛有约三分之二试管体积的水中 无明显实验现象
(3)(结论与反思)
①上述实验表明,Al和CuCl2溶液的反应是分步进行的。第一步反应生成CuCl,第二步CuCl继续和Al反应生成Cu。请分别写出上述两步反应的化学方程式:第一步: ,第二步: 。
②待测溶液中含有大量CuCl,为什么它没有以白色沉淀的形式存在?请说明原因: 。
③设计实验③的目的是 。
(4)(启示与拓展)
通过对Al和CuCl2溶液反应的实验探究,使我们认识到,我们不少的传统认识远没有做到细致入微,特别是当观察到有红色固体析出,于是就贸然断定这个反应是个简单的、一步完成的置换反应。实际上还要关注物质变化的过程,通过比较和分析,得出可靠的结论。经过无数次实验证明,有些化学反应看似一步完成,实际上是分步进行的。请根据你所学知识,任举一例反应可能分步进行的实例: 。
18.现有A,B两种银白色的金属,某同学想要探究这两种金属的活动性
(设计实验)
取大小相同的两块金属,用砂纸打磨光亮,分别放入两支试管中再加入等量的同种稀盐酸,操作与现象如表:
实验 试管1 试管2
操作
现象 金属表面产生气泡较慢 金属表面产生气泡较快
(思考结论)
(1)通过上述实验,判断出两种金属的活动性顺序是A B(填“>”或“<”)。
(2)假设金属B是铝,写出其中发生反应的化学方程式 。
(3)实验前用砂纸打磨金属片的目的是 。
19.利用化学研发新材料,改善人们生活。
(1)北京冬奥会火炬“飞扬”选用氢气做燃料,优点是 ;领奖礼仪服内胆添加石墨烯(单层的石墨片)发热材料,石墨烯属于 (填“单质”或“化合物”)。
(2)重庆白居寺长江大桥是目前世界最大跨度公轨两用钢桁梁斜拉索桥,采用高强度抗拉钢丝(含Fe、Si、Mn、Cr、Ti等),该钢的硬度和强度比纯铁更 ,能拉成丝体现了金属的 性。
(3)稀土储氢合金材料在较低温度下能可逆地吸收和释放氢气,写出LaNi5与氢气在加压条件下生成LaNi5H6的化学方程式 。
20.金属材料广泛应用于生产生活中。
(1)由于铜具有良好的 性,所以铜常用于制作导线。
(2)铝在空气中表现出良好的抗腐蚀性能,用化学方程式表示其原因 。
(3)用化学方程式表示以赤铁矿石(主要成分为 )为原料冶炼生铁的反应原理: 。
(4)向 、 、 的混合溶液中,加入一定量的铁粉,充分反应后过滤,滤液呈蓝色。下列判断正确的是 (填序号)。
A 向滤渣中加入稀盐酸,可能有气泡产生
B 滤液中一定含有 、 和
C 与原溶液相比,滤液的质量可能增大
D 向滤液中滴入稀盐酸,可能会有白色沉淀出现
(5)现有碳酸氢钠样品 (杂质不含钠元素,受热不变化),其中钠元素的质量分数为23%,180℃时,将样品加热一段时间后称得固体质量为 ,则分解的碳酸氢钠占原碳酸氢钠的质量分数为 。(已知: )
答案解析部分
1.【答案】C
2.【答案】D
3.【答案】A
4.【答案】D
5.【答案】A
6.【答案】D
7.【答案】C
8.【答案】D
9.【答案】B
10.【答案】D
11.【答案】B
12.【答案】B
13.【答案】A
14.【答案】B
15.【答案】N2;CaO;原子排列方式不同
16.【答案】(1)大;置换;
(2)FeCl3、HCl;80%;12
17.【答案】(1)+1
(2)Ⅱ
(3);;待测溶液中氯离子过高;证明溶液中氯化铝没有生成氢氧化铝沉淀
(4)碳燃烧生成二氧化碳可能是碳首先和氧气反应生成一氧化碳、一氧化碳再和氧气生成二氧化碳(合理即可)
18.【答案】(1)<
(2)2Al+6HCl═2AlCl3+3H2↑
(3)除去金属表面的氧化膜或污物,利于反应进行
19.【答案】(1)热值大;单质
(2)大;延展
(3)
20.【答案】(1)导电
(2)
(3)
(4)BD
(5)40%
同课章节目录
