江苏省南通市名校联盟2023-2024学年高三上学期1月第二次调研化学试卷(含答案)
文档属性
| 名称 | 江苏省南通市名校联盟2023-2024学年高三上学期1月第二次调研化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-14 00:00:00 | ||
图片预览



文档简介
南通市名校联盟2023-2024学年高三上学期1月第二次调研
化学
注意事项
考生在答题前请认真阅读本注意事项及各题答题要求:
1.本试卷共8页,满分为100分,考试时间为75分钟。考试结束后,请将本试卷和答题卡一并交回。
2.答题前,请务必将自己的姓名、准考证号用0.5毫米黑色墨水的签字笔填写在试卷及答题卡的规定位置。
3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符。
4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑:如需改动,请用橡皮擦干净后,再选涂其他答案。作答非选择题,必须用0.5毫米黑色墨水的签字笔在答题卡上的指定位置作答,在其他位置作答一律无效。
5.如需作图,必须用2B铅笔绘、写清楚,线条、符号等须加黑、加粗。
可能用到的相对原子质量:
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.下列有关物质性质与用途具有对应关系的是( )
A.能与酸反应,可用于制作红色涂料
B.吸收产生,可用作呼吸面具供氧剂
C.有还原性,可用于自来水的杀菌消毒
D.硬度大,可用于制造光导纤维
2.沸石是一类分子架构奇特的含水矿物的总称。其中的天然沸石是一类含水铝硅酸盐晶体的总称,它们会因释放水而呈沸腾状,故而得名沸石,又称分子筛(严格说,沸石和分子筛两个术语的内涵是不同的,但经常被不加区别地混用)。它们往往具有复杂的结构,可以灵活地吸水和脱水。以下给出了几种沸石的结构图( )
其中一种A型沸石的分子式可表示为。用氢氧化钠、铝酸钠和偏硅酸钠在室温下混合后在结晶,干燥即可得到A型沸石。则下列说法不正确的是( )
A.沸石具有广泛的用途,可作为吸附剂、干燥剂、催化剂等,并可用于防止溶液暴沸
B.相比较一些传统干燥剂如等,沸石具备优异的再生性能,可反复使用
C.用氢氧化钠、铝酸钾和偏硅酸钠在室温下混合后在结晶,干燥一定可以得到纯净的A型沸石
D.由上图给出的沸石笼孔道的结构示意可以推测分子筛的得名可能来源于沸石具有“只要客体分子能够通过连接沸石笼的孔道,就可以进出沸石”的特殊性质
3.钼的某种三元化合物的晶体结构如图所示。下列说法正确的是( )
A.电负性大小: B.第一电离能大小:
C.金属性强弱: D.半径大小:
4.实验室以为原料,制备并获得晶体。下列图示装置和原理能达到实验目的是( )
甲 乙 丙 丁
A.用装置甲制取 B.用装置乙除去中的
C.用装置丙干燥并收集 D.用装置丁蒸干溶液获得
5.以下反应是天然产物顺式茉莉酮全合成中的一步,下列说法中正确的是( )
A.生成物的分子式为 B.反应物可以发生氧化、取代和水解反应
C.图示反应类型为加成反应 D.生成物中的原子可能处于同一平面内
阅读下列材料,完成6-7题:
工业上常用焦炭还原二氧化硅制得粗硅。若要制取高纯硅,则需要将粗硅转化为四氯化硅或三氯氢硅(化学式)。发生的主要反应如下:
①
②
③
④
⑤
据此回答6~7题:
6.下列说法错误的是( )
A.反应③的 B.反应④的
C. D.反应⑤在常温下不一定可以自发进行
7.下列对该工业的说法,正确的一项是( )
A.向反应容器中加入大量二氧化硅和焦炭有利于反应①~⑤正向进行
B.或后续可使用高纯度的活泼金属如等还原得到高纯硅
C.工业上不使用还原可能的原因是在高温下易发生爆炸
D.实验室中也可以用代替进行反应以提高反应的效率和高纯硅的产率
8.在探究高效吸收试剂的同时,研究人员还致力于吸收剂的再生与循环利用。以乙二胺为例,乙二胺水溶液可高效吸收;吸收所得溶液流入腔室1中,通电电解,可实现的释放与乙二胺的再生。已知:亲核试剂在反应过程中,它倾向于与电正性物种结合。结合下图,下列对该工业的说法,不正确的一项是( )
A.该工业有利于实现“碳达峰”和“碳中和”
B.乙二胺的氮可以作为亲核试剂进攻分子实现吸收
C.电解过程中,阳极铜会失去电子形成
D.能与乙二胺形成,使乙二胺与的结合平衡正向进行,得以释放:阴极则发生离子的还原,重新生成并释放出乙二胺
9.,银离子在溶液中与间苯二胺和对苯二胺定量发生如下反应:
氧化得到的偶联产物在波长处的摩尔消光系数为。利用这一反应,通过分光光度法可测定起始溶液中的银离子浓度。这是不同于氯离子滴定法的一种更为精确的测定方法。现做如下实验测定乙酸银()的溶度积:,在纯水中配得乙酸银的饱和水溶液。取溶液,按计量加入两种苯二胺,至显色稳定后,稀释定容至。用的比色皿,测得溶液在处的吸光度为0.225。已知朗伯-比尔方程,其中A:吸光度;:摩尔消光系数;:光通过溶液的路径长;c:溶液浓度。下列说法不正确的是( )
A.氯离子滴定法可能的一个误差来源是银离子难以完全沉淀
B.若卤化银可与相应的卤离子形成配合物,则使用氯离子滴定法时氯化物不宜过量
C.计算可得原始配置的溶液中
D.计算可得乙酸银的
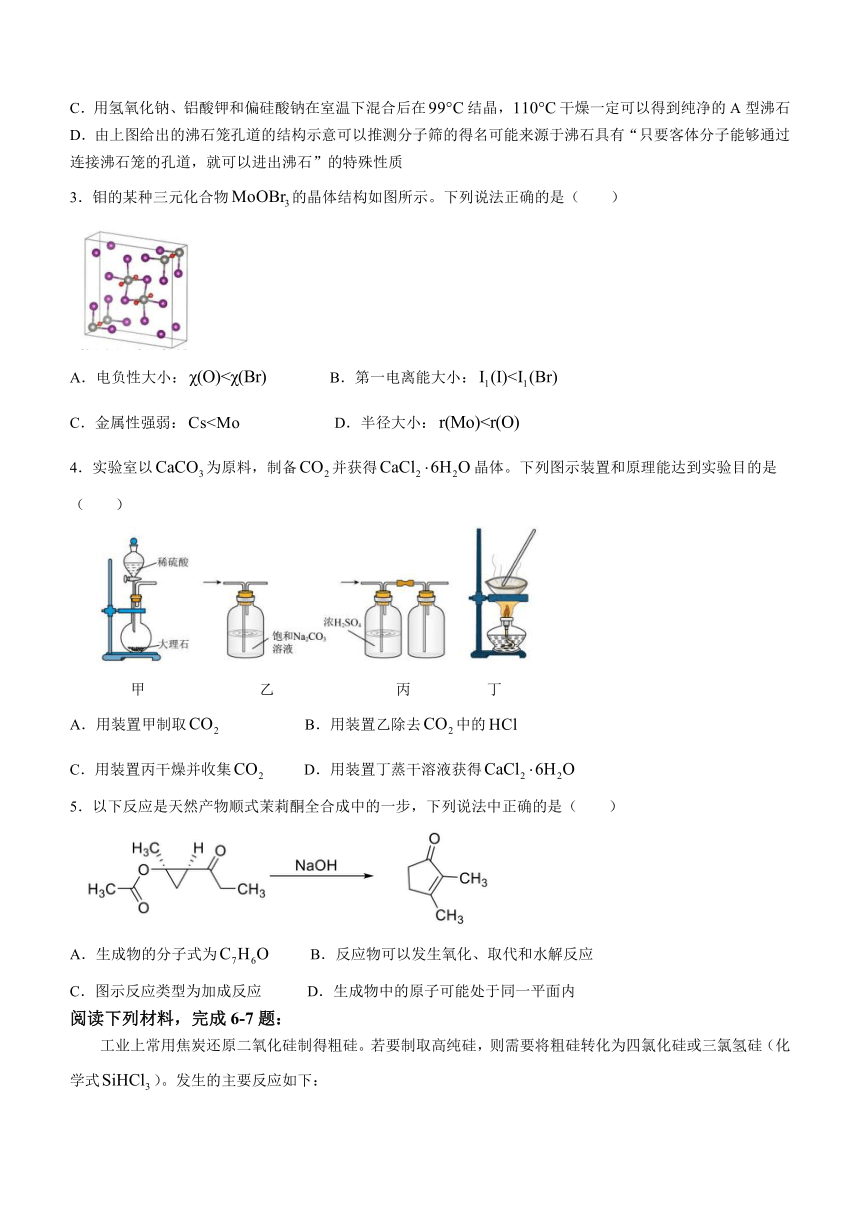
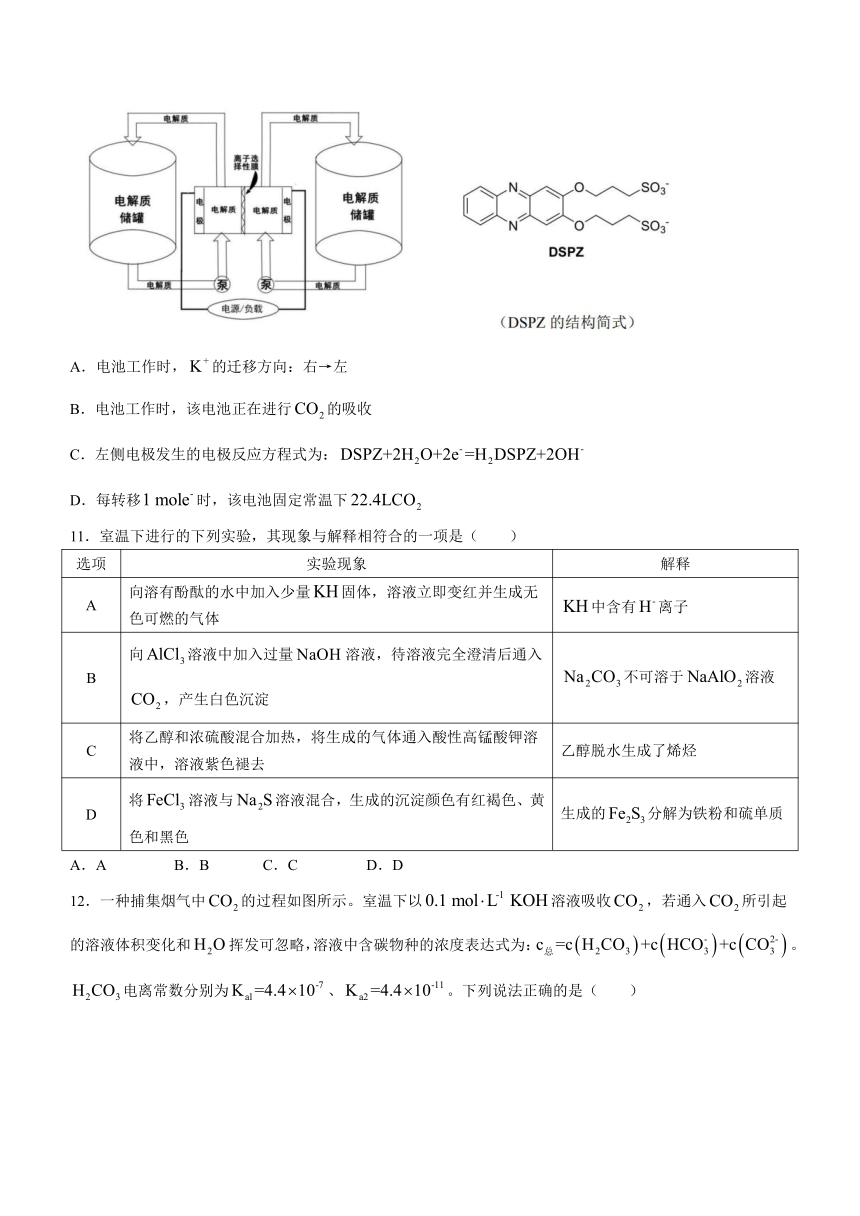
10.下左图示出了一种捕获系统,初始状态下,左侧电解质储罐中装入与的混合溶液,右侧电解质储罐中装入的混合溶液,中央为电解装置,电解装置的左右两侧为电极、中间为离子选择性膜,在电解过程中可允许通过。通过不断调换正负极可实现的吸收和释放。已知的结构简式如下右图所示。当左侧电极连接电源负极时,反应过程中转化为。下列说法错误的一项是( )
A.电池工作时,的迁移方向:右→左
B.电池工作时,该电池正在进行的吸收
C.左侧电极发生的电极反应方程式为:
D.每转移时,该电池固定常温下
11.室温下进行的下列实验,其现象与解释相符合的一项是( )
选项 实验现象 解释
A 向溶有酚酞的水中加入少量固体,溶液立即变红并生成无色可燃的气体 中含有离子
B 向溶液中加入过量溶液,待溶液完全澄清后通入,产生白色沉淀 不可溶于溶液
C 将乙醇和浓硫酸混合加热,将生成的气体通入酸性高锰酸钾溶液中,溶液紫色褪去 乙醇脱水生成了烯烃
D 将溶液与溶液混合,生成的沉淀颜色有红褐色、黄色和黑色 生成的分解为铁粉和硫单质
A.A B.B C.C D.D
12.一种捕集烟气中的过程如图所示。室温下以溶液吸收,若通入所引起的溶液体积变化和挥发可忽略,溶液中含碳物种的浓度表达式为:。电离常数分别为、。下列说法正确的是( )
A.吸收所得到的溶液中:
B.完全转化为时,溶液中:
C.溶液吸收,溶液中:
D.如图所示的“吸收”、“转化”过程中,溶液的温度下降
13.乙醇-水催化重整可获得。其主要反应为
,
,在、时,若仅考虑上述反应,平衡时和的选择性及的产率随温度的变化如图所示。
其中的选择性,下列说法正确的是( )
A.图中曲线①表示平衡时产率随温度的变化
B.升高温度,平衡时的选择性增大
C.一定温度下,增大可提高乙醇平衡转化率
D.一定温度下,加入或选用高效催化剂,均能提高平衡时产率
二、非选择题:共4题,共61分。
14.(15分)硫的化合物丰富多样、应用广泛,请回答以下问题:
(1)单质硫即存在多样的同素异形体。
I.一种硫单质的存在形式是无限长的链状结构,硫原子之间以单键相连。若仅考虑其中的3个硫原子,则它们所形成的空间构型为:_________(选填“V形”或“直线形”):
Ⅱ.硫单质最稳定的存在形式是环状结构分子。将硫溶于苯中,所得溶液的沸点升高了。已知:①对于稀溶液沸点升高的数值,可通过沸点升高公式求得。式中为稀溶液沸点升高常数,苯的沸点升高常数;②在沸点升高公式中,b为溶质的质量摩尔浓度,计算公式为:,单位为:;③苯中硫的存在形式即为最稳定的形式。
请通过以上信息,计算该形式下硫的分子式,并画出该分子的结构示意图(参考数据);
______________________________________________________________________________________________
(2)连硫酸是一类S原子直接相连成键的酸。通式为,对应的命名为连x硫酸。
几种常见连硫酸可通过氧化低价硫化合物的方式制得。写出下列反应的化学方程式:
I.用细粉状的氧化亚硫酸,可在溶液中生成连二硫酸,同时产生一种碱:_________;
Ⅱ.与饱和冷溶液反应可得连三硫酸钠,同时产生一种硫酸盐:_________;
(3)事实上,硫酸在稀溶液中第二步的解离其实是不完全的,且,则在的溶液中,_________;
15.(15分)某有机物G具有解热、镇痛以及抗炎等功效,如图为G的合成路线:
回答下列问题:
(1)A→B的反应类型为_________。
(2)D中氮原子的杂化方式为_________。
(3)C→D的转化经历CXD的反应过程,其中反应I为加成反应,试写出中间体X的结构简式_________。
(4)D的一种同分异构体符合下列条件,写出该同分异构体的结构简式:_________。
既能发生银镜反应又能发生水解反应,含苯环的水解产物含有手性碳和6种不同化学环境的氢原子。
(5)已知:(表示烃基)
写出以和为原料合成的合成路线(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
______________________________________________________________________________________________
16.(16分)过渡金属在日常生活、工业生产和医疗化工中随处可见。它们渗透到我们生活的方方面面,如影随形。请回答下列问题:
I.铁与砷的窃窃私语
(1)砷()是广泛存在于环境中的一种无机污染物。砷及其化合物具有极强的毒性。铁氧化物是自然界的活性组分之一,在自然界中广泛存在,在砷的生物地球化学循环中起着重要的作用。针铁矿和赤铁矿均具有表面活性强、性能稳定、吸附能力强等优点,环境中的砷可以通过吸附于其表面而被固持,进而影响砷在环境中的界面行为。
①对铁氧化物对的吸附量具有显著影响。在水溶液中,含离子一般带负电。
则越低,的吸附量越大的原因可能是_________;
②砷吸附到针铁矿(a)和赤铁矿(b)后形成的络合物的结构模型如下图所示:
则其中的杂化方式分别为:_________、_________;
Ⅱ.星光熠熠的纳米金颗粒
(2)放射治疗是生物医学中治疗恶性肿瘤的一种重要手段。放射治疗采用高剂量、高穿透性的X射线、射线以及电子光子束辐照癌变的肿瘤细胞,通过破坏其脱氧核糖核酸而将其杀死或破坏。但是,较高的放射剂量和较长的治疗时间会对生命体产生极大的生物毒性。为降低放射治疗的生物毒性,减弱放射治疗带来的副作用,靶向放射治疗成为放射治疗研究的热点。纳米金颗粒具备优异的辐射敏化性质和光学性质,同时兼具良好的生物相容性,因此纳米金协助的放射治疗迅速成为靶向治疗的重要发展方向。一个纳米金颗粒的结构如下:
纳米金尺寸不同,其理化性质也不同,对于肿瘤细胞的影响重大。一般尺寸较小的颗粒表面曲率较大,表面可以吸附的配体分子数较少,同时成像背景较低,但是其分散性非常好。尺寸大的颗粒易于发生聚集,不易分散。Chithrani通过研究发现,在尺寸内,的纳米金颗粒具有最高的摄取效率。其原因为_________;
III.臭名昭著的液态金属
(3)汞的毒性人类很早就知道。实验室内通常使用覆盖硫磺的方法使得转化为无毒的。
①写出反应的化学方程式:__________________;
②该反应几乎在瞬间就可以反应完全。相比之下比汞活泼的铁与硫磺发生类似反应则十分困难:只有在加热的条件下才可以发生化合生成。请合理推测以上反常现象出现的原因:_________;
③是溶解度最小的硫化物。实验室常用王水来溶解。已知价的汞易形成4配位的配离子,且反应过程中会产生一种极易被氧化为另一种红棕色气体的无色无味气体和一种淡黄色的沉淀。给出反应的离子方程式:_________(淡黄色的沉淀要求以最稳定存在形式的分子式书写)
17.(15分)阅读下列材料:
化学是一门以实验为基础的学科。任何一个理论如果与实际情况不符,那一定是错误的理论。但是,受限于技术水平,人们往往不能全面、准确地了解一种现象的本质,因此难免产生一些错误的理论或认识,例如“热质说”、“燃素说”等。这些理论虽然对化学的发展有着不利的影响,但是它们蕴含了无数先辈化学家勤恳的努力与思考,也体现了人类永不停歇的探索精神和探究毅力。也正是前人不懈地试错和纠错才促使后人走上了发现真理的道路。
第83号元素铋()在很长一段时间内都被认为是原子序数最大的非放射性元素。直至有研究指出铋具有极其微弱的放射性(半衰期约为年)。至此,第82号元素铅()才宣告成为了原子序数最大的非放射性元素。某研究性学习小组拟对这两个元素及其化合物的性质展开探究。在实验开始前,该小组的成员从《无机化学》上获得了以下相关信息:
①铅的三大强酸盐中只有和是易溶于水的;
②溶度积:,;
③周期数越大,价电子中s轨道上的电子越难以失去;
④铅易形成溶解度较大的配合物。
请你回答下列问题:
(1)小组成员将铅块分别投入足量不同浓度的盐酸和硫酸中,发现酸的浓度越高,铅溶解越多,试分别解释原因__________________;
(2)一种棕黄色的微溶钠盐铋酸钠()可用于鉴定,小组成员在碱性环境下用氧化可制得,写出反应的化学方程式_________;再将少量投入过量硫酸酸化的溶液中加热,观察到溶液先变红后有黑色沉淀生成,请解释实验现象_________;
(3)古时油画多用作为白色颜料,但在含有的空气中白色油画易发黑发暗,人们一般用过氧化氢溶液处理油画使之变白翻新,反应的离子方程式为_________;小组中有成员好奇为什么不用硫酸盐浓溶液进行沉淀的转化进行翻新,请你计算下面数据为该成员释疑解惑:要实现转化,则应满足________;
(4)请结合(1)~(3)题干的信息和所学知识,设计以单质为原料制取碱性溶液的方案:_________;(可选用的试剂:硫酸溶液,溶液,,,溶液)
(5)结合材料,请你合理推测铋长时间被认为没有放射性的原因可能是_________。
南通市名校联盟2023-2024学年高三上学期1月第二次调研
化学参考答案及评分建议
说明:
1.化学方程式中的反应物、生成物错误不给分:未配平或反应条件未写或错写均应扣分。
2.有效数字的计算规则、带单位计算暂不作要求。
一、单项选择题:共13题,每题3分,共39分。
1.B 2.C 3.B 4.C 5.B 6.C 7.B 8.D 9.C
10.D 11.A 12.C 13.B
二、非选择题:共4题,共61分。
14.(15分)
(1)I.V形 (2分)
Ⅱ.解:由得 (1分)
而硫的质量摩尔浓度 (1分)
所以 (1分)
设一个分子中有n个硫原子,则 (1分)
即分子式为 (1分,不回答不得这1分)
结构为 (1分,其中“○”“●”换成“S”也可,不画出立体结构也可)
(若考生使用其他方法计算,只要答案正确并且过程合理也得满分)
(2)I. (2分,加“↓”扣一分)
II. (3分)
(3)10 (2分)
15.(15分)
(1)还原反应(2分)
(2)、(2分)
(3) (3分)
(4)或 (3分)
(5)(5分)
16.(16分)
I.(1)①越低,吸附剂越容易带上正电荷,对带有负电的的吸附效果越好
(2分)
②、 (2分,写对1个得1分,错写不倒扣分)
Ⅱ.(2)较大尺寸的纳米金倾向于在癌症位置积累,小尺寸的纳米金则倾向于在癌症组织内扩散,而中等尺寸的纳米金则倾向于被癌症细胞摄取
(3分,答出“较大尺寸倾向于积累”等类似大意即可算1点,答出1点得2分,2点即可得3分)
III.(3)① (2分)
②汞在室温下呈液态,与疏的接触面积显著增大,反应速率显著上升
(3分,从铁的角度回答,如“铁与硫的接触面积小”等答案也可酌情给分)
③ (3分“S”不得分)
17.(15分)
(1)溶解度较小,覆盖在铅块表面阻碍反应,随着盐酸浓度增大,浓度增大,形成配离子
而溶解;溶解度较小,覆盖在铅块表面阻碍反应,随着硫酸浓度增大,发生反应:
,不会生成阻碍反应
(2分,1点1分,不写方程式正常赋分)
(2) (2分)
在酸性环境下少量先将氧化为,反应完全后过量与反应生成了 (2分,意思对即可)
(3) (2分)
(1分)
(4)向中加入适量溶液并通入过量,过滤取滤渣备用;将单质溶于过量硫酸溶液中并加入过量滤渣,微热至溶液呈紫红色且黑色固体不再溶解,冷却至室温后加入过量溶液至无沉淀生成,过滤 (4分)
(5)半衰期过长,受限于技术水平检测不出其微弱的放射性 (2分,意思对即可)
化学
注意事项
考生在答题前请认真阅读本注意事项及各题答题要求:
1.本试卷共8页,满分为100分,考试时间为75分钟。考试结束后,请将本试卷和答题卡一并交回。
2.答题前,请务必将自己的姓名、准考证号用0.5毫米黑色墨水的签字笔填写在试卷及答题卡的规定位置。
3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符。
4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑:如需改动,请用橡皮擦干净后,再选涂其他答案。作答非选择题,必须用0.5毫米黑色墨水的签字笔在答题卡上的指定位置作答,在其他位置作答一律无效。
5.如需作图,必须用2B铅笔绘、写清楚,线条、符号等须加黑、加粗。
可能用到的相对原子质量:
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.下列有关物质性质与用途具有对应关系的是( )
A.能与酸反应,可用于制作红色涂料
B.吸收产生,可用作呼吸面具供氧剂
C.有还原性,可用于自来水的杀菌消毒
D.硬度大,可用于制造光导纤维
2.沸石是一类分子架构奇特的含水矿物的总称。其中的天然沸石是一类含水铝硅酸盐晶体的总称,它们会因释放水而呈沸腾状,故而得名沸石,又称分子筛(严格说,沸石和分子筛两个术语的内涵是不同的,但经常被不加区别地混用)。它们往往具有复杂的结构,可以灵活地吸水和脱水。以下给出了几种沸石的结构图( )
其中一种A型沸石的分子式可表示为。用氢氧化钠、铝酸钠和偏硅酸钠在室温下混合后在结晶,干燥即可得到A型沸石。则下列说法不正确的是( )
A.沸石具有广泛的用途,可作为吸附剂、干燥剂、催化剂等,并可用于防止溶液暴沸
B.相比较一些传统干燥剂如等,沸石具备优异的再生性能,可反复使用
C.用氢氧化钠、铝酸钾和偏硅酸钠在室温下混合后在结晶,干燥一定可以得到纯净的A型沸石
D.由上图给出的沸石笼孔道的结构示意可以推测分子筛的得名可能来源于沸石具有“只要客体分子能够通过连接沸石笼的孔道,就可以进出沸石”的特殊性质
3.钼的某种三元化合物的晶体结构如图所示。下列说法正确的是( )
A.电负性大小: B.第一电离能大小:
C.金属性强弱: D.半径大小:
4.实验室以为原料,制备并获得晶体。下列图示装置和原理能达到实验目的是( )
甲 乙 丙 丁
A.用装置甲制取 B.用装置乙除去中的
C.用装置丙干燥并收集 D.用装置丁蒸干溶液获得
5.以下反应是天然产物顺式茉莉酮全合成中的一步,下列说法中正确的是( )
A.生成物的分子式为 B.反应物可以发生氧化、取代和水解反应
C.图示反应类型为加成反应 D.生成物中的原子可能处于同一平面内
阅读下列材料,完成6-7题:
工业上常用焦炭还原二氧化硅制得粗硅。若要制取高纯硅,则需要将粗硅转化为四氯化硅或三氯氢硅(化学式)。发生的主要反应如下:
①
②
③
④
⑤
据此回答6~7题:
6.下列说法错误的是( )
A.反应③的 B.反应④的
C. D.反应⑤在常温下不一定可以自发进行
7.下列对该工业的说法,正确的一项是( )
A.向反应容器中加入大量二氧化硅和焦炭有利于反应①~⑤正向进行
B.或后续可使用高纯度的活泼金属如等还原得到高纯硅
C.工业上不使用还原可能的原因是在高温下易发生爆炸
D.实验室中也可以用代替进行反应以提高反应的效率和高纯硅的产率
8.在探究高效吸收试剂的同时,研究人员还致力于吸收剂的再生与循环利用。以乙二胺为例,乙二胺水溶液可高效吸收;吸收所得溶液流入腔室1中,通电电解,可实现的释放与乙二胺的再生。已知:亲核试剂在反应过程中,它倾向于与电正性物种结合。结合下图,下列对该工业的说法,不正确的一项是( )
A.该工业有利于实现“碳达峰”和“碳中和”
B.乙二胺的氮可以作为亲核试剂进攻分子实现吸收
C.电解过程中,阳极铜会失去电子形成
D.能与乙二胺形成,使乙二胺与的结合平衡正向进行,得以释放:阴极则发生离子的还原,重新生成并释放出乙二胺
9.,银离子在溶液中与间苯二胺和对苯二胺定量发生如下反应:
氧化得到的偶联产物在波长处的摩尔消光系数为。利用这一反应,通过分光光度法可测定起始溶液中的银离子浓度。这是不同于氯离子滴定法的一种更为精确的测定方法。现做如下实验测定乙酸银()的溶度积:,在纯水中配得乙酸银的饱和水溶液。取溶液,按计量加入两种苯二胺,至显色稳定后,稀释定容至。用的比色皿,测得溶液在处的吸光度为0.225。已知朗伯-比尔方程,其中A:吸光度;:摩尔消光系数;:光通过溶液的路径长;c:溶液浓度。下列说法不正确的是( )
A.氯离子滴定法可能的一个误差来源是银离子难以完全沉淀
B.若卤化银可与相应的卤离子形成配合物,则使用氯离子滴定法时氯化物不宜过量
C.计算可得原始配置的溶液中
D.计算可得乙酸银的
10.下左图示出了一种捕获系统,初始状态下,左侧电解质储罐中装入与的混合溶液,右侧电解质储罐中装入的混合溶液,中央为电解装置,电解装置的左右两侧为电极、中间为离子选择性膜,在电解过程中可允许通过。通过不断调换正负极可实现的吸收和释放。已知的结构简式如下右图所示。当左侧电极连接电源负极时,反应过程中转化为。下列说法错误的一项是( )
A.电池工作时,的迁移方向:右→左
B.电池工作时,该电池正在进行的吸收
C.左侧电极发生的电极反应方程式为:
D.每转移时,该电池固定常温下
11.室温下进行的下列实验,其现象与解释相符合的一项是( )
选项 实验现象 解释
A 向溶有酚酞的水中加入少量固体,溶液立即变红并生成无色可燃的气体 中含有离子
B 向溶液中加入过量溶液,待溶液完全澄清后通入,产生白色沉淀 不可溶于溶液
C 将乙醇和浓硫酸混合加热,将生成的气体通入酸性高锰酸钾溶液中,溶液紫色褪去 乙醇脱水生成了烯烃
D 将溶液与溶液混合,生成的沉淀颜色有红褐色、黄色和黑色 生成的分解为铁粉和硫单质
A.A B.B C.C D.D
12.一种捕集烟气中的过程如图所示。室温下以溶液吸收,若通入所引起的溶液体积变化和挥发可忽略,溶液中含碳物种的浓度表达式为:。电离常数分别为、。下列说法正确的是( )
A.吸收所得到的溶液中:
B.完全转化为时,溶液中:
C.溶液吸收,溶液中:
D.如图所示的“吸收”、“转化”过程中,溶液的温度下降
13.乙醇-水催化重整可获得。其主要反应为
,
,在、时,若仅考虑上述反应,平衡时和的选择性及的产率随温度的变化如图所示。
其中的选择性,下列说法正确的是( )
A.图中曲线①表示平衡时产率随温度的变化
B.升高温度,平衡时的选择性增大
C.一定温度下,增大可提高乙醇平衡转化率
D.一定温度下,加入或选用高效催化剂,均能提高平衡时产率
二、非选择题:共4题,共61分。
14.(15分)硫的化合物丰富多样、应用广泛,请回答以下问题:
(1)单质硫即存在多样的同素异形体。
I.一种硫单质的存在形式是无限长的链状结构,硫原子之间以单键相连。若仅考虑其中的3个硫原子,则它们所形成的空间构型为:_________(选填“V形”或“直线形”):
Ⅱ.硫单质最稳定的存在形式是环状结构分子。将硫溶于苯中,所得溶液的沸点升高了。已知:①对于稀溶液沸点升高的数值,可通过沸点升高公式求得。式中为稀溶液沸点升高常数,苯的沸点升高常数;②在沸点升高公式中,b为溶质的质量摩尔浓度,计算公式为:,单位为:;③苯中硫的存在形式即为最稳定的形式。
请通过以上信息,计算该形式下硫的分子式,并画出该分子的结构示意图(参考数据);
______________________________________________________________________________________________
(2)连硫酸是一类S原子直接相连成键的酸。通式为,对应的命名为连x硫酸。
几种常见连硫酸可通过氧化低价硫化合物的方式制得。写出下列反应的化学方程式:
I.用细粉状的氧化亚硫酸,可在溶液中生成连二硫酸,同时产生一种碱:_________;
Ⅱ.与饱和冷溶液反应可得连三硫酸钠,同时产生一种硫酸盐:_________;
(3)事实上,硫酸在稀溶液中第二步的解离其实是不完全的,且,则在的溶液中,_________;
15.(15分)某有机物G具有解热、镇痛以及抗炎等功效,如图为G的合成路线:
回答下列问题:
(1)A→B的反应类型为_________。
(2)D中氮原子的杂化方式为_________。
(3)C→D的转化经历CXD的反应过程,其中反应I为加成反应,试写出中间体X的结构简式_________。
(4)D的一种同分异构体符合下列条件,写出该同分异构体的结构简式:_________。
既能发生银镜反应又能发生水解反应,含苯环的水解产物含有手性碳和6种不同化学环境的氢原子。
(5)已知:(表示烃基)
写出以和为原料合成的合成路线(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
______________________________________________________________________________________________
16.(16分)过渡金属在日常生活、工业生产和医疗化工中随处可见。它们渗透到我们生活的方方面面,如影随形。请回答下列问题:
I.铁与砷的窃窃私语
(1)砷()是广泛存在于环境中的一种无机污染物。砷及其化合物具有极强的毒性。铁氧化物是自然界的活性组分之一,在自然界中广泛存在,在砷的生物地球化学循环中起着重要的作用。针铁矿和赤铁矿均具有表面活性强、性能稳定、吸附能力强等优点,环境中的砷可以通过吸附于其表面而被固持,进而影响砷在环境中的界面行为。
①对铁氧化物对的吸附量具有显著影响。在水溶液中,含离子一般带负电。
则越低,的吸附量越大的原因可能是_________;
②砷吸附到针铁矿(a)和赤铁矿(b)后形成的络合物的结构模型如下图所示:
则其中的杂化方式分别为:_________、_________;
Ⅱ.星光熠熠的纳米金颗粒
(2)放射治疗是生物医学中治疗恶性肿瘤的一种重要手段。放射治疗采用高剂量、高穿透性的X射线、射线以及电子光子束辐照癌变的肿瘤细胞,通过破坏其脱氧核糖核酸而将其杀死或破坏。但是,较高的放射剂量和较长的治疗时间会对生命体产生极大的生物毒性。为降低放射治疗的生物毒性,减弱放射治疗带来的副作用,靶向放射治疗成为放射治疗研究的热点。纳米金颗粒具备优异的辐射敏化性质和光学性质,同时兼具良好的生物相容性,因此纳米金协助的放射治疗迅速成为靶向治疗的重要发展方向。一个纳米金颗粒的结构如下:
纳米金尺寸不同,其理化性质也不同,对于肿瘤细胞的影响重大。一般尺寸较小的颗粒表面曲率较大,表面可以吸附的配体分子数较少,同时成像背景较低,但是其分散性非常好。尺寸大的颗粒易于发生聚集,不易分散。Chithrani通过研究发现,在尺寸内,的纳米金颗粒具有最高的摄取效率。其原因为_________;
III.臭名昭著的液态金属
(3)汞的毒性人类很早就知道。实验室内通常使用覆盖硫磺的方法使得转化为无毒的。
①写出反应的化学方程式:__________________;
②该反应几乎在瞬间就可以反应完全。相比之下比汞活泼的铁与硫磺发生类似反应则十分困难:只有在加热的条件下才可以发生化合生成。请合理推测以上反常现象出现的原因:_________;
③是溶解度最小的硫化物。实验室常用王水来溶解。已知价的汞易形成4配位的配离子,且反应过程中会产生一种极易被氧化为另一种红棕色气体的无色无味气体和一种淡黄色的沉淀。给出反应的离子方程式:_________(淡黄色的沉淀要求以最稳定存在形式的分子式书写)
17.(15分)阅读下列材料:
化学是一门以实验为基础的学科。任何一个理论如果与实际情况不符,那一定是错误的理论。但是,受限于技术水平,人们往往不能全面、准确地了解一种现象的本质,因此难免产生一些错误的理论或认识,例如“热质说”、“燃素说”等。这些理论虽然对化学的发展有着不利的影响,但是它们蕴含了无数先辈化学家勤恳的努力与思考,也体现了人类永不停歇的探索精神和探究毅力。也正是前人不懈地试错和纠错才促使后人走上了发现真理的道路。
第83号元素铋()在很长一段时间内都被认为是原子序数最大的非放射性元素。直至有研究指出铋具有极其微弱的放射性(半衰期约为年)。至此,第82号元素铅()才宣告成为了原子序数最大的非放射性元素。某研究性学习小组拟对这两个元素及其化合物的性质展开探究。在实验开始前,该小组的成员从《无机化学》上获得了以下相关信息:
①铅的三大强酸盐中只有和是易溶于水的;
②溶度积:,;
③周期数越大,价电子中s轨道上的电子越难以失去;
④铅易形成溶解度较大的配合物。
请你回答下列问题:
(1)小组成员将铅块分别投入足量不同浓度的盐酸和硫酸中,发现酸的浓度越高,铅溶解越多,试分别解释原因__________________;
(2)一种棕黄色的微溶钠盐铋酸钠()可用于鉴定,小组成员在碱性环境下用氧化可制得,写出反应的化学方程式_________;再将少量投入过量硫酸酸化的溶液中加热,观察到溶液先变红后有黑色沉淀生成,请解释实验现象_________;
(3)古时油画多用作为白色颜料,但在含有的空气中白色油画易发黑发暗,人们一般用过氧化氢溶液处理油画使之变白翻新,反应的离子方程式为_________;小组中有成员好奇为什么不用硫酸盐浓溶液进行沉淀的转化进行翻新,请你计算下面数据为该成员释疑解惑:要实现转化,则应满足________;
(4)请结合(1)~(3)题干的信息和所学知识,设计以单质为原料制取碱性溶液的方案:_________;(可选用的试剂:硫酸溶液,溶液,,,溶液)
(5)结合材料,请你合理推测铋长时间被认为没有放射性的原因可能是_________。
南通市名校联盟2023-2024学年高三上学期1月第二次调研
化学参考答案及评分建议
说明:
1.化学方程式中的反应物、生成物错误不给分:未配平或反应条件未写或错写均应扣分。
2.有效数字的计算规则、带单位计算暂不作要求。
一、单项选择题:共13题,每题3分,共39分。
1.B 2.C 3.B 4.C 5.B 6.C 7.B 8.D 9.C
10.D 11.A 12.C 13.B
二、非选择题:共4题,共61分。
14.(15分)
(1)I.V形 (2分)
Ⅱ.解:由得 (1分)
而硫的质量摩尔浓度 (1分)
所以 (1分)
设一个分子中有n个硫原子,则 (1分)
即分子式为 (1分,不回答不得这1分)
结构为 (1分,其中“○”“●”换成“S”也可,不画出立体结构也可)
(若考生使用其他方法计算,只要答案正确并且过程合理也得满分)
(2)I. (2分,加“↓”扣一分)
II. (3分)
(3)10 (2分)
15.(15分)
(1)还原反应(2分)
(2)、(2分)
(3) (3分)
(4)或 (3分)
(5)(5分)
16.(16分)
I.(1)①越低,吸附剂越容易带上正电荷,对带有负电的的吸附效果越好
(2分)
②、 (2分,写对1个得1分,错写不倒扣分)
Ⅱ.(2)较大尺寸的纳米金倾向于在癌症位置积累,小尺寸的纳米金则倾向于在癌症组织内扩散,而中等尺寸的纳米金则倾向于被癌症细胞摄取
(3分,答出“较大尺寸倾向于积累”等类似大意即可算1点,答出1点得2分,2点即可得3分)
III.(3)① (2分)
②汞在室温下呈液态,与疏的接触面积显著增大,反应速率显著上升
(3分,从铁的角度回答,如“铁与硫的接触面积小”等答案也可酌情给分)
③ (3分“S”不得分)
17.(15分)
(1)溶解度较小,覆盖在铅块表面阻碍反应,随着盐酸浓度增大,浓度增大,形成配离子
而溶解;溶解度较小,覆盖在铅块表面阻碍反应,随着硫酸浓度增大,发生反应:
,不会生成阻碍反应
(2分,1点1分,不写方程式正常赋分)
(2) (2分)
在酸性环境下少量先将氧化为,反应完全后过量与反应生成了 (2分,意思对即可)
(3) (2分)
(1分)
(4)向中加入适量溶液并通入过量,过滤取滤渣备用;将单质溶于过量硫酸溶液中并加入过量滤渣,微热至溶液呈紫红色且黑色固体不再溶解,冷却至室温后加入过量溶液至无沉淀生成,过滤 (4分)
(5)半衰期过长,受限于技术水平检测不出其微弱的放射性 (2分,意思对即可)
同课章节目录
