贵州省黔东南州2023-2024学年高二上学期期末考试化学试题(含解析)
文档属性
| 名称 | 贵州省黔东南州2023-2024学年高二上学期期末考试化学试题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-14 00:00:00 | ||
图片预览


文档简介
黔东南州2023-2024学年高二上学期期末考试化学
本试卷满分100分,考试用时75分钟.
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上.
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案标号.回答非选择题时,将答案写在答题卡上.写在本试卷上无效.
3.考试结束后,将本试卷和答题卡一并交回.
4.本试卷主要考试内容:人教版选择性必修1,选择性必修2第一章.
5.可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.下列图中所发生的现象与电子跃迁无关的是( )
A.节日里燃放的烟花 B.五彩的霓虹广告灯 C.蜡烛燃烧 D.平面镜成像
A.A B.B C.C D.D
2.下列事实不能用勒夏特列原理(化学平衡移动原理)解释的是( )
A.合成氨时,选定温度为,而不是常温
B.人体血液的稳定在范围内
C.氯气在水中的溶解度大于在饱和食盐水中的溶解度
D.生活中,可用热的纯碱溶液除油污
3.若将原子的电子排布式写成,则违背了( )
A.能量守恒原理 B.泡利不相容原理 C.能量最低原理 D.洪特规则
4.将下列各物质加入或通入水中,能促进水的电离的是( )
A. B. C. D.
5.常温下,下列离子在酸性条件下能大量存在的是( )
A. B. C. D.
6.在载人航天器中,可以利用和的反应,将航天员呼出的转化为等,发生的反应为,下列说法正确的是( )
A.该反应的反应物键能总和大于生成物键能总
B.加入合适的催化剂,的值将减小
C.每断裂键,同时形成键
D.对于反应与的值相同
7.下列有关元素周期表和元素周期律的说法正确的是( )
A.同一周期从左到右,元素的第一电离能依次增大
B.同一主族从上到下,元素的电负性依次减小
C.d区元素最后一个核外电子一定填充在s能级上
D.元素周期表中,s区、d区和区的元素是金属元素
8.下列有关微粒性质的比较中,正确的是( )
A.原子半径: B.最高正价:
C.基态原子未成对电子数: D.第一电离能:
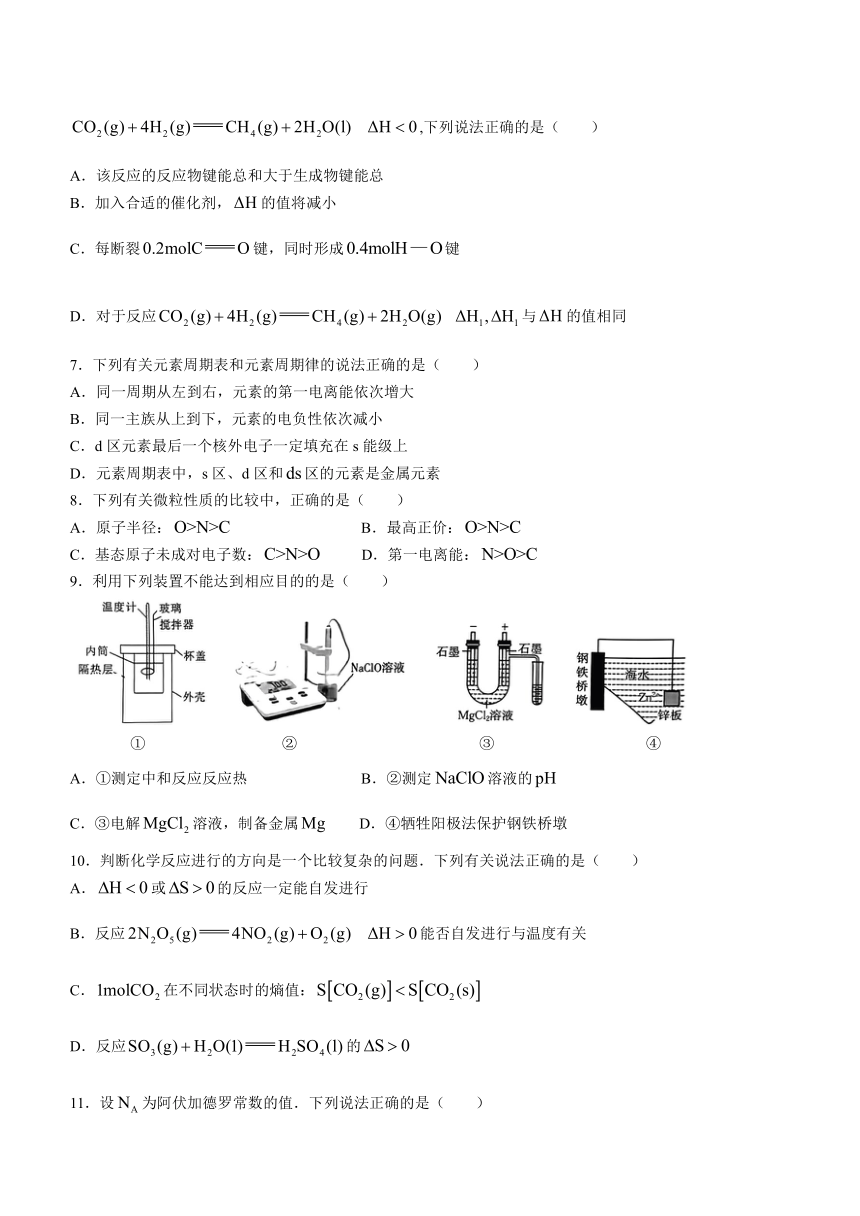
9.利用下列装置不能达到相应目的的是( )
① ② ③ ④
A.①测定中和反应反应热 B.②测定溶液的
C.③电解溶液,制备金属 D.④牺牲阳极法保护钢铁桥墩
10.判断化学反应进行的方向是一个比较复杂的问题.下列有关说法正确的是( )
A.或的反应一定能自发进行
B.反应能否自发进行与温度有关
C.在不同状态时的熵值:
D.反应的
11.设为阿伏加德罗常数的值.下列说法正确的是( )
A.时,的溶液中含有的数目为
B.的溶液中含有的数目为
C.时,的溶液中含有的数目为
D.时,的溶液中,水电离出的的数目为
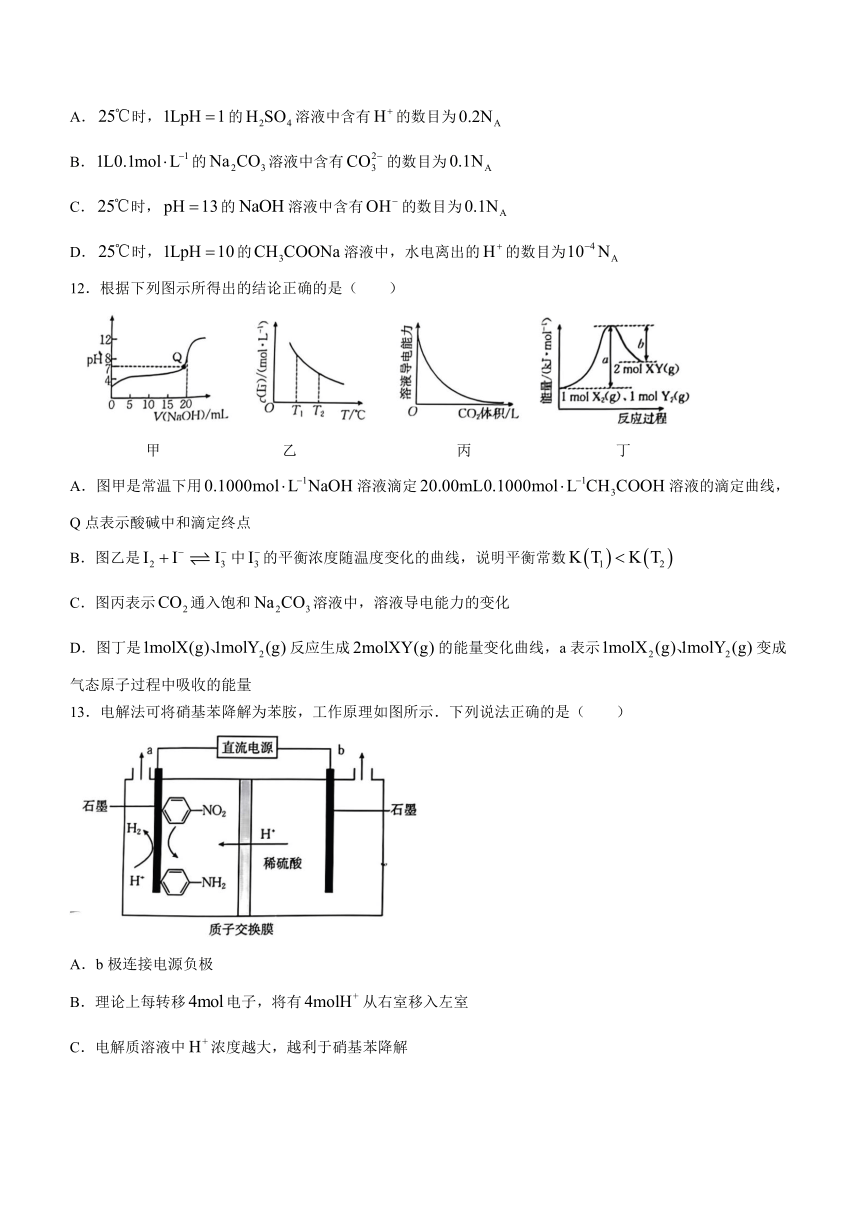
12.根据下列图示所得出的结论正确的是( )
甲 乙 丙 丁
A.图甲是常温下用溶液滴定溶液的滴定曲线,Q点表示酸碱中和滴定终点
B.图乙是中的平衡浓度随温度变化的曲线,说明平衡常数
C.图丙表示通入饱和溶液中,溶液导电能力的变化
D.图丁是反应生成的能量变化曲线,a表示变成气态原子过程中吸收的能量
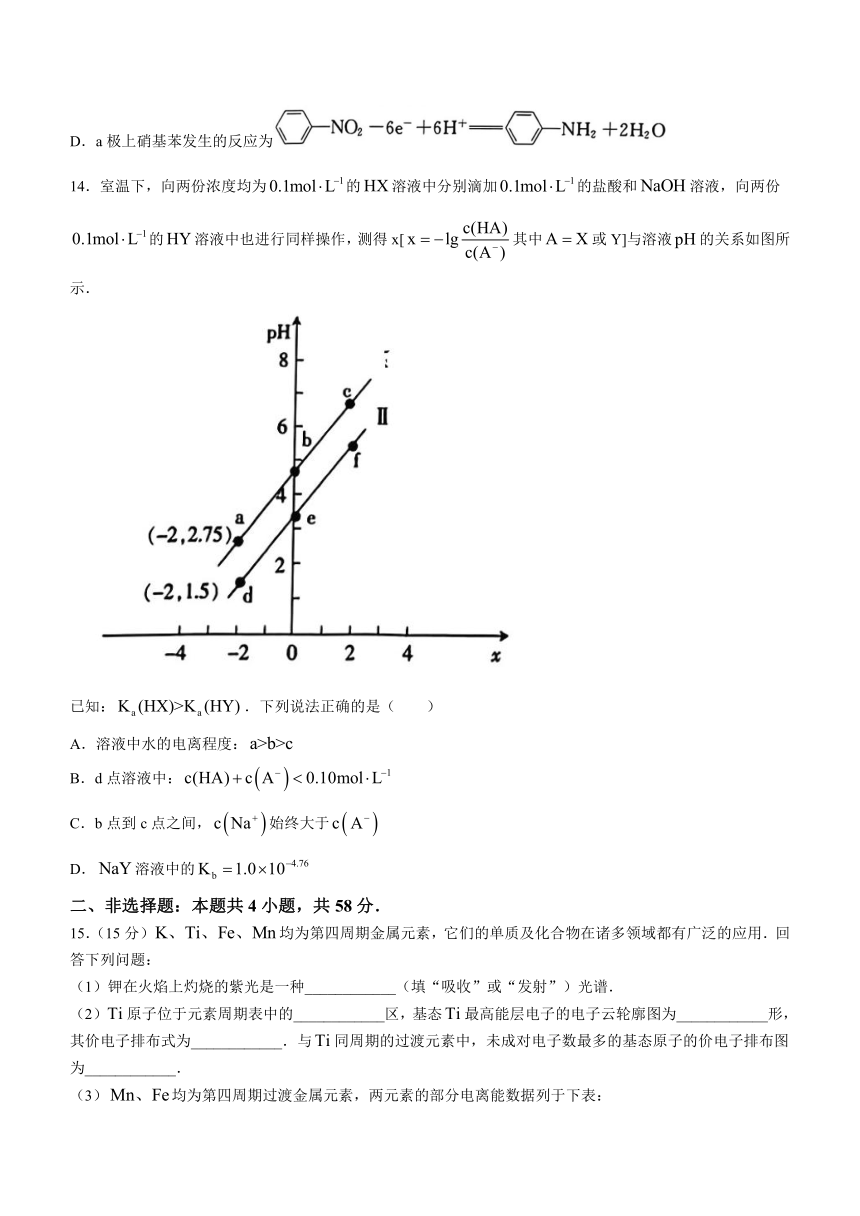
13.电解法可将硝基苯降解为苯胺,工作原理如图所示.下列说法正确的是( )
A.b极连接电源负极
B.理论上每转移电子,将有从右室移入左室
C.电解质溶液中浓度越大,越利于硝基苯降解
D.a极上硝基苯发生的反应为
14.室温下,向两份浓度均为的溶液中分别滴加的盐酸和溶液,向两份的溶液中也进行同样操作,测得x[其中或Y]与溶液的关系如图所示.
已知:.下列说法正确的是( )
A.溶液中水的电离程度:
B.d点溶液中:
C.b点到c点之间,始终大于
D.溶液中的
二、非选择题:本题共4小题,共58分.
15.(15分)均为第四周期金属元素,它们的单质及化合物在诸多领域都有广泛的应用.回答下列问题:
(1)钾在火焰上灼烧的紫光是一种____________(填“吸收”或“发射”)光谱.
(2)原子位于元素周期表中的____________区,基态最高能层电子的电子云轮廓图为____________形,其价电子排布式为____________.与同周期的过渡元素中,未成对电子数最多的基态原子的价电子排布图为____________.
(3)均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素
电离能/ 717 759
1509 1561
3248 2957
锰元素位于第四周期第族.比较两元素的可知,气态再失去1个电子比气态再失去1个电子难,原因是______________________________________________________________.
(4)琥珀酸亚铁片是用于预防和治疗缺铁性贫血的常见药物,临床建议服用维生素C促进亚铁的吸收,避免生成,从结构角度来看,易被氧化成的原因是________________________________________________________.
(5)与的半径大小关系为____________(填“大于”或“小于”).
16.(14分)用氧化还原滴定法测定的质量分数:一定条件下,将溶解并还原为,再以溶液作指示剂,用标准液滴定至全部生成.
(1)配制标准液的过程中,溶液转移时的操作如图所示.
①仪器a的名称为____________.
②图中错误的地方有____________处,请指出其中一处:____________.
(2)滴定时:
①标准液应盛装在____________(填“酸”或“碱”)式滴定管中,理由为_____________________(用离子方程式表示,写一个即可).
②滴定过程中,眼睛应注视____________.
③到达滴定终点时的现象为____________.
④若称取试样,消耗标准溶液,则的质量分数为____________(用含m、c、V的代数式表示,不考虑操作过程中质量的损失).
(3)下列实验误差分析错误的是____________(填标号).
A.滴定前滴定管内无气泡,终点读数时有气泡,所测定的结果偏小
B.刚看到指示剂局部的颜色有变化就停止滴定,所测定的结果偏大
C.读数时,滴定前府视,滴定后仰视,所测定的结果偏小
D.未用标液溶液润洗滴定管,所测定的结果偏大
17.(14分)主要用作颜料、冶金助熔剂、油漆催干剂、橡胶硫化促进剂、杀虫剂等.一种以方铅矿(含及少量等)为原料制备的工艺流程如图:
回答下列问题:
(1)在元素周期表中位于第____________周期____________族.
(2)“酸浸氧化”过程中与发生反应生成,反应的离子方程式为____________________.
(3)验证滤液1中存在,可取样后滴加少量____________(填化学式)溶液,观察到有蓝色沉淀析出.
(4)已知:.要实现转化为的最小值为____________(保留两位有效数字).“洗涤”时,检验固体是否洗涤干净的操作是____________.
(5)已知焙烧可制得铅的氧化物,为了研究其产物成分,取进行焙烧,其热重曲线如图所示,请写出时所得铅的氧化物的化学式:____________.
18.(15分)研发二氧化碳的利用技术,将二氧化碳转化为能源是减轻环境污染和解决能源问题的方案之一.回答下列问题:
(1)利用合成二甲醚有两种工艺.
工艺1:
涉及以下主要反应:
反应Ⅰ.甲醇的合成:
反应Ⅱ.逆水汽变换:
反应Ⅲ.甲醇脱水:
工艺2:反应Ⅳ.
①____________,反应Ⅳ在____________(填“低温”“高温”或“任意温度”)下自发进行.
②反应Ⅳ的活化能(正)____________(填“>”“<”或“=”)(逆).
③在恒温恒容的密闭容器中,下列说法能判断反应Ⅳ达到平衡的是____________(填标号).
A.气体物质中碳元素与氧元素的质量比不变
B.容器内浓度保持不变
C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
(2)在不同压强下,按照投料合成甲醇(反应Ⅰ),实验测得的平衡转化率和的平衡产率随温度的变化关系如图甲、乙所示.
图甲 图乙
①下列说法正确的是____________(填标号).
A.图甲纵坐标表示的平衡产率
B.
C.为了同时提高的平衡转化率和的平衡产率,应选择低温、高压条件
D.一定温度、压强下,提高的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是_________________________________.
(3)在T,温度下,将和充入的恒容密闭容器中发生反应Ⅰ和Ⅳ,达到平衡状态时和的物质的量分别为和.
①反应经过达到平衡,内的平均反应速率____________.
②温度时反应Ⅰ的平衡常数____________.
黔东南州2023-2024学年高二上学期期末考试
化学参考答案
1.D 【解析】平面镜成像是光线反射的结果,与电子跃迁无关,D项符合题意.
2.A 【解析】合成氨的反应为放热反应,升高温度平衡逆向移动,不利于生成氨气,所以选定温度为,而不是常温,主要是从速率角度考虑,与平衡移动无关,不能用勒夏特列原理解释,A项符合题意.
3.D 【解析】洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同.故违背了洪特规则,D项符合题意.
4.A 【解析】在水中电离出的发生水解,促进水的电离,A项符合题意.
5.C 【解析】均能与结合,形成弱电解质,A、B、D项均不符合题意.
6.C 【解析】该反应的反应物键能总和小于生成物键能总和,A项错误;催化剂不改变的大小,B项错误;的状态不同,与的值不相同,D项错误.
7.B 【解析】d区元素最后一个核外电子可能填充在d能级上,也可能填充在s能级上,C项错误;s区的元素中H元素是非金属元素,D项错误.
8.D 【解析】同周期元素,从左到右原子半径依次减小,A项错误;氧没有最高正价,B项错误;基态原子中,氮原子未成对电子数为3,氧和碳均为2,C项错误.
9.C 【解析】③电解溶液制备不到,反应的化学方程式为,C项符合题意.
10.B 【解析】且的反应一定能自发进行,A项错误;同一物质在固态时的熵值小于在气态时的熵值,C项错误;反应的气体分子数减少,该反应的,D项错误.
11.D 【解析】时,的溶液中含有的物质的量为,A项错误;是强碱弱酸盐,碳酸根离子在溶液中会水解使溶液呈碱性,的数目小于,B项错误;缺溶液的体积,无法计算,C项错误.
12.D 【解析】滴定终点指酸与碱恰好完全反应,同浓度的溶液滴定醋酸溶液,需要消耗氢氧化钠溶液的体积为点不是滴定终点,A项错误;根据图像可知,随着温度升高,降低,说明升高温度,平衡向逆反应方向移动,正反应为放热反应,即升高温度,平衡常数减小,推出,B项错误;碳酸氢钠的溶解度小于碳酸钠,将通入饱和碳酸钠溶液中发生反应,剩余溶液仍是饱和碳酸氢钠溶液,碳酸氢钠属于可溶强电解质,因此通入饱和碳酸钠溶液中导电能力虽然减弱,但不会趋于0,C项错误.
13.B 【解析】b极为阳极,与电源正极相连,A项错误;电解质溶液中浓度过高,在电极上得电子的氢离子会更多,不利于硝基苯得电子,不利于硝基苯降解,C项错误;极上硝基苯发生的反应为,D项错误.
14.B 【解析】为弱酸,的溶液中点的,说明d点滴加了酸,抑制了水的电离,b点和c点滴加了溶液,趋向于滴定终点,但滴定终点为碱性溶液,所以℃点还没有达到滴定终点,故溶液中水的电离程度:,A项错误;根据电荷守恒,,酸性时,,碱性时,,C项错误;,D项错误.
15.(1)发射(1分)
(2)d(2分);球(2分);(2分);(2分)
(3)的价电子排布式为,处于半满状态,能量比较低,再失去一个电子需要的能量较大(2分)
(4)的价电子排布式为的价电子排布式为,而全满能量越低结构更稳定,所以比更稳定,更易被氧化为(2分)
(5)小于(2分)
【解析】(1)激发态的电子从能量较高的轨道跃迁到能量较低的轨道,以光的形式释放出能量,属于发射光谱.
(2)是22号元素,故其核外电子排布式为,电子最后进入能级,故原子位于元素周期表中的d区,最高能层为第4层,即电子,s能级的电子云轮廓图为球形,其价电子排布式为,与同周期的过渡元素中,未成对电子数最多的即,其基态原子的外围电子排布图为.
(3)锰元素位于第四周期第族,是25号元素,基态的价电子排布式为或者的价电子排布式为的价电子排布式为的价电子处于半满状态,能量比较低,再失去一个电子需要的能量较大.
(4)由于的价电子排布式为的价电子排布式为,而全满能量越低结构更稳定,所以比更稳定,更易被氧化为.
(5)当原子核外电子排布的电子层数相同时,核外电子数越多则有效核电荷数越少,对应的微粒半径越大,故的核外电子数比少,故半径大小关系为小于.
16.(1)①容量瓶(或容量瓶,1分)
②2(1分);玻璃棒应伸入刻度线以下(或容量瓶瓶塞应系在细颈瓶口,2分)
(2)①酸(1分);(或,2分)
②锥形瓶中溶液颜色的变化(1分)
③当滴入最后半滴标准液时,锥形瓶中溶液颜色变为红色,且内颜色不变(2分)
④(2分)
(3)BC(2分)
17.(1)六(2分);(2分)
(2)(2分)
(3)(2分)
(4)(2分);取少许最后一次洗涤液于试管中,向其中加入盐酸酸化的溶液(2分)
(5)(2分)
【解析】(2)与发生反应生成、S,则铁离子表现氧化性,被还原为亚铁离子,离子方程式为.
(3)验证滤液1中存在与溶液发生反应,生成蓝色沉淀.
(4)要实现转化为;检验固体是否洗涤干净的操作是取少许最后一次洗涤液于试管中,向其中加入盐酸酸化的溶液.
(5)的物质的量为,则时,铅的氧化物含有,即,则含氧元素,即,则该氧化物的化学式为.
18.(1)①(2分);低温(1分) ②<(2分) ③BD(2分)
(2)①AC(2分)
②温度到一定值时,此时反应以反应Ⅱ为主,反应Ⅱ是气体体积不变的反应,改变压强平衡不移动,二氧化碳转化率不变,三条压强曲线交于一点(2分)
(3)①0.1(2分) ②10(2分)
【解析】(1)③反应前后质量守恒、原子守恒,碳与氧元素质量比恒定不变,A项不符合题意;体积不变,气体质量不变,气体密度是定值不能判断达到平衡状态,C项不符合题意.
(2)①图甲中,同一温度下压强增大反应Ⅰ平衡正向移动,甲醇的产率越高,因此,B项错误;催化剂不能提高的平衡转化率,D项错误.
(3)根据碳元素守恒可知,,有和生成,则反应Ⅰ生成的为,消耗的为;反应Ⅳ生成的为,消耗的为;则平衡时,.由此计算可得,反应Ⅰ的平衡常数.
本试卷满分100分,考试用时75分钟.
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上.
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案标号.回答非选择题时,将答案写在答题卡上.写在本试卷上无效.
3.考试结束后,将本试卷和答题卡一并交回.
4.本试卷主要考试内容:人教版选择性必修1,选择性必修2第一章.
5.可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.下列图中所发生的现象与电子跃迁无关的是( )
A.节日里燃放的烟花 B.五彩的霓虹广告灯 C.蜡烛燃烧 D.平面镜成像
A.A B.B C.C D.D
2.下列事实不能用勒夏特列原理(化学平衡移动原理)解释的是( )
A.合成氨时,选定温度为,而不是常温
B.人体血液的稳定在范围内
C.氯气在水中的溶解度大于在饱和食盐水中的溶解度
D.生活中,可用热的纯碱溶液除油污
3.若将原子的电子排布式写成,则违背了( )
A.能量守恒原理 B.泡利不相容原理 C.能量最低原理 D.洪特规则
4.将下列各物质加入或通入水中,能促进水的电离的是( )
A. B. C. D.
5.常温下,下列离子在酸性条件下能大量存在的是( )
A. B. C. D.
6.在载人航天器中,可以利用和的反应,将航天员呼出的转化为等,发生的反应为,下列说法正确的是( )
A.该反应的反应物键能总和大于生成物键能总
B.加入合适的催化剂,的值将减小
C.每断裂键,同时形成键
D.对于反应与的值相同
7.下列有关元素周期表和元素周期律的说法正确的是( )
A.同一周期从左到右,元素的第一电离能依次增大
B.同一主族从上到下,元素的电负性依次减小
C.d区元素最后一个核外电子一定填充在s能级上
D.元素周期表中,s区、d区和区的元素是金属元素
8.下列有关微粒性质的比较中,正确的是( )
A.原子半径: B.最高正价:
C.基态原子未成对电子数: D.第一电离能:
9.利用下列装置不能达到相应目的的是( )
① ② ③ ④
A.①测定中和反应反应热 B.②测定溶液的
C.③电解溶液,制备金属 D.④牺牲阳极法保护钢铁桥墩
10.判断化学反应进行的方向是一个比较复杂的问题.下列有关说法正确的是( )
A.或的反应一定能自发进行
B.反应能否自发进行与温度有关
C.在不同状态时的熵值:
D.反应的
11.设为阿伏加德罗常数的值.下列说法正确的是( )
A.时,的溶液中含有的数目为
B.的溶液中含有的数目为
C.时,的溶液中含有的数目为
D.时,的溶液中,水电离出的的数目为
12.根据下列图示所得出的结论正确的是( )
甲 乙 丙 丁
A.图甲是常温下用溶液滴定溶液的滴定曲线,Q点表示酸碱中和滴定终点
B.图乙是中的平衡浓度随温度变化的曲线,说明平衡常数
C.图丙表示通入饱和溶液中,溶液导电能力的变化
D.图丁是反应生成的能量变化曲线,a表示变成气态原子过程中吸收的能量
13.电解法可将硝基苯降解为苯胺,工作原理如图所示.下列说法正确的是( )
A.b极连接电源负极
B.理论上每转移电子,将有从右室移入左室
C.电解质溶液中浓度越大,越利于硝基苯降解
D.a极上硝基苯发生的反应为
14.室温下,向两份浓度均为的溶液中分别滴加的盐酸和溶液,向两份的溶液中也进行同样操作,测得x[其中或Y]与溶液的关系如图所示.
已知:.下列说法正确的是( )
A.溶液中水的电离程度:
B.d点溶液中:
C.b点到c点之间,始终大于
D.溶液中的
二、非选择题:本题共4小题,共58分.
15.(15分)均为第四周期金属元素,它们的单质及化合物在诸多领域都有广泛的应用.回答下列问题:
(1)钾在火焰上灼烧的紫光是一种____________(填“吸收”或“发射”)光谱.
(2)原子位于元素周期表中的____________区,基态最高能层电子的电子云轮廓图为____________形,其价电子排布式为____________.与同周期的过渡元素中,未成对电子数最多的基态原子的价电子排布图为____________.
(3)均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素
电离能/ 717 759
1509 1561
3248 2957
锰元素位于第四周期第族.比较两元素的可知,气态再失去1个电子比气态再失去1个电子难,原因是______________________________________________________________.
(4)琥珀酸亚铁片是用于预防和治疗缺铁性贫血的常见药物,临床建议服用维生素C促进亚铁的吸收,避免生成,从结构角度来看,易被氧化成的原因是________________________________________________________.
(5)与的半径大小关系为____________(填“大于”或“小于”).
16.(14分)用氧化还原滴定法测定的质量分数:一定条件下,将溶解并还原为,再以溶液作指示剂,用标准液滴定至全部生成.
(1)配制标准液的过程中,溶液转移时的操作如图所示.
①仪器a的名称为____________.
②图中错误的地方有____________处,请指出其中一处:____________.
(2)滴定时:
①标准液应盛装在____________(填“酸”或“碱”)式滴定管中,理由为_____________________(用离子方程式表示,写一个即可).
②滴定过程中,眼睛应注视____________.
③到达滴定终点时的现象为____________.
④若称取试样,消耗标准溶液,则的质量分数为____________(用含m、c、V的代数式表示,不考虑操作过程中质量的损失).
(3)下列实验误差分析错误的是____________(填标号).
A.滴定前滴定管内无气泡,终点读数时有气泡,所测定的结果偏小
B.刚看到指示剂局部的颜色有变化就停止滴定,所测定的结果偏大
C.读数时,滴定前府视,滴定后仰视,所测定的结果偏小
D.未用标液溶液润洗滴定管,所测定的结果偏大
17.(14分)主要用作颜料、冶金助熔剂、油漆催干剂、橡胶硫化促进剂、杀虫剂等.一种以方铅矿(含及少量等)为原料制备的工艺流程如图:
回答下列问题:
(1)在元素周期表中位于第____________周期____________族.
(2)“酸浸氧化”过程中与发生反应生成,反应的离子方程式为____________________.
(3)验证滤液1中存在,可取样后滴加少量____________(填化学式)溶液,观察到有蓝色沉淀析出.
(4)已知:.要实现转化为的最小值为____________(保留两位有效数字).“洗涤”时,检验固体是否洗涤干净的操作是____________.
(5)已知焙烧可制得铅的氧化物,为了研究其产物成分,取进行焙烧,其热重曲线如图所示,请写出时所得铅的氧化物的化学式:____________.
18.(15分)研发二氧化碳的利用技术,将二氧化碳转化为能源是减轻环境污染和解决能源问题的方案之一.回答下列问题:
(1)利用合成二甲醚有两种工艺.
工艺1:
涉及以下主要反应:
反应Ⅰ.甲醇的合成:
反应Ⅱ.逆水汽变换:
反应Ⅲ.甲醇脱水:
工艺2:反应Ⅳ.
①____________,反应Ⅳ在____________(填“低温”“高温”或“任意温度”)下自发进行.
②反应Ⅳ的活化能(正)____________(填“>”“<”或“=”)(逆).
③在恒温恒容的密闭容器中,下列说法能判断反应Ⅳ达到平衡的是____________(填标号).
A.气体物质中碳元素与氧元素的质量比不变
B.容器内浓度保持不变
C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
(2)在不同压强下,按照投料合成甲醇(反应Ⅰ),实验测得的平衡转化率和的平衡产率随温度的变化关系如图甲、乙所示.
图甲 图乙
①下列说法正确的是____________(填标号).
A.图甲纵坐标表示的平衡产率
B.
C.为了同时提高的平衡转化率和的平衡产率,应选择低温、高压条件
D.一定温度、压强下,提高的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是_________________________________.
(3)在T,温度下,将和充入的恒容密闭容器中发生反应Ⅰ和Ⅳ,达到平衡状态时和的物质的量分别为和.
①反应经过达到平衡,内的平均反应速率____________.
②温度时反应Ⅰ的平衡常数____________.
黔东南州2023-2024学年高二上学期期末考试
化学参考答案
1.D 【解析】平面镜成像是光线反射的结果,与电子跃迁无关,D项符合题意.
2.A 【解析】合成氨的反应为放热反应,升高温度平衡逆向移动,不利于生成氨气,所以选定温度为,而不是常温,主要是从速率角度考虑,与平衡移动无关,不能用勒夏特列原理解释,A项符合题意.
3.D 【解析】洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同.故违背了洪特规则,D项符合题意.
4.A 【解析】在水中电离出的发生水解,促进水的电离,A项符合题意.
5.C 【解析】均能与结合,形成弱电解质,A、B、D项均不符合题意.
6.C 【解析】该反应的反应物键能总和小于生成物键能总和,A项错误;催化剂不改变的大小,B项错误;的状态不同,与的值不相同,D项错误.
7.B 【解析】d区元素最后一个核外电子可能填充在d能级上,也可能填充在s能级上,C项错误;s区的元素中H元素是非金属元素,D项错误.
8.D 【解析】同周期元素,从左到右原子半径依次减小,A项错误;氧没有最高正价,B项错误;基态原子中,氮原子未成对电子数为3,氧和碳均为2,C项错误.
9.C 【解析】③电解溶液制备不到,反应的化学方程式为,C项符合题意.
10.B 【解析】且的反应一定能自发进行,A项错误;同一物质在固态时的熵值小于在气态时的熵值,C项错误;反应的气体分子数减少,该反应的,D项错误.
11.D 【解析】时,的溶液中含有的物质的量为,A项错误;是强碱弱酸盐,碳酸根离子在溶液中会水解使溶液呈碱性,的数目小于,B项错误;缺溶液的体积,无法计算,C项错误.
12.D 【解析】滴定终点指酸与碱恰好完全反应,同浓度的溶液滴定醋酸溶液,需要消耗氢氧化钠溶液的体积为点不是滴定终点,A项错误;根据图像可知,随着温度升高,降低,说明升高温度,平衡向逆反应方向移动,正反应为放热反应,即升高温度,平衡常数减小,推出,B项错误;碳酸氢钠的溶解度小于碳酸钠,将通入饱和碳酸钠溶液中发生反应,剩余溶液仍是饱和碳酸氢钠溶液,碳酸氢钠属于可溶强电解质,因此通入饱和碳酸钠溶液中导电能力虽然减弱,但不会趋于0,C项错误.
13.B 【解析】b极为阳极,与电源正极相连,A项错误;电解质溶液中浓度过高,在电极上得电子的氢离子会更多,不利于硝基苯得电子,不利于硝基苯降解,C项错误;极上硝基苯发生的反应为,D项错误.
14.B 【解析】为弱酸,的溶液中点的,说明d点滴加了酸,抑制了水的电离,b点和c点滴加了溶液,趋向于滴定终点,但滴定终点为碱性溶液,所以℃点还没有达到滴定终点,故溶液中水的电离程度:,A项错误;根据电荷守恒,,酸性时,,碱性时,,C项错误;,D项错误.
15.(1)发射(1分)
(2)d(2分);球(2分);(2分);(2分)
(3)的价电子排布式为,处于半满状态,能量比较低,再失去一个电子需要的能量较大(2分)
(4)的价电子排布式为的价电子排布式为,而全满能量越低结构更稳定,所以比更稳定,更易被氧化为(2分)
(5)小于(2分)
【解析】(1)激发态的电子从能量较高的轨道跃迁到能量较低的轨道,以光的形式释放出能量,属于发射光谱.
(2)是22号元素,故其核外电子排布式为,电子最后进入能级,故原子位于元素周期表中的d区,最高能层为第4层,即电子,s能级的电子云轮廓图为球形,其价电子排布式为,与同周期的过渡元素中,未成对电子数最多的即,其基态原子的外围电子排布图为.
(3)锰元素位于第四周期第族,是25号元素,基态的价电子排布式为或者的价电子排布式为的价电子排布式为的价电子处于半满状态,能量比较低,再失去一个电子需要的能量较大.
(4)由于的价电子排布式为的价电子排布式为,而全满能量越低结构更稳定,所以比更稳定,更易被氧化为.
(5)当原子核外电子排布的电子层数相同时,核外电子数越多则有效核电荷数越少,对应的微粒半径越大,故的核外电子数比少,故半径大小关系为小于.
16.(1)①容量瓶(或容量瓶,1分)
②2(1分);玻璃棒应伸入刻度线以下(或容量瓶瓶塞应系在细颈瓶口,2分)
(2)①酸(1分);(或,2分)
②锥形瓶中溶液颜色的变化(1分)
③当滴入最后半滴标准液时,锥形瓶中溶液颜色变为红色,且内颜色不变(2分)
④(2分)
(3)BC(2分)
17.(1)六(2分);(2分)
(2)(2分)
(3)(2分)
(4)(2分);取少许最后一次洗涤液于试管中,向其中加入盐酸酸化的溶液(2分)
(5)(2分)
【解析】(2)与发生反应生成、S,则铁离子表现氧化性,被还原为亚铁离子,离子方程式为.
(3)验证滤液1中存在与溶液发生反应,生成蓝色沉淀.
(4)要实现转化为;检验固体是否洗涤干净的操作是取少许最后一次洗涤液于试管中,向其中加入盐酸酸化的溶液.
(5)的物质的量为,则时,铅的氧化物含有,即,则含氧元素,即,则该氧化物的化学式为.
18.(1)①(2分);低温(1分) ②<(2分) ③BD(2分)
(2)①AC(2分)
②温度到一定值时,此时反应以反应Ⅱ为主,反应Ⅱ是气体体积不变的反应,改变压强平衡不移动,二氧化碳转化率不变,三条压强曲线交于一点(2分)
(3)①0.1(2分) ②10(2分)
【解析】(1)③反应前后质量守恒、原子守恒,碳与氧元素质量比恒定不变,A项不符合题意;体积不变,气体质量不变,气体密度是定值不能判断达到平衡状态,C项不符合题意.
(2)①图甲中,同一温度下压强增大反应Ⅰ平衡正向移动,甲醇的产率越高,因此,B项错误;催化剂不能提高的平衡转化率,D项错误.
(3)根据碳元素守恒可知,,有和生成,则反应Ⅰ生成的为,消耗的为;反应Ⅳ生成的为,消耗的为;则平衡时,.由此计算可得,反应Ⅰ的平衡常数.
同课章节目录
