6.2 化学反应的速率与限度 同步训练(含解析) 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 6.2 化学反应的速率与限度 同步训练(含解析) 2023-2024学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 443.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-14 21:19:23 | ||
图片预览



文档简介
6.2 化学反应的速率与限度 同步训练
一、单选题
1.对某一可逆反应来说,下列有关使用催化剂和不使用催化剂的说法不正确的是( )
A.使用催化剂不能增大反应物的平衡转化率
B.使用催化剂能同等程度改变正、逆反应速率
C.不使用催化剂,反应物在相同时间段内改变的物质的量一定比使用催化剂时少
D.不使用催化剂,平衡时混合物的组成不会改变
2.某反应的反应机理、能量与反应进程的关系如下图所示,下列说法正确的是( )
A.是该反应的催化剂
B.第一反应、第二步反应,和总反应都是放热反应|
C.第一步反应决定总反应的速率
D.在第一步反应中作还原剂
3.已知:CaSO4(s) Ca2+(aq)+SO42-(aq) H<0。对含有大量CaSO4(s)的浊液改变一个条件,下列图像符合浊液中c(Ca2+)变化的是( )
A.加入少量BaCl2(s)
B.加少量蒸馏水
C.加少量硫酸
D.适当升高温度
4.在催化剂a和催化剂b的作用下,氮气分子参与反应的有关反应历程如图所示:
下列说法错误的是( )
A.过程①为工业合成氨气
B.过程②中参加反应的分子,化学键未完全断裂
C.温度不变,缩小体积,过程①②的反应速率均增大
D.上述反应包括在催化剂表面发生的反应物吸附及产物脱附等过程
5.下列关于化学反应速率与限度的说法中,错误的是( )
A.化学反应限度可以通过改变条件而改变
B.决定化学反应速率的主要因素是反应物本身的性质
C.可逆反应达到化学平衡状态时,正、逆反应的化学反应速率都为零
D.化学反应限度决定了反应物在该条件下的最大转化率
6.溶液中存在平衡:.现在用溶液进行下列实验:
结合实验下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中被还原
C.对比②和④可知酸性溶液氧化性弱
D.若向④中加入溶液至过量,溶液变为绿色
7.在5 L的恒容密闭容器中进行反应4NH3(g)+6NO(g)=5N2(g)+6H2O(g),2 min后,NH3减少了0.4 mol,则该反应的化学反应速率表示正确的是( )
A.v(NH3)=0.004 mol·L-1·min-1 B.v(H2O)=0.001 mol·L-1·s-1
C.v(NO)=0.006 mol·L-1·s-1 D.v(N2)=0.005 mol·L-1·min-1
8.下列分析错误的是( )
A.“木与木相摩则然(燃)”的“然”是热能转变为化学能
B.“司烜氏,掌以夫遂(青铜凹镜)取明火于日”的“夫遂”是合金
C.“著作酒醴(甜酒),尔惟曲蘖(酒曲)”的“曲蘖”是催化剂
D.“浮梁巧烧瓷,颜色比琼玖”的“瓷”是硅酸盐产品
9.可逆反应mA(s)+nB(g) eC(g)+fD(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.达到平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中,化学计量数的关系为n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
10.对已达到化学平衡的反应2X(g)+Y(g) 2Z(g),减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
11.在1L的密闭容器中进行反应A (g) + 3B (g) 2C (g),0~2 min内A的物质的量由2 mol减小到0.8 mol,则用A的浓度变化表示的反应速率为
A.1.2 mol / ( L·min ) B.1 mol / ( L·min )
C.0.6 mol / ( L·min ) D.0.4 mol / ( L·min )
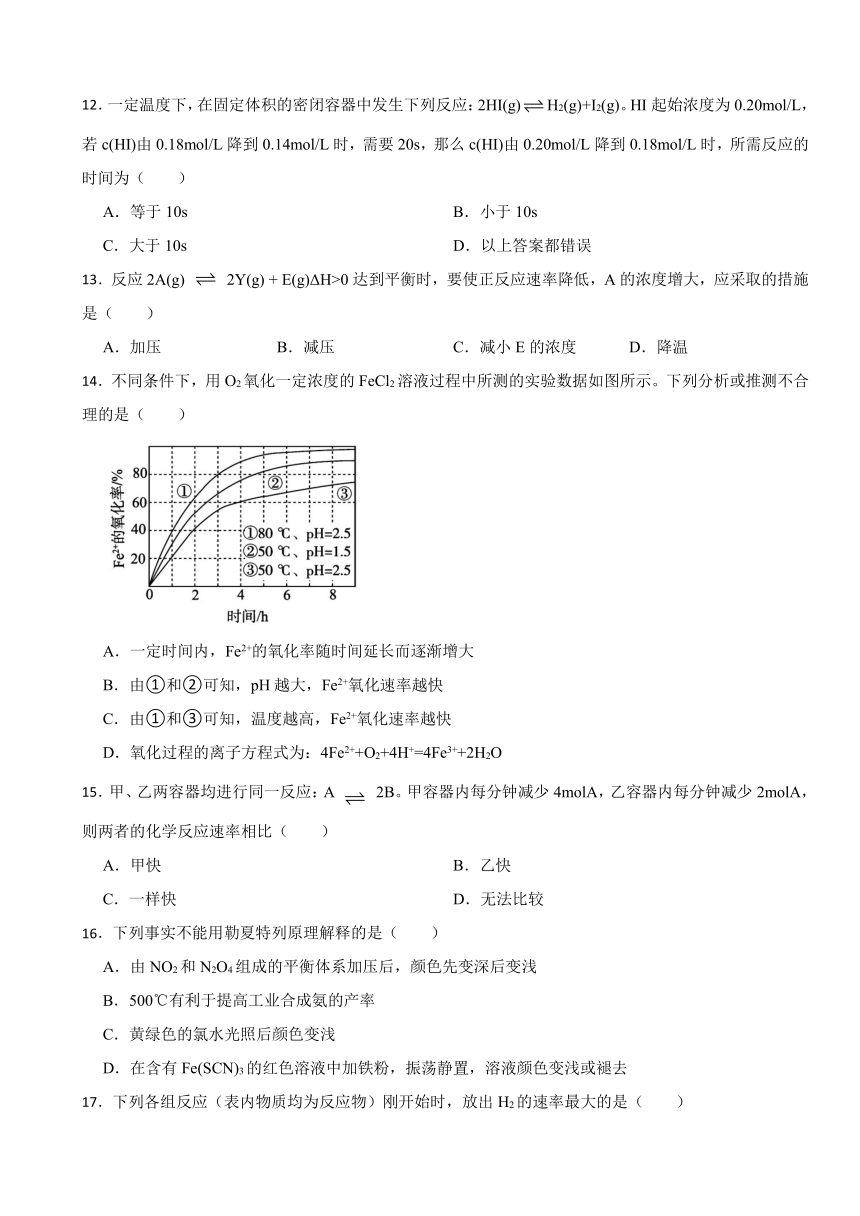
12.一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)H2(g)+I2(g)。HI起始浓度为0.20mol/L,若c(HI)由0.18mol/L降到0.14mol/L时,需要20s,那么c(HI)由0.20mol/L降到0.18mol/L时,所需反应的时间为( )
A.等于10s B.小于10s
C.大于10s D.以上答案都错误
13.反应2A(g) 2Y(g) + E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压 B.减压 C.减小E的浓度 D.降温
14.不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是( )
A.一定时间内,Fe2+的氧化率随时间延长而逐渐增大
B.由①和②可知,pH越大,Fe2+氧化速率越快
C.由①和③可知,温度越高,Fe2+氧化速率越快
D.氧化过程的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
15.甲、乙两容器均进行同一反应:A 2B。甲容器内每分钟减少4molA,乙容器内每分钟减少2molA,则两者的化学反应速率相比( )
A.甲快 B.乙快
C.一样快 D.无法比较
16.下列事实不能用勒夏特列原理解释的是( )
A.由NO2和N2O4组成的平衡体系加压后,颜色先变深后变浅
B.500℃有利于提高工业合成氨的产率
C.黄绿色的氯水光照后颜色变浅
D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
17.下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是( )
编号 金属(粉末状) 酸的浓度 酸的体积 反应温度
A 0.1molMg 6mol/L硝酸 10mL 60℃
B 0.1molMg 3mol/L盐酸 10mL 60℃
C 0.1molFe 3mol/L盐酸 10mL 60℃
D 0.1molMg 3mol/L盐酸 10mL 30℃
A.A B.B C.C D.D
18.用100mL1mol·L-1盐酸与锌粉反应制备氢气,下列措施能加快反应速率的是
A.降低温度 B.改用200mL1mol·L-1盐酸
C.用锌块代替锌粉 D.滴加少量CuCl2溶液
19.1,3-丁二烯和Br2以物质的量之比为1:1发生加成反应分两步:第一步Br+进攻1,3-丁二烯生成中间体C(溴正离子);第二步Br-进攻中间体C完成1,2-加成或1,4-加成。反应过程中的能量变化如下图所示,下列说法正确的是( )
A.其它条件相同时,生成产物B的速率快于产物A的速率
B.升高温度,1,3-丁二烯的平衡转化率增大
C.该加成反应的反应热为Eb-Ea
D.该反应的速率主要取决于第一步反应的快慢
20.一定条件下,向密闭容器中通入一定量的CO和制备甲醇,反应为,测得容器内的分压与反应时间的关系如图所示。反应到图中X点时,用分压表示的平均变化率为( )
A. B.
C. D.
二、综合题
21.Ⅰ.将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内正反应的平均反应速率为: ;
(2)反应前A的物质的量浓度是: ;
(3)10s末,生成物D的浓度为 ;
(4)Ⅱ.在体积为2 L的密闭容器中(体积不变),充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的物质的量随时间变化如图所示:
从反应开始到10 min,氢气的平均反应速率v(H2)= 。
(5)下列说法正确的是____。
A.当t=0时,v(逆)=0
B.进行到3 min时,正反应速率和逆反应速率相等
C.10 min后容器中压强不再改变
D.3 min前v(正)>v(逆),3 min后v(正)22.T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题:
(1)写出该反应的化学方程式 .
(2)反应开始至3min时,用D表示的平均反应速率为 mol/(L min).
(3)若升高温度,则v(正) ,v(逆) (填“加快”或“减慢”)。
(4)若反应在甲、乙两个相同容器内同时进行,分别测得甲中v(A)=0.3 mol·L-1·min-1,乙中v(B)=0.2 mol·L-1·min-1,则 容器中反应更快。
23.根据要求回答下列问题:
反应的能量变化趋势如图所示。
(1)该反应为 (填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率加快,下列措施不可行的是____(填字母)。
A.将铁片改为铁粉 B.滴加少量溶液
C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)欲区分葡萄糖和淀粉,可选用____(填字母,下同)。
A.碘水 B.银氨溶液 C.盐酸 D.溶液
(4)氮的化合物常用作制冷剂的是 (填名称),向蔗糖中滴加少量浓硫酸并搅拌,出现“黑色面包”,并产生刺激性无色气体,这一现象显示浓硫酸的 (填性质)。
(5)燃煤排放的尾气中含有二氧化硫、氮的氧化物(主要为)等污染物,工业上采用碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。脱硫的离子方程式为 ,实验证明相对于,更难脱除,其原因可能是 。
24.如图所示,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g) xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
(1)若甲中两条曲线分别代表有催化剂和无催化剂的情况,则 曲线代表无催化剂时的情况。
(2)若乙表示反应达到平衡状态后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He后的情况,则 曲线表示恒温恒容的情况,且此时混合气体中w(C) (填“变大”“变小”或“不变”)。
(3)根据丙可以判断该可逆反应的正反应是 (填“放热”或“吸热”)反应,x的值为 。
(4)丁表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随温度(T)的变化情况,根据你的理解,丁的纵坐标可以是 (填序号)。
①w(C) ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)
升高温度,平衡向 (填“正反应”或“逆反应”)方向移动。
25.某学生用纯净的Cu与50mL过量浓HNO3反应制取NO2 (不考虑NO气体的影响),实验结果如图所示(气体体积均为标准状况下测定,且忽略溶液体积变化)。
回答下面问题:
(1)该反应是一个放热明显的化学反应,写出反应的离子方程式 。
(2)由图象可知O-A、A-B、B-C段的反应速率最大的是 (填“O-A”“A-B”或“B-C”)。1min后A-B段反应速率逐渐加快,除产物可能有催化作用外,其主要原因还有: 。2min后B-C段反应速率又逐渐变慢的原因是 。
(3)计算在1~3 min内的反应速率: v(H+ )= mol·L-1·min-1。
(4)若开始向反应溶液中加入固体KNO3,则1min时测得V(NO2) 84 mL (填“大于”“小于”“等于”或“不确定”)。
(5)下列措施不能加快v(NO2)的是____。
A.使用Cu粉代替Cu块 B.使用含有石墨的粗铜代替纯铜
C.使用稀硝酸代替浓硝酸 D.在硝酸中加入少量浓硫酸
答案解析部分
1.【答案】C
【解析】【解答】A.使用催化剂不影响平衡,不能改变转化率,A不符合题意;
B.使用催化剂能同等程度的改变反应速率,B不符合题意;
C.反应达到平衡后,相同时间段内物质的改变量均为零,C符合题意;
D.平衡时混合物的组成不会改变,催化剂对平衡不影响,D不符合题意;
故答案为:C。
【分析】催化剂能加快化学反应速率但是不能影响化学平衡。
2.【答案】C
【解析】【解答】A.Fe2+在第一步反应中消耗,在第二步反应中生成,则Fe2+是该反应的催化剂,碘离子是反应物,故A不符合题意;
B.由图可知,第一步反应为吸热反应,第二步反应和总反应都是放热反应,故B不符合题意;
C.由图可知,第一步反应的活化能比第二步反应的大,第一步反应决定总反应的速率,故C符合题意;
D.第一步反应中中硫元素化合价下降,则在第一步反应中作氧化剂,故D不符合题意;
故答案为:C。
【分析】A、注意催化剂指的是第一反应的反应物,第二反应的生成物,中间产物指的是第一反应的生成物,第二反应的反应物;
B、反应物的总能量大于生成物的总能量,反应放热,反之反应吸热;
C、活化能大为决速步骤;
D、硫元素化合价降低,作为氧化剂。
3.【答案】C
【解析】【解答】A. 加少量BaCl2生成BaSO4沉淀,c(SO42-)减小,使CaSO4溶解平衡向溶解方向移动,c(Ca2+)增大,故A不符合题意;
B. 加少量蒸馏水,CaSO4(s)继续溶解至饱和,c(Ca2+)不变,故B不符合题意;
C. 加少量硫酸c(SO42-)增大,使CaSO4溶解平衡向沉淀方向移动,c(Ca2+)减小,故C符合题意;
D. 适当升高温度,使CaSO4溶解平衡向沉淀方向移动,c(Ca2+)减小,故D不符合题意;
故答案为C。
【分析】根据勒夏特列原理:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
4.【答案】B
【解析】【解答】A.由图①反应历程可知在催化剂a表面氮气和氢气反应生成氨气,故A不符合题意;
B.由过程②反应历程可知氨气和氧气在催化剂b表面发生反应,氧气完全断裂成氧原子,氨分子中的N-H键完全断裂,然后H原子与O原子结合成水分子,N与O结合成NO,反应物中所有化学键均断裂,故B符合题意;
C. 温度不变,缩小体积,增大了体系内的压强,对有气体参加的反应能提高化学反应速率,故C不符合题意;
D.上述过程中反应物分子被催化剂吸附,在催化剂表面断裂成原子,原子再重新结合成新的分子脱离催化剂,故D不符合题意;
故答案为:B。
【分析】A、根据图象可以知道过程 ① 中的分子有H2、N2和NH3;
B、结合图象可以发现所有化学键都断裂;
C、压缩体积,浓度增大,速率增大;
D、根据图象可以知道过程 ① 有反应物吸附,过程 ② 有生成物脱附。
5.【答案】C
【解析】【解答】A.改变温度、压强、浓度,可以使化学反应限度发生变化,故A不符合题意;
B.反应物本身的性质决定化学反应的快慢,故B不符合题意;
C.可逆反应达到化学平衡状态时,正、逆反应的化学反应速率相等,但不为零,故C符合题意;
D.化学反应达到平衡时,反应物浓度不再改变,在该条件下反应物的转化率达到最大值,故D不符合题意;
故答案为:C。
【分析】达到平衡时,各物质浓度保持不变,消耗速率和生成速率相等,达到动态平衡;达到最大限度,当外界条件发生改变,平衡也会发生改变。
6.【答案】C
【解析】【解答】A、滴加稀硫酸,氢离子浓度增大, 的平衡逆向移动,①中溶液橙色加深,滴加NaOH溶液,的平衡正向移动,③中溶液变黄,故A正确;
B、 ②中溶液变为绿色,说明被乙醇还原为,故B正确;
C、对比②和④可知,酸性条件下,能将乙醇氧化,而碱性条件下不能氧化,说明酸性溶液氧化性强,故C错误;
D、 若向④中加入溶液至过量,的平衡逆向移动,溶液变为绿色,故D正确;
故答案为:C。
【分析】A、滴加稀硫酸,该反应的平衡逆向移动,滴加NaOH溶液,该反应的平衡正向移动;
B、乙醇具有还原性;
C、 溶液在酸性条件下的氧化性强于碱性条件;
D、 向④中加入溶液至过量,的平衡逆向移动。
7.【答案】B
【解析】【解答】A.反应在5 L容器中进行,2 min后,NH3减少了0.4 mol,则v(NH3)= ,A不符合题意;
B.根据选项A分析可知v(NH3)=0.04 mol/(L·min),由于v(H2O):v(NH3)=6:4,所以v(H2O)= v(NH3)= ×0.04 mol/(L·min)=0.06 mol/(L·min)=0.001 mol·L-1·s-1,B符合题意;
C.根据选项A分析可知v(NH3)=0.04 mol/(L·min),由于v(NO):v(NH3)=6:4,所以v(NO)= v(NH3)= ×0.04 mol/(L·min)=0.06 mol/(L·min)=0.001 mol·L-1·s-1,C不符合题意;
D.根据选项A分析可知v(NH3)=0.04 mol/(L·min),由于v(N2):v(NH3)=5:4,所以v(N2)= v(NH3)= ×0.04 mol/(L·min)=0.05mol/(L·min),D不符合题意;
故答案为:B。
【分析】先根据NH3的物质的量变化计算反应速率,然后根据用不同物质表示反应速率时,速率比等于化学方程式中相应物质的化学计量数的比进行计算判断。
8.【答案】A
【解析】【解答】A.“木与木相摩则然(燃)”为燃烧过程,燃烧是化学能转变为热能,A符合题意;
B.“夫遂”是古人用于日下取火的青铜凹镜,青铜是铜加入锡或铅的合金,B不符合题意;
C.“曲蘖(酒曲)”是催化葡萄糖分解生成酒精的酶,为催化剂,C不符合题意;
D.“瓷”即陶瓷,由黏土(主要成分为硅酸盐)烧制而成,为硅酸盐产品,D不符合题意。
故答案为:A。
【分析】燃烧是将化学能转化为热能,摩擦的过程主要是达到可燃物的着火点,其他选项均正确
9.【答案】B
【解析】【解答】根据图像①可知,T2温度是首先平衡,故T2>T1,根据①中C的体积分数可知,该反应为放热反应。根据图像②可知,P2压强下首先平衡,故P2>P1,又由于C的体积分数可知,P2条件下平衡向逆反应方向移动,故n<e+f 。A选项,加入催化剂不改变平衡,不符合题意。B选项符合题意。C选项,化学方程式中n<e+f。D选项,达到平衡后加入A,但A为固体,对化学平衡无影响。故不符合题意。
【分析】A.催化剂不能使平衡发生移动,C的体积分数不变;
B.由温度与C的体积分数的关系图可知,温度T2>T1,升高温度产物C的体积分数降低,平衡向逆反应方向移动;
C.由压强与C的体积分图像可知,压强p2>P1,增大压强C的体积分数降低,平衡向逆反应方向移动,所以反应前的气体系数和小雨反应后气体系数和;
D.A为固体,改变用量不影响平衡移动。
10.【答案】C
【解析】【解答】该反应的反应物和生成物均为气体,减小压强,正、逆反应速率都将减小,这一点只有C项符合;该反应是一个正向气体分子总数减小的反应,减小压强,平衡向逆反应方向移动。
故答案为:C
【分析】对于反应 2X(g)+Y(g) 2Z(g) ,压强减小,正、逆反应速率都将减小,正反应是物质的量减小的反应,减小压强,反应逆向进行。
11.【答案】C
【解析】【解答】在1L的密闭容器中进行反应A(g)+3B(g) 2C(g),0~2min内A的物质的量由2mol减小到0.8mol,则用A的浓度变化表示的反应速率v(A)= =0.6mol·L-1 mol-1;
故答案为:C。
【分析】利用υ=Δc/Δt计算。
12.【答案】B
【解析】【解答】c(HI)由0.18mol/L降到0.14mol/L时,需要20s,即平均速率为 ;则c(HI)由0.20mol/L降到0.18mol/L,假设速率不变,则需要,但浓度越大,化学反应速率越大,需要的时间就短,所以需要时间小于10s;
故答案为:B。
【分析】利用υ=Δc/Δt计算,依据影响反应速率的因素分析。
13.【答案】D
【解析】【解答】A、增大压强,平衡向逆反应方向移动,A的浓度增大,但正、逆反应速率都增大,故A不符合题意;
B、降低压强,正、逆速率都减小,平衡向正反应方向移动,A的浓度降低,故B不符合题意;
C、减小E的浓度,平衡向正向反应方向移动,A的浓度减小,正逆反应速率减小,故C不符合题意;
D、正反应为吸热反应,降低温度,平衡逆反应方向移动,正、逆反应速率都减小,A的浓度增大,故D符合题意。
故答案为:D。
【分析】达平衡时,要使v正降低,可采取降低温度、减小压强或减小浓度的措施,使c(A)增大,应使平衡向逆反应方向移动,据此结合选项分析解答。
14.【答案】B
【解析】【解答】A.由图像可知,Fe2+的氧化率随时间延长而逐渐增大,故A不符合题意;
B.由图像可知,①和②的反应温度和溶液的pH均不相同,无法判断溶液的pH和Fe2+氧化速率的关系,故B符合题意;
C.由图像可知,①和③的溶液的pH相同,温度越高,Fe2+氧化速率越快,故C不符合题意;
D.氧化过程发生的反应为酸性条件下,亚铁离子与氧气反应生成铁离子和水,反应的离子方程式为为4Fe2++O2+4H+=4Fe3++2H2O,故D不符合题意;
故答案为:B。
【分析】A.Fe2+的氧化率随时间延长而逐渐增大;
C.①和③只有温度一个变量;
D.氧化过程中发生的反应为4Fe2++O2+4H+=4Fe3++2H2O。
15.【答案】D
【解析】【解答】化学反应速率的计算公式v=△n/V △t,对于甲和乙的时间△t是相等的,甲的△n为4mol,乙的△n为2mol,但甲和乙容器的体积未知,故不能比较两容器中的反应速率。
故答案为:D。
【分析】化学反应速率的计算公式,对于甲和乙的时间△t是相等的,但甲和乙容器的体积未知,故不能比较两容器中的反应速率。
16.【答案】B
【解析】【解答】A、二氧化氮气体中存在平衡2NO2 N2O4,加压后二氧化氮的浓度增大,颜色变深,平衡2NO2 N2O4向正反应移动,二氧化氮的浓度又降低,故气体颜色变浅,但仍比原来的颜色深,能用勒夏特列原理解释,故A不选;
B、合成氨反应是放热反应,为提高氨的产率,理论上应采取降低温度的措施,采用500℃主要考虑反应速率,使催化剂活性最大,与平衡无关,不能用勒夏特列原理解释,
C、对氯水中的次氯酸受光照射会分解,次氯酸浓度减小,使得化学平衡Cl2+H2O HCl+HClO向右移动,能用勒夏特列原理解释,故C不选;
D、溶液中存在平衡Fe3++SCN- Fe(SCN)2+,加铁粉,铁与Fe3+反应,Fe3+浓度降低,则平衡向左移动进行,溶液颜色变浅或褪去,能用勒夏特利原理来解释,故D不选。
故答案为:B。
【分析】 勒夏特列原理:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时注意反应必须是可逆反应,否则勒夏特列原理不适用,据此分析。
17.【答案】B
【解析】【解答】硝酸和镁反应不生成氢气,A选项排除;镁的金属性比铁的强,所以在外界条件相同的情况下,镁比铁的反应速率快,反应速率B>C,排除C选项;在相同的条件下,温度越高、化学反应速率越快,反应速率B>D,因此放出H2的速率最大的是B;
故答案为:B。
【分析】本题的易错点为A,要注意硝酸具有强氧化性,与活泼金属反应一般不放出氢气。
18.【答案】D
【解析】【解答】A.降低温度,会减慢反应速率,A不符合题意;
B.改用200mL1mol·L-1盐酸,溶液浓度不变,反应速率不受影响,B不符合题意;
C.用锌块代替锌粉,会减小反应物的接触面积,减慢反应速率,C不符合题意;
D.滴加少量CuCl2溶液,Zn和CuCl2生成Cu,形成铜锌电池回路,加快反应速率,D符合题意;
故答案为:D。
【分析】依据影响反应速率的因素分析。
19.【答案】D
【解析】【解答】A.据图可知中间体C生成B的活化能更高,反应速率应更慢,A不符合题意;
B.据图可知生成1,3-丁二烯的反应为放热反应,升高温度平衡逆向移动,平衡转化率减小,B不符合题意;
C.Ea是第二步反应中1,2-加成反应的活化能,Eb是第二步反应中1,4-加成反应的活化能,Eb-Ea是只是两种活化能的差值,图中数据不能计算该加成反应的反应热,C不符合题意;
D.据图可知第一步反应的活化能更大,反应速率更慢,整体反应速率取决于慢反应,D符合题意;
故答案为:D。
【分析】A.根据图示活化能越高速率越慢
B.根据焓变=生成物的能量-反应物的能量,结合温度变化进行判断
C.根据图示焓变=生成物的能量-反应物的能量,未给出数据
D.活化能越高速率越慢,活化能高的决定着速率
20.【答案】B
【解析】【解答】反应至X点,氢气的变化量为1.6MPa,则用分压表示的平均变化率为,故B符合题意;
故答案为:B。
【分析】 X点时,氢气减少1.6MPa。
21.【答案】(1)0.04mol L 1 s 1
(2)1.5 mol L 1
(3)0.4 mol L 1
(4)0.1125 mol L 1 min 1
(5)A;C
【解析】【解答】Ⅰ. 反应:3A(g)+B(g) 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,列三段式进行计算;
3A(g)+B(g) 2C(g)+2D(g)
起始量 n m 0 0
变化量 1.2 0.4 0.8 0.8
平衡量 1.8 0.6 0.8 0.8
达到平衡,测得A的物质的量为1.8mol,n=1.8+1.2=3;B的物质的量为0.6mol,m=0.6+0.4=1;
V(C)=0.8mol/2L/10s=0.04 mol L 1 s 1
反应前A的物质的量浓度是C(A) =3mol/2L=1.5 mol L 1
10s末,生成物D的浓度C(D)=0.8mol/2L=0.4 mol L 1
Ⅱ.(1) 从反应开始到平衡,v(CO2)= 1-0.25mol/2L/10min=0.0375mol L-1 min-1,速率之比等于化学计量数之比,v(H2)=3×0.0375mol L-1 min-1=0.1125 mol L-1 min-1,
(2)A.t=0时,逆反应还没开始,v(逆)=0,A符合题意;
B.进行到3分钟时,CO2和CH3OH(g)的浓度相同,不能得出正逆反应速率相等,B不符合题意;
C.反应在10min时达到平衡,压强不再变化,C符合题意;
D.3min前后反应物浓度都在减小,生成物浓度都在增大,平衡前10min是v正>v逆,D不符合题意;
【分析】Ⅰ.列三段式进行计算;
3A(g)+B(g) 2C(g)+2D(g)
起始量 n m 0 0
变化量 1.2 0.4 0.8 0.8
平衡量 1.8 0.6 0.8 0.8
达到平衡,测得A的物质的量为1.8mol,n=1.8+1.2=3;B的物质的量为0.6mol,m=0.6+0.4=1;
Ⅱ.(1) 速率之比等于化学计量数之比;
(2)A.t=0时,v(逆)=0;
B.浓度相同,不能得出正逆反应速率相等;
C.达到平衡时,压强不再变化;
D.正逆反应大小的判断;
考查化学平衡的计算,化学平衡及转化率的计算,三段式。
22.【答案】(1)2A(g)+B(g) 3D(g)+E(s)
(2)0.1
(3)加快;加快
(4)乙
【解析】【解答】(1)根据图象曲线变化可以知道A、B为反应物,C、D为生成物,A的物质的量变化为1.0mol-0.6mol=0.4mol,B的物质的量变化为1.0mol-0.8mol=0.2mol,D的物质的量变化为0.6mol,E的物质的量变化为0.2mol,根据物质的量变化与化学计量数成正比可以知道A、BD、E的计量数之比为0.4mol:0.2mol:0.6mol:0.2mol=2:1:3:1,所以该反应的化学方程式为:2A(g)+B(g) 3D(g)+E(s),因此,本题正确答案是:2A(g)+B(g) 3D(g)+E(s);(2)反应开始至3min时,D的物质的量变化为0.6mol,则用D表示的平均反应速率为v(D)= mol/(L min)=0.1 mol/(L min),故答案为:0.1;(3)若升高温度,则增加活化分子数,正逆反应速率均增大,故答案为:加快;加快;(4)甲中v(A)=0.3 mol·L-1·min-1;乙中v(B)=0.2 mol·L-1·min-1,换算成v(A)=0.4mol·L-1·min-1,则乙容器中反应更快,故答案为:乙。
【分析】(1)根据达到平衡时各物质的物质的量变化关系,得出化学方程式中各物质的计量数之比,据此写出化学方程式;
(2)利用图象得出3min时D的物质的量变化,再根据v=计算出答案;
(3)升温正逆反应速率均增大;
(4)将乙容器中的速率转化为用A来表示,从而比较两容器中的速率大小。
23.【答案】(1)放热
(2)D
(3)B
(4)液氨;脱水性、强氧化性
(5)2OH-+ClO-+SO2=+Cl-+H2O;相同条件 下SO2在水溶液中溶解性大于NO
【解析】【解答】(1)从图可知,反应物总能量高于生成物总能量,所以该反应为放热反应,故答案为:放热;
(2)A、改铁片为铁粉,增大了接触面积,反应速率增大,故A不选;
B、滴加少量溶液与Fe反应生成Cu,形成原电池,加快反应速率,故B不选;
C、升高温度,反应速率增大,故C不选;
D、反应物为铁和硫酸反应,改稀硫酸为98%的浓硫酸,发生钝化现象,不产生氢气,故D选;故答案为:D;
(3)葡萄糖为还原性糖,可与弱氧化剂发生反应,淀粉不能,用银氨溶液可以鉴别葡萄糖与淀粉,
故答案为:B;
(4)氨气极易溶于水,氨气易液化,液氨汽化需要吸收大量的热,具有制冷作用,常用作制冷剂,化学式NH3;浓硫酸具有脱水性、强氧化性,蔗糖碳化后,与浓硫酸发生氧化还原反应,故答案为:液氨;脱水性、强氧化性;
(5)碱性条件下,NaClO溶液与二氧化硫反应生成硫酸根离子和氯离子,离子方程式为2OH-+ClO-+SO2=+Cl-+H2O,实验证明相对于SO2,NO更难脱除,其原因可能是相同条件 下SO2在水溶液中溶解性大于NO,故答案为:2OH-+ClO-+SO2=+Cl-+H2O;相同条件 下SO2在水溶液中溶解性大于NO。
【分析】(1)根据放热反应中反应物具有的总能量大于生成物具有的总能量,吸热反应中反应物具有的总能量小于生成物具有的总能量;
(2)依据影响反应速率的因素分析;
(3)葡萄糖为还原性糖;
(4)依据氨气的性质判断;
(5)碱性条件下,NaClO溶液与二氧化硫反应生成硫酸根离子和氯离子;利用溶解性判断。
24.【答案】(1)b
(2)a;变小
(3)吸热;1
(4)①②③;正反应
【解析】【解答】(1)使用催化剂可以加快化学反应速率,缩短反应到达平衡的时间。
(2)恒温恒容通入He后,混合物中各组分浓度、压强均不变,平衡不发生移动,但混合气体的总质量增加,w(C)变小;恒温恒压通入He后,组分压强减小,反应速率减小,到达平衡的时间延长。
(3)丙中图像显示,恒压条件下,升高温度,w(C)增大,说明正反应为吸热反应;恒温条件下,增大压强,w(C)增大,平衡向正反应方向移动,即x<2,所以x=1。
(4)丁中升高温度,平衡向正反应方向移动,则w(C)增大,A和B的转化率提高,而体系内压强、c(A)和c(B)均减小。
【分析】根据外界条件的改变对化学反应速率和化学平衡的影响,结合图像变化进行分析即可.
25.【答案】(1)Cu+4H++2NO=Cu2++2NO2↑+2H2O
(2)A—B;该反应是放热反应,1 min后溶液温度明显升高,反应速率加快;2 min后反应物硝酸浓度的减小成为影响反应速率的主要原因,反应物浓度逐渐减小,反应速率逐渐变慢
(3)0.225
(4)大于
(5)C
【解析】【解答】(1)铜和浓硝酸反应生成硝酸铜和二氧化氮,其离子方程式为:Cu+4H++2NO=Cu2++2NO2↑+2H2O;
(2)相同时间内,A—B段产生的气体最多,故A—B段反应速率最快;反应速率还与浓度、温度有关,1 min后A—B段反应速率逐渐加快,除产物可能有催化作用外,还可能因为反应放热,体系温度升高,故其主要原因还有:该反应是放热反应,1 min后溶液温度明显升高,反应速率加快,2 min后反应物硝酸浓度的减小成为影响反应速率的主要原因,反应物浓度逐渐减小,反应速率逐渐变慢;
(3)1—3 min内生成的V(NO2)=252 mL,n(NO2)=0.01125 mol,由离子方程式可知n(H+)=2n(NO2)=0.0225 mol,v(H+)=;
(4)向反应溶液中加入固体KNO3,硝酸根离子浓度增大,反应速率加快,1 min时测得V(NO2)大于84 mL;
(5)A.使用Cu粉代替Cu块,接触面积增大,反应速率加快,A不正确;
B.使用含有石墨的粗铜代替纯铜,构成原电池,反应速率加快,B不正确;
C.使用稀硝酸代替浓硝酸,反应产生NO,不产生NO2,C正确;
D.在硝酸中加入少量浓硫酸,H+的浓度增大,反应速率加快,D不正确;
故答案为:C;
【分析】(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水;
(2)依据影响反应速率的因素分析;
(3)利用υ=Δc/Δt计算;
(4)依据影响反应速率的因素分析,利用反应的实质分析;
(5)依据反应的实质和影响反应速率的因素分析;
一、单选题
1.对某一可逆反应来说,下列有关使用催化剂和不使用催化剂的说法不正确的是( )
A.使用催化剂不能增大反应物的平衡转化率
B.使用催化剂能同等程度改变正、逆反应速率
C.不使用催化剂,反应物在相同时间段内改变的物质的量一定比使用催化剂时少
D.不使用催化剂,平衡时混合物的组成不会改变
2.某反应的反应机理、能量与反应进程的关系如下图所示,下列说法正确的是( )
A.是该反应的催化剂
B.第一反应、第二步反应,和总反应都是放热反应|
C.第一步反应决定总反应的速率
D.在第一步反应中作还原剂
3.已知:CaSO4(s) Ca2+(aq)+SO42-(aq) H<0。对含有大量CaSO4(s)的浊液改变一个条件,下列图像符合浊液中c(Ca2+)变化的是( )
A.加入少量BaCl2(s)
B.加少量蒸馏水
C.加少量硫酸
D.适当升高温度
4.在催化剂a和催化剂b的作用下,氮气分子参与反应的有关反应历程如图所示:
下列说法错误的是( )
A.过程①为工业合成氨气
B.过程②中参加反应的分子,化学键未完全断裂
C.温度不变,缩小体积,过程①②的反应速率均增大
D.上述反应包括在催化剂表面发生的反应物吸附及产物脱附等过程
5.下列关于化学反应速率与限度的说法中,错误的是( )
A.化学反应限度可以通过改变条件而改变
B.决定化学反应速率的主要因素是反应物本身的性质
C.可逆反应达到化学平衡状态时,正、逆反应的化学反应速率都为零
D.化学反应限度决定了反应物在该条件下的最大转化率
6.溶液中存在平衡:.现在用溶液进行下列实验:
结合实验下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中被还原
C.对比②和④可知酸性溶液氧化性弱
D.若向④中加入溶液至过量,溶液变为绿色
7.在5 L的恒容密闭容器中进行反应4NH3(g)+6NO(g)=5N2(g)+6H2O(g),2 min后,NH3减少了0.4 mol,则该反应的化学反应速率表示正确的是( )
A.v(NH3)=0.004 mol·L-1·min-1 B.v(H2O)=0.001 mol·L-1·s-1
C.v(NO)=0.006 mol·L-1·s-1 D.v(N2)=0.005 mol·L-1·min-1
8.下列分析错误的是( )
A.“木与木相摩则然(燃)”的“然”是热能转变为化学能
B.“司烜氏,掌以夫遂(青铜凹镜)取明火于日”的“夫遂”是合金
C.“著作酒醴(甜酒),尔惟曲蘖(酒曲)”的“曲蘖”是催化剂
D.“浮梁巧烧瓷,颜色比琼玖”的“瓷”是硅酸盐产品
9.可逆反应mA(s)+nB(g) eC(g)+fD(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.达到平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中,化学计量数的关系为n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
10.对已达到化学平衡的反应2X(g)+Y(g) 2Z(g),减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
11.在1L的密闭容器中进行反应A (g) + 3B (g) 2C (g),0~2 min内A的物质的量由2 mol减小到0.8 mol,则用A的浓度变化表示的反应速率为
A.1.2 mol / ( L·min ) B.1 mol / ( L·min )
C.0.6 mol / ( L·min ) D.0.4 mol / ( L·min )
12.一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)H2(g)+I2(g)。HI起始浓度为0.20mol/L,若c(HI)由0.18mol/L降到0.14mol/L时,需要20s,那么c(HI)由0.20mol/L降到0.18mol/L时,所需反应的时间为( )
A.等于10s B.小于10s
C.大于10s D.以上答案都错误
13.反应2A(g) 2Y(g) + E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压 B.减压 C.减小E的浓度 D.降温
14.不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是( )
A.一定时间内,Fe2+的氧化率随时间延长而逐渐增大
B.由①和②可知,pH越大,Fe2+氧化速率越快
C.由①和③可知,温度越高,Fe2+氧化速率越快
D.氧化过程的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
15.甲、乙两容器均进行同一反应:A 2B。甲容器内每分钟减少4molA,乙容器内每分钟减少2molA,则两者的化学反应速率相比( )
A.甲快 B.乙快
C.一样快 D.无法比较
16.下列事实不能用勒夏特列原理解释的是( )
A.由NO2和N2O4组成的平衡体系加压后,颜色先变深后变浅
B.500℃有利于提高工业合成氨的产率
C.黄绿色的氯水光照后颜色变浅
D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
17.下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是( )
编号 金属(粉末状) 酸的浓度 酸的体积 反应温度
A 0.1molMg 6mol/L硝酸 10mL 60℃
B 0.1molMg 3mol/L盐酸 10mL 60℃
C 0.1molFe 3mol/L盐酸 10mL 60℃
D 0.1molMg 3mol/L盐酸 10mL 30℃
A.A B.B C.C D.D
18.用100mL1mol·L-1盐酸与锌粉反应制备氢气,下列措施能加快反应速率的是
A.降低温度 B.改用200mL1mol·L-1盐酸
C.用锌块代替锌粉 D.滴加少量CuCl2溶液
19.1,3-丁二烯和Br2以物质的量之比为1:1发生加成反应分两步:第一步Br+进攻1,3-丁二烯生成中间体C(溴正离子);第二步Br-进攻中间体C完成1,2-加成或1,4-加成。反应过程中的能量变化如下图所示,下列说法正确的是( )
A.其它条件相同时,生成产物B的速率快于产物A的速率
B.升高温度,1,3-丁二烯的平衡转化率增大
C.该加成反应的反应热为Eb-Ea
D.该反应的速率主要取决于第一步反应的快慢
20.一定条件下,向密闭容器中通入一定量的CO和制备甲醇,反应为,测得容器内的分压与反应时间的关系如图所示。反应到图中X点时,用分压表示的平均变化率为( )
A. B.
C. D.
二、综合题
21.Ⅰ.将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内正反应的平均反应速率为: ;
(2)反应前A的物质的量浓度是: ;
(3)10s末,生成物D的浓度为 ;
(4)Ⅱ.在体积为2 L的密闭容器中(体积不变),充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的物质的量随时间变化如图所示:
从反应开始到10 min,氢气的平均反应速率v(H2)= 。
(5)下列说法正确的是____。
A.当t=0时,v(逆)=0
B.进行到3 min时,正反应速率和逆反应速率相等
C.10 min后容器中压强不再改变
D.3 min前v(正)>v(逆),3 min后v(正)
(1)写出该反应的化学方程式 .
(2)反应开始至3min时,用D表示的平均反应速率为 mol/(L min).
(3)若升高温度,则v(正) ,v(逆) (填“加快”或“减慢”)。
(4)若反应在甲、乙两个相同容器内同时进行,分别测得甲中v(A)=0.3 mol·L-1·min-1,乙中v(B)=0.2 mol·L-1·min-1,则 容器中反应更快。
23.根据要求回答下列问题:
反应的能量变化趋势如图所示。
(1)该反应为 (填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率加快,下列措施不可行的是____(填字母)。
A.将铁片改为铁粉 B.滴加少量溶液
C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)欲区分葡萄糖和淀粉,可选用____(填字母,下同)。
A.碘水 B.银氨溶液 C.盐酸 D.溶液
(4)氮的化合物常用作制冷剂的是 (填名称),向蔗糖中滴加少量浓硫酸并搅拌,出现“黑色面包”,并产生刺激性无色气体,这一现象显示浓硫酸的 (填性质)。
(5)燃煤排放的尾气中含有二氧化硫、氮的氧化物(主要为)等污染物,工业上采用碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。脱硫的离子方程式为 ,实验证明相对于,更难脱除,其原因可能是 。
24.如图所示,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g) xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
(1)若甲中两条曲线分别代表有催化剂和无催化剂的情况,则 曲线代表无催化剂时的情况。
(2)若乙表示反应达到平衡状态后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He后的情况,则 曲线表示恒温恒容的情况,且此时混合气体中w(C) (填“变大”“变小”或“不变”)。
(3)根据丙可以判断该可逆反应的正反应是 (填“放热”或“吸热”)反应,x的值为 。
(4)丁表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随温度(T)的变化情况,根据你的理解,丁的纵坐标可以是 (填序号)。
①w(C) ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)
升高温度,平衡向 (填“正反应”或“逆反应”)方向移动。
25.某学生用纯净的Cu与50mL过量浓HNO3反应制取NO2 (不考虑NO气体的影响),实验结果如图所示(气体体积均为标准状况下测定,且忽略溶液体积变化)。
回答下面问题:
(1)该反应是一个放热明显的化学反应,写出反应的离子方程式 。
(2)由图象可知O-A、A-B、B-C段的反应速率最大的是 (填“O-A”“A-B”或“B-C”)。1min后A-B段反应速率逐渐加快,除产物可能有催化作用外,其主要原因还有: 。2min后B-C段反应速率又逐渐变慢的原因是 。
(3)计算在1~3 min内的反应速率: v(H+ )= mol·L-1·min-1。
(4)若开始向反应溶液中加入固体KNO3,则1min时测得V(NO2) 84 mL (填“大于”“小于”“等于”或“不确定”)。
(5)下列措施不能加快v(NO2)的是____。
A.使用Cu粉代替Cu块 B.使用含有石墨的粗铜代替纯铜
C.使用稀硝酸代替浓硝酸 D.在硝酸中加入少量浓硫酸
答案解析部分
1.【答案】C
【解析】【解答】A.使用催化剂不影响平衡,不能改变转化率,A不符合题意;
B.使用催化剂能同等程度的改变反应速率,B不符合题意;
C.反应达到平衡后,相同时间段内物质的改变量均为零,C符合题意;
D.平衡时混合物的组成不会改变,催化剂对平衡不影响,D不符合题意;
故答案为:C。
【分析】催化剂能加快化学反应速率但是不能影响化学平衡。
2.【答案】C
【解析】【解答】A.Fe2+在第一步反应中消耗,在第二步反应中生成,则Fe2+是该反应的催化剂,碘离子是反应物,故A不符合题意;
B.由图可知,第一步反应为吸热反应,第二步反应和总反应都是放热反应,故B不符合题意;
C.由图可知,第一步反应的活化能比第二步反应的大,第一步反应决定总反应的速率,故C符合题意;
D.第一步反应中中硫元素化合价下降,则在第一步反应中作氧化剂,故D不符合题意;
故答案为:C。
【分析】A、注意催化剂指的是第一反应的反应物,第二反应的生成物,中间产物指的是第一反应的生成物,第二反应的反应物;
B、反应物的总能量大于生成物的总能量,反应放热,反之反应吸热;
C、活化能大为决速步骤;
D、硫元素化合价降低,作为氧化剂。
3.【答案】C
【解析】【解答】A. 加少量BaCl2生成BaSO4沉淀,c(SO42-)减小,使CaSO4溶解平衡向溶解方向移动,c(Ca2+)增大,故A不符合题意;
B. 加少量蒸馏水,CaSO4(s)继续溶解至饱和,c(Ca2+)不变,故B不符合题意;
C. 加少量硫酸c(SO42-)增大,使CaSO4溶解平衡向沉淀方向移动,c(Ca2+)减小,故C符合题意;
D. 适当升高温度,使CaSO4溶解平衡向沉淀方向移动,c(Ca2+)减小,故D不符合题意;
故答案为C。
【分析】根据勒夏特列原理:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
4.【答案】B
【解析】【解答】A.由图①反应历程可知在催化剂a表面氮气和氢气反应生成氨气,故A不符合题意;
B.由过程②反应历程可知氨气和氧气在催化剂b表面发生反应,氧气完全断裂成氧原子,氨分子中的N-H键完全断裂,然后H原子与O原子结合成水分子,N与O结合成NO,反应物中所有化学键均断裂,故B符合题意;
C. 温度不变,缩小体积,增大了体系内的压强,对有气体参加的反应能提高化学反应速率,故C不符合题意;
D.上述过程中反应物分子被催化剂吸附,在催化剂表面断裂成原子,原子再重新结合成新的分子脱离催化剂,故D不符合题意;
故答案为:B。
【分析】A、根据图象可以知道过程 ① 中的分子有H2、N2和NH3;
B、结合图象可以发现所有化学键都断裂;
C、压缩体积,浓度增大,速率增大;
D、根据图象可以知道过程 ① 有反应物吸附,过程 ② 有生成物脱附。
5.【答案】C
【解析】【解答】A.改变温度、压强、浓度,可以使化学反应限度发生变化,故A不符合题意;
B.反应物本身的性质决定化学反应的快慢,故B不符合题意;
C.可逆反应达到化学平衡状态时,正、逆反应的化学反应速率相等,但不为零,故C符合题意;
D.化学反应达到平衡时,反应物浓度不再改变,在该条件下反应物的转化率达到最大值,故D不符合题意;
故答案为:C。
【分析】达到平衡时,各物质浓度保持不变,消耗速率和生成速率相等,达到动态平衡;达到最大限度,当外界条件发生改变,平衡也会发生改变。
6.【答案】C
【解析】【解答】A、滴加稀硫酸,氢离子浓度增大, 的平衡逆向移动,①中溶液橙色加深,滴加NaOH溶液,的平衡正向移动,③中溶液变黄,故A正确;
B、 ②中溶液变为绿色,说明被乙醇还原为,故B正确;
C、对比②和④可知,酸性条件下,能将乙醇氧化,而碱性条件下不能氧化,说明酸性溶液氧化性强,故C错误;
D、 若向④中加入溶液至过量,的平衡逆向移动,溶液变为绿色,故D正确;
故答案为:C。
【分析】A、滴加稀硫酸,该反应的平衡逆向移动,滴加NaOH溶液,该反应的平衡正向移动;
B、乙醇具有还原性;
C、 溶液在酸性条件下的氧化性强于碱性条件;
D、 向④中加入溶液至过量,的平衡逆向移动。
7.【答案】B
【解析】【解答】A.反应在5 L容器中进行,2 min后,NH3减少了0.4 mol,则v(NH3)= ,A不符合题意;
B.根据选项A分析可知v(NH3)=0.04 mol/(L·min),由于v(H2O):v(NH3)=6:4,所以v(H2O)= v(NH3)= ×0.04 mol/(L·min)=0.06 mol/(L·min)=0.001 mol·L-1·s-1,B符合题意;
C.根据选项A分析可知v(NH3)=0.04 mol/(L·min),由于v(NO):v(NH3)=6:4,所以v(NO)= v(NH3)= ×0.04 mol/(L·min)=0.06 mol/(L·min)=0.001 mol·L-1·s-1,C不符合题意;
D.根据选项A分析可知v(NH3)=0.04 mol/(L·min),由于v(N2):v(NH3)=5:4,所以v(N2)= v(NH3)= ×0.04 mol/(L·min)=0.05mol/(L·min),D不符合题意;
故答案为:B。
【分析】先根据NH3的物质的量变化计算反应速率,然后根据用不同物质表示反应速率时,速率比等于化学方程式中相应物质的化学计量数的比进行计算判断。
8.【答案】A
【解析】【解答】A.“木与木相摩则然(燃)”为燃烧过程,燃烧是化学能转变为热能,A符合题意;
B.“夫遂”是古人用于日下取火的青铜凹镜,青铜是铜加入锡或铅的合金,B不符合题意;
C.“曲蘖(酒曲)”是催化葡萄糖分解生成酒精的酶,为催化剂,C不符合题意;
D.“瓷”即陶瓷,由黏土(主要成分为硅酸盐)烧制而成,为硅酸盐产品,D不符合题意。
故答案为:A。
【分析】燃烧是将化学能转化为热能,摩擦的过程主要是达到可燃物的着火点,其他选项均正确
9.【答案】B
【解析】【解答】根据图像①可知,T2温度是首先平衡,故T2>T1,根据①中C的体积分数可知,该反应为放热反应。根据图像②可知,P2压强下首先平衡,故P2>P1,又由于C的体积分数可知,P2条件下平衡向逆反应方向移动,故n<e+f 。A选项,加入催化剂不改变平衡,不符合题意。B选项符合题意。C选项,化学方程式中n<e+f。D选项,达到平衡后加入A,但A为固体,对化学平衡无影响。故不符合题意。
【分析】A.催化剂不能使平衡发生移动,C的体积分数不变;
B.由温度与C的体积分数的关系图可知,温度T2>T1,升高温度产物C的体积分数降低,平衡向逆反应方向移动;
C.由压强与C的体积分图像可知,压强p2>P1,增大压强C的体积分数降低,平衡向逆反应方向移动,所以反应前的气体系数和小雨反应后气体系数和;
D.A为固体,改变用量不影响平衡移动。
10.【答案】C
【解析】【解答】该反应的反应物和生成物均为气体,减小压强,正、逆反应速率都将减小,这一点只有C项符合;该反应是一个正向气体分子总数减小的反应,减小压强,平衡向逆反应方向移动。
故答案为:C
【分析】对于反应 2X(g)+Y(g) 2Z(g) ,压强减小,正、逆反应速率都将减小,正反应是物质的量减小的反应,减小压强,反应逆向进行。
11.【答案】C
【解析】【解答】在1L的密闭容器中进行反应A(g)+3B(g) 2C(g),0~2min内A的物质的量由2mol减小到0.8mol,则用A的浓度变化表示的反应速率v(A)= =0.6mol·L-1 mol-1;
故答案为:C。
【分析】利用υ=Δc/Δt计算。
12.【答案】B
【解析】【解答】c(HI)由0.18mol/L降到0.14mol/L时,需要20s,即平均速率为 ;则c(HI)由0.20mol/L降到0.18mol/L,假设速率不变,则需要,但浓度越大,化学反应速率越大,需要的时间就短,所以需要时间小于10s;
故答案为:B。
【分析】利用υ=Δc/Δt计算,依据影响反应速率的因素分析。
13.【答案】D
【解析】【解答】A、增大压强,平衡向逆反应方向移动,A的浓度增大,但正、逆反应速率都增大,故A不符合题意;
B、降低压强,正、逆速率都减小,平衡向正反应方向移动,A的浓度降低,故B不符合题意;
C、减小E的浓度,平衡向正向反应方向移动,A的浓度减小,正逆反应速率减小,故C不符合题意;
D、正反应为吸热反应,降低温度,平衡逆反应方向移动,正、逆反应速率都减小,A的浓度增大,故D符合题意。
故答案为:D。
【分析】达平衡时,要使v正降低,可采取降低温度、减小压强或减小浓度的措施,使c(A)增大,应使平衡向逆反应方向移动,据此结合选项分析解答。
14.【答案】B
【解析】【解答】A.由图像可知,Fe2+的氧化率随时间延长而逐渐增大,故A不符合题意;
B.由图像可知,①和②的反应温度和溶液的pH均不相同,无法判断溶液的pH和Fe2+氧化速率的关系,故B符合题意;
C.由图像可知,①和③的溶液的pH相同,温度越高,Fe2+氧化速率越快,故C不符合题意;
D.氧化过程发生的反应为酸性条件下,亚铁离子与氧气反应生成铁离子和水,反应的离子方程式为为4Fe2++O2+4H+=4Fe3++2H2O,故D不符合题意;
故答案为:B。
【分析】A.Fe2+的氧化率随时间延长而逐渐增大;
C.①和③只有温度一个变量;
D.氧化过程中发生的反应为4Fe2++O2+4H+=4Fe3++2H2O。
15.【答案】D
【解析】【解答】化学反应速率的计算公式v=△n/V △t,对于甲和乙的时间△t是相等的,甲的△n为4mol,乙的△n为2mol,但甲和乙容器的体积未知,故不能比较两容器中的反应速率。
故答案为:D。
【分析】化学反应速率的计算公式,对于甲和乙的时间△t是相等的,但甲和乙容器的体积未知,故不能比较两容器中的反应速率。
16.【答案】B
【解析】【解答】A、二氧化氮气体中存在平衡2NO2 N2O4,加压后二氧化氮的浓度增大,颜色变深,平衡2NO2 N2O4向正反应移动,二氧化氮的浓度又降低,故气体颜色变浅,但仍比原来的颜色深,能用勒夏特列原理解释,故A不选;
B、合成氨反应是放热反应,为提高氨的产率,理论上应采取降低温度的措施,采用500℃主要考虑反应速率,使催化剂活性最大,与平衡无关,不能用勒夏特列原理解释,
C、对氯水中的次氯酸受光照射会分解,次氯酸浓度减小,使得化学平衡Cl2+H2O HCl+HClO向右移动,能用勒夏特列原理解释,故C不选;
D、溶液中存在平衡Fe3++SCN- Fe(SCN)2+,加铁粉,铁与Fe3+反应,Fe3+浓度降低,则平衡向左移动进行,溶液颜色变浅或褪去,能用勒夏特利原理来解释,故D不选。
故答案为:B。
【分析】 勒夏特列原理:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时注意反应必须是可逆反应,否则勒夏特列原理不适用,据此分析。
17.【答案】B
【解析】【解答】硝酸和镁反应不生成氢气,A选项排除;镁的金属性比铁的强,所以在外界条件相同的情况下,镁比铁的反应速率快,反应速率B>C,排除C选项;在相同的条件下,温度越高、化学反应速率越快,反应速率B>D,因此放出H2的速率最大的是B;
故答案为:B。
【分析】本题的易错点为A,要注意硝酸具有强氧化性,与活泼金属反应一般不放出氢气。
18.【答案】D
【解析】【解答】A.降低温度,会减慢反应速率,A不符合题意;
B.改用200mL1mol·L-1盐酸,溶液浓度不变,反应速率不受影响,B不符合题意;
C.用锌块代替锌粉,会减小反应物的接触面积,减慢反应速率,C不符合题意;
D.滴加少量CuCl2溶液,Zn和CuCl2生成Cu,形成铜锌电池回路,加快反应速率,D符合题意;
故答案为:D。
【分析】依据影响反应速率的因素分析。
19.【答案】D
【解析】【解答】A.据图可知中间体C生成B的活化能更高,反应速率应更慢,A不符合题意;
B.据图可知生成1,3-丁二烯的反应为放热反应,升高温度平衡逆向移动,平衡转化率减小,B不符合题意;
C.Ea是第二步反应中1,2-加成反应的活化能,Eb是第二步反应中1,4-加成反应的活化能,Eb-Ea是只是两种活化能的差值,图中数据不能计算该加成反应的反应热,C不符合题意;
D.据图可知第一步反应的活化能更大,反应速率更慢,整体反应速率取决于慢反应,D符合题意;
故答案为:D。
【分析】A.根据图示活化能越高速率越慢
B.根据焓变=生成物的能量-反应物的能量,结合温度变化进行判断
C.根据图示焓变=生成物的能量-反应物的能量,未给出数据
D.活化能越高速率越慢,活化能高的决定着速率
20.【答案】B
【解析】【解答】反应至X点,氢气的变化量为1.6MPa,则用分压表示的平均变化率为,故B符合题意;
故答案为:B。
【分析】 X点时,氢气减少1.6MPa。
21.【答案】(1)0.04mol L 1 s 1
(2)1.5 mol L 1
(3)0.4 mol L 1
(4)0.1125 mol L 1 min 1
(5)A;C
【解析】【解答】Ⅰ. 反应:3A(g)+B(g) 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,列三段式进行计算;
3A(g)+B(g) 2C(g)+2D(g)
起始量 n m 0 0
变化量 1.2 0.4 0.8 0.8
平衡量 1.8 0.6 0.8 0.8
达到平衡,测得A的物质的量为1.8mol,n=1.8+1.2=3;B的物质的量为0.6mol,m=0.6+0.4=1;
V(C)=0.8mol/2L/10s=0.04 mol L 1 s 1
反应前A的物质的量浓度是C(A) =3mol/2L=1.5 mol L 1
10s末,生成物D的浓度C(D)=0.8mol/2L=0.4 mol L 1
Ⅱ.(1) 从反应开始到平衡,v(CO2)= 1-0.25mol/2L/10min=0.0375mol L-1 min-1,速率之比等于化学计量数之比,v(H2)=3×0.0375mol L-1 min-1=0.1125 mol L-1 min-1,
(2)A.t=0时,逆反应还没开始,v(逆)=0,A符合题意;
B.进行到3分钟时,CO2和CH3OH(g)的浓度相同,不能得出正逆反应速率相等,B不符合题意;
C.反应在10min时达到平衡,压强不再变化,C符合题意;
D.3min前后反应物浓度都在减小,生成物浓度都在增大,平衡前10min是v正>v逆,D不符合题意;
【分析】Ⅰ.列三段式进行计算;
3A(g)+B(g) 2C(g)+2D(g)
起始量 n m 0 0
变化量 1.2 0.4 0.8 0.8
平衡量 1.8 0.6 0.8 0.8
达到平衡,测得A的物质的量为1.8mol,n=1.8+1.2=3;B的物质的量为0.6mol,m=0.6+0.4=1;
Ⅱ.(1) 速率之比等于化学计量数之比;
(2)A.t=0时,v(逆)=0;
B.浓度相同,不能得出正逆反应速率相等;
C.达到平衡时,压强不再变化;
D.正逆反应大小的判断;
考查化学平衡的计算,化学平衡及转化率的计算,三段式。
22.【答案】(1)2A(g)+B(g) 3D(g)+E(s)
(2)0.1
(3)加快;加快
(4)乙
【解析】【解答】(1)根据图象曲线变化可以知道A、B为反应物,C、D为生成物,A的物质的量变化为1.0mol-0.6mol=0.4mol,B的物质的量变化为1.0mol-0.8mol=0.2mol,D的物质的量变化为0.6mol,E的物质的量变化为0.2mol,根据物质的量变化与化学计量数成正比可以知道A、BD、E的计量数之比为0.4mol:0.2mol:0.6mol:0.2mol=2:1:3:1,所以该反应的化学方程式为:2A(g)+B(g) 3D(g)+E(s),因此,本题正确答案是:2A(g)+B(g) 3D(g)+E(s);(2)反应开始至3min时,D的物质的量变化为0.6mol,则用D表示的平均反应速率为v(D)= mol/(L min)=0.1 mol/(L min),故答案为:0.1;(3)若升高温度,则增加活化分子数,正逆反应速率均增大,故答案为:加快;加快;(4)甲中v(A)=0.3 mol·L-1·min-1;乙中v(B)=0.2 mol·L-1·min-1,换算成v(A)=0.4mol·L-1·min-1,则乙容器中反应更快,故答案为:乙。
【分析】(1)根据达到平衡时各物质的物质的量变化关系,得出化学方程式中各物质的计量数之比,据此写出化学方程式;
(2)利用图象得出3min时D的物质的量变化,再根据v=计算出答案;
(3)升温正逆反应速率均增大;
(4)将乙容器中的速率转化为用A来表示,从而比较两容器中的速率大小。
23.【答案】(1)放热
(2)D
(3)B
(4)液氨;脱水性、强氧化性
(5)2OH-+ClO-+SO2=+Cl-+H2O;相同条件 下SO2在水溶液中溶解性大于NO
【解析】【解答】(1)从图可知,反应物总能量高于生成物总能量,所以该反应为放热反应,故答案为:放热;
(2)A、改铁片为铁粉,增大了接触面积,反应速率增大,故A不选;
B、滴加少量溶液与Fe反应生成Cu,形成原电池,加快反应速率,故B不选;
C、升高温度,反应速率增大,故C不选;
D、反应物为铁和硫酸反应,改稀硫酸为98%的浓硫酸,发生钝化现象,不产生氢气,故D选;故答案为:D;
(3)葡萄糖为还原性糖,可与弱氧化剂发生反应,淀粉不能,用银氨溶液可以鉴别葡萄糖与淀粉,
故答案为:B;
(4)氨气极易溶于水,氨气易液化,液氨汽化需要吸收大量的热,具有制冷作用,常用作制冷剂,化学式NH3;浓硫酸具有脱水性、强氧化性,蔗糖碳化后,与浓硫酸发生氧化还原反应,故答案为:液氨;脱水性、强氧化性;
(5)碱性条件下,NaClO溶液与二氧化硫反应生成硫酸根离子和氯离子,离子方程式为2OH-+ClO-+SO2=+Cl-+H2O,实验证明相对于SO2,NO更难脱除,其原因可能是相同条件 下SO2在水溶液中溶解性大于NO,故答案为:2OH-+ClO-+SO2=+Cl-+H2O;相同条件 下SO2在水溶液中溶解性大于NO。
【分析】(1)根据放热反应中反应物具有的总能量大于生成物具有的总能量,吸热反应中反应物具有的总能量小于生成物具有的总能量;
(2)依据影响反应速率的因素分析;
(3)葡萄糖为还原性糖;
(4)依据氨气的性质判断;
(5)碱性条件下,NaClO溶液与二氧化硫反应生成硫酸根离子和氯离子;利用溶解性判断。
24.【答案】(1)b
(2)a;变小
(3)吸热;1
(4)①②③;正反应
【解析】【解答】(1)使用催化剂可以加快化学反应速率,缩短反应到达平衡的时间。
(2)恒温恒容通入He后,混合物中各组分浓度、压强均不变,平衡不发生移动,但混合气体的总质量增加,w(C)变小;恒温恒压通入He后,组分压强减小,反应速率减小,到达平衡的时间延长。
(3)丙中图像显示,恒压条件下,升高温度,w(C)增大,说明正反应为吸热反应;恒温条件下,增大压强,w(C)增大,平衡向正反应方向移动,即x<2,所以x=1。
(4)丁中升高温度,平衡向正反应方向移动,则w(C)增大,A和B的转化率提高,而体系内压强、c(A)和c(B)均减小。
【分析】根据外界条件的改变对化学反应速率和化学平衡的影响,结合图像变化进行分析即可.
25.【答案】(1)Cu+4H++2NO=Cu2++2NO2↑+2H2O
(2)A—B;该反应是放热反应,1 min后溶液温度明显升高,反应速率加快;2 min后反应物硝酸浓度的减小成为影响反应速率的主要原因,反应物浓度逐渐减小,反应速率逐渐变慢
(3)0.225
(4)大于
(5)C
【解析】【解答】(1)铜和浓硝酸反应生成硝酸铜和二氧化氮,其离子方程式为:Cu+4H++2NO=Cu2++2NO2↑+2H2O;
(2)相同时间内,A—B段产生的气体最多,故A—B段反应速率最快;反应速率还与浓度、温度有关,1 min后A—B段反应速率逐渐加快,除产物可能有催化作用外,还可能因为反应放热,体系温度升高,故其主要原因还有:该反应是放热反应,1 min后溶液温度明显升高,反应速率加快,2 min后反应物硝酸浓度的减小成为影响反应速率的主要原因,反应物浓度逐渐减小,反应速率逐渐变慢;
(3)1—3 min内生成的V(NO2)=252 mL,n(NO2)=0.01125 mol,由离子方程式可知n(H+)=2n(NO2)=0.0225 mol,v(H+)=;
(4)向反应溶液中加入固体KNO3,硝酸根离子浓度增大,反应速率加快,1 min时测得V(NO2)大于84 mL;
(5)A.使用Cu粉代替Cu块,接触面积增大,反应速率加快,A不正确;
B.使用含有石墨的粗铜代替纯铜,构成原电池,反应速率加快,B不正确;
C.使用稀硝酸代替浓硝酸,反应产生NO,不产生NO2,C正确;
D.在硝酸中加入少量浓硫酸,H+的浓度增大,反应速率加快,D不正确;
故答案为:C;
【分析】(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水;
(2)依据影响反应速率的因素分析;
(3)利用υ=Δc/Δt计算;
(4)依据影响反应速率的因素分析,利用反应的实质分析;
(5)依据反应的实质和影响反应速率的因素分析;
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
