化学人教版(2019)必修第一册4.2元素性质的周期性变化规律(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2元素性质的周期性变化规律(共17张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-15 11:28:31 | ||
图片预览


文档简介
(共17张PPT)
第四章 物质结构 元素周期律
第二节 元素周期律
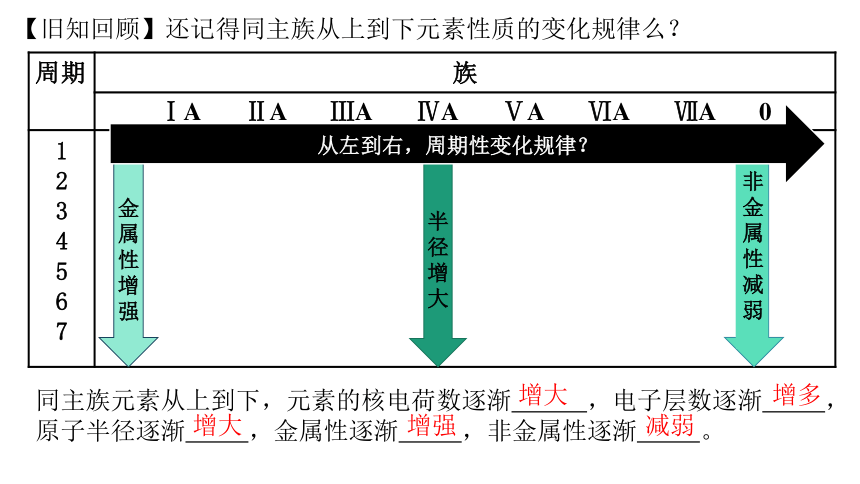
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 2 3 4 5 6 7
半径增大
金属性增强
非金属性减弱
从左到右,周期性变化规律?
【旧知回顾】还记得同主族从上到下元素性质的变化规律么?
同主族元素从上到下,元素的核电荷数逐渐 ,电子层数逐渐 ,原子半径逐渐 ,金属性逐渐 ,非金属性逐渐 。
增大
增多
增大
增强
减弱
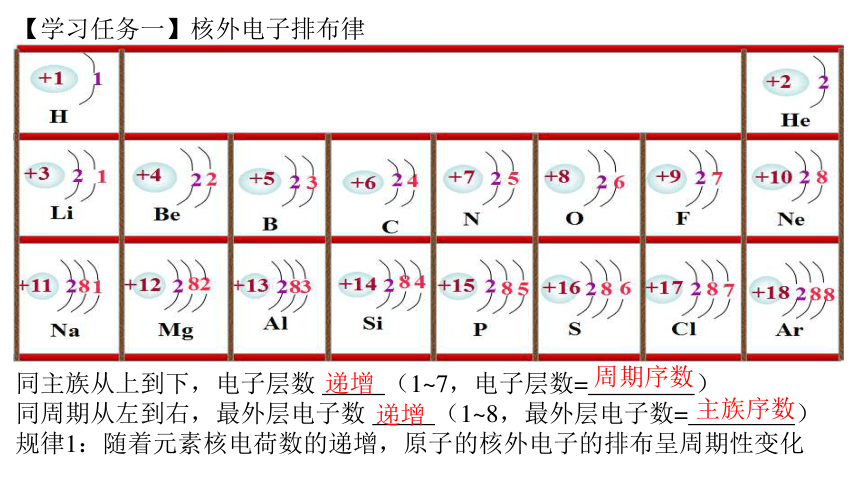
同主族从上到下,电子层数 (1~7,电子层数= )
同周期从左到右,最外层电子数 (1~8,最外层电子数= )
规律1:随着元素核电荷数的递增,原子的核外电子的排布呈周期性变化
【学习任务一】核外电子排布律
递增
递增
周期序数
主族序数
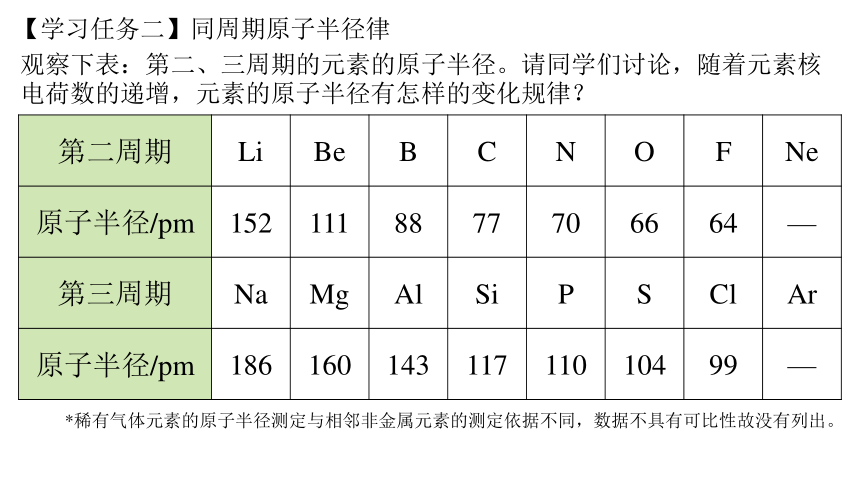
观察下表:第二、三周期的元素的原子半径。请同学们讨论,随着元素核电荷数的递增,元素的原子半径有怎样的变化规律?
第二周期 Li Be B C N O F Ne
原子半径/pm 152 111 88 77 70 66 64 —
第三周期 Na Mg Al Si P S Cl Ar
原子半径/pm 186 160 143 117 110 104 99 —
【学习任务二】同周期原子半径律
*稀有气体元素的原子半径测定与相邻非金属元素的测定依据不同,数据不具有可比性故没有列出。
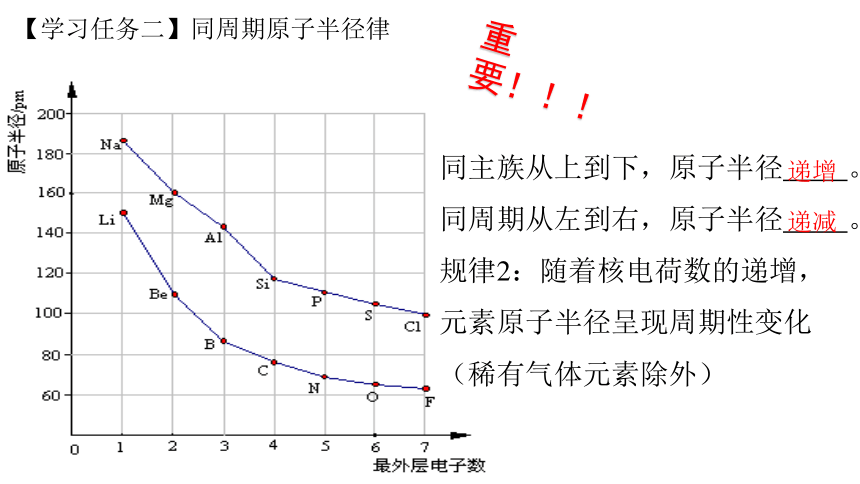
【学习任务二】同周期原子半径律
同主族从上到下,原子半径 。
同周期从左到右,原子半径 。
规律2:随着核电荷数的递增,元素原子半径呈现周期性变化(稀有气体元素除外)
递增
递减
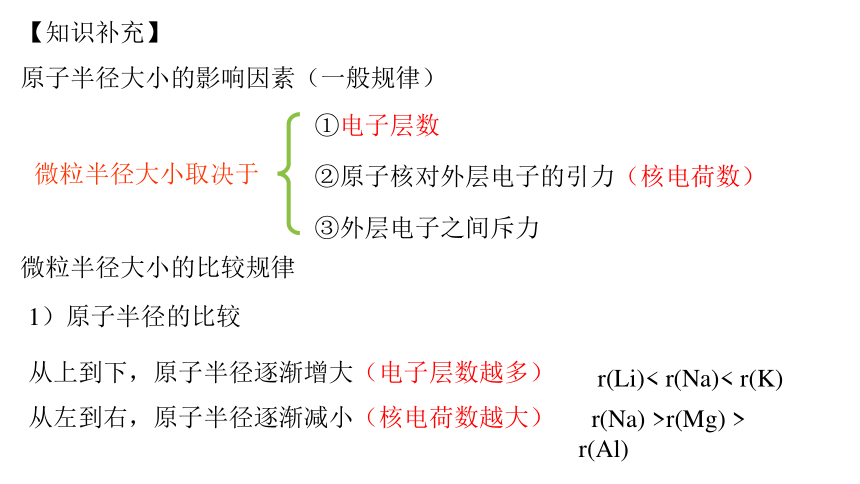
重要!!!
①电子层数
②原子核对外层电子的引力(核电荷数)
③外层电子之间斥力
微粒半径大小取决于
【知识补充】
原子半径大小的影响因素(一般规律)
微粒半径大小的比较规律
1)原子半径的比较
从上到下,原子半径逐渐增大(电子层数越多)
从左到右,原子半径逐渐减小(核电荷数越大)
r(Li)< r(Na)< r(K)
r(Na) >r(Mg) > r(Al)
例: O2- > F- > Na+ > Mg2+ > Al3+
(第二周期阴离子)
(第三周期阳离子)
(3)电子层结构相同的离子,核电荷数越大,半径 。
(2) 电子层结构不同的离子,电子层数越多,半径 。
举例: r(Li+) < r(Na+) < r(K+ )
电子层n: 1 2 3
r(F-) < r(Cl-) < r(Br-) < r( I-)
n:2 3 4 5
2)离子半径的比较
(1)同种元素的微粒: 阳离子<中性原子<阴离子
核外电子数越多,半径 。
举例: r(Cl)< r(Cl-)
r(H+)越大
越大
越小
观察第二、三周期元素的最高正化合价与最低化合价。
主族中,同周期从左往右,元素的最高正价重复出现由+1到+7递增,最低负价由-4到-1递增的变化。(O、F和稀有气体元素除外)
同主族从上到下,元素的最高正价和最低负价相同。
0
+7
+6
+5
+4
+3
—
+2
—
+1
—
最高正化合价
最低负化合价
Ar(氩)
Cl(氯)
S(硫)
P(磷)
Si(硅)
Al(铝)
Mg(镁)
Na(钠)
11~17号元素
0
—
-1
—
-2
+3
—
+2
—
+1
—
最高正化合价
最低负化合价
Ne(氖)
F(氟)
O(氧)
N(氮)
C(碳)
B(硼)
Be(铍)
Li(锂)
3~9号元素
+4
+5
规律3:随着核电荷数的递增,元素的主要化合价呈周期性变化。
-4
-3
-3
-4
-2
-1
【学习任务三】化合价变化律
总结 ①元素最高正价 == 原子最外层电子数=族序数
元素最低负价 == 原子最外层电子数—8
②金属元素无负价;O无最高正价,F无正价
最高化合价
最低化合价
+1
+2
+3
+4
-4
+5
-3
+6
-2
+7
-1
【知识补充】
元素化合价与最外层电子数的关系
【思考与讨论】随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价呈现什么规律性的变化?P108
原子序数 电子层数 最外层电子数 原子半径的变化 (不考虑稀有气体) 最高或最低化合价变化
1~2 1 1→2 —— +1 0
3~10 0.152nm→0.071nm 大→小 +1 +5
-4→-1→0
11~18
结论: 2
1→8
3
1→8
0.186nm→0.099nm
大→小
-4→-1→0
+1 +7
同周期,从左到右(随着原子序数的递增),最外层电子数:1→8 逐渐增加(第一周期除外),原子半径:大→小(稀有气体除外)
最高正价:+1→+7(O/F除外,第一周期除外)‘最低化合价:-4→-1→0 (第一周期除外)
呈周期性变化
金属性:
元素原子失电子的能力(还原能力)
非金属性:
元素原子得电子的能力(氧化能力)
判断依据是什么呢?
注意:
金属性(非金属性)的强弱只与原子失(得)电子的能力有关,与失(得)电子的多少无关。
【思考】元素的金属性、非金属性是否也呈现周期性变化?
经过前面的学习我们已经知道,同主族元素,从上到下,随着半径的增大,金属性逐渐增强,非金属性逐渐减弱,那同周期从左到右元素的金属性与非金属性是否也呈现周期性变化呢?
【学习任务四】第三周期元素性质的递变
同周期左到右:电子层数同,原子半径↘
Na Mg Al Si P S Cl Ar
【探究】第三周期元素性质的递变——P109
理论分析:根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性和非金属性变化规律么?
吸引力( )
非金属性逐渐( )
失电子能力逐渐( )
得电子能力逐渐( )
金属性逐渐( )
递增
减弱
减弱
增强
增强
原子序数 11 12 13
元素符号 Na Mg Al
与冷水反应
与热水反应 ——
与酸反应 ——
剧烈反应,溶液变红
无明显现象
较剧烈,溶液变浅红
结论:钠、镁、铝单质金属性强弱的顺序是:
钠 > 镁 > 铝
剧烈,大量气泡
较剧烈,有气泡
无明显现象
无明显现象
实验证明:
1.比较与水或酸置换出H2能力
2.Na、Mg、Al的氢氧化物碱性比较——比较与水反应后滴加酚酞时溶液颜色
单质 与水反应条件 剧烈程度 颜色 结论
Na 与冷水反应 剧烈
Mg 与热水反应 较剧烈 Al 不与水反应 剧烈 红色
红色较浅
无明显现象
钠 > 镁 > 铝
同周期,从左往右,金属性逐渐减弱
越左下角越强
氢化物化学式
元素
14Si
15P
16S
17Cl
化合条件
稳定性
SiH4
PH3
H2S
HCl
高温下少量反应
磷蒸气,困难
加热反应
光照或点燃化合
很不稳定
不稳定
较不稳定
稳定
3.非金属气态氢化物的稳定性
3.最高价氧化物对应水化物的酸性
非金属元素 Si P S Cl
最高价氧化物对应水化物的酸性 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4
强酸
结论:非金属性:Si < P < S < Cl
同一周期,从左到右,非金属性递增
越右上角越强
11Na 12Mg 13Al 14Si 15P 16S 17Cl
与水反应的剧烈程度减弱;
与酸反应的剧烈程度减弱;
NaOH Mg(OH)2 Al(OH)3
强碱 中强碱 两性
最高价氧化物水化物碱性减弱
金属性减弱
与H2反应越容易,越剧烈;
SiH4 PH3 H2S HCl
简单气态氢化物越稳定;
非金属性增强
H4SiO4 H3PO4 H2SO4 HClO4
弱酸 中强酸 强酸 最强酸
最高价氧化物水化物酸性增强。
单质还原性减弱;
单质氧化性增强;
【小结】
元素金属性、非金属性变化规律
【总结】
元素周期表和元素周期律的应用
周期 族 Ⅰ A Ⅱ A Ⅲ A Ⅳ A Ⅴ A Ⅵ A Ⅶ A 0
1
2 B
3 Al Si
4 Ge As
5 Sb Te
6 Po At
7
金属性逐渐增强
非金属性逐渐增强
非金属性逐渐增强
金属性逐渐增强
金属
非金属
Cs
F
一、金属性与非金属性的递变
二、“位-构-性”的关系
三、寻找新物质
1.半导体材料——金属与非金属分界线
2.研制农药——氟、氯、硫、磷、砷
3.催化剂和耐高温耐腐蚀的合金元素——过渡元素
第四章 物质结构 元素周期律
第二节 元素周期律
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 2 3 4 5 6 7
半径增大
金属性增强
非金属性减弱
从左到右,周期性变化规律?
【旧知回顾】还记得同主族从上到下元素性质的变化规律么?
同主族元素从上到下,元素的核电荷数逐渐 ,电子层数逐渐 ,原子半径逐渐 ,金属性逐渐 ,非金属性逐渐 。
增大
增多
增大
增强
减弱
同主族从上到下,电子层数 (1~7,电子层数= )
同周期从左到右,最外层电子数 (1~8,最外层电子数= )
规律1:随着元素核电荷数的递增,原子的核外电子的排布呈周期性变化
【学习任务一】核外电子排布律
递增
递增
周期序数
主族序数
观察下表:第二、三周期的元素的原子半径。请同学们讨论,随着元素核电荷数的递增,元素的原子半径有怎样的变化规律?
第二周期 Li Be B C N O F Ne
原子半径/pm 152 111 88 77 70 66 64 —
第三周期 Na Mg Al Si P S Cl Ar
原子半径/pm 186 160 143 117 110 104 99 —
【学习任务二】同周期原子半径律
*稀有气体元素的原子半径测定与相邻非金属元素的测定依据不同,数据不具有可比性故没有列出。
【学习任务二】同周期原子半径律
同主族从上到下,原子半径 。
同周期从左到右,原子半径 。
规律2:随着核电荷数的递增,元素原子半径呈现周期性变化(稀有气体元素除外)
递增
递减
重要!!!
①电子层数
②原子核对外层电子的引力(核电荷数)
③外层电子之间斥力
微粒半径大小取决于
【知识补充】
原子半径大小的影响因素(一般规律)
微粒半径大小的比较规律
1)原子半径的比较
从上到下,原子半径逐渐增大(电子层数越多)
从左到右,原子半径逐渐减小(核电荷数越大)
r(Li)< r(Na)< r(K)
r(Na) >r(Mg) > r(Al)
例: O2- > F- > Na+ > Mg2+ > Al3+
(第二周期阴离子)
(第三周期阳离子)
(3)电子层结构相同的离子,核电荷数越大,半径 。
(2) 电子层结构不同的离子,电子层数越多,半径 。
举例: r(Li+) < r(Na+) < r(K+ )
电子层n: 1 2 3
r(F-) < r(Cl-) < r(Br-) < r( I-)
n:2 3 4 5
2)离子半径的比较
(1)同种元素的微粒: 阳离子<中性原子<阴离子
核外电子数越多,半径 。
举例: r(Cl)< r(Cl-)
r(H+)
越大
越小
观察第二、三周期元素的最高正化合价与最低化合价。
主族中,同周期从左往右,元素的最高正价重复出现由+1到+7递增,最低负价由-4到-1递增的变化。(O、F和稀有气体元素除外)
同主族从上到下,元素的最高正价和最低负价相同。
0
+7
+6
+5
+4
+3
—
+2
—
+1
—
最高正化合价
最低负化合价
Ar(氩)
Cl(氯)
S(硫)
P(磷)
Si(硅)
Al(铝)
Mg(镁)
Na(钠)
11~17号元素
0
—
-1
—
-2
+3
—
+2
—
+1
—
最高正化合价
最低负化合价
Ne(氖)
F(氟)
O(氧)
N(氮)
C(碳)
B(硼)
Be(铍)
Li(锂)
3~9号元素
+4
+5
规律3:随着核电荷数的递增,元素的主要化合价呈周期性变化。
-4
-3
-3
-4
-2
-1
【学习任务三】化合价变化律
总结 ①元素最高正价 == 原子最外层电子数=族序数
元素最低负价 == 原子最外层电子数—8
②金属元素无负价;O无最高正价,F无正价
最高化合价
最低化合价
+1
+2
+3
+4
-4
+5
-3
+6
-2
+7
-1
【知识补充】
元素化合价与最外层电子数的关系
【思考与讨论】随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价呈现什么规律性的变化?P108
原子序数 电子层数 最外层电子数 原子半径的变化 (不考虑稀有气体) 最高或最低化合价变化
1~2 1 1→2 —— +1 0
3~10 0.152nm→0.071nm 大→小 +1 +5
-4→-1→0
11~18
结论: 2
1→8
3
1→8
0.186nm→0.099nm
大→小
-4→-1→0
+1 +7
同周期,从左到右(随着原子序数的递增),最外层电子数:1→8 逐渐增加(第一周期除外),原子半径:大→小(稀有气体除外)
最高正价:+1→+7(O/F除外,第一周期除外)‘最低化合价:-4→-1→0 (第一周期除外)
呈周期性变化
金属性:
元素原子失电子的能力(还原能力)
非金属性:
元素原子得电子的能力(氧化能力)
判断依据是什么呢?
注意:
金属性(非金属性)的强弱只与原子失(得)电子的能力有关,与失(得)电子的多少无关。
【思考】元素的金属性、非金属性是否也呈现周期性变化?
经过前面的学习我们已经知道,同主族元素,从上到下,随着半径的增大,金属性逐渐增强,非金属性逐渐减弱,那同周期从左到右元素的金属性与非金属性是否也呈现周期性变化呢?
【学习任务四】第三周期元素性质的递变
同周期左到右:电子层数同,原子半径↘
Na Mg Al Si P S Cl Ar
【探究】第三周期元素性质的递变——P109
理论分析:根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性和非金属性变化规律么?
吸引力( )
非金属性逐渐( )
失电子能力逐渐( )
得电子能力逐渐( )
金属性逐渐( )
递增
减弱
减弱
增强
增强
原子序数 11 12 13
元素符号 Na Mg Al
与冷水反应
与热水反应 ——
与酸反应 ——
剧烈反应,溶液变红
无明显现象
较剧烈,溶液变浅红
结论:钠、镁、铝单质金属性强弱的顺序是:
钠 > 镁 > 铝
剧烈,大量气泡
较剧烈,有气泡
无明显现象
无明显现象
实验证明:
1.比较与水或酸置换出H2能力
2.Na、Mg、Al的氢氧化物碱性比较——比较与水反应后滴加酚酞时溶液颜色
单质 与水反应条件 剧烈程度 颜色 结论
Na 与冷水反应 剧烈
Mg 与热水反应 较剧烈 Al 不与水反应 剧烈 红色
红色较浅
无明显现象
钠 > 镁 > 铝
同周期,从左往右,金属性逐渐减弱
越左下角越强
氢化物化学式
元素
14Si
15P
16S
17Cl
化合条件
稳定性
SiH4
PH3
H2S
HCl
高温下少量反应
磷蒸气,困难
加热反应
光照或点燃化合
很不稳定
不稳定
较不稳定
稳定
3.非金属气态氢化物的稳定性
3.最高价氧化物对应水化物的酸性
非金属元素 Si P S Cl
最高价氧化物对应水化物的酸性 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4
强酸
结论:非金属性:Si < P < S < Cl
同一周期,从左到右,非金属性递增
越右上角越强
11Na 12Mg 13Al 14Si 15P 16S 17Cl
与水反应的剧烈程度减弱;
与酸反应的剧烈程度减弱;
NaOH Mg(OH)2 Al(OH)3
强碱 中强碱 两性
最高价氧化物水化物碱性减弱
金属性减弱
与H2反应越容易,越剧烈;
SiH4 PH3 H2S HCl
简单气态氢化物越稳定;
非金属性增强
H4SiO4 H3PO4 H2SO4 HClO4
弱酸 中强酸 强酸 最强酸
最高价氧化物水化物酸性增强。
单质还原性减弱;
单质氧化性增强;
【小结】
元素金属性、非金属性变化规律
【总结】
元素周期表和元素周期律的应用
周期 族 Ⅰ A Ⅱ A Ⅲ A Ⅳ A Ⅴ A Ⅵ A Ⅶ A 0
1
2 B
3 Al Si
4 Ge As
5 Sb Te
6 Po At
7
金属性逐渐增强
非金属性逐渐增强
非金属性逐渐增强
金属性逐渐增强
金属
非金属
Cs
F
一、金属性与非金属性的递变
二、“位-构-性”的关系
三、寻找新物质
1.半导体材料——金属与非金属分界线
2.研制农药——氟、氯、硫、磷、砷
3.催化剂和耐高温耐腐蚀的合金元素——过渡元素
