化学人教版(2019)必修第一册4.1.2元素周期表、核素(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1.2元素周期表、核素(共22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-15 11:30:27 | ||
图片预览




文档简介
(共22张PPT)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第二课时 元素周期表、核素
1869年,俄国化学家门捷列夫在前人研究的基础上,将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列,制出了第一张元素周期表。
【学习任务一】元素周期表的历史
科学史话
元素周期表的发展
1789年,拉瓦锡在《化学概要》中提出第一个元素分类表,此后,人们对元素体系的研究不断深入。
1829年,德国化学家德贝赖纳提出了“三素组”的概念,对于探寻元素性质的规律具有启发性。
1867年,俄国化学家门捷列夫在研究中开始触及到元素进行分类。
1905年,瑞士化学家维尔纳制成了现代形式的元素周期表。
1913年,英国物理学家莫塞莱发现并证明了周期表元素的原子序数等于原子的核电荷数。
螺旋型周期表
元素周期表 —— 塔型
原子结构的奥秘揭开以后,元素周期表中元素的排序依据由相对原子质量大小改为原子的核电荷数,因此元素周期表中原子序数与原子结构之间存在如下关系:
原子序数 = 核电荷数 = 质子数 = 核外电子数
【学习任务二】认识元素周期表
一、原子序数与原子结构之间的联系
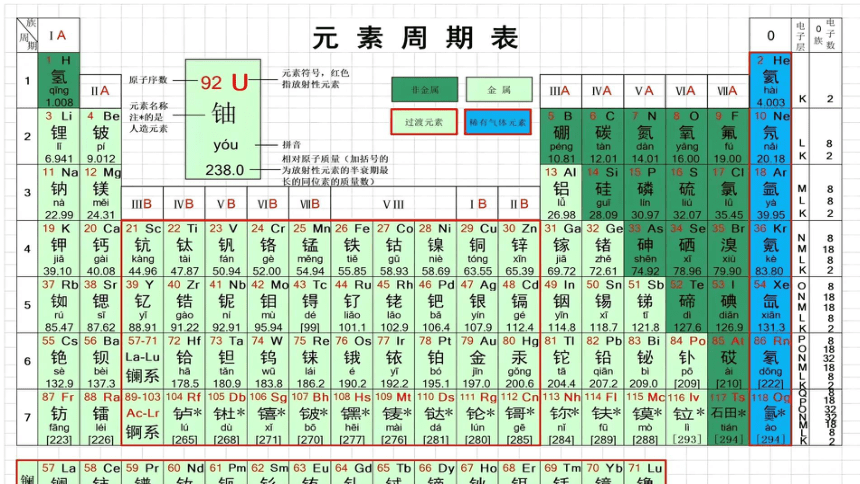
元素周期表有 个横行, 个纵列。每一个横行叫做一个 ,每一个纵列叫做一个 ( 三个纵列共同组成 )。
18
7
周期
族
8、9、10
第Ⅷ族
二、元素周期表的结构
周期序数 起止元素 包括元素种数 核外电子层数
1 H~He 2 1
2
3
4
5
6
7 Fr~Og(118号) 7
Li~Ne 8 2
Na~Ar 8 3
K~Kr 18 4
Rb~Xe 18 5
Cs~Rn 32 6
32
三、周期序数与原子核外电子层数的联系 P95 思考与讨论
周期序数 = 电子层数
第一周期 2种元素
第二周期 8种元素 第三周期 8种元素 第四周期 18种元素
第五周期 18种元素 第六周期 32种元素 第七周期 32种元素 四、周期的分类
短周期
长周期
五、族的分类
六、族序数与最外层电子数的联系
族
主族:
副族:
第VIII族:
0 族:
包括第8、9、10 纵行(不用A、B表示)
稀有气体元素
(共16个族)
罗马数字(表示族序数)+字母A(表示主族)
罗马数字(表示族序数)+字母B(表示副族)
我们昨天书写了1~20号元素的原子结构示意图,这20种元素都属于 族元素,他们的最外层电子数与族序数有何关系呢?
主
主族序数 = 最外层电子数
【总结】
周期
(7个)
族
(16个)
短周期
长周期
第 1周期
第 2周期
第 6周期
第 3周期
第 5周期
第 4周期
第 7周期
—— 2 种
—— 8 种
—— 8 种
—— 18 种
—— 18 种
—— 32 种
——32 种
主族
副族
第VIII族
0 族
包括第8、9、10 纵行
稀有气体元素
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
Ⅷ
0
主族
主族
副族
副族
过渡元素(或过渡金属)
周期序数=电子层数
主族序数=最外层电子数
【知识梳理】
横行: 相同, 递增。
纵列: 相同, 递增。
电子层数
电子层数
原子序数
最外层电子数
元素周期表的 周期最短,只有 种元素,第二、第三周期各
有 种元素,前三周期称为 ,其他周期称为 。
长周期
第一
2
8
短周期
每一周期中元素的 相同,从左到右 递增,周期序数就是该周期元素所具有的 。
族序数由罗马数字与字母A、B组成(除了第Ⅷ族和0族),主族元素的族序数后面标 ,由 和 共同构成;副族元素的族序数后面标 ,完全由 构成。
电子层数
电子层数
原子序数
A
短周期元素
B
长周期元素
长周期元素
第ⅠA族的金属元素又叫 ,第ⅦA族元素又叫 。
稀有气体元素的原子最外层电子数为 (He的最外层电子数为 ),元素化学性质比较 ,通常很难与其他物质发生化学反应,把它们的化合价定为 ,因而叫做0族。
8
2
稳定
0
碱金属元素
卤族元素
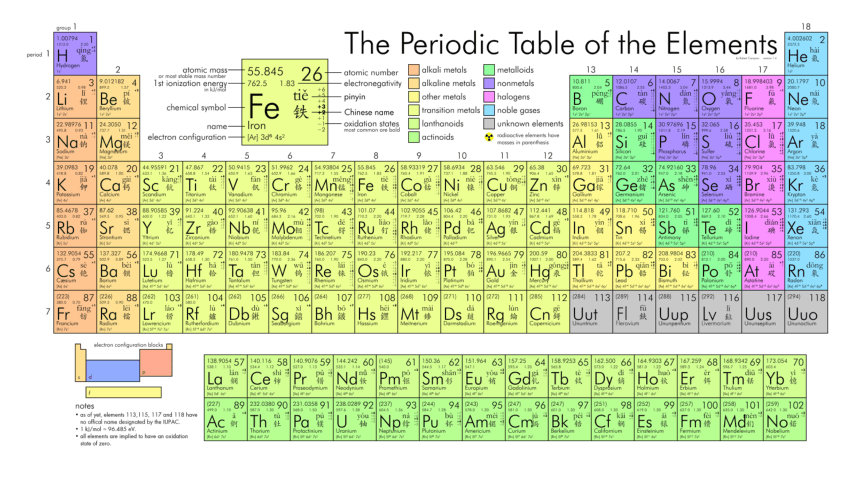
元素符号
元素名称
原子序数
相对原子质量
七、元素周期表中的方格
为什么图中 H 的质量数有3个呢?
质量数
H
1
氢
1.008
1
2
3
元素是具有相同质子数(核电荷数)的一类原子的总称。
同种元素原子的原子核中质子数是相同的。同种元素原子的原子核中,中子数不一定相同。
概念:把具有一定数目质子和一定数目中子的一种原子叫做核素。
氢元素的原子核 原子名称
质子数(Z) 中子数(N) 1 0 氕(pie)
1 1 氘(dao)
1 2 氚(chuan)
【学习任务三】核素与同位素
特征:有确定的质子数和中子数,同种元素的不同核素质子数相同,中子数不同。
一、核素
概念:质子数相同而中子数不同的同一元素的不同原子互称为同位素。(即同一种元素的不同核素互称为同位素)
二、同位素
【思考】同位素中的“同位”是什么意思?
“同位”是指核素在元素周期表中占据相同的位置,例如1H、2H、3H都是氢元素,在元素周期表中占据1号位置,因此他们质子数相同,都为1,而中子数不同,因此质量数也不同。
【核心知识讲解】
1.元素、核素、同位素、同素异形体的比较
元素 核素 同位素 同素异形体
本质
范畴
特性 只有种类,没有个数 化学反应中的最小微粒
举例
质子数(核电荷数)相同的一类原子
质子数、中子数都一定的原子
质子数相同、中子数不同的核素
同种元素组成的不同单质
同类原子
原子
原子
单质
化学性质几乎完全相同,因质量数不同,物理性质不同
组成元素相同,性质不同
H、C、O三种元素
各为一种核素
互为同位素
O2与O3互为同素异形体
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第二课时 元素周期表、核素
1869年,俄国化学家门捷列夫在前人研究的基础上,将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列,制出了第一张元素周期表。
【学习任务一】元素周期表的历史
科学史话
元素周期表的发展
1789年,拉瓦锡在《化学概要》中提出第一个元素分类表,此后,人们对元素体系的研究不断深入。
1829年,德国化学家德贝赖纳提出了“三素组”的概念,对于探寻元素性质的规律具有启发性。
1867年,俄国化学家门捷列夫在研究中开始触及到元素进行分类。
1905年,瑞士化学家维尔纳制成了现代形式的元素周期表。
1913年,英国物理学家莫塞莱发现并证明了周期表元素的原子序数等于原子的核电荷数。
螺旋型周期表
元素周期表 —— 塔型
原子结构的奥秘揭开以后,元素周期表中元素的排序依据由相对原子质量大小改为原子的核电荷数,因此元素周期表中原子序数与原子结构之间存在如下关系:
原子序数 = 核电荷数 = 质子数 = 核外电子数
【学习任务二】认识元素周期表
一、原子序数与原子结构之间的联系
元素周期表有 个横行, 个纵列。每一个横行叫做一个 ,每一个纵列叫做一个 ( 三个纵列共同组成 )。
18
7
周期
族
8、9、10
第Ⅷ族
二、元素周期表的结构
周期序数 起止元素 包括元素种数 核外电子层数
1 H~He 2 1
2
3
4
5
6
7 Fr~Og(118号) 7
Li~Ne 8 2
Na~Ar 8 3
K~Kr 18 4
Rb~Xe 18 5
Cs~Rn 32 6
32
三、周期序数与原子核外电子层数的联系 P95 思考与讨论
周期序数 = 电子层数
第一周期 2种元素
第二周期 8种元素 第三周期 8种元素 第四周期 18种元素
第五周期 18种元素 第六周期 32种元素 第七周期 32种元素 四、周期的分类
短周期
长周期
五、族的分类
六、族序数与最外层电子数的联系
族
主族:
副族:
第VIII族:
0 族:
包括第8、9、10 纵行(不用A、B表示)
稀有气体元素
(共16个族)
罗马数字(表示族序数)+字母A(表示主族)
罗马数字(表示族序数)+字母B(表示副族)
我们昨天书写了1~20号元素的原子结构示意图,这20种元素都属于 族元素,他们的最外层电子数与族序数有何关系呢?
主
主族序数 = 最外层电子数
【总结】
周期
(7个)
族
(16个)
短周期
长周期
第 1周期
第 2周期
第 6周期
第 3周期
第 5周期
第 4周期
第 7周期
—— 2 种
—— 8 种
—— 8 种
—— 18 种
—— 18 种
—— 32 种
——32 种
主族
副族
第VIII族
0 族
包括第8、9、10 纵行
稀有气体元素
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
Ⅷ
0
主族
主族
副族
副族
过渡元素(或过渡金属)
周期序数=电子层数
主族序数=最外层电子数
【知识梳理】
横行: 相同, 递增。
纵列: 相同, 递增。
电子层数
电子层数
原子序数
最外层电子数
元素周期表的 周期最短,只有 种元素,第二、第三周期各
有 种元素,前三周期称为 ,其他周期称为 。
长周期
第一
2
8
短周期
每一周期中元素的 相同,从左到右 递增,周期序数就是该周期元素所具有的 。
族序数由罗马数字与字母A、B组成(除了第Ⅷ族和0族),主族元素的族序数后面标 ,由 和 共同构成;副族元素的族序数后面标 ,完全由 构成。
电子层数
电子层数
原子序数
A
短周期元素
B
长周期元素
长周期元素
第ⅠA族的金属元素又叫 ,第ⅦA族元素又叫 。
稀有气体元素的原子最外层电子数为 (He的最外层电子数为 ),元素化学性质比较 ,通常很难与其他物质发生化学反应,把它们的化合价定为 ,因而叫做0族。
8
2
稳定
0
碱金属元素
卤族元素
元素符号
元素名称
原子序数
相对原子质量
七、元素周期表中的方格
为什么图中 H 的质量数有3个呢?
质量数
H
1
氢
1.008
1
2
3
元素是具有相同质子数(核电荷数)的一类原子的总称。
同种元素原子的原子核中质子数是相同的。同种元素原子的原子核中,中子数不一定相同。
概念:把具有一定数目质子和一定数目中子的一种原子叫做核素。
氢元素的原子核 原子名称
质子数(Z) 中子数(N) 1 0 氕(pie)
1 1 氘(dao)
1 2 氚(chuan)
【学习任务三】核素与同位素
特征:有确定的质子数和中子数,同种元素的不同核素质子数相同,中子数不同。
一、核素
概念:质子数相同而中子数不同的同一元素的不同原子互称为同位素。(即同一种元素的不同核素互称为同位素)
二、同位素
【思考】同位素中的“同位”是什么意思?
“同位”是指核素在元素周期表中占据相同的位置,例如1H、2H、3H都是氢元素,在元素周期表中占据1号位置,因此他们质子数相同,都为1,而中子数不同,因此质量数也不同。
【核心知识讲解】
1.元素、核素、同位素、同素异形体的比较
元素 核素 同位素 同素异形体
本质
范畴
特性 只有种类,没有个数 化学反应中的最小微粒
举例
质子数(核电荷数)相同的一类原子
质子数、中子数都一定的原子
质子数相同、中子数不同的核素
同种元素组成的不同单质
同类原子
原子
原子
单质
化学性质几乎完全相同,因质量数不同,物理性质不同
组成元素相同,性质不同
H、C、O三种元素
各为一种核素
互为同位素
O2与O3互为同素异形体
