9.3 溶液的浓度分层练习(含答案)---2023-2024学年九年级化学人教版下册
文档属性
| 名称 | 9.3 溶液的浓度分层练习(含答案)---2023-2024学年九年级化学人教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 373.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-15 12:01:08 | ||
图片预览


文档简介
9.3 溶液的浓度分层练习---2023-2024学年九年级化学人教版下册
一、单选题
1.下列排列顺序正确的是( )
A.硫元素的含量:
B.金属的活动性:
C.溶于水后的水温:
D.物质的溶解度:
2.如图是硝酸钾和氯化钾的溶解度曲线,下列说法正确的是( )
A.氯化钾的溶解度比硝酸钾小
B.时,硝酸钾和氯化钾溶液的溶质质量分数一定相等
C.将时硝酸钾饱和溶液降温至,溶液质量不变
D.时,硝酸钾饱和溶液中溶质与溶剂的质量比为11:10
3.20℃时,取甲、乙、丙、丁四种纯净物各40g,分别加入到四个盛有100g水的烧杯中,充分溶解,其溶解情况如下表:
物质 甲 乙 丙 丁
未溶解固体的质量/g 8.4 4 0 18.4
下列说法正确的是( )
A.所得四杯溶液一定都是饱和溶液
B.四杯溶液中溶质的质量分数大小关系为:丁>甲>乙>丙
C.升高温度,四杯溶液中溶质的质量分数一定会改变
D.四杯溶液中各加入20℃100g的水后,溶液质量相等,且均为不饱和溶液
4.地球上71%的面积覆盖着水,水是生命之源,也是重要的溶剂,下列说法正确的是( )
A.将1gNaCl投入到100g水中,溶质的质量分数为1%
B.常温下KNO3、Ca(OH)2的饱和溶液降温后仍是饱和溶液
C.将NaCl、蔗糖溶于水后,溶质均以分子形式存在
D.溶质在溶解的过程中,有的放出热量,有的吸收热量
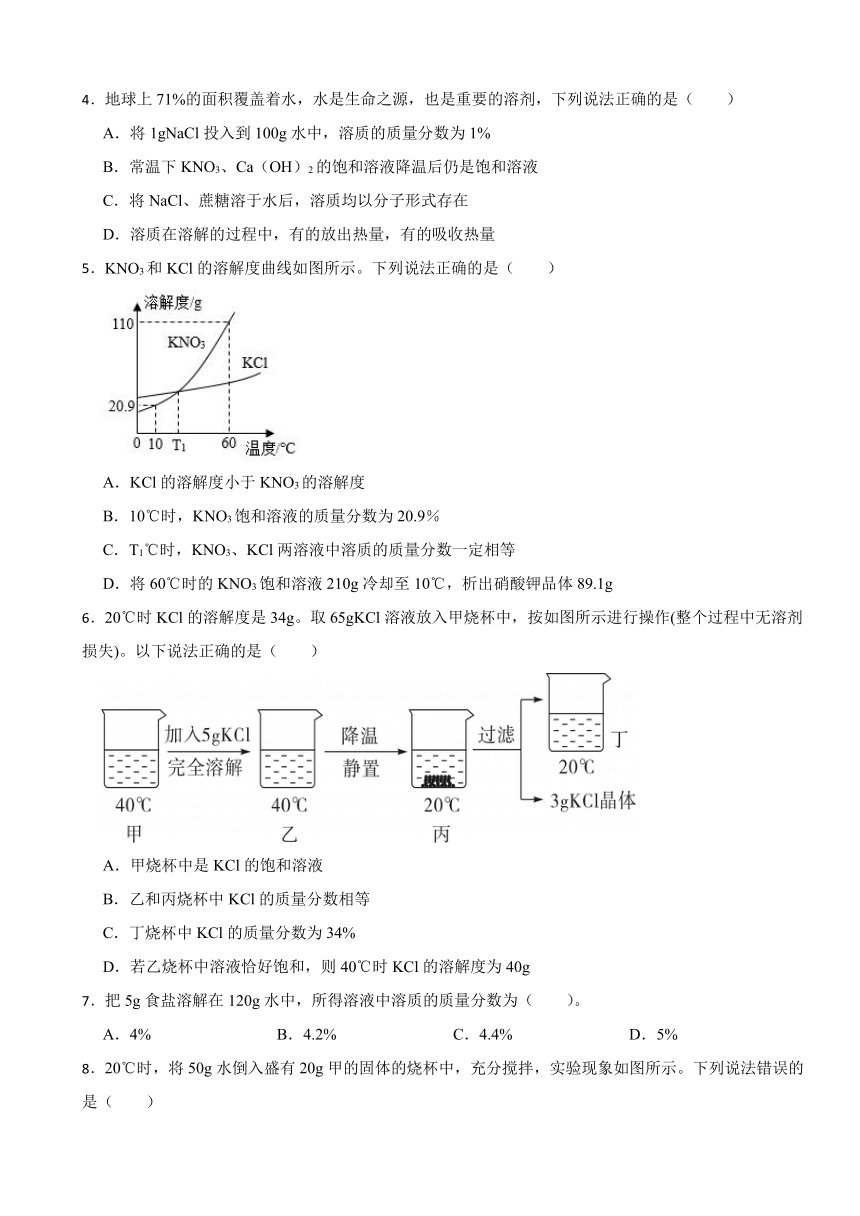
5.KNO3和KCl的溶解度曲线如图所示。下列说法正确的是( )
A.KCl的溶解度小于KNO3的溶解度
B.10℃时,KNO3饱和溶液的质量分数为20.9%
C.T1℃时,KNO3、KCl两溶液中溶质的质量分数一定相等
D.将60℃时的KNO3饱和溶液210g冷却至10℃,析出硝酸钾品体89.1g
6.20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
7.把5g食盐溶解在120g水中,所得溶液中溶质的质量分数为( )。
A.4% B.4.2% C.4.4% D.5%
8.20℃时,将50g水倒入盛有20g甲的固体的烧杯中,充分搅拌,实验现象如图所示。下列说法错误的是( )
A.①是饱和溶液
B.②和③都是不饱和溶液
C.①和②溶液的溶质质量分数不相同
D.②和③溶液的溶质质量分数相同
9.KCl的溶解度曲线如右图所示。在下表对应的温度下,向4只盛有100 g水的烧杯中,分别加入40 g KCl固体,充分溶解。
烧杯序号 ① ② ③ ④
温度(℃) 20 30 50 60
下列关于①~④所得溶液的说法不正确的是( )
A.溶质质量:①<②
B.溶液质量:②<③
C.溶质质量分数:③<④
D.④中溶质与溶剂的质量比为2: 5
10.下列说法正确的是( )
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于100g水中,所得溶液的溶质质量分数一定是5%
11.已知硫酸的浓度越大,密度就越大,现将等体积90%和10%的硫酸溶液混合,所得溶液的溶质质量分数为( )
A.>50% B.=50% C.<50% D.不能确定
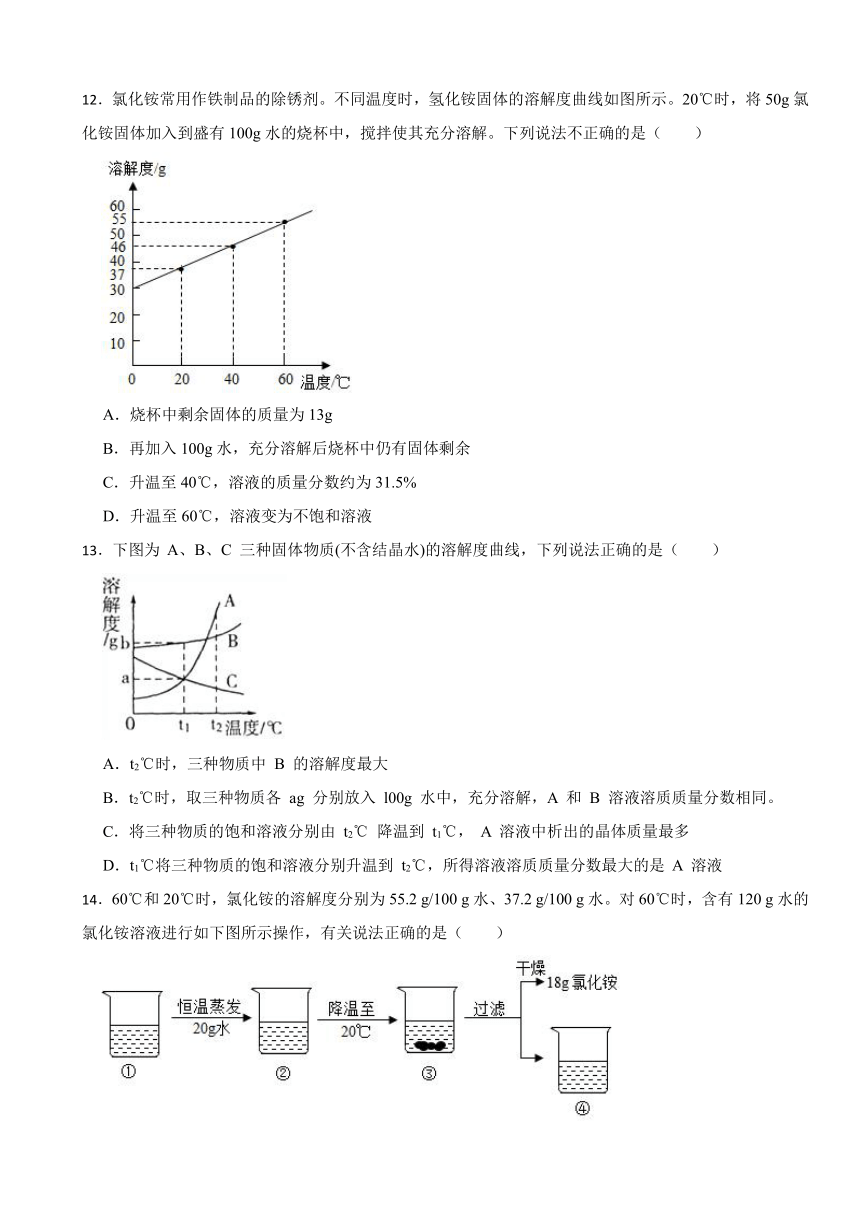
12.氯化铵常用作铁制品的除锈剂。不同温度时,氢化铵固体的溶解度曲线如图所示。20℃时,将50g氯化铵固体加入到盛有100g水的烧杯中,搅拌使其充分溶解。下列说法不正确的是( )
A.烧杯中剩余固体的质量为13g
B.再加入100g水,充分溶解后烧杯中仍有固体剩余
C.升温至40℃,溶液的质量分数约为31.5%
D.升温至60℃,溶液变为不饱和溶液
13.下图为 A、B、C 三种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )
A.t2℃时,三种物质中 B 的溶解度最大
B.t2℃时,取三种物质各 ag 分别放入 l00g 水中,充分溶解,A 和 B 溶液溶质质量分数相同。
C.将三种物质的饱和溶液分别由 t2℃ 降温到 t1℃, A 溶液中析出的晶体质量最多
D.t1℃将三种物质的饱和溶液分别升温到 t2℃,所得溶液溶质质量分数最大的是 A 溶液
14.60℃和20℃时,氯化铵的溶解度分别为55.2 g/100 g水、37.2 g/100 g水。对60℃时,含有120 g水的氯化铵溶液进行如下图所示操作,有关说法正确的是( )
A.溶液①的溶质质量分数小于溶液②
B.溶液②为60℃时,氯化铵的不饱和溶液
C.溶液④中含氯化铵19.2 g
D.若溶液①蒸发25 g水,仍无氯化铵析出
二、非选择题
15.若6.5克锌与100克稀硫酸恰好完全反应。
(1)在100克稀硫酸中,溶质的化学式是 ,其质量是 ,溶剂的化学式是 ,其质量为 。
(2)完全反应后,所得溶液的质量为 ,其中溶质的化学式为 ,其质量为 。
16.20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示。
请回答下列问题:
(1)图2中乙溶液一定是 溶液(填“饱和”或“不饱和”)。
(2)图3中表示乙的溶解度曲线的是 (填“M”或“N”):图2中乙溶液降温至30℃ 析出晶体(填“会”或“不会”)。
(3)50℃时甲的饱和溶液中溶质质量分数为 (计算结果精确到0.1%)。
17.向20g铜锌合金中不断加入一定溶质质量分数的稀盐酸,加入稀盐酸的质量与固体质量的关系如下图所示。请计算:
(1)合金中铜的质量为 。
(2)所用稀盐酸的溶质质量分数 。
18.一定浓度的次氯酸钠(NaClO)溶液能有效杀灭“新冠”病毒。利用次氯酸钠发生器,通过电解溶 质质量分数为20%食盐水能够制得次氯酸钠溶液,该反应方程式为: 。要制取7.45gNaClO,求理论上需要该NaCl溶液的质量。
19.硝酸钾、氯化钾的溶解度曲线如图1所示。
(1)P点的含义是 。
(2)当温度 时,氯化钾的溶解度大于硝酸钾的溶解度。
(3)t2℃时,分别将30g硝酸钾和氯化钾加入到50g水中,充分溶解后一定形成饱和溶液的是 ,其溶液的溶质质量分数为 (结果精确到0.1%)。
(4)图2是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为 。
(5)下列有关说法错误的是_____。
A.①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
20.下图是某盐酸试剂瓶标签上的部分文字说明。
盐酸(分析纯) 化学式HCl 质量分数36% 密度:1.18g/cm3
(1)取10mL该盐酸可配制成9%的盐酸 g。
(2)使用一段时间后,浓盐酸的溶质质量分数小于36%的原因是什么?
21.溶解是生活中常见的现象,不同物质在水中的溶解能力不同。下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)。
温度(℃) 0 20 40 60 80 100
KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
(1)上表中的两种物质在40℃时, (填化学式)的溶解度较大。
(2)请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法 。
(3)20℃时,将20gNaCl放入50g水中,所得溶液的质量是 g。
(4)从NaCl溶液中得到NaCl晶体的方法是 。
(5)请用表格中的数据计算20℃时,NaCl饱和溶液的质量分数 。
答案解析部分
1.【答案】B
2.【答案】D
3.【答案】D
4.【答案】D
5.【答案】D
6.【答案】D
7.【答案】A
8.【答案】B
9.【答案】C
10.【答案】C
11.【答案】A
12.【答案】B
13.【答案】B
14.【答案】A
15.【答案】(1)H2SO4;9.8;H2O;90.2
(2)106.3;ZnSO4;16.1
16.【答案】(1)不饱和
(2)N;不会
(3)44.4%
17.【答案】(1)13.5g
(2)12.2%
18.【答案】解:设需要氯化钠的质量为x
NaCl +H2O NaClO+H2↑
58.5 74.5
x 7.45g
x=5.85g
需要氯化钠溶液的质量为5.85g/20%=29.25g
答:理论上需要该NaCl溶液的质量为29.25g
19.【答案】(1)t1℃时,硝酸钾和氯化钾的溶解度相同
(2)小于t1℃
(3)氯化钾;28.6%
(4)降低温度
(5)C
20.【答案】(1)47.2
(2)浓盐酸具有挥发性
21.【答案】(1)KNO3
(2)增加KNO3(或降低温度或蒸发溶剂)
(3)68
(4)蒸发结晶
(5)26.5%
一、单选题
1.下列排列顺序正确的是( )
A.硫元素的含量:
B.金属的活动性:
C.溶于水后的水温:
D.物质的溶解度:
2.如图是硝酸钾和氯化钾的溶解度曲线,下列说法正确的是( )
A.氯化钾的溶解度比硝酸钾小
B.时,硝酸钾和氯化钾溶液的溶质质量分数一定相等
C.将时硝酸钾饱和溶液降温至,溶液质量不变
D.时,硝酸钾饱和溶液中溶质与溶剂的质量比为11:10
3.20℃时,取甲、乙、丙、丁四种纯净物各40g,分别加入到四个盛有100g水的烧杯中,充分溶解,其溶解情况如下表:
物质 甲 乙 丙 丁
未溶解固体的质量/g 8.4 4 0 18.4
下列说法正确的是( )
A.所得四杯溶液一定都是饱和溶液
B.四杯溶液中溶质的质量分数大小关系为:丁>甲>乙>丙
C.升高温度,四杯溶液中溶质的质量分数一定会改变
D.四杯溶液中各加入20℃100g的水后,溶液质量相等,且均为不饱和溶液
4.地球上71%的面积覆盖着水,水是生命之源,也是重要的溶剂,下列说法正确的是( )
A.将1gNaCl投入到100g水中,溶质的质量分数为1%
B.常温下KNO3、Ca(OH)2的饱和溶液降温后仍是饱和溶液
C.将NaCl、蔗糖溶于水后,溶质均以分子形式存在
D.溶质在溶解的过程中,有的放出热量,有的吸收热量
5.KNO3和KCl的溶解度曲线如图所示。下列说法正确的是( )
A.KCl的溶解度小于KNO3的溶解度
B.10℃时,KNO3饱和溶液的质量分数为20.9%
C.T1℃时,KNO3、KCl两溶液中溶质的质量分数一定相等
D.将60℃时的KNO3饱和溶液210g冷却至10℃,析出硝酸钾品体89.1g
6.20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
7.把5g食盐溶解在120g水中,所得溶液中溶质的质量分数为( )。
A.4% B.4.2% C.4.4% D.5%
8.20℃时,将50g水倒入盛有20g甲的固体的烧杯中,充分搅拌,实验现象如图所示。下列说法错误的是( )
A.①是饱和溶液
B.②和③都是不饱和溶液
C.①和②溶液的溶质质量分数不相同
D.②和③溶液的溶质质量分数相同
9.KCl的溶解度曲线如右图所示。在下表对应的温度下,向4只盛有100 g水的烧杯中,分别加入40 g KCl固体,充分溶解。
烧杯序号 ① ② ③ ④
温度(℃) 20 30 50 60
下列关于①~④所得溶液的说法不正确的是( )
A.溶质质量:①<②
B.溶液质量:②<③
C.溶质质量分数:③<④
D.④中溶质与溶剂的质量比为2: 5
10.下列说法正确的是( )
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于100g水中,所得溶液的溶质质量分数一定是5%
11.已知硫酸的浓度越大,密度就越大,现将等体积90%和10%的硫酸溶液混合,所得溶液的溶质质量分数为( )
A.>50% B.=50% C.<50% D.不能确定
12.氯化铵常用作铁制品的除锈剂。不同温度时,氢化铵固体的溶解度曲线如图所示。20℃时,将50g氯化铵固体加入到盛有100g水的烧杯中,搅拌使其充分溶解。下列说法不正确的是( )
A.烧杯中剩余固体的质量为13g
B.再加入100g水,充分溶解后烧杯中仍有固体剩余
C.升温至40℃,溶液的质量分数约为31.5%
D.升温至60℃,溶液变为不饱和溶液
13.下图为 A、B、C 三种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )
A.t2℃时,三种物质中 B 的溶解度最大
B.t2℃时,取三种物质各 ag 分别放入 l00g 水中,充分溶解,A 和 B 溶液溶质质量分数相同。
C.将三种物质的饱和溶液分别由 t2℃ 降温到 t1℃, A 溶液中析出的晶体质量最多
D.t1℃将三种物质的饱和溶液分别升温到 t2℃,所得溶液溶质质量分数最大的是 A 溶液
14.60℃和20℃时,氯化铵的溶解度分别为55.2 g/100 g水、37.2 g/100 g水。对60℃时,含有120 g水的氯化铵溶液进行如下图所示操作,有关说法正确的是( )
A.溶液①的溶质质量分数小于溶液②
B.溶液②为60℃时,氯化铵的不饱和溶液
C.溶液④中含氯化铵19.2 g
D.若溶液①蒸发25 g水,仍无氯化铵析出
二、非选择题
15.若6.5克锌与100克稀硫酸恰好完全反应。
(1)在100克稀硫酸中,溶质的化学式是 ,其质量是 ,溶剂的化学式是 ,其质量为 。
(2)完全反应后,所得溶液的质量为 ,其中溶质的化学式为 ,其质量为 。
16.20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示。
请回答下列问题:
(1)图2中乙溶液一定是 溶液(填“饱和”或“不饱和”)。
(2)图3中表示乙的溶解度曲线的是 (填“M”或“N”):图2中乙溶液降温至30℃ 析出晶体(填“会”或“不会”)。
(3)50℃时甲的饱和溶液中溶质质量分数为 (计算结果精确到0.1%)。
17.向20g铜锌合金中不断加入一定溶质质量分数的稀盐酸,加入稀盐酸的质量与固体质量的关系如下图所示。请计算:
(1)合金中铜的质量为 。
(2)所用稀盐酸的溶质质量分数 。
18.一定浓度的次氯酸钠(NaClO)溶液能有效杀灭“新冠”病毒。利用次氯酸钠发生器,通过电解溶 质质量分数为20%食盐水能够制得次氯酸钠溶液,该反应方程式为: 。要制取7.45gNaClO,求理论上需要该NaCl溶液的质量。
19.硝酸钾、氯化钾的溶解度曲线如图1所示。
(1)P点的含义是 。
(2)当温度 时,氯化钾的溶解度大于硝酸钾的溶解度。
(3)t2℃时,分别将30g硝酸钾和氯化钾加入到50g水中,充分溶解后一定形成饱和溶液的是 ,其溶液的溶质质量分数为 (结果精确到0.1%)。
(4)图2是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为 。
(5)下列有关说法错误的是_____。
A.①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
20.下图是某盐酸试剂瓶标签上的部分文字说明。
盐酸(分析纯) 化学式HCl 质量分数36% 密度:1.18g/cm3
(1)取10mL该盐酸可配制成9%的盐酸 g。
(2)使用一段时间后,浓盐酸的溶质质量分数小于36%的原因是什么?
21.溶解是生活中常见的现象,不同物质在水中的溶解能力不同。下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)。
温度(℃) 0 20 40 60 80 100
KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
(1)上表中的两种物质在40℃时, (填化学式)的溶解度较大。
(2)请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法 。
(3)20℃时,将20gNaCl放入50g水中,所得溶液的质量是 g。
(4)从NaCl溶液中得到NaCl晶体的方法是 。
(5)请用表格中的数据计算20℃时,NaCl饱和溶液的质量分数 。
答案解析部分
1.【答案】B
2.【答案】D
3.【答案】D
4.【答案】D
5.【答案】D
6.【答案】D
7.【答案】A
8.【答案】B
9.【答案】C
10.【答案】C
11.【答案】A
12.【答案】B
13.【答案】B
14.【答案】A
15.【答案】(1)H2SO4;9.8;H2O;90.2
(2)106.3;ZnSO4;16.1
16.【答案】(1)不饱和
(2)N;不会
(3)44.4%
17.【答案】(1)13.5g
(2)12.2%
18.【答案】解:设需要氯化钠的质量为x
NaCl +H2O NaClO+H2↑
58.5 74.5
x 7.45g
x=5.85g
需要氯化钠溶液的质量为5.85g/20%=29.25g
答:理论上需要该NaCl溶液的质量为29.25g
19.【答案】(1)t1℃时,硝酸钾和氯化钾的溶解度相同
(2)小于t1℃
(3)氯化钾;28.6%
(4)降低温度
(5)C
20.【答案】(1)47.2
(2)浓盐酸具有挥发性
21.【答案】(1)KNO3
(2)增加KNO3(或降低温度或蒸发溶剂)
(3)68
(4)蒸发结晶
(5)26.5%
同课章节目录
