化学人教版(2019)选择性必修2 2.1.1共价键(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.1.1共价键(共27张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-16 09:24:10 | ||
图片预览








文档简介
(共27张PPT)
第二章
第一节 共价键
0
第1课时
旧知回顾
1、什么是化学键?化学键有哪些类型?
2、什么是离子键?什么是共价键?
3、化学键类型与电负性的关系是什么?
电负性的差值
0
极性键
离子键
H和Cl的电负性的差值
0.9
非极性键
Na和Cl的电负性的差值
2.1
元素的电负性差值很大,化学反应形成的电子对不会被共用,形成离子键,而共价键是电负性差值不大的原子间形成的共价键。
1.7
元素 Na Cl H Cl
电负性 0.9 3.0 2.1 3.0
化学键:相邻原子之间强烈的相互作用
一、共价键
1.定义:原子之间通过共用电子对所形成的相互作用
2.成键微粒: 原子
3.成键性质: 共用电子对作用
4.影响共价键的因素
原子半径
共用电子对的对数
原子半径越小,共用电子对越多,共价键越强
一、共价键
5.共价键存在的范围
一般: 非金属与非金属
单质 (O2、N2等)
化合物 (H2O、CO2等)
原子团(NH4+、SO42-等)
【思考】你能用电子式表示H2、HCl、Cl2分子的形成过程吗 能不能从核外电子排布的角度解释为什么只能有H2、HCl、Cl2,不可能有H3、H2Cl和Cl3 ?
共价键的特征一:具有饱和性
H
↑
1s
Cl
3p
↑↓
↑↓
↑
↑↓
3s
H
↓
1s
H2
Cl
3p
↑↓
↑↓
↓
↑↓
3s
Cl2
——电子配对原理
现代价键理论认为,一个原子有几个未成对电子,便可和几个自旋状态相反的电子配对成键
二、共价键的性质
轨道最大重叠
共价键具有方向性
内容:两个原子轨道重叠越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定
(并不是指电子只会在两核间运动,只是在两核间运动的概率变大)
为什么两个1s轨道不完全重叠?
(s-sσ键无方向性)
(量子力学计算结果)
共价键的特征二:具有方向性
二、共价键的性质
三、共价键的类型
1、按共用电子对数目
单键:如H-H键
双键:如C=C键
三键:如N≡N键
2、按共用电子对是否偏移
非极性键:如Cl-Cl键
极性键:如H-Cl键
3、按电子云的重叠方式
σ键
π键
(1)σ键
H
H
+
H
H
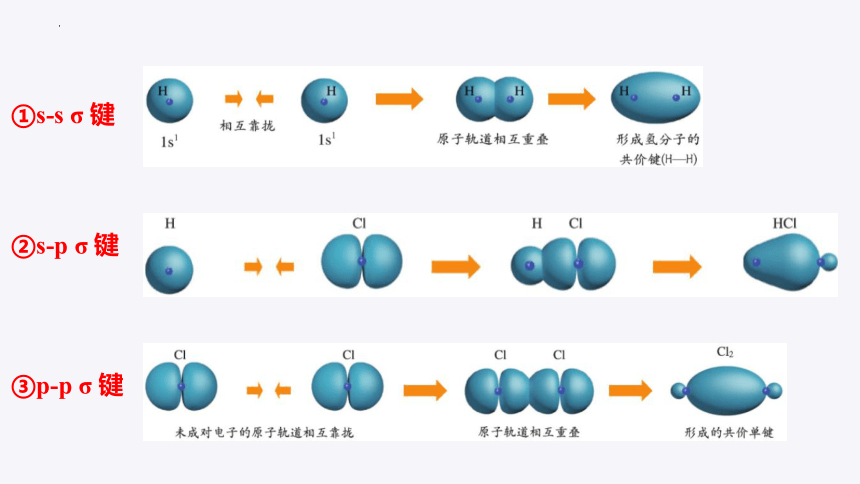
以H2形成为例:两个H原子的1s轨道上的电子是如何形成H-H共价键的呢?
相互靠拢
原子轨道相互重叠
形成氢分子的共价键(H-H)
①s-s σ 键
1s1
1s1
“头碰头”
①s-s σ 键
②s-p σ 键
③p-p σ 键
s—s
px—s
px—px
H-H:
H-Cl:
Cl-Cl:
σ键
s s σ键,如:H-H
-
s p σ键,如:H-Cl
-
p p σ键,如:Cl-Cl
-
原子轨道的重叠方式:
种类
轴对称
电子云的对称方式:
可以旋转,较稳定
以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云
的图形不变,这种特征称为轴对称。
S-S σ键
S-P σ键
P-P σ键
σ键的特征:
1.原子轨道的重叠方式:
2.轴对称,可绕键轴旋转;
3.形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性。
4.共价单键均为σ键!!!以形成σ键的两原子核的连线为轴,任何一个原子均可以旋转,旋转时并不破坏σ键的结构。
“头碰头”
(1)σ键:成键原子轨道沿键轴方向以“头碰头”的方式发生轨道的重叠,电子云的图形对称
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的π键
原子轨道的重叠方式:
成键轨道:
电子云的对称方式:
能量相对σ键较低,更易断裂,更易发生化学反应
π键不可旋转
肩并肩
p-p轨道
镜面对称
乙烯和乙烷的化学性质不同
π键
(2)π键:两个p轨道相互平行的“肩并肩”的方式发生原子轨道的重叠
O2 的形成过程
p-pσ键
p-pπ键
两对孤对
电子对电子云
↑↓ ↑ ↑
2p轨道
思考:分析N如何形成N2
p-pσ键
p-pπ键
p-pπ键
↑ ↑ ↑
2p轨道
N2(N N)形成过程
≡
N2共价三键:
1个 σ键,2个π键
(1)受能量最低原理的影响,两个原子之间形成共价键时首先会形成σ键;
(2)但受电子云形状及空间伸展方向的影响,两个原子之间只能形成1个σ键。
N
N
π键
π键
σ键
思考:如何判断共价键的类型?
σ
σ
π
σ
π
共价单键为____键;
共价双键中有一个____键、一个____键;
共价三键由一个_____键和两个______键组成。
共价键总是优先形成σ键(轨道重叠大,键稳定)
双键和三键中π键容易断裂,是化学反应的积极参与者
特例:N2中π键较σ键牢固
小结:σ键与π键的比较
键的类型 σ键 π键
原子轨道重叠方式
原子轨道重叠程度
对称类型
键的强度
旋转情况
成键情况 “头碰头”
“肩并肩”
大
小
轴对称
镜面对称
键的强度大,键牢固
键的强度小,易断裂
单键可以绕键轴任意旋转,不破坏σ键
不能旋转,否则破坏π键
单键都是σ键,双键含一个σ键和一个π键,三键含一个σ键和二个π键
1)观察乙烷、乙烯、乙炔的分子结构,它们的分子中的共价键分别由几个σ键,几个π键构成?
7个 σ键
5个 σ键,1个π键
3个 σ键,2个π键
【问题和预测】
【探究】P36
【绘制图示】模仿图2-3所示,绘制乙炔分子中π键。(提示:两个碳原子各自用2个p轨道形成π键。)
【探究】P36
钠和氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢?你能从元素的电负性差别来理解吗?讨论后请填写下表:
元素 Na Cl H Cl C O
电负性
电负性之差 (绝对值 )
结论:当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是____________键;而____________键是元素电负性相差不大的原子之间形成的化学键。 0.9 3.0
2.1 3.0
2.5 3.5
2.1
0.9
1.0
离子
共价
【问题与讨论】P36
课堂小结
共价键
本质:原子之间通过共用电子对(或原子轨道重叠)形成共价键
特征:具有方向性和饱和性
成键方式
σ键
原子轨道“头碰头”重叠,电子云呈轴对称
特征
π键
原子轨道“肩并肩”重叠,电子云呈镜面对称
特征
共价三键——1个σ键、2个π键
共价单键——1个σ键
共价双键——1个σ键、1个π键
一般规律
课后练习
1.如图表示氢原子的电子云重叠示意图。以下各种说法中错误的是( )
A.图中电子云重叠意味着电子在核间出现的机会多
B.氢原子的核外的s轨道重叠形成共价键
C.氢原子的核外电子呈云雾状,在两核间分布得密一些,将两核吸引
D.氢原子之间形成σ键,s-s σ键没有方向性
C
2.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是( )
A.CH4与NH3 B.C2H6与C2H4 C.H2与Cl2 D.Cl2与N2
A
3.下列四组物质中只含有共价键的是( )
A.H2、O3、C60、N60、
B.Cl2、S8、NaCl、Na2O2、NaHCO3
C.P4、Br2、H2O2、Xe、XeF4
D.NH4HCO3、N2H4、NH3、 、KNO3
A
课后练习
2.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是( )
A.CH4与NH3 B.C2H6与C2H4 C.H2与Cl2 D.Cl2与N2
A
3.下列四组物质中只含有共价键的是( )
A.H2、O3、C60、N60、
B.Cl2、S8、NaCl、Na2O2、NaHCO3
C.P4、Br2、H2O2、Xe、XeF4
D.NH4HCO3、N2H4、NH3、 、KNO3
A
课后练习
4.在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中两个氮原子之间的键型构成是( )
A.仅有一个σ键 B.仅有一个π键
C.一个σ键,一个π键 D.一个σ键,两个π键
C
5.分析下列化学式中画有横线的元素,选出符合要求的物质,填空。
A.NH3 B.H2O C.HCl D.CH4 E.C2H6 F.N2
(1)所有的价电子都参与形成共价键的是_______。
(2)只有一个价电子参与形成共价键的是___。
(3)最外层有未参与成键的电子对的是_____________。
(4)既有σ键又有π键的是___。
D、E
C
A、B、C、F
F
课后练习
6.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误 的是( )
A.电负性:Cl>S
B. S2Cl2为含有极性键和非极性键的分子
C.S2Br2与 S2Cl2结构相似,都含有
D. 与H2O反应的化学方程式可能为
2S2Cl2+2H2O = SO2↑+3S↓+4HCl
C
课后练习
7. 在下列分子中①HF ②Br2 ③H2O ④N2 ⑤CO2 ⑥H2 ⑦H2O2 ⑧HCN
(1)分子中只有σ 键的是:
(2)分子中含有π键的是:
(3)分子中所有原子均满足最外层8电子结构的是:
(4)分子中含有s-s σ键的是:
(5)分子中含有s-p σ键的是:
(6)分子中含有p-p σ键的是:
② ④ ⑤ ⑦ ⑧
① ② ③ ⑥ ⑦
④ ⑤ ⑧
② ④ ⑤
⑥
① ③ ⑦ ⑧
s-s σ键只有H2
s-p σ键一定有H原子
p-p σ键一定没有H原子
课后练习
第二章
第一节 共价键
0
第1课时
旧知回顾
1、什么是化学键?化学键有哪些类型?
2、什么是离子键?什么是共价键?
3、化学键类型与电负性的关系是什么?
电负性的差值
0
极性键
离子键
H和Cl的电负性的差值
0.9
非极性键
Na和Cl的电负性的差值
2.1
元素的电负性差值很大,化学反应形成的电子对不会被共用,形成离子键,而共价键是电负性差值不大的原子间形成的共价键。
1.7
元素 Na Cl H Cl
电负性 0.9 3.0 2.1 3.0
化学键:相邻原子之间强烈的相互作用
一、共价键
1.定义:原子之间通过共用电子对所形成的相互作用
2.成键微粒: 原子
3.成键性质: 共用电子对作用
4.影响共价键的因素
原子半径
共用电子对的对数
原子半径越小,共用电子对越多,共价键越强
一、共价键
5.共价键存在的范围
一般: 非金属与非金属
单质 (O2、N2等)
化合物 (H2O、CO2等)
原子团(NH4+、SO42-等)
【思考】你能用电子式表示H2、HCl、Cl2分子的形成过程吗 能不能从核外电子排布的角度解释为什么只能有H2、HCl、Cl2,不可能有H3、H2Cl和Cl3 ?
共价键的特征一:具有饱和性
H
↑
1s
Cl
3p
↑↓
↑↓
↑
↑↓
3s
H
↓
1s
H2
Cl
3p
↑↓
↑↓
↓
↑↓
3s
Cl2
——电子配对原理
现代价键理论认为,一个原子有几个未成对电子,便可和几个自旋状态相反的电子配对成键
二、共价键的性质
轨道最大重叠
共价键具有方向性
内容:两个原子轨道重叠越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定
(并不是指电子只会在两核间运动,只是在两核间运动的概率变大)
为什么两个1s轨道不完全重叠?
(s-sσ键无方向性)
(量子力学计算结果)
共价键的特征二:具有方向性
二、共价键的性质
三、共价键的类型
1、按共用电子对数目
单键:如H-H键
双键:如C=C键
三键:如N≡N键
2、按共用电子对是否偏移
非极性键:如Cl-Cl键
极性键:如H-Cl键
3、按电子云的重叠方式
σ键
π键
(1)σ键
H
H
+
H
H
以H2形成为例:两个H原子的1s轨道上的电子是如何形成H-H共价键的呢?
相互靠拢
原子轨道相互重叠
形成氢分子的共价键(H-H)
①s-s σ 键
1s1
1s1
“头碰头”
①s-s σ 键
②s-p σ 键
③p-p σ 键
s—s
px—s
px—px
H-H:
H-Cl:
Cl-Cl:
σ键
s s σ键,如:H-H
-
s p σ键,如:H-Cl
-
p p σ键,如:Cl-Cl
-
原子轨道的重叠方式:
种类
轴对称
电子云的对称方式:
可以旋转,较稳定
以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云
的图形不变,这种特征称为轴对称。
S-S σ键
S-P σ键
P-P σ键
σ键的特征:
1.原子轨道的重叠方式:
2.轴对称,可绕键轴旋转;
3.形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性。
4.共价单键均为σ键!!!以形成σ键的两原子核的连线为轴,任何一个原子均可以旋转,旋转时并不破坏σ键的结构。
“头碰头”
(1)σ键:成键原子轨道沿键轴方向以“头碰头”的方式发生轨道的重叠,电子云的图形对称
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的π键
原子轨道的重叠方式:
成键轨道:
电子云的对称方式:
能量相对σ键较低,更易断裂,更易发生化学反应
π键不可旋转
肩并肩
p-p轨道
镜面对称
乙烯和乙烷的化学性质不同
π键
(2)π键:两个p轨道相互平行的“肩并肩”的方式发生原子轨道的重叠
O2 的形成过程
p-pσ键
p-pπ键
两对孤对
电子对电子云
↑↓ ↑ ↑
2p轨道
思考:分析N如何形成N2
p-pσ键
p-pπ键
p-pπ键
↑ ↑ ↑
2p轨道
N2(N N)形成过程
≡
N2共价三键:
1个 σ键,2个π键
(1)受能量最低原理的影响,两个原子之间形成共价键时首先会形成σ键;
(2)但受电子云形状及空间伸展方向的影响,两个原子之间只能形成1个σ键。
N
N
π键
π键
σ键
思考:如何判断共价键的类型?
σ
σ
π
σ
π
共价单键为____键;
共价双键中有一个____键、一个____键;
共价三键由一个_____键和两个______键组成。
共价键总是优先形成σ键(轨道重叠大,键稳定)
双键和三键中π键容易断裂,是化学反应的积极参与者
特例:N2中π键较σ键牢固
小结:σ键与π键的比较
键的类型 σ键 π键
原子轨道重叠方式
原子轨道重叠程度
对称类型
键的强度
旋转情况
成键情况 “头碰头”
“肩并肩”
大
小
轴对称
镜面对称
键的强度大,键牢固
键的强度小,易断裂
单键可以绕键轴任意旋转,不破坏σ键
不能旋转,否则破坏π键
单键都是σ键,双键含一个σ键和一个π键,三键含一个σ键和二个π键
1)观察乙烷、乙烯、乙炔的分子结构,它们的分子中的共价键分别由几个σ键,几个π键构成?
7个 σ键
5个 σ键,1个π键
3个 σ键,2个π键
【问题和预测】
【探究】P36
【绘制图示】模仿图2-3所示,绘制乙炔分子中π键。(提示:两个碳原子各自用2个p轨道形成π键。)
【探究】P36
钠和氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢?你能从元素的电负性差别来理解吗?讨论后请填写下表:
元素 Na Cl H Cl C O
电负性
电负性之差 (绝对值 )
结论:当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是____________键;而____________键是元素电负性相差不大的原子之间形成的化学键。 0.9 3.0
2.1 3.0
2.5 3.5
2.1
0.9
1.0
离子
共价
【问题与讨论】P36
课堂小结
共价键
本质:原子之间通过共用电子对(或原子轨道重叠)形成共价键
特征:具有方向性和饱和性
成键方式
σ键
原子轨道“头碰头”重叠,电子云呈轴对称
特征
π键
原子轨道“肩并肩”重叠,电子云呈镜面对称
特征
共价三键——1个σ键、2个π键
共价单键——1个σ键
共价双键——1个σ键、1个π键
一般规律
课后练习
1.如图表示氢原子的电子云重叠示意图。以下各种说法中错误的是( )
A.图中电子云重叠意味着电子在核间出现的机会多
B.氢原子的核外的s轨道重叠形成共价键
C.氢原子的核外电子呈云雾状,在两核间分布得密一些,将两核吸引
D.氢原子之间形成σ键,s-s σ键没有方向性
C
2.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是( )
A.CH4与NH3 B.C2H6与C2H4 C.H2与Cl2 D.Cl2与N2
A
3.下列四组物质中只含有共价键的是( )
A.H2、O3、C60、N60、
B.Cl2、S8、NaCl、Na2O2、NaHCO3
C.P4、Br2、H2O2、Xe、XeF4
D.NH4HCO3、N2H4、NH3、 、KNO3
A
课后练习
2.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是( )
A.CH4与NH3 B.C2H6与C2H4 C.H2与Cl2 D.Cl2与N2
A
3.下列四组物质中只含有共价键的是( )
A.H2、O3、C60、N60、
B.Cl2、S8、NaCl、Na2O2、NaHCO3
C.P4、Br2、H2O2、Xe、XeF4
D.NH4HCO3、N2H4、NH3、 、KNO3
A
课后练习
4.在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中两个氮原子之间的键型构成是( )
A.仅有一个σ键 B.仅有一个π键
C.一个σ键,一个π键 D.一个σ键,两个π键
C
5.分析下列化学式中画有横线的元素,选出符合要求的物质,填空。
A.NH3 B.H2O C.HCl D.CH4 E.C2H6 F.N2
(1)所有的价电子都参与形成共价键的是_______。
(2)只有一个价电子参与形成共价键的是___。
(3)最外层有未参与成键的电子对的是_____________。
(4)既有σ键又有π键的是___。
D、E
C
A、B、C、F
F
课后练习
6.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法
A.电负性:Cl>S
B.
C.
D.
2S2Cl2+2H2O = SO2↑+3S↓+4HCl
C
课后练习
7. 在下列分子中①HF ②Br2 ③H2O ④N2 ⑤CO2 ⑥H2 ⑦H2O2 ⑧HCN
(1)分子中只有σ 键的是:
(2)分子中含有π键的是:
(3)分子中所有原子均满足最外层8电子结构的是:
(4)分子中含有s-s σ键的是:
(5)分子中含有s-p σ键的是:
(6)分子中含有p-p σ键的是:
② ④ ⑤ ⑦ ⑧
① ② ③ ⑥ ⑦
④ ⑤ ⑧
② ④ ⑤
⑥
① ③ ⑦ ⑧
s-s σ键只有H2
s-p σ键一定有H原子
p-p σ键一定没有H原子
课后练习
