化学人教版(2019)必修第二册7.3.1乙醇(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.1乙醇(共39张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 217.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-16 11:10:22 | ||
图片预览








文档简介
(共39张PPT)
高中化学-2019人教版《必修第二册》-教学课件
第三节 乙醇与乙酸
(第一课时 乙醇)
第七章 有机化合物
对酒当歌
我国是世界上最早掌握酿酒技术的国家之一,千年积淀,留下了灿烂的酒文化
白日放歌须纵酒,青春作伴好还乡。
明月几时有,把酒问青天。
借问酒家何处有,牧童遥指杏花村。
花间一壶酒,独斟无相亲。举杯邀明月,对影成三人。
关于“酒”的颠峰对决
飞花令
主要成分
主要成分
实验探究Ⅰ:乙醇的物理性质
1.观察颜色、状态、气味
2.溶解性实验
(1)向酒精中倒入任意体积水摇匀,观察现象
(2)荧光笔涂画在手上,用棉签蘸取乙醇反复擦拭手上的字,看是否能擦去
一、物理性质
颜色 气味 状态 挥发性 溶解性
无色
透明
特殊
香味
液 体
跟水以任意比互溶
易挥发
(沸点78℃)
能够溶解多种无机物和有机物
俗称
乙醇
酒精
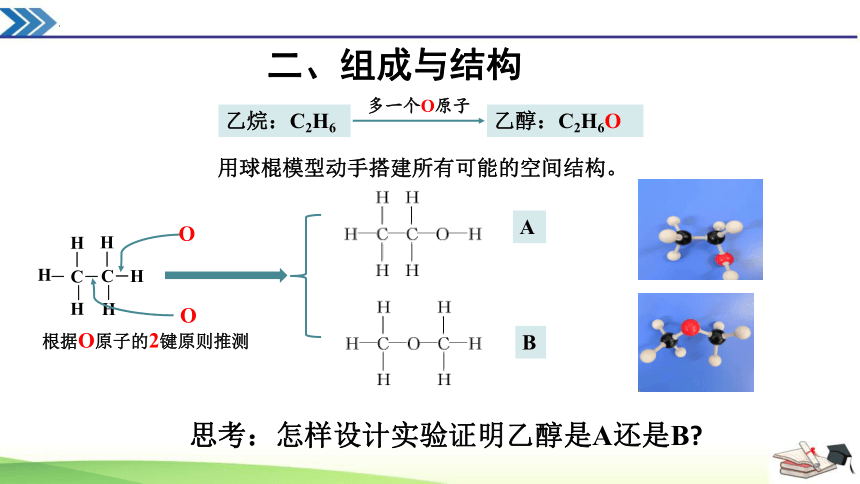
二、组成与结构
乙醇:C2H6O
乙烷:C2H6
多一个O原子
∣
∣
- C-
H
H
H
∣
∣
C-H
H
H
根据O原子的2键原则推测
O
O
A
B
思考:怎样设计实验证明乙醇是A还是B
用球棍模型动手搭建所有可能的空间结构。
1、水的结构式 乙烷的结构式
2、金属钠保存在煤油中,煤油的主要成分是烃类。
3、钠能与水反应产生氢气。
资料卡片
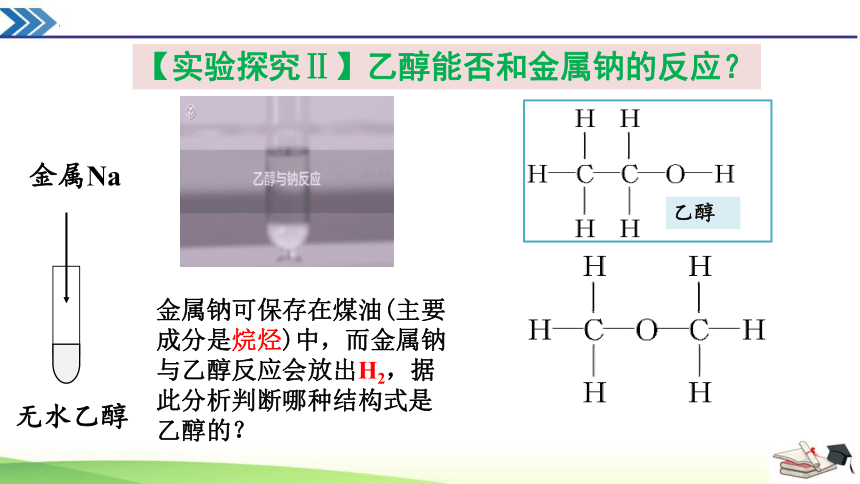
金属Na
无水乙醇
金属钠可保存在煤油(主要成分是烷烃)中,而金属钠与乙醇反应会放出H2,据此分析判断哪种结构式是乙醇的?
乙醇
【实验探究Ⅱ】乙醇能否和金属钠的反应?
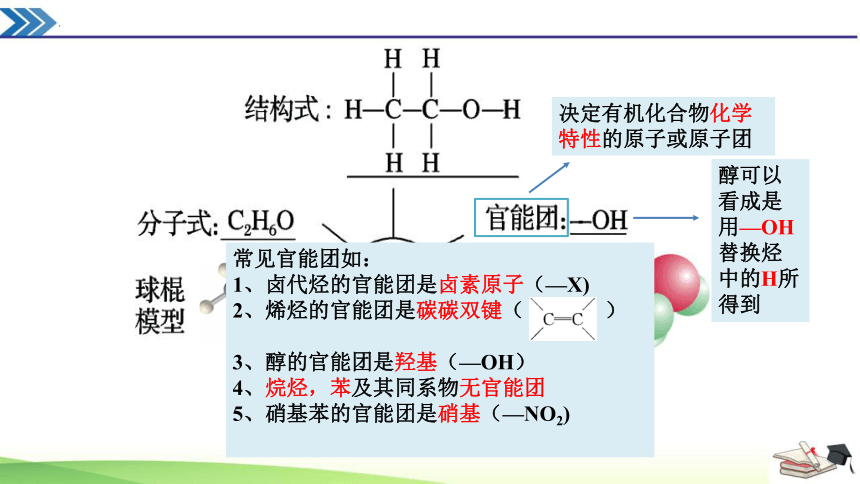
决定有机化合物化学特性的原子或原子团
常见官能团如:
1、卤代烃的官能团是卤素原子(—X)
2、烯烃的官能团是碳碳双键( )
3、醇的官能团是羟基(—OH)
4、烷烃,苯及其同系物无官能团
5、硝基苯的官能团是硝基(—NO2)
醇可以看成是用—OH替换烃中的H所得到
三、化学性质
1、和金属钠反应
2Na+2CH3CH2OH―→2CH3CH2ONa+H2↑
找出不同点
①方程
钠与水的反应 钠与乙醇的反应
浮在水面上
熔化成小球
钠在水面来回游动
发出嘶嘶的响声
②现象
钠沉在乙醇底部
缓慢放出气泡
说明乙醇羟基上的氢原子不如水分子中的氢原子活泼
③计算
1mol —OH
0.5molH2
例题1、已知分子中含有羟基的物质都能与钠反应产生氢气。
乙醇CH3CH2OH、乙二醇 、丙三醇
分别与足量金属钠作用,产生等量的氢气。则这三种醇的物质的量之比为( )
A
思考:以上三种物质是否互为同系物?若不是,请你写
出乙醇的几个同系物
A.6∶3∶2 B.1∶2∶3 C.3∶2∶1 D.4∶3∶2
魔术——烧不坏的手帕?
三、化学性质
2、氧化反应
①、燃烧氧化
2CO2 +3H2O
C2H5OH + 3 O2
点燃
实验现象:
产生淡蓝色火焰,放出大量的热
焊接银器、铜器时,表面会生成发黑的氧化膜。工匠师傅说,可以先把银器和铜器在火上烧热,马上蘸一下酒精,铜银会光亮如初。
这其中包含的科学道理是什么呢?
【探究实验Ⅲ】乙醇的催化氧化
向试管中加入约 2 ml 无水乙醇,取一根光洁的铜丝绕成螺旋状,置于酒精灯外焰上加热,然后伸入无水乙醇中,反复几次,观察铜丝的变化并闻一闻液体的气味。
【思考】
(1)铜丝加热后有什么变化?
(2)铜丝伸入后乙醇有什么现象?
(3)铜丝在反应中的作用?氧化剂是谁?
②、催化氧化
实验操作
实验现象
方程式
铜丝表面
由红变黑,
2Cu+O2 2CuO
====
在空气中灼烧过的铜丝表面由黑变红,试管中的液体有刺激性气味
2、氧化反应
【思考】
(1)铜丝加热后有什么变化?
(2)铜丝伸入后乙醇有什么现象?
(3)铜丝在反应中的作用?氧化剂是谁?
红
黑
红
Cu
CuO
Cu
催化剂
氧气
2Cu+O2 2CuO
====
C—C—H
H
H
H
H
O—H
—
—
—
—
—
+ C u O
第一步
第二步
总反应
C—C
H
H
H
H
O
—
—
—
—
—
—
+Cu+H2O
乙醛,有刺激性气味,沸点20.8°C,易挥发
醛基,可简写为—CHO
2CH3C H2O H + O2 2CH3CHO+2H2O
Cu
△
羟基去H
羟基所连C上去H
Cu、Ag都可做催化剂
思考:催化剂真的不参与化学反应吗?
Cu
氢原子
碳原子
氧原子
乙醛
是不是所有的醇都能发生催化氧化
断键机理
C OH
R2
R1
R3
(3).
(2). 2 CH——OH + O2
R2
R1
Cu
△
(1). 2R—CH2—OH + O2
Cu
△
O
=
2R——C——H + 2H2O
O
=
2R1——C—————R2 + 2H2O
(2).
(3).
伯醇(—OH所在碳只有一个烃基或没有烃基),去氢氧化为醛
仲醇(—OH所在碳有两个烃基),去氢氧化为酮
叔醇(—OH所在碳有三个烃基), 则不能去氢氧化。
连接-OH的碳原子上必须有H, 才发生去氢氧化(催化氧化)
醇催化氧化规律
④
①
③
H—C—C—O—H
H H
H H
②
思考:乙醇在发生各种反应时,都断裂哪些化学键?
和金属钠
燃烧氧化
催化氧化
全断
①
①和③
CH2=CH2↑+ H2O
浓H2SO4
170℃
H—C—C—OH
H H
H H
CH3CH2OH+HBr CH3CH2Br+H2O
断键分析
断②④
断②
例题2,某实验小组用如图所示装置进行乙醇的催化氧化实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:_________________________________________________________在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是________反应(填“吸热”或“放热”)。
(2)甲和乙两个水浴作用不相同:甲的作用是________;乙的作用是________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________,集气瓶中收集到的主要成分是____________。
③、强氧化剂氧化
KMnO4
K2Cr2O7
CH3CH2OH
CH3COOH
Cr3+
Mn2+
2、氧化反应
加入乙醇
四.乙醇的“是非功过”
燃料
造酒原料
有机溶剂和化工原料
请联系实际生活归纳乙醇的用途?
杀菌、消毒
酒精(乙醇)
乙醛
乙酸
乙醛脱氢酶
乙醇脱氢酶
有毒性
造成酒后第二天恶心的主要原因,给肝脏带来损害的主要物质
无毒性
被人体迅速转化为能量,最后分解成H2O和CO2
乙醇进入人体后的代谢过程
资料卡片
课堂总结
一、物理性质
二、结构及官能团
课堂总结
三、化学性质
课堂练习
1、判断正误
(1)能用分液方法分离酒精和水的混合物( )
(2)可用无水硫酸铜检验工业酒精中是否有水( )
(3)乙醇是一种很好的有机溶剂,能萃取碘水中的碘( )
(4)医疗上常用体积分数为95%的乙醇溶液作消毒剂( )
(5)羟基是乙醇的官能团,决定乙醇的主要化学性质( )
(6)乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-
而显碱性( )
(7)乙醇与钠反应可以产生氢气,所以乙醇显酸性( )
(8)醇分子中含有六个氢原子,故1 mol乙醇与足量的钠反
应可以生成3 mol的氢气( )
×
×
√
×
×
√
×
×
2、下列有关乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法
A
3、下列说法正确的是( )
①检测乙醇中是否含有水可加入少量的无水硫酸铜,如变蓝则含水 ②除去乙醇中微量水可加入金属钠,使其完全反应 ③获得无水乙醇的方法是直接加热蒸馏 ④获得无水乙醇的方法通常采用先用生石灰吸水,然后再加热蒸馏
A.①③ B.②④
C.①④ D.③④
C
4、酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是橙色的酸性K2Cr2O7水溶液遇乙醇迅速生成绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小
③乙醇有还原性 ④乙醇是烃的含氧衍生物
A.②④ B.②③ C.①③ D.①④
C
5、按照下图装置持续通入X气体或蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体或蒸气可能是(假设每个反应均完全)( )
A.CH3CH2OH B.CO或H2
C.NH3 D.H2
A
6、将W1 g光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2 g。实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系不正确的是( )
A.石灰水 W1<W2 B.CO W1=W2
C.NaHSO4 W1>W2 D.乙醇溶液 W1<W2
D
7、丙烯醇(CH2=CH—CH2OH)可发生的化学反应有( )
①加成 ②氧化 ③燃烧 ④与Na反应
A.只有①②③ B.①②③④
C.只有①②④ D.只有①③④
B
8、香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示:下列有关香叶醇的叙述正确的是( )
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应不能发生取代反应
A
请同学们利用本节课的知识设计一个简单的酒精检测仪吧!
谢 谢 !
高中化学-2019人教版《必修第二册》-教学课件
第三节 乙醇与乙酸
(第一课时 乙醇)
第七章 有机化合物
对酒当歌
我国是世界上最早掌握酿酒技术的国家之一,千年积淀,留下了灿烂的酒文化
白日放歌须纵酒,青春作伴好还乡。
明月几时有,把酒问青天。
借问酒家何处有,牧童遥指杏花村。
花间一壶酒,独斟无相亲。举杯邀明月,对影成三人。
关于“酒”的颠峰对决
飞花令
主要成分
主要成分
实验探究Ⅰ:乙醇的物理性质
1.观察颜色、状态、气味
2.溶解性实验
(1)向酒精中倒入任意体积水摇匀,观察现象
(2)荧光笔涂画在手上,用棉签蘸取乙醇反复擦拭手上的字,看是否能擦去
一、物理性质
颜色 气味 状态 挥发性 溶解性
无色
透明
特殊
香味
液 体
跟水以任意比互溶
易挥发
(沸点78℃)
能够溶解多种无机物和有机物
俗称
乙醇
酒精
二、组成与结构
乙醇:C2H6O
乙烷:C2H6
多一个O原子
∣
∣
- C-
H
H
H
∣
∣
C-H
H
H
根据O原子的2键原则推测
O
O
A
B
思考:怎样设计实验证明乙醇是A还是B
用球棍模型动手搭建所有可能的空间结构。
1、水的结构式 乙烷的结构式
2、金属钠保存在煤油中,煤油的主要成分是烃类。
3、钠能与水反应产生氢气。
资料卡片
金属Na
无水乙醇
金属钠可保存在煤油(主要成分是烷烃)中,而金属钠与乙醇反应会放出H2,据此分析判断哪种结构式是乙醇的?
乙醇
【实验探究Ⅱ】乙醇能否和金属钠的反应?
决定有机化合物化学特性的原子或原子团
常见官能团如:
1、卤代烃的官能团是卤素原子(—X)
2、烯烃的官能团是碳碳双键( )
3、醇的官能团是羟基(—OH)
4、烷烃,苯及其同系物无官能团
5、硝基苯的官能团是硝基(—NO2)
醇可以看成是用—OH替换烃中的H所得到
三、化学性质
1、和金属钠反应
2Na+2CH3CH2OH―→2CH3CH2ONa+H2↑
找出不同点
①方程
钠与水的反应 钠与乙醇的反应
浮在水面上
熔化成小球
钠在水面来回游动
发出嘶嘶的响声
②现象
钠沉在乙醇底部
缓慢放出气泡
说明乙醇羟基上的氢原子不如水分子中的氢原子活泼
③计算
1mol —OH
0.5molH2
例题1、已知分子中含有羟基的物质都能与钠反应产生氢气。
乙醇CH3CH2OH、乙二醇 、丙三醇
分别与足量金属钠作用,产生等量的氢气。则这三种醇的物质的量之比为( )
A
思考:以上三种物质是否互为同系物?若不是,请你写
出乙醇的几个同系物
A.6∶3∶2 B.1∶2∶3 C.3∶2∶1 D.4∶3∶2
魔术——烧不坏的手帕?
三、化学性质
2、氧化反应
①、燃烧氧化
2CO2 +3H2O
C2H5OH + 3 O2
点燃
实验现象:
产生淡蓝色火焰,放出大量的热
焊接银器、铜器时,表面会生成发黑的氧化膜。工匠师傅说,可以先把银器和铜器在火上烧热,马上蘸一下酒精,铜银会光亮如初。
这其中包含的科学道理是什么呢?
【探究实验Ⅲ】乙醇的催化氧化
向试管中加入约 2 ml 无水乙醇,取一根光洁的铜丝绕成螺旋状,置于酒精灯外焰上加热,然后伸入无水乙醇中,反复几次,观察铜丝的变化并闻一闻液体的气味。
【思考】
(1)铜丝加热后有什么变化?
(2)铜丝伸入后乙醇有什么现象?
(3)铜丝在反应中的作用?氧化剂是谁?
②、催化氧化
实验操作
实验现象
方程式
铜丝表面
由红变黑,
2Cu+O2 2CuO
====
在空气中灼烧过的铜丝表面由黑变红,试管中的液体有刺激性气味
2、氧化反应
【思考】
(1)铜丝加热后有什么变化?
(2)铜丝伸入后乙醇有什么现象?
(3)铜丝在反应中的作用?氧化剂是谁?
红
黑
红
Cu
CuO
Cu
催化剂
氧气
2Cu+O2 2CuO
====
C—C—H
H
H
H
H
O—H
—
—
—
—
—
+ C u O
第一步
第二步
总反应
C—C
H
H
H
H
O
—
—
—
—
—
—
+Cu+H2O
乙醛,有刺激性气味,沸点20.8°C,易挥发
醛基,可简写为—CHO
2CH3C H2O H + O2 2CH3CHO+2H2O
Cu
△
羟基去H
羟基所连C上去H
Cu、Ag都可做催化剂
思考:催化剂真的不参与化学反应吗?
Cu
氢原子
碳原子
氧原子
乙醛
是不是所有的醇都能发生催化氧化
断键机理
C OH
R2
R1
R3
(3).
(2). 2 CH——OH + O2
R2
R1
Cu
△
(1). 2R—CH2—OH + O2
Cu
△
O
=
2R——C——H + 2H2O
O
=
2R1——C—————R2 + 2H2O
(2).
(3).
伯醇(—OH所在碳只有一个烃基或没有烃基),去氢氧化为醛
仲醇(—OH所在碳有两个烃基),去氢氧化为酮
叔醇(—OH所在碳有三个烃基), 则不能去氢氧化。
连接-OH的碳原子上必须有H, 才发生去氢氧化(催化氧化)
醇催化氧化规律
④
①
③
H—C—C—O—H
H H
H H
②
思考:乙醇在发生各种反应时,都断裂哪些化学键?
和金属钠
燃烧氧化
催化氧化
全断
①
①和③
CH2=CH2↑+ H2O
浓H2SO4
170℃
H—C—C—OH
H H
H H
CH3CH2OH+HBr CH3CH2Br+H2O
断键分析
断②④
断②
例题2,某实验小组用如图所示装置进行乙醇的催化氧化实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:_________________________________________________________在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是________反应(填“吸热”或“放热”)。
(2)甲和乙两个水浴作用不相同:甲的作用是________;乙的作用是________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________,集气瓶中收集到的主要成分是____________。
③、强氧化剂氧化
KMnO4
K2Cr2O7
CH3CH2OH
CH3COOH
Cr3+
Mn2+
2、氧化反应
加入乙醇
四.乙醇的“是非功过”
燃料
造酒原料
有机溶剂和化工原料
请联系实际生活归纳乙醇的用途?
杀菌、消毒
酒精(乙醇)
乙醛
乙酸
乙醛脱氢酶
乙醇脱氢酶
有毒性
造成酒后第二天恶心的主要原因,给肝脏带来损害的主要物质
无毒性
被人体迅速转化为能量,最后分解成H2O和CO2
乙醇进入人体后的代谢过程
资料卡片
课堂总结
一、物理性质
二、结构及官能团
课堂总结
三、化学性质
课堂练习
1、判断正误
(1)能用分液方法分离酒精和水的混合物( )
(2)可用无水硫酸铜检验工业酒精中是否有水( )
(3)乙醇是一种很好的有机溶剂,能萃取碘水中的碘( )
(4)医疗上常用体积分数为95%的乙醇溶液作消毒剂( )
(5)羟基是乙醇的官能团,决定乙醇的主要化学性质( )
(6)乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-
而显碱性( )
(7)乙醇与钠反应可以产生氢气,所以乙醇显酸性( )
(8)醇分子中含有六个氢原子,故1 mol乙醇与足量的钠反
应可以生成3 mol的氢气( )
×
×
√
×
×
√
×
×
2、下列有关乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法
A
3、下列说法正确的是( )
①检测乙醇中是否含有水可加入少量的无水硫酸铜,如变蓝则含水 ②除去乙醇中微量水可加入金属钠,使其完全反应 ③获得无水乙醇的方法是直接加热蒸馏 ④获得无水乙醇的方法通常采用先用生石灰吸水,然后再加热蒸馏
A.①③ B.②④
C.①④ D.③④
C
4、酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是橙色的酸性K2Cr2O7水溶液遇乙醇迅速生成绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小
③乙醇有还原性 ④乙醇是烃的含氧衍生物
A.②④ B.②③ C.①③ D.①④
C
5、按照下图装置持续通入X气体或蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体或蒸气可能是(假设每个反应均完全)( )
A.CH3CH2OH B.CO或H2
C.NH3 D.H2
A
6、将W1 g光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2 g。实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系不正确的是( )
A.石灰水 W1<W2 B.CO W1=W2
C.NaHSO4 W1>W2 D.乙醇溶液 W1<W2
D
7、丙烯醇(CH2=CH—CH2OH)可发生的化学反应有( )
①加成 ②氧化 ③燃烧 ④与Na反应
A.只有①②③ B.①②③④
C.只有①②④ D.只有①③④
B
8、香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示:下列有关香叶醇的叙述正确的是( )
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应不能发生取代反应
A
请同学们利用本节课的知识设计一个简单的酒精检测仪吧!
谢 谢 !
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
