第九单元溶液分层练习 人教版初中化学九年级下册(含解析)
文档属性
| 名称 | 第九单元溶液分层练习 人教版初中化学九年级下册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 511.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-16 21:19:17 | ||
图片预览




文档简介
第九单元溶液
学校:___________姓名:___________班级:___________考号:___________
一、选择题
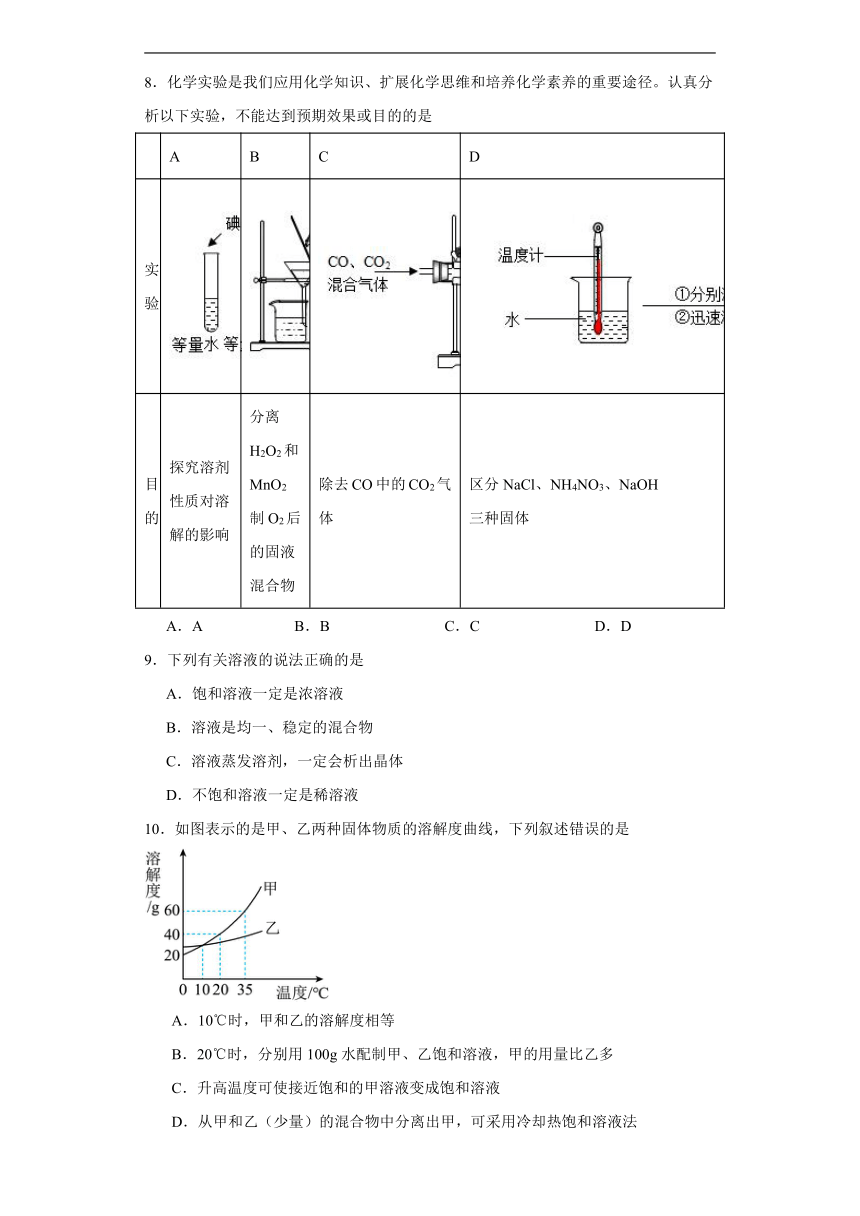
1.如图为甲、乙两种固体物质在水中的溶解度曲线,下列说法错误的是
A.降低温度能使乙物质的不饱和溶液变成饱和溶液
B.在t1℃时,M点表示甲、乙两物质的溶解度相等
C.在t2℃时,N点表示甲物质的不饱和溶液
D.在t1℃时,100g水可以溶解25g甲物质
2.在t℃时,向mg水中加入ng硫酸铜晶体,充分搅拌后得到硫酸铜溶液。有关说法正确的是
A.溶质的质量是ng B.溶剂的质量是mg
C.溶液的质量是(m+n)g D.溶解度是g/100g水
3.如图为A、B、C三种物质的溶解度曲线,下列叙述中错误的是
A.t1℃时,50g水中加入25gB形成的溶液质量为70g
B.t2℃时,三种物质的溶解度由大到小的顺序为
C.要使B从其浓溶液中析出,可采用蒸发溶剂结晶法
D.要将C的不饱和溶液转化为饱和溶液可以采取降温的方法
4.—定质量某硝酸钾样品中不含可溶性杂质。在10℃时加蒸馏水使之充分溶解,残留固体的质量为250g。若该实验在40℃下进行时,残留固体质量为120g;70℃时,残留固体质量为20g。已知KNO3在不同温度下的溶解度如下。对该样品的推断正确的是
温度/℃ 10 40 55 70
溶解度/g 20 65 100 140
A.该硝酸钾样品为纯净物 B.40℃时溶于水的硝酸钾为130g
C.70℃时KNO3溶液为饱和溶液 D.55℃左右时KNO3完全溶解
5.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.t2℃时,甲、乙饱和溶液的溶质的质量分数相等
C.t1℃时,乙的饱和溶液降温后变为不饱和溶液
D.将t2℃时,甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大
6.化学学科核心素养展现了化学课程对学生发展的重要价值。下列示例说法中错误的是
A.化学观念:金刚石和石墨的碳原子排列方式不同,所以物理性质存在明显差异
B.科学思维:与稀盐酸反应生成,所以也能与稀盐酸反应生成
C.科学探究与实践:将碘分别加入水和汽油中,探究碘在不同溶剂中的溶解性
D.科学态度与责任:将生活垃圾分类投放,实现资源的回收再利用
7.下列生活事实的解释中,不合理的是
A.漂白粉可杀菌消毒,因其具有吸附性
B.洗洁精可清除油污,因其具有乳化作用
C.某合金可做保险丝,因该合金的熔点低
D.氦气可填充气球,因其密度小和化学性质稳定
8.化学实验是我们应用化学知识、扩展化学思维和培养化学素养的重要途径。认真分析以下实验,不能达到预期效果或目的的是
A B C D
实验
目的 探究溶剂性质对溶解的影响 分离H2O2和MnO2制O2后的固液混合物 除去CO中的CO2气 体 区分NaCl、NH4NO3、NaOH 三种固体
A.A B.B C.C D.D
9.下列有关溶液的说法正确的是
A.饱和溶液一定是浓溶液
B.溶液是均一、稳定的混合物
C.溶液蒸发溶剂,一定会析出晶体
D.不饱和溶液一定是稀溶液
10.如图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述错误的是
A.10℃时,甲和乙的溶解度相等
B.20℃时,分别用100g水配制甲、乙饱和溶液,甲的用量比乙多
C.升高温度可使接近饱和的甲溶液变成饱和溶液
D.从甲和乙(少量)的混合物中分离出甲,可采用冷却热饱和溶液法
二、判断题
11.气体的溶解度随压强的增大而增大。
12.凡是无色、透明的液体都是溶液。 (判断对错)
13.溶液中至少有两种物质。( )
14.20℃时,硝酸钾的溶解度为31.6( )
15.溶液的体积等于溶质和溶剂的体积之和( )
三、综合应用题
16.请根据如图回答有关问题:
(1)写出仪器的名称:a 。
(2)写出实验室用A装置制氧气的化学方程式 ;可用E装置收集氧气的理由是 。
(3)实验室选用B、C装置制取气体时,装置C和B相比的优点除了便于随时添加液体药品外,还能 。将仪器a中的液体加入圆底烧瓶需进行的操作有 。
(4)实验室用5%的双氧水170g最多能制得氧气多少克 ?(写出计算过程)
17.工业盐酸中常混有少量的FeCl3而呈黄色.同学们想用自己配置NaOH溶液来测定某工业盐酸中FeCl3的含量,进行如下实验:
(1)配置NaOH溶液。
①已知:水的密度为1.0g/mL。实验室配制200g溶质质量分数为20%的NaOH溶液,需要称取NaOH固体 g,需要量取水 mL。
②配制的操作示意图如下,该同学实验操作中的错误操作是 。如果其他操作都正确,该同学配制的氢氧化钠溶液溶质质量分数 。(填“偏大”“偏小”“不变”之一)完成该实验正确操作顺序为 (填序号)。
(2)同学们改正错误后,准确的配制出氢氧化钠溶液来测定某工业盐酸中FeCl3的含量进行如下实验:取该工业盐酸100g,滴加上述配制的NaOH溶液,加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。FeCl3与NaOH反应的化学方程式为:FeCl3+3NaOH═Fe(OH)3↓+3NaCl。请计算:
①与FeCl3反应消耗的NaOH溶液中溶质的质量是 g。
②该工业盐酸中FeCl3的质量分数 。
18.溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)消毒酒精是医疗上常用的一种溶液,其溶质是 。
(2)现有100g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增大一倍,应蒸发掉水 g。
(3)为了探究影响物质溶解性的因素,小林设计并进行了如下实验。
①实验一的目的是 。实验一的现象是:氯化钠溶于水溶液,氯化钠几乎不溶于酒精。对比得出的实验结论是 。
②实验二的目的是 。
思路分析:在实验中需要改变的因素是 ,需要保持不变的因素是 。
实验步骤及现象:取一定量的硝酸钾加入5mL水中,充分振荡,有部分硝酸钾未溶解;加热后硝酸钾完全溶解,冷至室温又有部分硝酸钾析出。
实验结论:在 保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会 ;降低温度时,其最大溶解量会 。
参考答案:
1.A
【详解】A.降低温度乙物质的溶解度上升,所以降低温度不能使乙物质的不饱和溶液变成饱和溶液,选项错误。
B.在t1℃时,M点甲、乙两物质曲线相交,表示甲、乙两物质的溶解度相等,正确。
C.在t2℃时,N点在甲物质溶解度曲线的下方,未达到甲饱和溶液所需的量,所以表示甲物质的不饱和溶液,正确。
D.在t1℃时,甲物质的溶解度为25g,所以100g水可以溶解25g甲物质,正确。
故选:A。
2.C
【详解】A、ng硫酸铜晶体含有的硫酸铜质量小于ng,所以溶质的质量小于ng,故选项错误;
B、硫酸铜晶体中含有结晶水,溶解的过程中水的质量在增加,所以溶剂的质量大于mg,故选项错误;
C、硫酸铜晶体完成溶于水中,所以溶液的质量是(m+n)g,故选项正确;
D、硫酸铜溶液的溶解度要在饱和条件下才能计算,不能确定硫酸铜溶液是否饱和,无法计算,故选项错误。
故选:C。
【点睛】硫酸铜晶体是五水硫酸铜,俗称胆矾、蓝矾。
3.D
【详解】A、t1℃时,B的溶解度为40g,则50g 水中加入 25g B,最多只能溶解20gB,还有5gB不能溶解,故形成的溶液质量为,选项正确;
B、由图可知,t2℃时,三种物质的溶解度由大到小的顺序为:A>B>C,选项正确;
C、B的溶解度随温度升高而增大,但受温度影响较小,故要使B 从其浓溶液中析出,可采用蒸发结晶法,选项正确;
D、C的溶解度随温度升高而减小,要将C的不饱和溶液转化为饱和溶液可以采取升温的方法,选项错误。
故选D。
4.D
【详解】A、10℃时,残留固体是250g,40℃时,残留固体是120g,故从10℃到40℃,溶质增加了250g-120g=130g,设溶剂的质量为x,则,x≈289g,70℃时,残留固体为20g,如果70℃时,是饱和溶液,设从40℃到70℃,溶质增加的质量为y,,y=216.75g,而实际溶质增加的质量为:120g-20g=100g,故70℃时的溶液为不饱和溶液,剩余的物质为杂质,该硝酸钾样品为混合物,不符合题意;
B、40℃时,硝酸钾的溶解度为65g,该温度下,溶于水的硝酸钾的质量为:,不符合题意;
C、由A的分析可知,70℃时,硝酸钾的溶液为不饱和溶液,不符合题意;
D、55℃时,硝酸钾的溶解度为100g,设从40℃到50℃,溶质增加的质量为z,则,z=101.15g,由以上分析可知,40℃时,残留的固体中,其中100g为硝酸钾,20g为杂质,故55℃左右时KNO3完全溶解,符合题意。
故选D。
5.B
【详解】A.t2℃以后,甲的溶解度大于乙的溶解度,选项说法错误。
B.t2℃时,甲、乙的溶解度相同,所以饱和溶液的溶质的质量分数相等,选项说法正确。
C.t1℃时,乙的饱和溶液降温后析出晶体,仍为饱和溶液,选项说法错误。
D.将t2℃时,等质量的甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大,选项说法错误。
故选:B。
6.B
【详解】A、金刚石和石墨都是由碳原子直接构成的,但由于它们的碳原子排列方式不同,则物理性质存在明显差异,该选项说法正确;
B、铝与盐酸反应生成氯化铝,但铁能与盐酸反应生成FeCl2,而不是FeCl3,该选项说法错误;
C、碘不能溶于水中,但能溶于汽油中,说明碘在不同溶剂中的溶解性不同,该选项说法正确;
D、将垃圾分类投放,可以实现资源的回收再利用,及保护环境,该选项说法正确。
故选B。
7.A
【详解】A、漂白粉可杀菌消毒,因其具有强氧化性,说法错误,符合题意;
B、洗洁精可清除油污,因其具有乳化作用是正确的叙述,不符合题意;
C、某合金可做保险丝,因该合金的熔点低是正确的叙述,不符合题意;
D、氦气可填充气球,因其密度小和化学性质稳定是正确的叙述,不符合题意;
故选A。
8.C
【详解】A、过程中碘在汽油中溶解的比水中多,能够比较同种物质在不同溶剂中溶解性,故选项能够达到实验目的;
B、过氧化氢溶液分解生成水和氧气,二氧化锰难溶于水,可用分离H2O2和MnO2制O2后的固液混合物,故选项实验操作能达到目的;
C、在加热条件下,一氧化碳和氧化铜反应生成铜和二氧化碳,不符合除杂原则,故选项实验操作不能达到目的;
D、NH4NO3、NaOH溶于水分别吸热、放热,使溶液的温度分别降低、升高,氯化钠溶于水温度几乎无变化,可以鉴别,故选项实验操作能达到目的。
故选C。
9.B
【解析】略
10.C
【详解】A、由溶解度曲线可知,10℃时,甲和乙的溶解度相等;故A正确,不符合题意;
B、由溶解度曲线可知,20℃时,甲的溶解度大于乙的溶解度,故分别用100g水配制甲、乙饱和溶液,甲的用量比乙多,故B正确,不符合题意;
C、由溶解度曲线可知,甲的溶解度随温度升高而增大,故当升高温度,甲的溶解度增大,不可使接近饱和的甲溶液变成饱和溶液,故C错误,符合题意;
D、由溶解度曲线可知,甲和乙的溶解度都是随温度升高而增大,甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,故从甲和乙(少量)的混合物中分离出甲,可采用冷却热饱和溶液法,故D正确,不符合题意;
故选C。
11.正确
【详解】气体的溶解度随压强的增大而增大,压强的减小而减小,正确。
12.错
【详解】无色、透明的液体不一定是溶液,例如水是无色、透明、均一、稳定的液体,水不是溶液。故错误;
13.正确
【详解】溶液由溶质与溶剂组成,所以溶液中至少有两种物质,选项正确,故填正确。
14.错误
【详解】20℃时,硝酸钾的溶解度为31.6g,溶解度的单位是“g”,故错误。
15.错误
【详解】由于粒子间存在着间隙,所以在溶解的过程中,溶质和溶剂粒子会彼此进入对方的空隙,所以溶液体积会比溶质与溶剂的体积和小,该说法错误。
16.(1)分液漏斗
(2) 氧气不易溶于水且不和水反应
(3) 控制反应速率 拔下玻璃塞,打开活塞2、1
(4)设最多能制得氧气的质量为x,则
解得x=4g
答:实验室用5%的双氧水170g最多能制得氧气4g。
【详解】(1)由图可知,仪器a为分液漏斗。
(2)A装置为加热固体的装置,且试管口塞一团棉花,适用于高锰酸钾制取氧气,高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:;
E装置为排水法收集装置,氧气不易溶于水且不和水反应,则可用排水法收集。
(3)装置C中,可通过分液漏斗控制液体的滴加速度,从而控制反应速率;
将仪器a中的液体加入圆底烧瓶,需拔下玻璃塞,打开活塞2、1。
(4)见答案。
17.(1) 40 160 称量氢氧化钠固体时砝码和药品放反且放砝码的托盘少一个烧杯,量取水时仰视读数 偏小 ④①③⑤②
(2) 2.4 3.25%设与2.4g氢氧化钠反应的氯化铁的质量为x
x=3.25g
该工业盐酸中FeCl3的质量分数为=3.25%。
答:工业盐酸中FeCl3的质量分数为3.25%。
【详解】(1)①称取NaOH固体=200g×20%=40g,需要量取水=200g-40g=160g,体积=160g÷(1.0g/mL)=160mL,故填:40;160;
②称量氢氧化钠固体时应左物右码,且两边都要放一个小烧杯,操作中将砝码和药品放反且放砝码的托盘少一个烧杯,这会导致实际称量药品质量偏小,量取水时应平视凹液面最低处读数,操作中仰视读数,这会导致实际量取的水偏多,如果其他操作都正确,配制的氢氧化钠溶液溶质质量分数会偏小,配制溶液的正确顺序是计算、称量、量取、溶解、装瓶,为④①③⑤②,故填:称量氢氧化钠固体时砝码和药品放反且放砝码的托盘少一个烧杯,量取水时仰视读数;偏小;④①③⑤②;
(2)①由图可以看出和氯化铁反应的氢氧化钠溶液的质量为182g﹣170g=12g,其溶质氢氧化钠的质量为12g×20%=2.4g,故填:2.4;
②见答案。
18. 酒精 50 比较氯化钠在水和酒精中的溶解情况 同种溶质在不同的溶剂中溶解性不同 比较温度对硝酸钾在水中的溶解性的影响 温度 一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量) 溶质和溶剂的种类和质量 增加 减少
【详解】(1)消毒酒精是医疗上常用的一种溶液,其溶质是酒精,溶剂是水;
(2)若使溶液的溶质质量分数增大一倍,设应蒸发掉水的质量为x,则有100g×10%=(100g-x)×20%,x=50g;
(3)
①根据图示可知实验一的目的是比较氯化钠在水和酒精中的溶解情况;
氯化钠溶于水,几乎不溶于酒精,对比得出的实验结论是同种溶质在不同的溶剂中溶解性不同。
②根据图示可知,硝酸钾和水定量条件下,温度从20℃硝酸钾固体未完全溶解到加热完全溶解再到降温20℃硝酸钾固体未完全溶解,可知实验二的目的是比较温度对硝酸钾在水中的溶解性的影响;
由上分析可知在实验中需要改变的因素是温度,需要保持不变的因素是一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量);
根据实验现象可知在溶质和溶剂的种类和质量保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会增加,降低温度时,其最大溶解量会减少。
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.如图为甲、乙两种固体物质在水中的溶解度曲线,下列说法错误的是
A.降低温度能使乙物质的不饱和溶液变成饱和溶液
B.在t1℃时,M点表示甲、乙两物质的溶解度相等
C.在t2℃时,N点表示甲物质的不饱和溶液
D.在t1℃时,100g水可以溶解25g甲物质
2.在t℃时,向mg水中加入ng硫酸铜晶体,充分搅拌后得到硫酸铜溶液。有关说法正确的是
A.溶质的质量是ng B.溶剂的质量是mg
C.溶液的质量是(m+n)g D.溶解度是g/100g水
3.如图为A、B、C三种物质的溶解度曲线,下列叙述中错误的是
A.t1℃时,50g水中加入25gB形成的溶液质量为70g
B.t2℃时,三种物质的溶解度由大到小的顺序为
C.要使B从其浓溶液中析出,可采用蒸发溶剂结晶法
D.要将C的不饱和溶液转化为饱和溶液可以采取降温的方法
4.—定质量某硝酸钾样品中不含可溶性杂质。在10℃时加蒸馏水使之充分溶解,残留固体的质量为250g。若该实验在40℃下进行时,残留固体质量为120g;70℃时,残留固体质量为20g。已知KNO3在不同温度下的溶解度如下。对该样品的推断正确的是
温度/℃ 10 40 55 70
溶解度/g 20 65 100 140
A.该硝酸钾样品为纯净物 B.40℃时溶于水的硝酸钾为130g
C.70℃时KNO3溶液为饱和溶液 D.55℃左右时KNO3完全溶解
5.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.t2℃时,甲、乙饱和溶液的溶质的质量分数相等
C.t1℃时,乙的饱和溶液降温后变为不饱和溶液
D.将t2℃时,甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大
6.化学学科核心素养展现了化学课程对学生发展的重要价值。下列示例说法中错误的是
A.化学观念:金刚石和石墨的碳原子排列方式不同,所以物理性质存在明显差异
B.科学思维:与稀盐酸反应生成,所以也能与稀盐酸反应生成
C.科学探究与实践:将碘分别加入水和汽油中,探究碘在不同溶剂中的溶解性
D.科学态度与责任:将生活垃圾分类投放,实现资源的回收再利用
7.下列生活事实的解释中,不合理的是
A.漂白粉可杀菌消毒,因其具有吸附性
B.洗洁精可清除油污,因其具有乳化作用
C.某合金可做保险丝,因该合金的熔点低
D.氦气可填充气球,因其密度小和化学性质稳定
8.化学实验是我们应用化学知识、扩展化学思维和培养化学素养的重要途径。认真分析以下实验,不能达到预期效果或目的的是
A B C D
实验
目的 探究溶剂性质对溶解的影响 分离H2O2和MnO2制O2后的固液混合物 除去CO中的CO2气 体 区分NaCl、NH4NO3、NaOH 三种固体
A.A B.B C.C D.D
9.下列有关溶液的说法正确的是
A.饱和溶液一定是浓溶液
B.溶液是均一、稳定的混合物
C.溶液蒸发溶剂,一定会析出晶体
D.不饱和溶液一定是稀溶液
10.如图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述错误的是
A.10℃时,甲和乙的溶解度相等
B.20℃时,分别用100g水配制甲、乙饱和溶液,甲的用量比乙多
C.升高温度可使接近饱和的甲溶液变成饱和溶液
D.从甲和乙(少量)的混合物中分离出甲,可采用冷却热饱和溶液法
二、判断题
11.气体的溶解度随压强的增大而增大。
12.凡是无色、透明的液体都是溶液。 (判断对错)
13.溶液中至少有两种物质。( )
14.20℃时,硝酸钾的溶解度为31.6( )
15.溶液的体积等于溶质和溶剂的体积之和( )
三、综合应用题
16.请根据如图回答有关问题:
(1)写出仪器的名称:a 。
(2)写出实验室用A装置制氧气的化学方程式 ;可用E装置收集氧气的理由是 。
(3)实验室选用B、C装置制取气体时,装置C和B相比的优点除了便于随时添加液体药品外,还能 。将仪器a中的液体加入圆底烧瓶需进行的操作有 。
(4)实验室用5%的双氧水170g最多能制得氧气多少克 ?(写出计算过程)
17.工业盐酸中常混有少量的FeCl3而呈黄色.同学们想用自己配置NaOH溶液来测定某工业盐酸中FeCl3的含量,进行如下实验:
(1)配置NaOH溶液。
①已知:水的密度为1.0g/mL。实验室配制200g溶质质量分数为20%的NaOH溶液,需要称取NaOH固体 g,需要量取水 mL。
②配制的操作示意图如下,该同学实验操作中的错误操作是 。如果其他操作都正确,该同学配制的氢氧化钠溶液溶质质量分数 。(填“偏大”“偏小”“不变”之一)完成该实验正确操作顺序为 (填序号)。
(2)同学们改正错误后,准确的配制出氢氧化钠溶液来测定某工业盐酸中FeCl3的含量进行如下实验:取该工业盐酸100g,滴加上述配制的NaOH溶液,加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。FeCl3与NaOH反应的化学方程式为:FeCl3+3NaOH═Fe(OH)3↓+3NaCl。请计算:
①与FeCl3反应消耗的NaOH溶液中溶质的质量是 g。
②该工业盐酸中FeCl3的质量分数 。
18.溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)消毒酒精是医疗上常用的一种溶液,其溶质是 。
(2)现有100g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增大一倍,应蒸发掉水 g。
(3)为了探究影响物质溶解性的因素,小林设计并进行了如下实验。
①实验一的目的是 。实验一的现象是:氯化钠溶于水溶液,氯化钠几乎不溶于酒精。对比得出的实验结论是 。
②实验二的目的是 。
思路分析:在实验中需要改变的因素是 ,需要保持不变的因素是 。
实验步骤及现象:取一定量的硝酸钾加入5mL水中,充分振荡,有部分硝酸钾未溶解;加热后硝酸钾完全溶解,冷至室温又有部分硝酸钾析出。
实验结论:在 保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会 ;降低温度时,其最大溶解量会 。
参考答案:
1.A
【详解】A.降低温度乙物质的溶解度上升,所以降低温度不能使乙物质的不饱和溶液变成饱和溶液,选项错误。
B.在t1℃时,M点甲、乙两物质曲线相交,表示甲、乙两物质的溶解度相等,正确。
C.在t2℃时,N点在甲物质溶解度曲线的下方,未达到甲饱和溶液所需的量,所以表示甲物质的不饱和溶液,正确。
D.在t1℃时,甲物质的溶解度为25g,所以100g水可以溶解25g甲物质,正确。
故选:A。
2.C
【详解】A、ng硫酸铜晶体含有的硫酸铜质量小于ng,所以溶质的质量小于ng,故选项错误;
B、硫酸铜晶体中含有结晶水,溶解的过程中水的质量在增加,所以溶剂的质量大于mg,故选项错误;
C、硫酸铜晶体完成溶于水中,所以溶液的质量是(m+n)g,故选项正确;
D、硫酸铜溶液的溶解度要在饱和条件下才能计算,不能确定硫酸铜溶液是否饱和,无法计算,故选项错误。
故选:C。
【点睛】硫酸铜晶体是五水硫酸铜,俗称胆矾、蓝矾。
3.D
【详解】A、t1℃时,B的溶解度为40g,则50g 水中加入 25g B,最多只能溶解20gB,还有5gB不能溶解,故形成的溶液质量为,选项正确;
B、由图可知,t2℃时,三种物质的溶解度由大到小的顺序为:A>B>C,选项正确;
C、B的溶解度随温度升高而增大,但受温度影响较小,故要使B 从其浓溶液中析出,可采用蒸发结晶法,选项正确;
D、C的溶解度随温度升高而减小,要将C的不饱和溶液转化为饱和溶液可以采取升温的方法,选项错误。
故选D。
4.D
【详解】A、10℃时,残留固体是250g,40℃时,残留固体是120g,故从10℃到40℃,溶质增加了250g-120g=130g,设溶剂的质量为x,则,x≈289g,70℃时,残留固体为20g,如果70℃时,是饱和溶液,设从40℃到70℃,溶质增加的质量为y,,y=216.75g,而实际溶质增加的质量为:120g-20g=100g,故70℃时的溶液为不饱和溶液,剩余的物质为杂质,该硝酸钾样品为混合物,不符合题意;
B、40℃时,硝酸钾的溶解度为65g,该温度下,溶于水的硝酸钾的质量为:,不符合题意;
C、由A的分析可知,70℃时,硝酸钾的溶液为不饱和溶液,不符合题意;
D、55℃时,硝酸钾的溶解度为100g,设从40℃到50℃,溶质增加的质量为z,则,z=101.15g,由以上分析可知,40℃时,残留的固体中,其中100g为硝酸钾,20g为杂质,故55℃左右时KNO3完全溶解,符合题意。
故选D。
5.B
【详解】A.t2℃以后,甲的溶解度大于乙的溶解度,选项说法错误。
B.t2℃时,甲、乙的溶解度相同,所以饱和溶液的溶质的质量分数相等,选项说法正确。
C.t1℃时,乙的饱和溶液降温后析出晶体,仍为饱和溶液,选项说法错误。
D.将t2℃时,等质量的甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大,选项说法错误。
故选:B。
6.B
【详解】A、金刚石和石墨都是由碳原子直接构成的,但由于它们的碳原子排列方式不同,则物理性质存在明显差异,该选项说法正确;
B、铝与盐酸反应生成氯化铝,但铁能与盐酸反应生成FeCl2,而不是FeCl3,该选项说法错误;
C、碘不能溶于水中,但能溶于汽油中,说明碘在不同溶剂中的溶解性不同,该选项说法正确;
D、将垃圾分类投放,可以实现资源的回收再利用,及保护环境,该选项说法正确。
故选B。
7.A
【详解】A、漂白粉可杀菌消毒,因其具有强氧化性,说法错误,符合题意;
B、洗洁精可清除油污,因其具有乳化作用是正确的叙述,不符合题意;
C、某合金可做保险丝,因该合金的熔点低是正确的叙述,不符合题意;
D、氦气可填充气球,因其密度小和化学性质稳定是正确的叙述,不符合题意;
故选A。
8.C
【详解】A、过程中碘在汽油中溶解的比水中多,能够比较同种物质在不同溶剂中溶解性,故选项能够达到实验目的;
B、过氧化氢溶液分解生成水和氧气,二氧化锰难溶于水,可用分离H2O2和MnO2制O2后的固液混合物,故选项实验操作能达到目的;
C、在加热条件下,一氧化碳和氧化铜反应生成铜和二氧化碳,不符合除杂原则,故选项实验操作不能达到目的;
D、NH4NO3、NaOH溶于水分别吸热、放热,使溶液的温度分别降低、升高,氯化钠溶于水温度几乎无变化,可以鉴别,故选项实验操作能达到目的。
故选C。
9.B
【解析】略
10.C
【详解】A、由溶解度曲线可知,10℃时,甲和乙的溶解度相等;故A正确,不符合题意;
B、由溶解度曲线可知,20℃时,甲的溶解度大于乙的溶解度,故分别用100g水配制甲、乙饱和溶液,甲的用量比乙多,故B正确,不符合题意;
C、由溶解度曲线可知,甲的溶解度随温度升高而增大,故当升高温度,甲的溶解度增大,不可使接近饱和的甲溶液变成饱和溶液,故C错误,符合题意;
D、由溶解度曲线可知,甲和乙的溶解度都是随温度升高而增大,甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,故从甲和乙(少量)的混合物中分离出甲,可采用冷却热饱和溶液法,故D正确,不符合题意;
故选C。
11.正确
【详解】气体的溶解度随压强的增大而增大,压强的减小而减小,正确。
12.错
【详解】无色、透明的液体不一定是溶液,例如水是无色、透明、均一、稳定的液体,水不是溶液。故错误;
13.正确
【详解】溶液由溶质与溶剂组成,所以溶液中至少有两种物质,选项正确,故填正确。
14.错误
【详解】20℃时,硝酸钾的溶解度为31.6g,溶解度的单位是“g”,故错误。
15.错误
【详解】由于粒子间存在着间隙,所以在溶解的过程中,溶质和溶剂粒子会彼此进入对方的空隙,所以溶液体积会比溶质与溶剂的体积和小,该说法错误。
16.(1)分液漏斗
(2) 氧气不易溶于水且不和水反应
(3) 控制反应速率 拔下玻璃塞,打开活塞2、1
(4)设最多能制得氧气的质量为x,则
解得x=4g
答:实验室用5%的双氧水170g最多能制得氧气4g。
【详解】(1)由图可知,仪器a为分液漏斗。
(2)A装置为加热固体的装置,且试管口塞一团棉花,适用于高锰酸钾制取氧气,高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:;
E装置为排水法收集装置,氧气不易溶于水且不和水反应,则可用排水法收集。
(3)装置C中,可通过分液漏斗控制液体的滴加速度,从而控制反应速率;
将仪器a中的液体加入圆底烧瓶,需拔下玻璃塞,打开活塞2、1。
(4)见答案。
17.(1) 40 160 称量氢氧化钠固体时砝码和药品放反且放砝码的托盘少一个烧杯,量取水时仰视读数 偏小 ④①③⑤②
(2) 2.4 3.25%设与2.4g氢氧化钠反应的氯化铁的质量为x
x=3.25g
该工业盐酸中FeCl3的质量分数为=3.25%。
答:工业盐酸中FeCl3的质量分数为3.25%。
【详解】(1)①称取NaOH固体=200g×20%=40g,需要量取水=200g-40g=160g,体积=160g÷(1.0g/mL)=160mL,故填:40;160;
②称量氢氧化钠固体时应左物右码,且两边都要放一个小烧杯,操作中将砝码和药品放反且放砝码的托盘少一个烧杯,这会导致实际称量药品质量偏小,量取水时应平视凹液面最低处读数,操作中仰视读数,这会导致实际量取的水偏多,如果其他操作都正确,配制的氢氧化钠溶液溶质质量分数会偏小,配制溶液的正确顺序是计算、称量、量取、溶解、装瓶,为④①③⑤②,故填:称量氢氧化钠固体时砝码和药品放反且放砝码的托盘少一个烧杯,量取水时仰视读数;偏小;④①③⑤②;
(2)①由图可以看出和氯化铁反应的氢氧化钠溶液的质量为182g﹣170g=12g,其溶质氢氧化钠的质量为12g×20%=2.4g,故填:2.4;
②见答案。
18. 酒精 50 比较氯化钠在水和酒精中的溶解情况 同种溶质在不同的溶剂中溶解性不同 比较温度对硝酸钾在水中的溶解性的影响 温度 一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量) 溶质和溶剂的种类和质量 增加 减少
【详解】(1)消毒酒精是医疗上常用的一种溶液,其溶质是酒精,溶剂是水;
(2)若使溶液的溶质质量分数增大一倍,设应蒸发掉水的质量为x,则有100g×10%=(100g-x)×20%,x=50g;
(3)
①根据图示可知实验一的目的是比较氯化钠在水和酒精中的溶解情况;
氯化钠溶于水,几乎不溶于酒精,对比得出的实验结论是同种溶质在不同的溶剂中溶解性不同。
②根据图示可知,硝酸钾和水定量条件下,温度从20℃硝酸钾固体未完全溶解到加热完全溶解再到降温20℃硝酸钾固体未完全溶解,可知实验二的目的是比较温度对硝酸钾在水中的溶解性的影响;
由上分析可知在实验中需要改变的因素是温度,需要保持不变的因素是一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量);
根据实验现象可知在溶质和溶剂的种类和质量保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会增加,降低温度时,其最大溶解量会减少。
同课章节目录
