2.1 共价键 课后练习(含解析) 2023-2024学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.1 共价键 课后练习(含解析) 2023-2024学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 638.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-18 09:40:20 | ||
图片预览



文档简介
2.1 共价键 课后练习
一、单选题
1.下列分子中所有原子都满足最外层8电子结构的是( )
A. B. C. D.
2.下列各组物质中所含化学键类型完全相同的是( )
A.NaF、 B.NaOH、NaClO
C.CaO、 D.、
3.下列说法正确的是
A.原子光谱是由基态原子吸收能量到激发态时,电子跃迁产生的
B.与中,键角大于键角
C.某元素基态原子的最外层电子排布式为,则该元素为ⅡA族元素
D.因为分子间有氢键,所以的稳定性比强
4.下列各组物质中,化学键类型完全相同的是( )
A.HI和NaI B.H2S和CO2 C.NaCl和CCl4 D.Na2O和NaOH
5.下列物质中,既含离子键又含共价键的是( )
A.NaCl B.CO2 C.NaOH D.Ne
6.科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图(Y和Y之间重复单元的W、X未全部标出)。W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。下列说法正确的是( )
A.简单气态氢化物的热稳定性:X>Y
B.第一电离能:I1(X)>I1(Y)>I1(Z)
C.该化合物中W、X、Y都满足8电子稳定结构
D.W、Y、Z三种元素组成的化合物中含有离子键和共价键
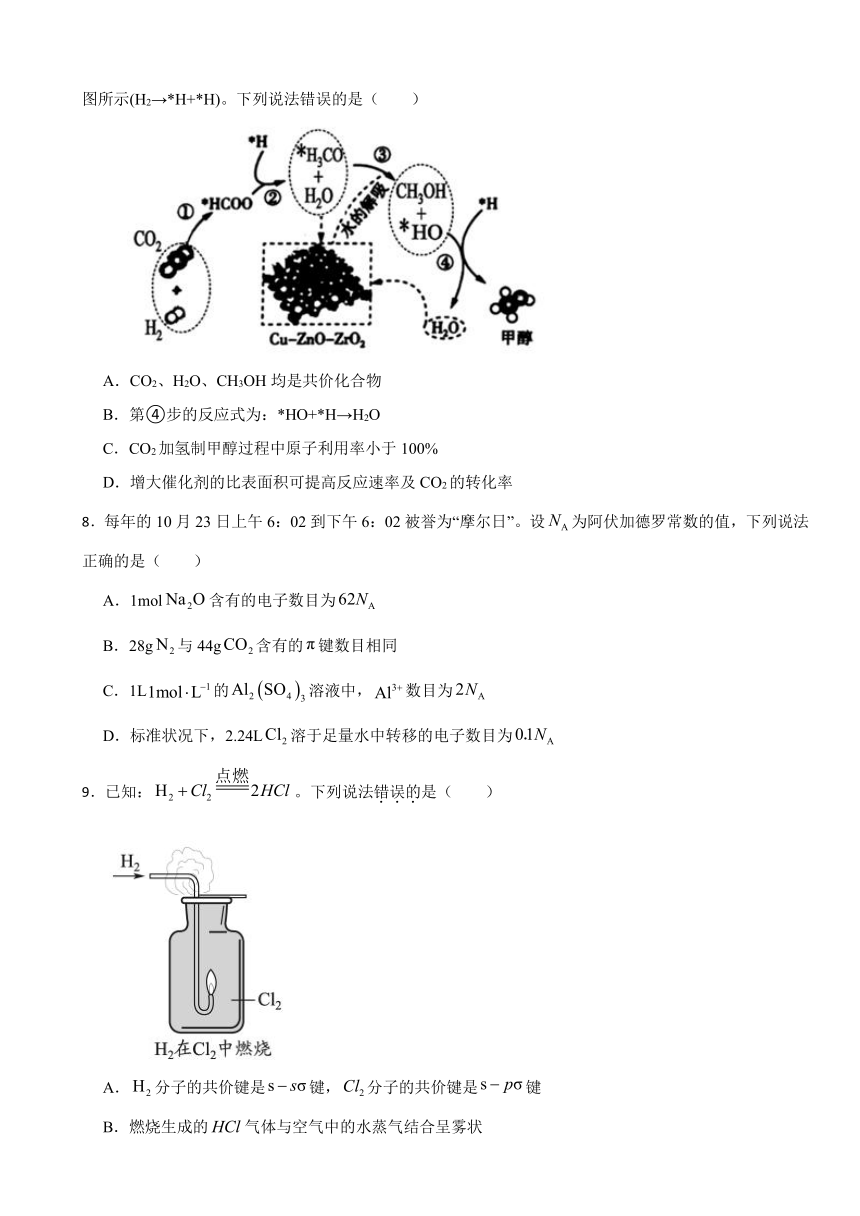
7.我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H)。下列说法错误的是( )
A.CO2、H2O、CH3OH均是共价化合物
B.第④步的反应式为:*HO+*H→H2O
C.CO2加氢制甲醇过程中原子利用率小于100%
D.增大催化剂的比表面积可提高反应速率及CO2的转化率
8.每年的10月23日上午6:02到下午6:02被誉为“摩尔日”。设为阿伏加德罗常数的值,下列说法正确的是( )
A.1mol含有的电子数目为
B.28g与44g含有的键数目相同
C.1L的溶液中,数目为
D.标准状况下,2.24L溶于足量水中转移的电子数目为
9.已知:。下列说法错误的是( )
A.分子的共价键是键,分子的共价键是键
B.燃烧生成的气体与空气中的水蒸气结合呈雾状
C.停止反应后,用蘸有浓氨水的玻璃棒靠近集气瓶口产生白烟
D.可通过原电池将与反应的化学能转化为电能
10.短周期主族元素W、X、Y、Z的原子序数依次增大,其中只有一种金属元素,四种元素形成的一种化合物可作软水剂和缓冲剂(结构如图)。下列说法正确的是( )
A.简单离子半径: X< Y
B.简单氢化物的稳定性: Z>X
C.X与Z形成的化合物不能用作食品干燥剂
D.W分别与Y、Z形成的化合物中所含化学键类型相同
11.目前,科学家发现在负压和超低温条件下,可将水形成像棉花糖一样的气溶胶的冰,该冰称为“气态冰”。下列说法不正确的是( )
A.该冰具有丁达尔效应
B.该条件下18 g“气态冰”的体积等于22.4 L
C.“气态冰”分子中存在极性共价键
D.“气态冰”与普通冰化学性质相同
12.如图表示(g)和(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
A.中的化学键属于离子键
B.1mol (g)和1mol (g)具有的总能量小于2mol NO(g)具有的总能量
C.通常情况下,(g)和(g)混合能直接生成NO
D.当高温的汽车尾气通过净化装置时,其中的催化剂可以将氧化成
13.我国科学家研制的催化剂能实现氨硼烷高效制备氢气,制氢原理:。下列说法正确的是( )
A.第一电离能:
B.键角:
C.价电子有10种空间运动状态
D.基态原子的s和p能级电子数之比为7:6
14.下列物质性质的变化规律,与共价键的键能大小有关的是( )
①F2、Cl2、Br2、I2的熔、沸点逐渐升高
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅
④NaF、NaCl、NaBr、NaI的熔点依次降低
A.①④ B.②③ C.③④ D.①③
15.2022年3月,中科院首创二氧化碳加氢制汽油技术在山东正式投产。转化过程示意图如下:
下列说法错误的是( )
A.反应①既存在键的断裂又存在键的断裂
B.反应②既存在键的形成又存在键的形成
C.有机物a是新戊烷,除a之外,戊烷还有两种同分异构体
D. 和 互为同分异构体
16.下列物质为含有共价键的盐是( )
A. B. C. D.NaClO
17.短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。下列说法正确的是( )
A.元素B所形成的氧化物不止一种
B.元素C的最高价氧化物对应的水化物为强碱
C.元素B与C形成的化合物既含有离子键又含有共价键
D.氢化物的沸点:A>B
18.既有离子键,又有共价键的化合物是( )
A.Na2SO4 B.KCl C.HCl D.O2
19.位于前三周期的四种主族元素W、X、Y、Z的原子序数依次增大、且总和为25。由这四种元素组成的某化合物的结构如图所示。下列有关叙述错误的是( )
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质与水反应不如与乙醇反应剧烈
C.常温下,Y的最高价氧化物对应的水化物可溶解铜
D.X的氟化物XF4中原子均为8电子稳定结构
20.下列物质的分子中,没有π键的是( )
A.CO2 B.N2
C.CH≡CH D.HClO
二、综合题
21.CH4、CH3OH是重要的含碳燃料,将CH4设计成零碳排放的燃料电池,原理如图。CH4在电池中除电极反应外还发生的如下重整反应,其反应速率远大于电极反应速率。
①CH4(g)+ H2O(g)→CO(g) + 3H2(g) ΔH1= + 206.2 kJ/mol
②CH4(g) + CO2(g)→2CO(g) + 2H2(g) ΔH2= + 247.3 kJ/mol
(1)负极反应式为CH4- 8e-+ 4O2- =CO2+ 2H2O、 、 。
(2)可循环使用的含碳物质有 (写化学式)。
(3)CO与H2O(g)反应可制得H2,同时产生一种温室效应气体,其热化学方程式为 。
(4)甲醇制氢的反应历程如图所示(*表示该物种吸附在固体催化剂表面),决定该过程总反应速率的步骤是 (填标号)。
a.碳氢键的断裂 b.氢氧键的断裂 c.碳氧键的形成
(5)在上述甲醇制氢的反应历程中,如果OH*参与CH3OH*→CH3O*步骤,则该步骤的历程如图所示,
OH*起到的作用是 。
(6)关于甲醇制氢反应CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) ΔH> 0,既可以加快反应速率,又可以提高H2平衡产率的措施有____(填标号) 。
A.升高温度 B.加入催化剂
C.增大H2O(g)浓度 D.增大压强
(7)CH2O*+ * CH2O*+ H*,正反应速率v1= k1c(CH2O*)c(*),逆反应速率v2= k1c(CHO*)c(H*),若K≥105反应进行完全,已知k1=2.5×109, k-1= 8.4×103,判断正反应 (填“进行完全”或“未进行完全”)
22.
(1)如图,写出下列价键的名称,并各举一例说明含有这种价键类型的物质。
① ② ③ ④ ⑤
化学键类型
举例
(2)某有机物的结构式为 ,
则分子中有 个σ键, 个π键。
23.化学反应的过程,既有物质的转化过程,也有化学能与热能或其他能量的转化过程。
已知反应3A(g)+B(g)2C(g)+D(g)的能量变化如图所示。
(1)该反应 (填“吸收”或“释放”) (用含、的式子表示)kJ能量。
(2)断开3 mol 和1 mol 中的化学键吸收的能量 (填“>”、“<”或“=”)形成2 mol 和1 mol 中的化学键释放的能量。
(3)恒温下,在2 L恒容密闭容器中加入3 mol A、2 mol B,2 min末测得 mol·L。
①2 min末,B的物质的量浓度为 。
②下列说法正确的是 (填标号)。
A.向容器中通入少量的He(不参与反应),正反应速率减慢
B.总压强保持不变时,反应达到平衡状态
C.从容器中抽走部分D,正反应速率加快,逆反应速率减慢
(4)以反应为原理设计成燃料电池,其利用率高,装置如图所示。
①A处加入的是 ,a处的电极反应式是 。
②当消耗标准状况下3.36 L O2时,导线上转移的电子的物质的量是 mol。
24.下面是同学们熟悉的物质:
①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3 ⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,只含有共价键的是 (填序号,下同);只含有离子键的是 ;既含有共价键又含有离子键的是 ;不存在化学键的是 。
(2)属于共价化合物的是 ;属于离子化合物的是 。
(3)将NaHSO4溶于水,破坏了NaHSO4中的 ,写出其电离方程式 ;
NaHSO4在熔融状态下电离,破坏了 ,写出其电离方程式 。
25.研究化学反应的能量变化和速率变化是研究化学反应的重要角度。
(1)化学反应中能量变化的主要原因是旧的化学键断裂会 能量;新的化学键形成会 能量。(填“放出”或“吸收”)
(2)用铝热法可冶炼铁,其反应为:Fe2O3+2Al 2Fe+Al2O3,属于放热反应,反应物的总能量 (填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为 mol。
(3)为探究反应过程中的能量变化,某小组同学用如图装置进行实验。
装置Ⅰ 装置Ⅱ
①装置Ⅰ中,Fe与CuSO4溶液反应的离子方程式是 。
②装置Ⅱ中,正极的电极反应式为 。
③关于装置Ⅱ,下列叙述正确的是 (填字母)。
a.H+在Cu表面被还原,产生气泡
b.电流从Zn片经导线流向Cu片
c.电子从Zn片经导线流向Cu片
d.Zn和Cu的都是电极材料,也都参与电极反应
(4)某兴趣小组将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是_____。
A.从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的原因水蒸发,致使酸的浓度升高
C.从t2→t3的原因是随着反应的进行镁条的质量下降
D.从t2→t3的原因是随着反应的进行,H+的浓度逐渐下降
答案解析部分
1.【答案】D
【解析】【解答】A.中H为1号元素,核外只有1个电子层K层,H原子与Cl所形成的HCl中Cl最外层满足8电子的稳定结构而H原子不满足,故A错;
B.为15号元素,最外层5个电子,Cl为17号元素,最外层由7个电子,则P与5个Cl原子形成5个共用电子对,则P原子最外层为10电子不满足8电子的稳定结构,故B错;
C.中B为5号元素,最外层为3个电子,B与3个F原子所形成的3个共用电子对,则B最外层未达到8电子的稳定结构,故C错;
D.中S为16号元素,最外层6个电子,F为9号元素,最外层7个电子,1个S原子与2个F原子形成2个共用电子对,即均满足8电子稳定结构,故D符合题意;
故答案为:D。
【分析】A、H原子最外层只有2个电子;
B、P原子与Cl公共电子对后,P最外层为10电子;
C、B与3个F原子所形成的3个共用电子对后,B最外层电子数为6;
D、1个S原子与2个F原子形成2个共用电子对,即均满足8电子。
2.【答案】B
【解析】【解答】A. NaF中钠离子和氟离子之间只存在离子键、含有离子键(铵根离子和氯离子)和共价键(铵根离子中氮原子和氢原子间),所以化学键类型不同,故A不选;
B. NaOH、NaClO含有离子键(钠离子与氢氧根离子、次氯酸根离子)和共价键(氧原子和氢原子、氧原子和氯原子间),所以化学键类型相同,故B选;
C. CaO中钙离子和氧离子之间只存在离子键、含有离子键(钠离子与过氧根离子间)和共价键(过氧根离子中两个氧原子间),所以化学键类型不同,故C不选;
D. 中镁离子和氯离子之间只存在离子键、中铝原子和氯原子间只存在共价键,所以化学键类型不同,故D不选;
故答案为:B。
【分析】活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族、第IIA族和第VIA族、第VIIA族元素之间易形成离子键。
3.【答案】B
【解析】【解答】A.原子光谱包括吸收光谱和发射光谱,由基态原子吸收能量到激发态时,电子跃迁产生吸收光谱,由激发态原子释放能量到基态时,电子跃迁产生发射光谱,A不符合题意;
B.中心原子周围的价层电子对数为:3+=3,则为平面三角形,键角为120°,而中心原子周围的价层电子对数为:3+=4,则为三角锥形,键角小于109°28′,故键角大于键角,B符合题意;
C.某元素基态原子的最外层电子排布式为,可能是Ca,也可能是3d14s2、3d24s2、3d34s2、3d54s2、3d64s2、3d74s2、3d84s2、3d104s2等元素,故该元素不一定为ⅡA族元素,C不符合题意;
D.氢键不是化学键,是分子间作用力的一种,故氢键只影响物理性质,不能影响化学性质,的稳定性比强是因为中的O-H键的键能比S-H的键能大,D不符合题意;
故答案为:B。
【分析】A.原子光谱有吸收光谱和发射光谱两种,由基态原子吸收能量到激发态时,电子跃迁产生吸收光谱,由激发态原子释放能量到基态时,电子跃迁产生发射光谱;
B.孤电子对间排斥力>孤电子对和成键电子对之间的排斥力>成键电子对之间的排斥力,孤电子对越多键角越小;
C.副族元素的最外层电子排布式也可能为4s2;
D.氢键与物质的稳定性无关。
4.【答案】B
【解析】【解答】A.HI含有共价键,NaI含有离子键,化学键类型不同,故A不符合题意;
B.H2S和CO2都只含有极性共价键,故B符合题意;
C.NaCl含有离子键,CCl4含有极性键,化学键不同,故C不符合题意;
D.Na2O2含有离子键和非极性共价键,NaOH含有离子键和极性键,故D不符合题意。
故答案为:B。
【分析】A.HI只含共价键,NaI只含离子键;
B.H2S和CO2都只含有极性共价键;
C.NaCl只含离子键,CCl4只含共价键;
D.Na2O只含离子键,NaOH含有离子键和共价键。
5.【答案】C
【解析】【解答】NaCl、CO2、NaOH、Ne等几种物质中,既含离子键又含共价键的是NaOH,C符合题意,
故答案为:C。
【分析】该题考查化学键的类型;离子键:是得失电子后正负电荷的相互作用力所形成的化学键,共价键是通过形成共用电子对的形式形成的化学键,通过原子核外电子的排布(主要是通过最外层电子数判断)是得还是失,得-失离子键,得-得共价键。
6.【答案】D
【解析】【解答】结合分析可知,W为H,X为C,Y为O,Z为Na元素,
A.非金属性CB.总体上金属元素第一电离能较小,非金属元素第一电离能较大;同周期元素从左到右第一电离能有增大趋势,则I1(Y)>I1(X)>I1(Z),故B不符合题意;
C.该化合物中,W(H)最外层电子数为2不满足8电子稳定结构,故C不符合题意;
D.W、Y、Z三种元素组成的化合物为氢氧化钠,含有离子键和共价键,故D符合题意;
故答案为:D。
【分析】四种原子序数依次递增的短周期元素X、Y、Z,W、X、Z分别位于不同周期,则W为H,Y、Z分别位于第二、第三周期;Z是同周期中金属性最强的元素,则Z为Na;X形成4个共价键,位于IVA族,其原子序数小于Z(Na),则X为C元素;Y形成2个共价键,位于第二周期ⅥA族,为O元素,以此分析解答。
7.【答案】D
【解析】【解答】A.CO2、H2O、CH3OH均为只含共价键的化合物,为共价化合物,A不符合题意;
B.据图可知第④步反应中CH3OH、*HO、和*H作用得到H2O和甲醇,所以该步骤的反应式为*HO+*H→H2O,B不符合题意;
C.根据图知,二氧化碳和氢气反应生成甲醇和水,该反应中除了生成甲醇外还生成水,所以二氧化碳加氢制甲醇的过程中原子利用率不是100%,C不符合题意;
D.催化剂只改变反应活化能,不能改变平衡转化率,D符合题意;
故答案为D。
【分析】
A.由非金属原子以共价键结合形成的为共价化合物,大多数有机物均为共价化合物;
B.根据图片推测化学式,观察箭头前后反应物和生成物的种类,甲醇前后没有变化,推测参与反应的为CH3OH、*HO、和*H三种物质,以此推测反应式;
C.根据反应式是否全部反应物都生成了生成物,即没有目标产物之外的物质产生,则利用率为100%,有其他物质产生则原子利用率低于100%;
D.催化剂改变反应速率,无法控制转化率。
8.【答案】B
9.【答案】A
【解析】【解答】A.H2分子里的共价键H-H键是由两个s电子重叠形成的,称为s-s σ键,Cl2分子里的共价键Cl-Cl键是由两个p电子重叠形成的,称为p-p σ键,故A符合题意;
B.HCl极易溶于水,遇到空气中的水蒸气后形成盐酸小液滴,盐酸小液滴呈雾状,故B不符合题意;
C.浓氨水易挥发,挥发的氨气和HCl发生反应NH3+HCl=NH4Cl,生成的NH4Cl为固体小颗粒,白烟,故C不符合题意;
D.与的反应是能够自发进行的氧化还原反应,可通过原电池将与反应的化学能转化为电能,故D不符合题意;
故答案为:A。
【分析】A.Cl2分子里的共价键Cl-Cl键是由两个p电子重叠形成的,为p-p σ键;
B.HCl遇空气中的水蒸气形成盐酸小液滴;
C.氨气与盐酸反应生成氯化铵;
D.能自发进行的氧化还原反应能设计成原电池。
10.【答案】C
【解析】【解答】A.Na+和O2-电子层数均为2层,但O2-核电荷数更小,所以半径更大,A不符合题意;
B.非金属性O>P,则简单氢化物的稳定性X(O)>Z(P),B不符合题意;
C.X与Z形成的化合物为P2O5,五氧化二磷溶于于水产生大量热并生成磷酸,其受热或遇水分解放热,放出有毒的腐蚀性烟气,具有强腐蚀性,常用作气体和液体的干燥剂,所以不可用作食品干燥剂,C符合题意;
D.H和Na元素形成的化合物NaH只含离子键,H和P元素形成的化合物PH3只含共价键,D不符合题意;
故答案为:C。
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,结合该化合物的结构式可知,W可形成1个共价键,X可形成2个共价键,Z可形成5个共价键,且W、X、Z均为非金属元素,Y为金属元素。可推出W是氢元素,X是氧元素,Y是钠元素,Z是磷元素。据此分析。
11.【答案】B
【解析】【解答】A.该冰是气溶胶,具有胶体的性质,因此能够发生丁达尔效应,A不符合题意;
B.该条件下18 g“气态冰”的物质的量是1 mol,但由于物质的状态不是气态,因此不能确定其体积大小,B符合题意;
C.“气态冰”分子是H2O分子,H2O中存在H-O键是极性共价键,C不符合题意;
D.“气态冰”与普通冰分子构成都是H2O,物质的分子组成相同,因此二者的化学性质也相同,D不符合题意;
故答案为:B。
【分析】A.该“气态冰”是气溶胶,胶体具有丁达尔效应;
B. 负压和超低温条件下 气体摩尔体积不是22.4L/mol;
C.水分子中存在极性共价键;
D.由分子构成的物质,分子是保持物质化学性质的最小粒子。
12.【答案】B
【解析】【解答】A. N2中化学键属于共价键,A不符合题意 ;
B. 反应生成NO为吸热反应,1mol N2(g)和1molO2 (g)具有的总能量小于2mol NO(g)具有的总能量,B符合题意 ;
C. N2 (g)和 O2(g)混合不能直接生成NO,C不符合题意 ;
D. 反应中氮化合价降低,将还原成N2,D不符合题意 ;
故答案为:B 。
【分析】 N2中化学键属于共价键,N2 (g)和 O2(g)混合不能直接生成NO,化合价降低,是还原反应。
13.【答案】B
【解析】【解答】A.同周期元素,从左到右第一电离能呈增大趋势,氮原子的2p轨道为稳定的半充满结构,第一电离能大于相邻元素,则硼、碳、氮、氧四种元素的第一电离能由小到大的顺序为,故A不符合题意;
B.氨分子中氮原子含有1对孤电子对,中氨分子的孤电子对与硼原子形成配位键,孤电子对对成键电子对的排斥力大,所以键角:,故B符合题意;
C.空间运动状态即原子轨道,价电子排布在3d和4s能级上,3d能级有5个原子轨道,4s能级有1个原子轨道,共填充5+1=6个原子轨道,即有6种空间运动状态,故C不符合题意;
D.铝元素的原子序数为13,基态原子的电子排布式为1s22s22p63s23p1,则原子中s和p能级电子数之比为,故D不符合题意;
故答案为:B。
【分析】A、单元数第一电离能半充满,出现反常;
B、孤电子对会对成键电子排斥力增大,键角变大;
C、Ni的价电子轨道为3d和4s,d轨道5个,s轨道1个;
D、结合基态原子的电子排布式判断。
14.【答案】B
【解析】【解答】①F2、Cl2、Br2、I2属于分子晶体,影响熔沸点的因素是分子间作用力的大小,物质的相对分子质量越大,分子间作用力越强,沸点越高,与共价键无关系,①不符合题意;
②HF、HI、HBr、HCl属于分子晶体,其稳定性和非金属性强弱有关系,即和形成的共价键有关系,②符合题意;
③金刚石、晶体硅属于原子晶体,原子之间存在共价键,原子半径越小,键能越大,熔沸点越高,与分子间作用力无关,故③符合题意;
④NaF、NaCl、NaBr、NaI属于离子晶体,离子半径越大,晶格能越小,熔沸点越低,④不符合题意;
综上,②③符合题意,
故答案为:B。
【分析】本题考查晶体的熔沸点、氢化物稳定性的有关判断,答题注意晶体的类型以及影响晶体熔沸点高低的因素的判断。
15.【答案】D
【解析】【解答】A、反应①中CO2与H2反应生成CO和H2O,既存在C=O的断裂又存在H-H的断裂,故A不符合题意;
B、由图可知,反应②生成了烃类物质,则既存在键的形成又存在键的形成,故B不符合题意;
C、由反应可知,有机物a是新戊烷,其还有正戊烷、异戊烷2种同分异构体,故C不符合题意;
D、 和 分子式相同,结构相同,属于同种物质,故D符合题意;
故答案为:D。
【分析】A、反应①CO2与H2反应生成CO和H2O;
B、反应②有烃类物质生成;
C、根据a的球棍模型可知,a为新戊烷;
D、分子式相同,结构不同的化合物互为同分异构体。
16.【答案】D
【解析】【解答】A. 是氧化物,A不符合题意;
B. 为氮化物,B不符合题意;
C.CaCl2为盐,是离子化合物,C不符合题意;
D.NaClO盐,有Na+和ClO-,存在共价键,D符合题意;
故答案为:D
【分析】A. 是氧化物;
B. 为氮化物;
C.CaCl2为盐,是离子化合物;
D.NaClO盐,有Na+和ClO-,ClO-存在共价键。
17.【答案】A
【解析】【解答】A.B为N元素,其氧化物有NO、NO2等不止一种,A符合题意;
B.C为Mg元素,其最高价氧化物对应的水化物为Mg(OH)2,是一种弱碱,B不符合题意;
C.N和Mg可以形成化合物Mg3N2,为只含离子键的离子化合物,C不符合题意;
D.A为碳元素,B为氮元素,碳、氮的氢化物均有多种,所以无法确定氢化物的沸点高低,D不符合题意;
综上所答案为A。
【分析】短周期主族元素A、B、C、D、E的原子序数依次递增,E原子最外层电子数是B原子内层电子数的3倍,则B只能有2个电子层,处于第2周期,故E原子最外层电子数为6,E原子最外层电子数是C原子最外层电子数的3倍,则C原子最外层电子数为2,B、C、E原子的最外层电子数之和为13,则B原子最外层电子数为13-6-2=5,则B为氮元素;A、B两元素相邻,A原子序数小于B,则A为碳元素;结合原子序数可知,C、D、E只能处于第3周期,故E为硫元素,C为镁元素;B、D原子最外层电子数之和等于C、E原子最外层电子数之和,则D原子最外层电子数=2+6-5=3,则D为铝元素。
18.【答案】A
【解析】【解答】A. Na2SO4中SO42-与Na+之间是离子键,SO42-中S和O之间是共价键,A符合题意;
B. KCl是离子化合物,B不符合题意;
C. HCl是共价化合物,C不符合题意;
D. O2是单质,D不符合题意;
故答案为:A
【分析】A. Na2SO4既有离子键,又有共价键 ;
B. KCl是离子化合物;
C. HCl是共价化合物;
D. O2 是单质。
19.【答案】B
【解析】【解答】由上述分析可知,W为H、X为C、Y为N、Z为Na,则:
A.H、C、N均以共价键结合,故A叙述不符合题意;
B.水能电离出氢离子,乙醇不能,钠的单质与水反应比与乙醇反应剧烈,故B叙述符合题意;
C.Y的最高化合价氧化物的水化物为硝酸,其有强氧化性,能溶解金属铜,故C叙述不符合题意;
D.CF4中C和F分别是+4价和-1价,均满足8电子稳定结构,故D叙述不符合题意;
故答案为:B。
【分析】由短周期主族元素组成的化合物,Z的原子序数最大、且可形成+1价阳离子,Z为Na;X可形成4个共价键,W可形成1个共价键,Y形成3个共价键,且W、X、Y、Z的原子序数依次增大、总和为25,由阴离子结构可知W为H、X为C、Y为N,满足1+6+7+11=25,以此来解答。
20.【答案】D
【解析】【解答】分子中所有的单键都是σ键,双键中有一个σ键,一个π键,叁键中有一个σ键,两个π键。CO2的电子式为 ,碳氧双键中存在π键,A不符合题意;
B. N2的电子式为 ,氮氮三键中存在2个π键,B不符合题意;
C.CH≡CH的电子式为 ,碳碳三键中2个π键,C不符合题意;
D.HClO电子式为 ,全部是单键,不存在π键;D符合题意。
故答案为:D。
【分析】分子中含有的碳碳双键、碳碳三键中含有 π键 ,注意苯分子中含有 π键 。
21.【答案】(1)H2-2e- +O2-=H2O;CO- 2e -+O2-=CO2
(2)CO、CO2
(3)CO(g) + H2O(g)=H2(g)+ CO2(g) △H= -41.1 kJ/mol
(4)c
(5)催化剂(或加快反应速率,或降低反应活化能)
(6)A;C
(7)进行完全
【解析】【解答】(1)由题干信息可知,CH4在电池中除电极反应外还发生的如下重整反应,其反应速率远大于电极反应速率,则负极参与反应的燃料物质还有CO和H2,故负极反应式为CH4- 8e-+ 4O2- =CO2+ 2H2O、H2-2e- +O2-=H2O、CO- 2e -+O2-=CO2,故答案为:H2-2e- +O2-=H2O;CO- 2e -+O2-=CO2;
(2)由(1)分析可知,可循环使用的含碳物质有CO、CO2,故答案为:CO、CO2;
(3)已知反应①CH4(g)+ H2O(g)→CO(g) + 3H2(g) ΔH1= + 206.2 kJ/mol ②CH4(g) + CO2(g)→2CO(g) + 2H2(g) ΔH2= + 247.3 kJ/mol ,则CO与H2O(g)反应可制得H2,同时产生一种温室效应气体即CO2,该反应为:CO(g)+H2O(g)=CO2(g)+H2(g),反应①-②得目标反应,根据盖斯定律可知,ΔH=ΔH1-ΔH2= (+ 206.2 kJ/mol)-(+ 247.3 kJ/mol)=-41.1 kJ/mol,故其热化学方程式为CO(g) + H2O(g)=H2(g)+ CO2(g) △H= -41.1 kJ/mol,故答案为:CO(g) + H2O(g)=H2(g)+ CO2(g) △H= -41.1 kJ/mol;
(4)反应步骤中活化能越大,反应速率越慢,最慢的一步为决速步骤,由题干反应历程图中可知,碳氧键的断裂过程的活化能最大,为决速步骤,故答案为:c;
(5)由题干图示信息可知,加入OH*后该步骤的活化能大大减小,能加快反应速率,即OH*起到的作用是催化剂(或加快反应速率,或降低反应活化能),故答案为:催化剂(或加快反应速率,或降低反应活化能);
(6)A. 升高温度反应速率加快,该反应正反应是一个吸热反应,则升高温度平衡正向移动,H2的平衡产率增大,A正确;
B. 加入催化剂反应速率加快,但平衡不移动,H2的平衡产率不变,B不合题意;
C. 增大H2O(g)浓度反应速率增大,增大反应物浓度,平衡正向移动,H2的平衡产率增大,C正确;
D. 增大压强即缩小体积,反应物、生成物浓度增大,反应速率加快,该反应正反应是一个气体体积增大的方向,故增大压强平衡逆向移动,H2的平衡产率减小,D不合题意;
故答案为:AC;
(7)CH2O*+ * CH2O*+ H*,正反应速率v1= k1c(CH2O*)c(*),逆反应速率v2= k-1c(CHO*)c(H*),若K≥105反应进行完全,已知k1=2.5×109, k-1= 8.4×103,达到平衡的本质特征为:正反应速率等于逆反应速率即v1= v2即k1c(CH2O*)c(*)= k-1c(CHO*)c(H*)则有=K==2.98×105>105 ,故判断正反应进行完全,故答案为:进行完全。
【分析】(1)氢气失去电子化合价升高,结合氧负离子形成水,一氧化碳失去电子,化合价升高,结合氧负离子形成二氧化碳;
(2)结合题干以及上题,可知一氧化碳和二氧化碳可以重复利用形成循环;
(3)一氧化碳和水发生氧化还原反应,生成氢气,氢元素化合价降低,则碳元素化合价升高,生成二氧化碳;
(4)决速步骤,即活化能最大的步骤,根据图示可知碳氧键的形成活化能最大;
(5)根据图示可知 OH* 降低了反应活化能,因此为催化剂;
(6)提高氢气产量,即平衡朝正向移动。
22.【答案】(1)s-s σ键;s-p σ键;p-p σ键;pz-pz π键;py-pyπ键;H2;HCl;Cl2;N2;N2
(2)7;3
【解析】【解答】(1)①是s轨道-s轨道,形成的是 σ键 ,举例是H2,②是s轨道-p轨道,形成的是 σ键 ,举例是HCl,③p轨道和p轨道形成的是 σ键,举例是Cl2,④pz轨道-pz轨道形成的是Π键,举例是N2,⑤py轨道-py轨道形成的是Π键,举例是N2
(2)分子中5个共价单键是σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,故该有机物分子中σ键总数是7,π键总数是3。
【分析】(1)根据一般情况下s-s,s-p,px-px,形成的是 σ键 ,而py-py,pz-pz形成的是Π键(2)根据结构简式找出含有单键和双键以及三键即可,单键含有的是的σ键 和双键含有1个σ键 和一个Π键,三键还哪有1个σ键 和2个Π键
23.【答案】(1)吸收;
(2)>
(3)0.75 mol·L;B
(4);;0.6
【解析】【解答】 (1)反应物的总能量低于生成物的总能量,反应需要吸收 能量;
(2)断开3 mol 和1 mol 中的化学键吸收的能量为E1kJ, 形成2 mol 和1 mol 中的化学键释放的能量为E2kJ,E1>E2;
(3)①2 min末,B物质的量浓度为0.75mol/L;
②A.通入少量He,浓度不变,正反应速率不变,A不符合题意;
B.反应前后气体体积会变,总压强会改变,当容器总压强保持不变时,达平衡状态,B符合题意;
C.从容器中抽走部分D,减小浓度,正反应速率会逐渐减慢,C不符合题意;
(4)①a为负极,加入是N2H4,发生氧化反应,电极反应式 ;
②当消耗标准状况下3.36 LO2物质的量为0.15mol,电极反应式:O2+2H2O+4e-=4OH-,转移电子的物质的量是0.15×4=0.6mol;
【分析】(1)反应物的总能量低于生成物的总能量,是吸收反应 ;
(2) 键能大小的比较;
(3)①物质的量浓度的计算;
②A.通入少量He,浓度不变,正反应速率不变;
B.反应前后气体体积会变,当容器总压强保持不变时,达平衡状态;
C.减小浓度,正反应速率会逐渐减慢;
(4)①负极发生氧化反应,电极反应式的书写 ;
②转移电子物质的量的计算。
24.【答案】(1))①②④;③;⑤⑥⑦⑨⑩;⑧
(2)④;③⑤⑥⑦⑨⑩
(3)离子键和共价键;NaHSO4=Na++H++SO42-;离子键;NaHSO4=Na++HSO4-
【解析】【解答】 O2、金刚石中只含有共价键;H2SO4只含有共价键,是共价化合物;NaBr中只含有离子键,是离子化合物;Na2CO3、NH4Cl、NaHSO4、Na2O2、NaOH中都是既含有离子键又含有共价键的离子化合物;稀有气体Ne是单原子分子,不含任何化学键。NaHSO4溶于水电离时,Na+与HSO4-之间的离子键被破坏,HSO4-中H+与SO42-之间的共价键也被破坏;而在熔融状态电离时只破坏离子键。
【分析】离子键通过电子转移生成阴离子,阳离子,阴阳离子之间存在静电引力形成的化学键,一般存在于金属与非金属组成的化合物中;共价键是原子间共用电子对所形成的相互作用,一般存在于非金属单质间;含有离子键的化合物为离子化合物;仅含有共价键的化合物为共价化合物。
25.【答案】(1)吸收;放出
(2)>;1
(3)Fe+Cu2+=Cu+Fe2+;2H++2e-= H2;ac
(4)A;D
【解析】【解答】(1)化学反应中能量变化的主要原因是旧的化学键断裂会吸收能量;新的化学键形成会放出能量,故答案为:吸收;放出;(2)铝热反应是放热反应,反应物的总能量大于生成物的总能量,由方程式Fe2O3+2Al 2Fe+Al2O3可知,若消耗了1molAl,则理论上可炼制Fe的物质的量为1mol,故答案为:>;1;(3)①实验Ⅰ中,Fe与CuSO4溶液发生原电池反应,Fe失去电子,铜离子得到电子,则Fe与CuSO4溶液反应的离子方程式是Fe+Cu2+=Cu+Fe2+,故答案为:Fe+Cu2+=Cu+Fe2+;
②装置Ⅱ中,正极为Cu,氢离子在正极得到电子,电极反应式为:2H++2e-= H2 ,故答案为:2H++2e-= H2 ;③a.铜为正极,H+在铜表面得到电子生成氢气,H+被还原,故a正确;
b.电流从正极流向负极,应该从Cu片经导线流向Zn片,故b不正确;
c.电子从负极沿导线流向正极,即从Zn片经导线流向Cu片,故c正确;
d.Zn和Cu的都是电极材料,但Cu不参与反应,故d不正确。
答案为:ac;(4)A.从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高,反应速率逐渐增大,故A正确;
B.反应放出的热量不至于使水蒸发,故B不正确;
C.镁条(固体)的质量下降,但是浓度不变,不会影响反应速率,故C不正确;
D.t2→t3的原因是盐酸的浓度逐渐降低,反应速率逐渐减小,此时浓度因素大于温度的影响,故D正确。
答案为:AD。
【分析】(3)实验I和实验II都是原电池,实验I的反应原理为Fe+Cu2+=Cu+Fe2+,Fe为负极,Cu为正极;实验II的反应原理为Fe+2H+=H2 +Fe2+,Zn为负极,Cu为正极;(4)镁与盐酸的反应为放热反应,开始反应时,温度不断升高,反应速率不断增大,但随着反应的进行,盐酸浓度逐渐减小,反应速率逐渐减小,以此解答。
一、单选题
1.下列分子中所有原子都满足最外层8电子结构的是( )
A. B. C. D.
2.下列各组物质中所含化学键类型完全相同的是( )
A.NaF、 B.NaOH、NaClO
C.CaO、 D.、
3.下列说法正确的是
A.原子光谱是由基态原子吸收能量到激发态时,电子跃迁产生的
B.与中,键角大于键角
C.某元素基态原子的最外层电子排布式为,则该元素为ⅡA族元素
D.因为分子间有氢键,所以的稳定性比强
4.下列各组物质中,化学键类型完全相同的是( )
A.HI和NaI B.H2S和CO2 C.NaCl和CCl4 D.Na2O和NaOH
5.下列物质中,既含离子键又含共价键的是( )
A.NaCl B.CO2 C.NaOH D.Ne
6.科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图(Y和Y之间重复单元的W、X未全部标出)。W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。下列说法正确的是( )
A.简单气态氢化物的热稳定性:X>Y
B.第一电离能:I1(X)>I1(Y)>I1(Z)
C.该化合物中W、X、Y都满足8电子稳定结构
D.W、Y、Z三种元素组成的化合物中含有离子键和共价键
7.我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H)。下列说法错误的是( )
A.CO2、H2O、CH3OH均是共价化合物
B.第④步的反应式为:*HO+*H→H2O
C.CO2加氢制甲醇过程中原子利用率小于100%
D.增大催化剂的比表面积可提高反应速率及CO2的转化率
8.每年的10月23日上午6:02到下午6:02被誉为“摩尔日”。设为阿伏加德罗常数的值,下列说法正确的是( )
A.1mol含有的电子数目为
B.28g与44g含有的键数目相同
C.1L的溶液中,数目为
D.标准状况下,2.24L溶于足量水中转移的电子数目为
9.已知:。下列说法错误的是( )
A.分子的共价键是键,分子的共价键是键
B.燃烧生成的气体与空气中的水蒸气结合呈雾状
C.停止反应后,用蘸有浓氨水的玻璃棒靠近集气瓶口产生白烟
D.可通过原电池将与反应的化学能转化为电能
10.短周期主族元素W、X、Y、Z的原子序数依次增大,其中只有一种金属元素,四种元素形成的一种化合物可作软水剂和缓冲剂(结构如图)。下列说法正确的是( )
A.简单离子半径: X< Y
B.简单氢化物的稳定性: Z>X
C.X与Z形成的化合物不能用作食品干燥剂
D.W分别与Y、Z形成的化合物中所含化学键类型相同
11.目前,科学家发现在负压和超低温条件下,可将水形成像棉花糖一样的气溶胶的冰,该冰称为“气态冰”。下列说法不正确的是( )
A.该冰具有丁达尔效应
B.该条件下18 g“气态冰”的体积等于22.4 L
C.“气态冰”分子中存在极性共价键
D.“气态冰”与普通冰化学性质相同
12.如图表示(g)和(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
A.中的化学键属于离子键
B.1mol (g)和1mol (g)具有的总能量小于2mol NO(g)具有的总能量
C.通常情况下,(g)和(g)混合能直接生成NO
D.当高温的汽车尾气通过净化装置时,其中的催化剂可以将氧化成
13.我国科学家研制的催化剂能实现氨硼烷高效制备氢气,制氢原理:。下列说法正确的是( )
A.第一电离能:
B.键角:
C.价电子有10种空间运动状态
D.基态原子的s和p能级电子数之比为7:6
14.下列物质性质的变化规律,与共价键的键能大小有关的是( )
①F2、Cl2、Br2、I2的熔、沸点逐渐升高
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅
④NaF、NaCl、NaBr、NaI的熔点依次降低
A.①④ B.②③ C.③④ D.①③
15.2022年3月,中科院首创二氧化碳加氢制汽油技术在山东正式投产。转化过程示意图如下:
下列说法错误的是( )
A.反应①既存在键的断裂又存在键的断裂
B.反应②既存在键的形成又存在键的形成
C.有机物a是新戊烷,除a之外,戊烷还有两种同分异构体
D. 和 互为同分异构体
16.下列物质为含有共价键的盐是( )
A. B. C. D.NaClO
17.短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。下列说法正确的是( )
A.元素B所形成的氧化物不止一种
B.元素C的最高价氧化物对应的水化物为强碱
C.元素B与C形成的化合物既含有离子键又含有共价键
D.氢化物的沸点:A>B
18.既有离子键,又有共价键的化合物是( )
A.Na2SO4 B.KCl C.HCl D.O2
19.位于前三周期的四种主族元素W、X、Y、Z的原子序数依次增大、且总和为25。由这四种元素组成的某化合物的结构如图所示。下列有关叙述错误的是( )
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质与水反应不如与乙醇反应剧烈
C.常温下,Y的最高价氧化物对应的水化物可溶解铜
D.X的氟化物XF4中原子均为8电子稳定结构
20.下列物质的分子中,没有π键的是( )
A.CO2 B.N2
C.CH≡CH D.HClO
二、综合题
21.CH4、CH3OH是重要的含碳燃料,将CH4设计成零碳排放的燃料电池,原理如图。CH4在电池中除电极反应外还发生的如下重整反应,其反应速率远大于电极反应速率。
①CH4(g)+ H2O(g)→CO(g) + 3H2(g) ΔH1= + 206.2 kJ/mol
②CH4(g) + CO2(g)→2CO(g) + 2H2(g) ΔH2= + 247.3 kJ/mol
(1)负极反应式为CH4- 8e-+ 4O2- =CO2+ 2H2O、 、 。
(2)可循环使用的含碳物质有 (写化学式)。
(3)CO与H2O(g)反应可制得H2,同时产生一种温室效应气体,其热化学方程式为 。
(4)甲醇制氢的反应历程如图所示(*表示该物种吸附在固体催化剂表面),决定该过程总反应速率的步骤是 (填标号)。
a.碳氢键的断裂 b.氢氧键的断裂 c.碳氧键的形成
(5)在上述甲醇制氢的反应历程中,如果OH*参与CH3OH*→CH3O*步骤,则该步骤的历程如图所示,
OH*起到的作用是 。
(6)关于甲醇制氢反应CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) ΔH> 0,既可以加快反应速率,又可以提高H2平衡产率的措施有____(填标号) 。
A.升高温度 B.加入催化剂
C.增大H2O(g)浓度 D.增大压强
(7)CH2O*+ * CH2O*+ H*,正反应速率v1= k1c(CH2O*)c(*),逆反应速率v2= k1c(CHO*)c(H*),若K≥105反应进行完全,已知k1=2.5×109, k-1= 8.4×103,判断正反应 (填“进行完全”或“未进行完全”)
22.
(1)如图,写出下列价键的名称,并各举一例说明含有这种价键类型的物质。
① ② ③ ④ ⑤
化学键类型
举例
(2)某有机物的结构式为 ,
则分子中有 个σ键, 个π键。
23.化学反应的过程,既有物质的转化过程,也有化学能与热能或其他能量的转化过程。
已知反应3A(g)+B(g)2C(g)+D(g)的能量变化如图所示。
(1)该反应 (填“吸收”或“释放”) (用含、的式子表示)kJ能量。
(2)断开3 mol 和1 mol 中的化学键吸收的能量 (填“>”、“<”或“=”)形成2 mol 和1 mol 中的化学键释放的能量。
(3)恒温下,在2 L恒容密闭容器中加入3 mol A、2 mol B,2 min末测得 mol·L。
①2 min末,B的物质的量浓度为 。
②下列说法正确的是 (填标号)。
A.向容器中通入少量的He(不参与反应),正反应速率减慢
B.总压强保持不变时,反应达到平衡状态
C.从容器中抽走部分D,正反应速率加快,逆反应速率减慢
(4)以反应为原理设计成燃料电池,其利用率高,装置如图所示。
①A处加入的是 ,a处的电极反应式是 。
②当消耗标准状况下3.36 L O2时,导线上转移的电子的物质的量是 mol。
24.下面是同学们熟悉的物质:
①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3 ⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,只含有共价键的是 (填序号,下同);只含有离子键的是 ;既含有共价键又含有离子键的是 ;不存在化学键的是 。
(2)属于共价化合物的是 ;属于离子化合物的是 。
(3)将NaHSO4溶于水,破坏了NaHSO4中的 ,写出其电离方程式 ;
NaHSO4在熔融状态下电离,破坏了 ,写出其电离方程式 。
25.研究化学反应的能量变化和速率变化是研究化学反应的重要角度。
(1)化学反应中能量变化的主要原因是旧的化学键断裂会 能量;新的化学键形成会 能量。(填“放出”或“吸收”)
(2)用铝热法可冶炼铁,其反应为:Fe2O3+2Al 2Fe+Al2O3,属于放热反应,反应物的总能量 (填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为 mol。
(3)为探究反应过程中的能量变化,某小组同学用如图装置进行实验。
装置Ⅰ 装置Ⅱ
①装置Ⅰ中,Fe与CuSO4溶液反应的离子方程式是 。
②装置Ⅱ中,正极的电极反应式为 。
③关于装置Ⅱ,下列叙述正确的是 (填字母)。
a.H+在Cu表面被还原,产生气泡
b.电流从Zn片经导线流向Cu片
c.电子从Zn片经导线流向Cu片
d.Zn和Cu的都是电极材料,也都参与电极反应
(4)某兴趣小组将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是_____。
A.从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的原因水蒸发,致使酸的浓度升高
C.从t2→t3的原因是随着反应的进行镁条的质量下降
D.从t2→t3的原因是随着反应的进行,H+的浓度逐渐下降
答案解析部分
1.【答案】D
【解析】【解答】A.中H为1号元素,核外只有1个电子层K层,H原子与Cl所形成的HCl中Cl最外层满足8电子的稳定结构而H原子不满足,故A错;
B.为15号元素,最外层5个电子,Cl为17号元素,最外层由7个电子,则P与5个Cl原子形成5个共用电子对,则P原子最外层为10电子不满足8电子的稳定结构,故B错;
C.中B为5号元素,最外层为3个电子,B与3个F原子所形成的3个共用电子对,则B最外层未达到8电子的稳定结构,故C错;
D.中S为16号元素,最外层6个电子,F为9号元素,最外层7个电子,1个S原子与2个F原子形成2个共用电子对,即均满足8电子稳定结构,故D符合题意;
故答案为:D。
【分析】A、H原子最外层只有2个电子;
B、P原子与Cl公共电子对后,P最外层为10电子;
C、B与3个F原子所形成的3个共用电子对后,B最外层电子数为6;
D、1个S原子与2个F原子形成2个共用电子对,即均满足8电子。
2.【答案】B
【解析】【解答】A. NaF中钠离子和氟离子之间只存在离子键、含有离子键(铵根离子和氯离子)和共价键(铵根离子中氮原子和氢原子间),所以化学键类型不同,故A不选;
B. NaOH、NaClO含有离子键(钠离子与氢氧根离子、次氯酸根离子)和共价键(氧原子和氢原子、氧原子和氯原子间),所以化学键类型相同,故B选;
C. CaO中钙离子和氧离子之间只存在离子键、含有离子键(钠离子与过氧根离子间)和共价键(过氧根离子中两个氧原子间),所以化学键类型不同,故C不选;
D. 中镁离子和氯离子之间只存在离子键、中铝原子和氯原子间只存在共价键,所以化学键类型不同,故D不选;
故答案为:B。
【分析】活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族、第IIA族和第VIA族、第VIIA族元素之间易形成离子键。
3.【答案】B
【解析】【解答】A.原子光谱包括吸收光谱和发射光谱,由基态原子吸收能量到激发态时,电子跃迁产生吸收光谱,由激发态原子释放能量到基态时,电子跃迁产生发射光谱,A不符合题意;
B.中心原子周围的价层电子对数为:3+=3,则为平面三角形,键角为120°,而中心原子周围的价层电子对数为:3+=4,则为三角锥形,键角小于109°28′,故键角大于键角,B符合题意;
C.某元素基态原子的最外层电子排布式为,可能是Ca,也可能是3d14s2、3d24s2、3d34s2、3d54s2、3d64s2、3d74s2、3d84s2、3d104s2等元素,故该元素不一定为ⅡA族元素,C不符合题意;
D.氢键不是化学键,是分子间作用力的一种,故氢键只影响物理性质,不能影响化学性质,的稳定性比强是因为中的O-H键的键能比S-H的键能大,D不符合题意;
故答案为:B。
【分析】A.原子光谱有吸收光谱和发射光谱两种,由基态原子吸收能量到激发态时,电子跃迁产生吸收光谱,由激发态原子释放能量到基态时,电子跃迁产生发射光谱;
B.孤电子对间排斥力>孤电子对和成键电子对之间的排斥力>成键电子对之间的排斥力,孤电子对越多键角越小;
C.副族元素的最外层电子排布式也可能为4s2;
D.氢键与物质的稳定性无关。
4.【答案】B
【解析】【解答】A.HI含有共价键,NaI含有离子键,化学键类型不同,故A不符合题意;
B.H2S和CO2都只含有极性共价键,故B符合题意;
C.NaCl含有离子键,CCl4含有极性键,化学键不同,故C不符合题意;
D.Na2O2含有离子键和非极性共价键,NaOH含有离子键和极性键,故D不符合题意。
故答案为:B。
【分析】A.HI只含共价键,NaI只含离子键;
B.H2S和CO2都只含有极性共价键;
C.NaCl只含离子键,CCl4只含共价键;
D.Na2O只含离子键,NaOH含有离子键和共价键。
5.【答案】C
【解析】【解答】NaCl、CO2、NaOH、Ne等几种物质中,既含离子键又含共价键的是NaOH,C符合题意,
故答案为:C。
【分析】该题考查化学键的类型;离子键:是得失电子后正负电荷的相互作用力所形成的化学键,共价键是通过形成共用电子对的形式形成的化学键,通过原子核外电子的排布(主要是通过最外层电子数判断)是得还是失,得-失离子键,得-得共价键。
6.【答案】D
【解析】【解答】结合分析可知,W为H,X为C,Y为O,Z为Na元素,
A.非金属性C
C.该化合物中,W(H)最外层电子数为2不满足8电子稳定结构,故C不符合题意;
D.W、Y、Z三种元素组成的化合物为氢氧化钠,含有离子键和共价键,故D符合题意;
故答案为:D。
【分析】四种原子序数依次递增的短周期元素X、Y、Z,W、X、Z分别位于不同周期,则W为H,Y、Z分别位于第二、第三周期;Z是同周期中金属性最强的元素,则Z为Na;X形成4个共价键,位于IVA族,其原子序数小于Z(Na),则X为C元素;Y形成2个共价键,位于第二周期ⅥA族,为O元素,以此分析解答。
7.【答案】D
【解析】【解答】A.CO2、H2O、CH3OH均为只含共价键的化合物,为共价化合物,A不符合题意;
B.据图可知第④步反应中CH3OH、*HO、和*H作用得到H2O和甲醇,所以该步骤的反应式为*HO+*H→H2O,B不符合题意;
C.根据图知,二氧化碳和氢气反应生成甲醇和水,该反应中除了生成甲醇外还生成水,所以二氧化碳加氢制甲醇的过程中原子利用率不是100%,C不符合题意;
D.催化剂只改变反应活化能,不能改变平衡转化率,D符合题意;
故答案为D。
【分析】
A.由非金属原子以共价键结合形成的为共价化合物,大多数有机物均为共价化合物;
B.根据图片推测化学式,观察箭头前后反应物和生成物的种类,甲醇前后没有变化,推测参与反应的为CH3OH、*HO、和*H三种物质,以此推测反应式;
C.根据反应式是否全部反应物都生成了生成物,即没有目标产物之外的物质产生,则利用率为100%,有其他物质产生则原子利用率低于100%;
D.催化剂改变反应速率,无法控制转化率。
8.【答案】B
9.【答案】A
【解析】【解答】A.H2分子里的共价键H-H键是由两个s电子重叠形成的,称为s-s σ键,Cl2分子里的共价键Cl-Cl键是由两个p电子重叠形成的,称为p-p σ键,故A符合题意;
B.HCl极易溶于水,遇到空气中的水蒸气后形成盐酸小液滴,盐酸小液滴呈雾状,故B不符合题意;
C.浓氨水易挥发,挥发的氨气和HCl发生反应NH3+HCl=NH4Cl,生成的NH4Cl为固体小颗粒,白烟,故C不符合题意;
D.与的反应是能够自发进行的氧化还原反应,可通过原电池将与反应的化学能转化为电能,故D不符合题意;
故答案为:A。
【分析】A.Cl2分子里的共价键Cl-Cl键是由两个p电子重叠形成的,为p-p σ键;
B.HCl遇空气中的水蒸气形成盐酸小液滴;
C.氨气与盐酸反应生成氯化铵;
D.能自发进行的氧化还原反应能设计成原电池。
10.【答案】C
【解析】【解答】A.Na+和O2-电子层数均为2层,但O2-核电荷数更小,所以半径更大,A不符合题意;
B.非金属性O>P,则简单氢化物的稳定性X(O)>Z(P),B不符合题意;
C.X与Z形成的化合物为P2O5,五氧化二磷溶于于水产生大量热并生成磷酸,其受热或遇水分解放热,放出有毒的腐蚀性烟气,具有强腐蚀性,常用作气体和液体的干燥剂,所以不可用作食品干燥剂,C符合题意;
D.H和Na元素形成的化合物NaH只含离子键,H和P元素形成的化合物PH3只含共价键,D不符合题意;
故答案为:C。
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,结合该化合物的结构式可知,W可形成1个共价键,X可形成2个共价键,Z可形成5个共价键,且W、X、Z均为非金属元素,Y为金属元素。可推出W是氢元素,X是氧元素,Y是钠元素,Z是磷元素。据此分析。
11.【答案】B
【解析】【解答】A.该冰是气溶胶,具有胶体的性质,因此能够发生丁达尔效应,A不符合题意;
B.该条件下18 g“气态冰”的物质的量是1 mol,但由于物质的状态不是气态,因此不能确定其体积大小,B符合题意;
C.“气态冰”分子是H2O分子,H2O中存在H-O键是极性共价键,C不符合题意;
D.“气态冰”与普通冰分子构成都是H2O,物质的分子组成相同,因此二者的化学性质也相同,D不符合题意;
故答案为:B。
【分析】A.该“气态冰”是气溶胶,胶体具有丁达尔效应;
B. 负压和超低温条件下 气体摩尔体积不是22.4L/mol;
C.水分子中存在极性共价键;
D.由分子构成的物质,分子是保持物质化学性质的最小粒子。
12.【答案】B
【解析】【解答】A. N2中化学键属于共价键,A不符合题意 ;
B. 反应生成NO为吸热反应,1mol N2(g)和1molO2 (g)具有的总能量小于2mol NO(g)具有的总能量,B符合题意 ;
C. N2 (g)和 O2(g)混合不能直接生成NO,C不符合题意 ;
D. 反应中氮化合价降低,将还原成N2,D不符合题意 ;
故答案为:B 。
【分析】 N2中化学键属于共价键,N2 (g)和 O2(g)混合不能直接生成NO,化合价降低,是还原反应。
13.【答案】B
【解析】【解答】A.同周期元素,从左到右第一电离能呈增大趋势,氮原子的2p轨道为稳定的半充满结构,第一电离能大于相邻元素,则硼、碳、氮、氧四种元素的第一电离能由小到大的顺序为,故A不符合题意;
B.氨分子中氮原子含有1对孤电子对,中氨分子的孤电子对与硼原子形成配位键,孤电子对对成键电子对的排斥力大,所以键角:,故B符合题意;
C.空间运动状态即原子轨道,价电子排布在3d和4s能级上,3d能级有5个原子轨道,4s能级有1个原子轨道,共填充5+1=6个原子轨道,即有6种空间运动状态,故C不符合题意;
D.铝元素的原子序数为13,基态原子的电子排布式为1s22s22p63s23p1,则原子中s和p能级电子数之比为,故D不符合题意;
故答案为:B。
【分析】A、单元数第一电离能半充满,出现反常;
B、孤电子对会对成键电子排斥力增大,键角变大;
C、Ni的价电子轨道为3d和4s,d轨道5个,s轨道1个;
D、结合基态原子的电子排布式判断。
14.【答案】B
【解析】【解答】①F2、Cl2、Br2、I2属于分子晶体,影响熔沸点的因素是分子间作用力的大小,物质的相对分子质量越大,分子间作用力越强,沸点越高,与共价键无关系,①不符合题意;
②HF、HI、HBr、HCl属于分子晶体,其稳定性和非金属性强弱有关系,即和形成的共价键有关系,②符合题意;
③金刚石、晶体硅属于原子晶体,原子之间存在共价键,原子半径越小,键能越大,熔沸点越高,与分子间作用力无关,故③符合题意;
④NaF、NaCl、NaBr、NaI属于离子晶体,离子半径越大,晶格能越小,熔沸点越低,④不符合题意;
综上,②③符合题意,
故答案为:B。
【分析】本题考查晶体的熔沸点、氢化物稳定性的有关判断,答题注意晶体的类型以及影响晶体熔沸点高低的因素的判断。
15.【答案】D
【解析】【解答】A、反应①中CO2与H2反应生成CO和H2O,既存在C=O的断裂又存在H-H的断裂,故A不符合题意;
B、由图可知,反应②生成了烃类物质,则既存在键的形成又存在键的形成,故B不符合题意;
C、由反应可知,有机物a是新戊烷,其还有正戊烷、异戊烷2种同分异构体,故C不符合题意;
D、 和 分子式相同,结构相同,属于同种物质,故D符合题意;
故答案为:D。
【分析】A、反应①CO2与H2反应生成CO和H2O;
B、反应②有烃类物质生成;
C、根据a的球棍模型可知,a为新戊烷;
D、分子式相同,结构不同的化合物互为同分异构体。
16.【答案】D
【解析】【解答】A. 是氧化物,A不符合题意;
B. 为氮化物,B不符合题意;
C.CaCl2为盐,是离子化合物,C不符合题意;
D.NaClO盐,有Na+和ClO-,存在共价键,D符合题意;
故答案为:D
【分析】A. 是氧化物;
B. 为氮化物;
C.CaCl2为盐,是离子化合物;
D.NaClO盐,有Na+和ClO-,ClO-存在共价键。
17.【答案】A
【解析】【解答】A.B为N元素,其氧化物有NO、NO2等不止一种,A符合题意;
B.C为Mg元素,其最高价氧化物对应的水化物为Mg(OH)2,是一种弱碱,B不符合题意;
C.N和Mg可以形成化合物Mg3N2,为只含离子键的离子化合物,C不符合题意;
D.A为碳元素,B为氮元素,碳、氮的氢化物均有多种,所以无法确定氢化物的沸点高低,D不符合题意;
综上所答案为A。
【分析】短周期主族元素A、B、C、D、E的原子序数依次递增,E原子最外层电子数是B原子内层电子数的3倍,则B只能有2个电子层,处于第2周期,故E原子最外层电子数为6,E原子最外层电子数是C原子最外层电子数的3倍,则C原子最外层电子数为2,B、C、E原子的最外层电子数之和为13,则B原子最外层电子数为13-6-2=5,则B为氮元素;A、B两元素相邻,A原子序数小于B,则A为碳元素;结合原子序数可知,C、D、E只能处于第3周期,故E为硫元素,C为镁元素;B、D原子最外层电子数之和等于C、E原子最外层电子数之和,则D原子最外层电子数=2+6-5=3,则D为铝元素。
18.【答案】A
【解析】【解答】A. Na2SO4中SO42-与Na+之间是离子键,SO42-中S和O之间是共价键,A符合题意;
B. KCl是离子化合物,B不符合题意;
C. HCl是共价化合物,C不符合题意;
D. O2是单质,D不符合题意;
故答案为:A
【分析】A. Na2SO4既有离子键,又有共价键 ;
B. KCl是离子化合物;
C. HCl是共价化合物;
D. O2 是单质。
19.【答案】B
【解析】【解答】由上述分析可知,W为H、X为C、Y为N、Z为Na,则:
A.H、C、N均以共价键结合,故A叙述不符合题意;
B.水能电离出氢离子,乙醇不能,钠的单质与水反应比与乙醇反应剧烈,故B叙述符合题意;
C.Y的最高化合价氧化物的水化物为硝酸,其有强氧化性,能溶解金属铜,故C叙述不符合题意;
D.CF4中C和F分别是+4价和-1价,均满足8电子稳定结构,故D叙述不符合题意;
故答案为:B。
【分析】由短周期主族元素组成的化合物,Z的原子序数最大、且可形成+1价阳离子,Z为Na;X可形成4个共价键,W可形成1个共价键,Y形成3个共价键,且W、X、Y、Z的原子序数依次增大、总和为25,由阴离子结构可知W为H、X为C、Y为N,满足1+6+7+11=25,以此来解答。
20.【答案】D
【解析】【解答】分子中所有的单键都是σ键,双键中有一个σ键,一个π键,叁键中有一个σ键,两个π键。CO2的电子式为 ,碳氧双键中存在π键,A不符合题意;
B. N2的电子式为 ,氮氮三键中存在2个π键,B不符合题意;
C.CH≡CH的电子式为 ,碳碳三键中2个π键,C不符合题意;
D.HClO电子式为 ,全部是单键,不存在π键;D符合题意。
故答案为:D。
【分析】分子中含有的碳碳双键、碳碳三键中含有 π键 ,注意苯分子中含有 π键 。
21.【答案】(1)H2-2e- +O2-=H2O;CO- 2e -+O2-=CO2
(2)CO、CO2
(3)CO(g) + H2O(g)=H2(g)+ CO2(g) △H= -41.1 kJ/mol
(4)c
(5)催化剂(或加快反应速率,或降低反应活化能)
(6)A;C
(7)进行完全
【解析】【解答】(1)由题干信息可知,CH4在电池中除电极反应外还发生的如下重整反应,其反应速率远大于电极反应速率,则负极参与反应的燃料物质还有CO和H2,故负极反应式为CH4- 8e-+ 4O2- =CO2+ 2H2O、H2-2e- +O2-=H2O、CO- 2e -+O2-=CO2,故答案为:H2-2e- +O2-=H2O;CO- 2e -+O2-=CO2;
(2)由(1)分析可知,可循环使用的含碳物质有CO、CO2,故答案为:CO、CO2;
(3)已知反应①CH4(g)+ H2O(g)→CO(g) + 3H2(g) ΔH1= + 206.2 kJ/mol ②CH4(g) + CO2(g)→2CO(g) + 2H2(g) ΔH2= + 247.3 kJ/mol ,则CO与H2O(g)反应可制得H2,同时产生一种温室效应气体即CO2,该反应为:CO(g)+H2O(g)=CO2(g)+H2(g),反应①-②得目标反应,根据盖斯定律可知,ΔH=ΔH1-ΔH2= (+ 206.2 kJ/mol)-(+ 247.3 kJ/mol)=-41.1 kJ/mol,故其热化学方程式为CO(g) + H2O(g)=H2(g)+ CO2(g) △H= -41.1 kJ/mol,故答案为:CO(g) + H2O(g)=H2(g)+ CO2(g) △H= -41.1 kJ/mol;
(4)反应步骤中活化能越大,反应速率越慢,最慢的一步为决速步骤,由题干反应历程图中可知,碳氧键的断裂过程的活化能最大,为决速步骤,故答案为:c;
(5)由题干图示信息可知,加入OH*后该步骤的活化能大大减小,能加快反应速率,即OH*起到的作用是催化剂(或加快反应速率,或降低反应活化能),故答案为:催化剂(或加快反应速率,或降低反应活化能);
(6)A. 升高温度反应速率加快,该反应正反应是一个吸热反应,则升高温度平衡正向移动,H2的平衡产率增大,A正确;
B. 加入催化剂反应速率加快,但平衡不移动,H2的平衡产率不变,B不合题意;
C. 增大H2O(g)浓度反应速率增大,增大反应物浓度,平衡正向移动,H2的平衡产率增大,C正确;
D. 增大压强即缩小体积,反应物、生成物浓度增大,反应速率加快,该反应正反应是一个气体体积增大的方向,故增大压强平衡逆向移动,H2的平衡产率减小,D不合题意;
故答案为:AC;
(7)CH2O*+ * CH2O*+ H*,正反应速率v1= k1c(CH2O*)c(*),逆反应速率v2= k-1c(CHO*)c(H*),若K≥105反应进行完全,已知k1=2.5×109, k-1= 8.4×103,达到平衡的本质特征为:正反应速率等于逆反应速率即v1= v2即k1c(CH2O*)c(*)= k-1c(CHO*)c(H*)则有=K==2.98×105>105 ,故判断正反应进行完全,故答案为:进行完全。
【分析】(1)氢气失去电子化合价升高,结合氧负离子形成水,一氧化碳失去电子,化合价升高,结合氧负离子形成二氧化碳;
(2)结合题干以及上题,可知一氧化碳和二氧化碳可以重复利用形成循环;
(3)一氧化碳和水发生氧化还原反应,生成氢气,氢元素化合价降低,则碳元素化合价升高,生成二氧化碳;
(4)决速步骤,即活化能最大的步骤,根据图示可知碳氧键的形成活化能最大;
(5)根据图示可知 OH* 降低了反应活化能,因此为催化剂;
(6)提高氢气产量,即平衡朝正向移动。
22.【答案】(1)s-s σ键;s-p σ键;p-p σ键;pz-pz π键;py-pyπ键;H2;HCl;Cl2;N2;N2
(2)7;3
【解析】【解答】(1)①是s轨道-s轨道,形成的是 σ键 ,举例是H2,②是s轨道-p轨道,形成的是 σ键 ,举例是HCl,③p轨道和p轨道形成的是 σ键,举例是Cl2,④pz轨道-pz轨道形成的是Π键,举例是N2,⑤py轨道-py轨道形成的是Π键,举例是N2
(2)分子中5个共价单键是σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,故该有机物分子中σ键总数是7,π键总数是3。
【分析】(1)根据一般情况下s-s,s-p,px-px,形成的是 σ键 ,而py-py,pz-pz形成的是Π键(2)根据结构简式找出含有单键和双键以及三键即可,单键含有的是的σ键 和双键含有1个σ键 和一个Π键,三键还哪有1个σ键 和2个Π键
23.【答案】(1)吸收;
(2)>
(3)0.75 mol·L;B
(4);;0.6
【解析】【解答】 (1)反应物的总能量低于生成物的总能量,反应需要吸收 能量;
(2)断开3 mol 和1 mol 中的化学键吸收的能量为E1kJ, 形成2 mol 和1 mol 中的化学键释放的能量为E2kJ,E1>E2;
(3)①2 min末,B物质的量浓度为0.75mol/L;
②A.通入少量He,浓度不变,正反应速率不变,A不符合题意;
B.反应前后气体体积会变,总压强会改变,当容器总压强保持不变时,达平衡状态,B符合题意;
C.从容器中抽走部分D,减小浓度,正反应速率会逐渐减慢,C不符合题意;
(4)①a为负极,加入是N2H4,发生氧化反应,电极反应式 ;
②当消耗标准状况下3.36 LO2物质的量为0.15mol,电极反应式:O2+2H2O+4e-=4OH-,转移电子的物质的量是0.15×4=0.6mol;
【分析】(1)反应物的总能量低于生成物的总能量,是吸收反应 ;
(2) 键能大小的比较;
(3)①物质的量浓度的计算;
②A.通入少量He,浓度不变,正反应速率不变;
B.反应前后气体体积会变,当容器总压强保持不变时,达平衡状态;
C.减小浓度,正反应速率会逐渐减慢;
(4)①负极发生氧化反应,电极反应式的书写 ;
②转移电子物质的量的计算。
24.【答案】(1))①②④;③;⑤⑥⑦⑨⑩;⑧
(2)④;③⑤⑥⑦⑨⑩
(3)离子键和共价键;NaHSO4=Na++H++SO42-;离子键;NaHSO4=Na++HSO4-
【解析】【解答】 O2、金刚石中只含有共价键;H2SO4只含有共价键,是共价化合物;NaBr中只含有离子键,是离子化合物;Na2CO3、NH4Cl、NaHSO4、Na2O2、NaOH中都是既含有离子键又含有共价键的离子化合物;稀有气体Ne是单原子分子,不含任何化学键。NaHSO4溶于水电离时,Na+与HSO4-之间的离子键被破坏,HSO4-中H+与SO42-之间的共价键也被破坏;而在熔融状态电离时只破坏离子键。
【分析】离子键通过电子转移生成阴离子,阳离子,阴阳离子之间存在静电引力形成的化学键,一般存在于金属与非金属组成的化合物中;共价键是原子间共用电子对所形成的相互作用,一般存在于非金属单质间;含有离子键的化合物为离子化合物;仅含有共价键的化合物为共价化合物。
25.【答案】(1)吸收;放出
(2)>;1
(3)Fe+Cu2+=Cu+Fe2+;2H++2e-= H2;ac
(4)A;D
【解析】【解答】(1)化学反应中能量变化的主要原因是旧的化学键断裂会吸收能量;新的化学键形成会放出能量,故答案为:吸收;放出;(2)铝热反应是放热反应,反应物的总能量大于生成物的总能量,由方程式Fe2O3+2Al 2Fe+Al2O3可知,若消耗了1molAl,则理论上可炼制Fe的物质的量为1mol,故答案为:>;1;(3)①实验Ⅰ中,Fe与CuSO4溶液发生原电池反应,Fe失去电子,铜离子得到电子,则Fe与CuSO4溶液反应的离子方程式是Fe+Cu2+=Cu+Fe2+,故答案为:Fe+Cu2+=Cu+Fe2+;
②装置Ⅱ中,正极为Cu,氢离子在正极得到电子,电极反应式为:2H++2e-= H2 ,故答案为:2H++2e-= H2 ;③a.铜为正极,H+在铜表面得到电子生成氢气,H+被还原,故a正确;
b.电流从正极流向负极,应该从Cu片经导线流向Zn片,故b不正确;
c.电子从负极沿导线流向正极,即从Zn片经导线流向Cu片,故c正确;
d.Zn和Cu的都是电极材料,但Cu不参与反应,故d不正确。
答案为:ac;(4)A.从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高,反应速率逐渐增大,故A正确;
B.反应放出的热量不至于使水蒸发,故B不正确;
C.镁条(固体)的质量下降,但是浓度不变,不会影响反应速率,故C不正确;
D.t2→t3的原因是盐酸的浓度逐渐降低,反应速率逐渐减小,此时浓度因素大于温度的影响,故D正确。
答案为:AD。
【分析】(3)实验I和实验II都是原电池,实验I的反应原理为Fe+Cu2+=Cu+Fe2+,Fe为负极,Cu为正极;实验II的反应原理为Fe+2H+=H2 +Fe2+,Zn为负极,Cu为正极;(4)镁与盐酸的反应为放热反应,开始反应时,温度不断升高,反应速率不断增大,但随着反应的进行,盐酸浓度逐渐减小,反应速率逐渐减小,以此解答。
