7.1氮的固定同步练习(含解析)2023——2024学年高中化学苏教版(2019)必修第二册
文档属性
| 名称 | 7.1氮的固定同步练习(含解析)2023——2024学年高中化学苏教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 897.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-18 18:28:00 | ||
图片预览




文档简介
7.1氮的固定同步练习
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.下列变化属于固氮的是
A.催化氧化生成 B.与反应生成
C.由制和 D.和在一定条件下反应生成
2.氨氮废水造成湖泊富营养化,某研究团队设计处理流程如下:
在硝化过程中实现转化,在反硝化过程中实现转化。下列说法正确的是
A.硝化过程中,含氮物质均发生还原反应
B.反硝化过程属于氮的固定
C.在一定条件下向废水中加入甲醇(CH3OH)可实现反硝化过程,甲醇中某元素的化合价会升高
D.HNO3完全转化成1molN2时,转移的电子数为5NA
3.下列化学用语正确的是
A.中子数为18的氯原子:
B.NaHCO3的电离方程式:NaHCO3=Na++H++
C.Al3+的结构示意图:
D.H2还原CuO反应中电子的转移:
4.工业上利用乙烯与水的加成反应来制取乙醇,发生的反应为C2H2+H2OC2H5OH,下列说法错误的是
A.C2H4的空间填充模型: B.H2O的电子式:
C.H2O和H2O2互为同素异形体 D.C2H4的结构简式:CH2=CH2
5.下列有关物质的电子式错误的是
A.H∶Cl B. C. D.
6.氮化钙是一种重要的化学试剂,通常条件下为易水解的固体。某小组在实验室利用如图所示装置制备氮化钙(夹持装置略,装置不能重复使用):
下列说法正确的是
A.上述装置最合理的连接顺序为i→gh→ab→ef→d
B.丁装置中碱石灰的作用是防止水解
C.乙装置中浓硫酸的作用是干燥
D.甲装置中还原铁粉的作用是除去中的水蒸气
7.下图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+l。下列叙述错误的是
R W X
Y Z
A.氢和R、W三种元素形成的阴离子有3种以上
B.RY2分子中每个原子的最外层均为8电子结构
C.X、Z的简单氢化物的热稳定性和还原性都是X的强
D.R、Y、Z的最高价氧化物对应水化物的酸性依次增强
8.氨是重要的化工原料,广泛用于生产铵盐、硝酸、纯碱、医药等,氮和磷都是植物生长的营养元素,氮及其化合物的转化具有重要应用,下列说法正确的是
A.栽种豆科植物作“绿肥”属于人工固氮
B.尿素[CO(NH2)2]属于含氮量较高的固态氮肥
C.NO和NO2的混合物一定可以被NaOH溶液完全吸收
D.工业上利用反应2NaCl+2NH3+CO2+11H2O=Na2CO3·10H2O↓+2NH4Cl生产纯碱
9.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是
A.离子半径的大小顺序:e>f>g>h
B.与a形成简单化合物的稳定性:b>c>d
C.a、c、d元素形成的化合物可能含有离子键
D.用电子式表示e和h形成化合物的过程:
10.下图是自然界中的氮循环过程。下列有关叙述错误的是
A.反应①、反应②及工业合成氨均属于氮的固定
B.反应④中,生成至少需要提供
C.反应③的反应方程式为
D.过程中参与循环的元素有氮元素,还有氢和氧元素
11.水解反应方程式为,下列说法错误的是
A.Cl的原子结构示意图为 B.的空间填充模型为
C.的电子式为: D.的结构式为H—Cl
12.中共中央、国务院印发《关于全面加强新时代大中小学劳动教育的意见》,明确提出“劳动教育是中国特色社会主义教育制度的重要内容,直接决定社会主义建设者和接班人的劳动精神面貌、劳动价值取向和劳动技能水平”。下列劳动项目与化学知识没有对应关系的是
选项 劳动项目 化学知识
A 环保行动:宣传使用聚碳酸酯制造的包装材料 聚碳酸酯在自然界可生物降解
B 学农活动:用肥料施肥 受热易分解
C 工厂生产:人工固氮 涉及氧化还原反应
D 工艺制作:用氢氟酸来刻蚀玻璃 玻璃中的能和HF反应
A.A B.B C.C D.D
13.我国科学家发明了LDH催化剂,能在常温常压下合成氨气(NH3),LDH合成氨的方法:
关于LDH方法与传统方法的说法正确的是
A.LDH方法中氧气作氧化剂 B.LDH方法中所用原料更便宜
C.传统方法中氮气作还原剂 D.LDH方法与传统方法所得产物完全一样
14.含氮元素的物质的循环转化关系如图。下列说法不正确的是
A.b、c、d三个过程的转化可能是由于与同一物质反应
B.反应h说明NO2为酸性氧化物
C.反应j可能为汽车尾气的处理过程
D.有两个反应涉及“氮的固定”
15.氮在自然界中存在十分广泛,在生物体内亦有极大作用,是组成氨基酸的基本元素之一。下列说法错误的是
A.豆科植物的根瘤菌、夏天的闪电都能进行自然固氮
B.分子的结构稳定,活泼金属着水时,用灭火
C.实验室可将浓氨水滴在生石灰上来制取氨气
D.打开下图中的止水夹,挤压胶头滴管的胶头使少量水进入烧瓶,可以引发喷泉
二、填空题
16.日本决定于2023年8月23日将福岛核电站的核污水排入大海,引起了国际上的关注和担忧。其中含有大量的放射性元素如角(),碘(),碳()等对人体能够造成一定的危害。
(1)碘()的质量数是 ,中子数是 。在生活中,我们也会摄入含碘()的食品来补充人体所需的甲状腺激素,()与()互为 。
(2)从元素周期表查得氢元素的某一数值为1.008,该数值表示___________。
A.一种氢原子的质量数 B.氢元素的近似相对原子质量
C.三种氢原子的平均相对原子质量 D.氢元素的相对原子质量
(3)碳()由于其半衰期长达5730年,在考古发现中起到了一定的作用,请画出其电子式 。
(4)前20号元素中,有A,B,C,D四种元素,它们的质子数依次增大,C的原子序数是另外三种元素的K层电子数之和的两倍。A的负离子和B的正离子电子层数相同,A和D的原子的最外层电子数相同,D需要得一个电子才能达到稳定结构。请依次写出A.C原子,D离子的结构示意图 , , 。
17.卤素单质及化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)日前,日本悍然将含有、等多种放射性核素的核污染水排入大海,对海洋生态造成极大危害。
①与互称为 ,原子中含有中子数为 。
②常用作食盐中的补碘剂,其化学名称是 。
(2)①液溴极易挥发,实验室保存时为防止其挥发,通常会加入 液封(填字母)。
a.水 b.煤油 c.
②海水提取溴时,常利用热空气将溴吹入溶液,已知反应生成了两种盐,其中一种为。写出与反应的离子方程式: 。
(3)是现今最常用的自来水消毒剂,可利用反应制备,该反应中氧化剂与还原剂的物质的量之比为 ,每生成转移的电子数为 。
(4)①氟气具有极强的氧化性,可与所有金属反应,但在室温下与铁、铜等块状金属反应却并不明显,可能的原因是 。
②-40℃时,与冰反应生成HFO和HF,HFO的电子式是 ,请写出HFO与水发生反应生成两种化合物的化学方程式 。
三、解答题
18.下表是元素周期表的一部分,表中所列的每个序号分别代表某一元素。
(1)元素②在周期表中的位置为 ;②的一种核素常用于文物考古,该核素的符号为 (以形式表示)。
(2)元素①与④可以形成离子化合物,请用电子式表示其形成过程 。
(3)元素③、④、⑤简单离子半径由小到大的顺序是 (填离子符号)。
(4)手机、电脑、电视屏幕使用的都是含铟(In)的导电玻璃。已知In元素与元素⑤同主族,下列关于In的说法中正确的是__________。
A.最外层有5个电子 B.最高价氧化物对应的水化物碱性比⑤强
C.失电子能力比⑤弱 D.可与稀硫酸反应产生氢气
(5)①与③组成18电子物质中含有的化学键类型有 。
A.离子键 B.极性共价键 C.非极性共价键
(6)下列有关性质的比较,不能用元素周期律解释的是__________(填标号)。
A.酸性: B.得电子能力:
C.热稳定性: D.热稳定性:
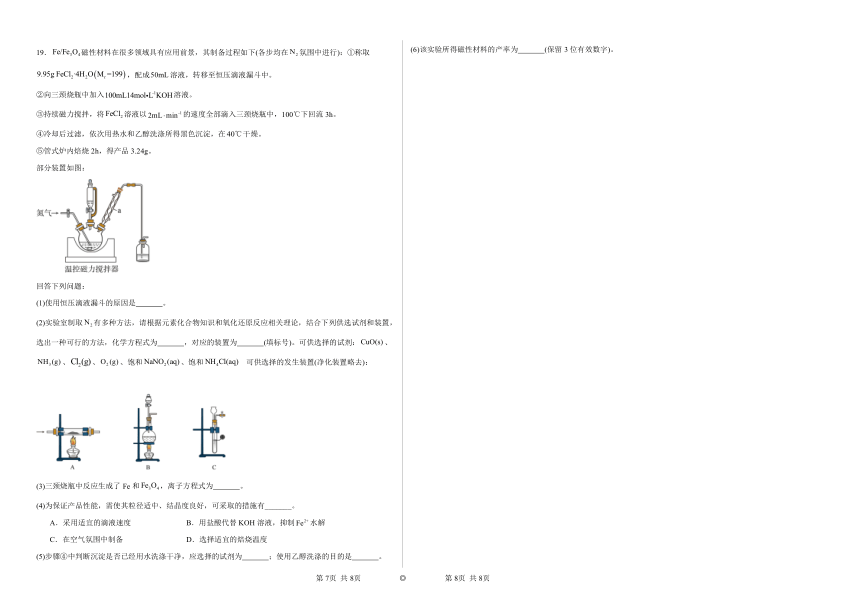
19.磁性材料在很多领域具有应用前景,其制备过程如下(各步均在氛围中进行):①称取,配成溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入溶液。
③持续磁力搅拌,将溶液以的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:
回答下列问题:
(1)使用恒压滴液漏斗的原因是 。
(2)实验室制取有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和装置,选出一种可行的方法,化学方程式为 ,对应的装置为 (填标号)。可供选择的试剂:、、、、饱和、饱和 可供选择的发生装置(净化装置略去):
(3)三颈烧瓶中反应生成了Fe和,离子方程式为 。
(4)为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。
A.采用适宜的滴液速度 B.用盐酸代替KOH溶液,抑制水解
C.在空气氛围中制备 D.选择适宜的焙烧温度
(5)步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为 ;使用乙醇洗涤的目的是 。
(6)该实验所得磁性材料的产率为 (保留3位有效数字)。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】由单质N2转变为化合物,就属于氮的固定,由此可知只有D符合条件,其余选项都是由氮的化合物转变为氮的化合物,都不属于氮的固定,故选D。
2.C
【详解】A.硝化过程中实现转化,氮元素化合价不断升高,发生氧化反应,故A错误;
B.氮的固定是将游离态氮转化为化合态的氮,反硝化过程中实现转化,将氮的化合态转化为氮气,不属于氮的固定,故B错误;
C.加入甲醇(CH3OH)可实现反硝化过程,废水中氮元素化合价降低,则甲醇中某元素的化合价会升高,故C正确;
D.HNO3转化成N2时氮元素化合价降低了5,生成1molN2时得到10mol电子,转移的电子数为10NA,故D错误;
故选:C。
3.C
【详解】A.中子数为18的氯原子:,故A错误;
B.NaHCO3的电离方程式:NaHCO3=Na++H,故B错误;
C.Al3+的结构示意图:,故C正确;
D.H2还原CuO反应中应该氢气失去电子给铜,箭头指向铜,故D错误;
故选C。
4.C
【详解】A.C2H4的空间填充模型,A正确;
B.H2O的电子式:,B正确;
C.H2O和H2O2互为同素异形体,C错误;
D.C2H4的结构简式:CH2=CH2,D正确;
故选C。
5.A
【详解】A.HCl属于共价化合物,氢原子和氯原子共用1对电子,氯原子最外层符合8电子稳定结构,电子式是,故A错误;
B.NaOH是离子化合物,钠离子和氢氧根离子存在离子键,氢氧根内O与H原子共用1对电子对,电子式为,故B正确;
C.Na2S是离子化合物,钠离子和硫离子存在离子键,电子式为,故C正确;
D.Na2O2中钠离子和过氧根离子存在离子键,过氧根内O与O原子存在共价键,电子式为,故D正确;
故选A。
6.A
【分析】由实验装置图可知,装置戊用于加水排出装置中的空气;装置丁中盛有的碱石灰用于除去空气中的二氧化碳和水蒸气,防止二氧化碳和水蒸气进入装置丙中干扰实验;装置甲中盛有的还原铁粉用于除去空气中的氧气,防止二氧气进入装置丙中干扰实验;装置丙为氮气与钙共热反应制备氮化钙;装置乙中盛有的浓硫酸用于吸收空气中的水蒸气,防止水蒸气进入丙中导致氮化钙水解,则装置的连接顺序为戊→丁→甲→丙→乙,则接口的连接顺序为i→gh→ab→ef→d。
【详解】A.由分析可知,装置最合理的接口连接顺序为i→gh→ab→ef→d,故A正确;
B.由分析可知,装置丁中盛有的碱石灰用于除去空气中的二氧化碳和水蒸气,防止二氧化碳和水蒸气进入装置丙中干扰实验,故B错误;
C.由分析可知,装置乙中盛有的浓硫酸用于吸收空气中的水蒸气,防止水蒸气进入丙中导致氮化钙水解,故C错误;
D.由分析可知,装置甲中盛有的还原铁粉用于除去空气中的氧气,防止二氧气进入装置丙中干扰实验,故D错误;
故选A。
7.C
【分析】Z原子的电子层数为n,最外层电子数为2n+l,则Z为Cl,根据图示依次推出R、W、X、Y分别为C、O、F、S。
【详解】A.氢和C、O三种元素形成的阴离子有3种以上,绝大多数为有机酸酸根离子,故A正确;
B.CS2的结构类似于CO2,每个原子都达到了最外层8电子结构,故B正确;
C.F的非金属性强于Cl,HCl的还原性强于HF,故C错误;
D.C、S、Cl的非金属性依次增强,对应最高价氧化物水化物的酸性依次增强,故D正确;
故选C。
8.B
【详解】A.豆科植物等根部的根瘤菌吸收空气中的氮气转变为含氮化合物,属于自然固氮,选项A错误;
B.尿素含氮量为100%≈46.7%,属于含氮量较高的固态氮肥,选项B正确;
C.NO和NO2与氢氧化钠发生反应NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+ NaNO3+H2O,故NO过量不能被NaOH溶液吸收,选项C错误;
D.工业上利用反应NaCl(饱和)+NH3+CO2+H2O= NaHCO3↓+NH4Cl、2NaHCO3Na2CO3 + CO2↑+H2O来生产纯碱,选项D错误;
答案选B。
9.C
【分析】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,a位于第一周期,为H元素;b、c、d位于第二周期,e、f、g、h位于第三周期,结合各元素的化合价可知,b为C元素,c为N元素,d为O元素,e为Na元素,f为Al元素,g为S元素,h为Cl元素。
【详解】A. 电子层越多离子半径越大,电子层结构相同的离子,核电荷数越大离子半径越小,则离子半径:S2->Cl->Na+>Al3+,故A错误;
B. 周期表中同主族从下到上,同周期从左到右,元素的非金属性增强,最高价氧化物对应的水化物的酸性增强,元素的氢化物稳定性增强,与a形成简单化合物的稳定性:H2O >NH3 >CH4,故B错误;
C. H、N、O可以形成酸硝酸、亚硝酸,也可以形成碱一水合氨,还可以形成盐硝酸铵,故C正确;
D. 用电子式表示e和h形成化合物的过程:,故D错误;
故选C。
10.B
【详解】A.反应①、反应②及工业合成氨均是将游离态氮转化成化合态氮,均属于氮的固定,A正确;
B.反应④中,生成,N化合价升高失去8mol电子,而1mol氧气转移4mol电子,故至少需要提供,B错误;
C.反应③为NO被O2氧化生成硝酸,反应方程式为,C正确;
D.分析此过程中参与循环的元素有氮元素,还有氢和氧元素,D正确;
故选B。
11.C
【详解】A.Cl的荷电核数为17,原子结构示意图为,A正确;
B.分子为V形结构,且O原子的半径比H原子的半径大,B正确;
C.是缺电子化合物,B提供3个电子,与3个Cl分别共用1对电子,电子式应为,C错误;
D.的结构式为H—Cl,D正确;
答案选C。
12.B
【详解】A.聚碳酸酯类材料可被自然界中的微生物和酶降解成等小分子化合物,减少白色污染,A项正确;
B.用肥料施肥,利用作氮肥,与受热易分解无关,B项错误;
C.工业生产中人工固氮是指将游离态氮转化为化合态氮,涉及氧化还原反应,C项正确;
D.氢氟酸与二氧化硅反应,可用于雕刻玻璃,D项正确。
故选B。
13.B
【详解】A.由图可知,LDH方法为LDH做催化剂条件下,氮气和水反应生成氨气和氧气,反应的方程式为2N2+6H2O4NH3+3O2,反应中氧元素的化合价升高被氧化,水是反应的还原剂、氧气是氧化产物,故A错误;
B.与传统方法使用氮气与氢气作反应物制备氨气相比,LDH方法使用氮气与水作反应物, 所用原料便宜且易得,故B正确;
C.传统方法发生的反应为催化剂作用下氮气与氢气高温高压条件下发生反应生成氨气,反应的方程式为N2+3H22NH3,反应中氮元素的化合价降低被还原,氮气是反应的氧化剂,故C错误;
D.由图可知,LDH方法为LDH做催化剂条件下,氮气和水反应生成氨气和氧气,传统方法发生的反应为催化剂作用下氮气与氢气高温高压条件下发生反应生成氨气,则LDH方法产物为氨气与氧气,传统方法产物只有氨气,两者不完全一样,故D错误;
故选B。
14.B
【详解】A.b、c、d 三个过程的转化都可以与 O2 反应实现,A 正确;
B.NO2溶于水反应产生 HNO3和 NO,生成物中含有 ,在该过程中 N 元素化合价发生了变化,因此不能根据过程 h 说明 NO2为酸性氧化物,B 错误;
C.汽车尾气中含有 NO,在尾气排放时,在尾气排放管中发生反应:,实现了由 NO向 N2的转化,故过程 j 可能为汽车尾气的处理过程,C 正确;
D.氮的固定是指将氮气转化为氮的化合物的过程,反应 c、k 这两步转化都属于单质转变为化合物,D正确;
故答案选B。
15.B
【详解】A.自然固氮是自然界中把氮元素固定在化合物中的过程,豆科植物的根瘤菌、夏天的闪电都能进行自然固氮,故A正确;
B.镁和氮气会反应生成,故B错误;
C.浓氨水滴在生石灰上,会放热使氨气逸出,可以制取氨气,故C正确;
D.氨气极易溶于水,可以用来做喷泉实验,故D正确;
故选B。
16.(1) 131 78 同位素;
(2)D
(3)
(4)
【分析】C的原子序数是另外三种元素的K层电子数之和的两倍,则C的原子序数为12,则C为Mg;D的原子序数比C大,D需要得一个电子才能达到稳定结构,则D为Cl,A和D的原子的最外层电子数相同,则A为F,以此解题。
【详解】(1)碘()的质量数是131;中子数是131-53=78;与互为同位素;
(2)从元素周期表中查得氢元素的某一数值为1.008,该数值为氢元素的相对原子质量,氢元所有同位素相对原子质量与其自然界中原子个数百分数的乘积之和;
故选D;
(3)最外层有4个电子,其电子式为:;
(4)由分析可知,A.C原子,D离子的结构示意图分别为:、、。
17.(1) 同位素 76 碘酸钾
(2) a
(3) 5:1
(4) 在金属表面形成一层保护性的金属氟化物薄膜,阻止进一步反应
【详解】(1)①与是质子数相同而中子数不同的同一元素I元素的不同原子,互称为同位素;
原子中含有中子数为129-53=76;
②常用作食盐中的补碘剂,其化学名称是碘酸钾;
(2)①液溴极易挥发,密度大于水的密度,实验室保存时为防止其挥发,通常会加入水封,答案选a;
②海水提取溴时,常利用热空气将溴吹入溶液,反应生成了两种盐,其中一种为,溴元素化合价升高,为氧化还原反应,同时生成溴化钠和二氧化钠,则与反应的离子方程式为:;
(3)反应中,中氯元素由+5价降为+4价为氧化剂,HCl中氯元素由-1价升高为+4价为还原剂,HCl部分转化为KCl化合价不变起酸的作用,故该反应中氧化剂与还原剂HCl的物质的量之比为5:1,反应转移电子数为5生成6个,故每生成转移的电子数为;
(4)①氟气具有极强的氧化性,可与所有金属反应,但在室温下与铁、铜等块状金属反应却并不明显,可能的原因是在金属表面形成一层保护性的金属氟化物薄膜,阻止进一步反应;
②HFO中O分别与H、F形成一对共用电子对,其电子式是, HFO与水发生反应生成两种化合物HF和双氧水,反应的化学方程式。
18.(1) 第2周期ⅣA族
(2)
(3)、、
(4)BD
(5)BC
(6)AD
【分析】根据元素在周期表中的位置可知,①为H,②为C,③O,④Na,⑤为Al,以此解题。
【详解】(1)由分析可知,②为C,则②在周期表中的位置为第2周期ⅣA族;其中可用于文物考古;
(2)由分析可知,①为H,④Na,两者可以形成离子化合物NaH,用电子式表示其形成过程为:;
(3)由分析可知,③O,④Na,⑤为Al,对于离子当核外电子数相同时,原子序数越小,半径越大,则其简单离子半径由小到大的顺序是:、、;
(4)A.In元素与元素⑤同主族,即与Al元素都是ⅢA族元素,最外层是3个电子,故A错误;
B.同主族元素从上到下,金属性逐渐增强,对应的最高价氧化物对应的水化物碱性增强,故B正确;
C.同主族元素从上到下原子失电子能力越强,故C错误;
D.In元素比Al元素金属性强,失电子能力越强,所以可与稀硫酸反应产生氢气,故D正确;
故选BD;
(5)由分析可知,①为H,③O,两者形成的18电子物质为H2O2;其中H和O之间为极性共价键,O和O之间为非极性共价键,故选:BC;
(6)A.氢化物的酸性与非金属性强弱没有关系,不能用元素周期律解释,故A符合;
B.元素的非金属性越强,其原子的得电子能力越强,即得电子能力,能用元素周期律解释,故B不符合;
C.非金属性越强,简单氢化物的稳定性越强,非金属性N>P,所以热稳定性,能用元素周期律解释,故C不符合;
D.碳酸钠、碳酸氢钠的热稳定性与非金属性强弱没有关系,不能用元素周期律解释,故D符合;
故选AD。
19.(1)平衡气压,便于液体顺利流下
(2) A(或B)
(3)
(4)AD
(5) 稀硝酸和硝酸银溶液 除去晶体表面水分,便于快速干燥
(6)90.0%
【分析】实验室中制备少量氮气的基本原理是用适当的氧化剂将氨或铵盐氧化,常见的可以是将氨气通入灼热的氧化铜中反应,可选择气体通入硬质玻璃管与固体在加热条件下发生反应,还可利用饱和NaNO2(aq)和饱和NH4Cl(aq)在加热下发生氧化还原反应制备氮气,可选择液体与液体加热制备气体型;
【详解】(1)恒压滴液漏斗在使用过程中可保持气压平衡,使液体顺利流下。
(2)据分析,将氨气通入灼热的氧化铜中反应可制得氮气:2NH3+3CuO3Cu+N2+3H2O;可选择气体通入硬质玻璃管与固体在加热条件下发生反应,即选择A装置。还可利用饱和NaNO2(aq)和饱和NH4Cl (aq)在加热下发生氧化还原反应制备氮气,反应的化学方程式为:NH4Cl+NaNO2NaCl+2H2O+N2↑,可选择液体与液体加热制备气体型,所以选择B装置
(3)三颈烧瓶中FeCl2溶液与100mL14mol/LKOH溶液发生反应生成了Fe和Fe3O4,根据氧化还原反应的规律可知,该反应的离子方程式为4Fe2++8OH-=Fe↓+Fe3O4↓+4H2O
(4)为保证产品性能,需使其粒径适中、结晶度良好,结晶度受反应速率与温度的影响,则:
A. 采用适宜的滴液速度,可使其粒径适中、结晶度良好,A正确;
B. 用盐酸代替KOH溶液,生成的晶体为Fe和Fe3O4,均会溶解在盐酸中,因此得不到该晶粒, B错误;
C. 在空气氛围中制备,铁、亚铁离子容易被空气氧化, C错误;
D. 选择适宜的焙烧温度,可使其粒径适中、结晶度良好,D正确;
故选AD;
(5)因为反应后溶液中有氯离子,所以在步骤④中判断沉淀是否已经用水洗涤干净,需取最后一次洗涤液,加入稀硝酸酸化后,再加入硝酸银溶液,若无白色沉淀生成,则证明已洗涤干净;故所需试剂为稀硝酸、硝酸银溶液;水与乙醇互溶、乙醇易挥发,则使用乙醇洗涤的目的是:除去晶体表面水分,便于快速干燥。
(6)9.95gFeCl2 4H2O的物质的量为,根据发生反应的离子方程式:4Fe2++8OH-=Fe↓+Fe3O4↓+4H2O,可知理论上所得的Fe和Fe3O4的物质的量各自为0.0125mol,所以得到的黑色产品质量应为0.0125mol×(56g/mol+232g/mol)=3.6g,实际得到的产品3.24g,所以其产率为=90.0%。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.下列变化属于固氮的是
A.催化氧化生成 B.与反应生成
C.由制和 D.和在一定条件下反应生成
2.氨氮废水造成湖泊富营养化,某研究团队设计处理流程如下:
在硝化过程中实现转化,在反硝化过程中实现转化。下列说法正确的是
A.硝化过程中,含氮物质均发生还原反应
B.反硝化过程属于氮的固定
C.在一定条件下向废水中加入甲醇(CH3OH)可实现反硝化过程,甲醇中某元素的化合价会升高
D.HNO3完全转化成1molN2时,转移的电子数为5NA
3.下列化学用语正确的是
A.中子数为18的氯原子:
B.NaHCO3的电离方程式:NaHCO3=Na++H++
C.Al3+的结构示意图:
D.H2还原CuO反应中电子的转移:
4.工业上利用乙烯与水的加成反应来制取乙醇,发生的反应为C2H2+H2OC2H5OH,下列说法错误的是
A.C2H4的空间填充模型: B.H2O的电子式:
C.H2O和H2O2互为同素异形体 D.C2H4的结构简式:CH2=CH2
5.下列有关物质的电子式错误的是
A.H∶Cl B. C. D.
6.氮化钙是一种重要的化学试剂,通常条件下为易水解的固体。某小组在实验室利用如图所示装置制备氮化钙(夹持装置略,装置不能重复使用):
下列说法正确的是
A.上述装置最合理的连接顺序为i→gh→ab→ef→d
B.丁装置中碱石灰的作用是防止水解
C.乙装置中浓硫酸的作用是干燥
D.甲装置中还原铁粉的作用是除去中的水蒸气
7.下图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+l。下列叙述错误的是
R W X
Y Z
A.氢和R、W三种元素形成的阴离子有3种以上
B.RY2分子中每个原子的最外层均为8电子结构
C.X、Z的简单氢化物的热稳定性和还原性都是X的强
D.R、Y、Z的最高价氧化物对应水化物的酸性依次增强
8.氨是重要的化工原料,广泛用于生产铵盐、硝酸、纯碱、医药等,氮和磷都是植物生长的营养元素,氮及其化合物的转化具有重要应用,下列说法正确的是
A.栽种豆科植物作“绿肥”属于人工固氮
B.尿素[CO(NH2)2]属于含氮量较高的固态氮肥
C.NO和NO2的混合物一定可以被NaOH溶液完全吸收
D.工业上利用反应2NaCl+2NH3+CO2+11H2O=Na2CO3·10H2O↓+2NH4Cl生产纯碱
9.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是
A.离子半径的大小顺序:e>f>g>h
B.与a形成简单化合物的稳定性:b>c>d
C.a、c、d元素形成的化合物可能含有离子键
D.用电子式表示e和h形成化合物的过程:
10.下图是自然界中的氮循环过程。下列有关叙述错误的是
A.反应①、反应②及工业合成氨均属于氮的固定
B.反应④中,生成至少需要提供
C.反应③的反应方程式为
D.过程中参与循环的元素有氮元素,还有氢和氧元素
11.水解反应方程式为,下列说法错误的是
A.Cl的原子结构示意图为 B.的空间填充模型为
C.的电子式为: D.的结构式为H—Cl
12.中共中央、国务院印发《关于全面加强新时代大中小学劳动教育的意见》,明确提出“劳动教育是中国特色社会主义教育制度的重要内容,直接决定社会主义建设者和接班人的劳动精神面貌、劳动价值取向和劳动技能水平”。下列劳动项目与化学知识没有对应关系的是
选项 劳动项目 化学知识
A 环保行动:宣传使用聚碳酸酯制造的包装材料 聚碳酸酯在自然界可生物降解
B 学农活动:用肥料施肥 受热易分解
C 工厂生产:人工固氮 涉及氧化还原反应
D 工艺制作:用氢氟酸来刻蚀玻璃 玻璃中的能和HF反应
A.A B.B C.C D.D
13.我国科学家发明了LDH催化剂,能在常温常压下合成氨气(NH3),LDH合成氨的方法:
关于LDH方法与传统方法的说法正确的是
A.LDH方法中氧气作氧化剂 B.LDH方法中所用原料更便宜
C.传统方法中氮气作还原剂 D.LDH方法与传统方法所得产物完全一样
14.含氮元素的物质的循环转化关系如图。下列说法不正确的是
A.b、c、d三个过程的转化可能是由于与同一物质反应
B.反应h说明NO2为酸性氧化物
C.反应j可能为汽车尾气的处理过程
D.有两个反应涉及“氮的固定”
15.氮在自然界中存在十分广泛,在生物体内亦有极大作用,是组成氨基酸的基本元素之一。下列说法错误的是
A.豆科植物的根瘤菌、夏天的闪电都能进行自然固氮
B.分子的结构稳定,活泼金属着水时,用灭火
C.实验室可将浓氨水滴在生石灰上来制取氨气
D.打开下图中的止水夹,挤压胶头滴管的胶头使少量水进入烧瓶,可以引发喷泉
二、填空题
16.日本决定于2023年8月23日将福岛核电站的核污水排入大海,引起了国际上的关注和担忧。其中含有大量的放射性元素如角(),碘(),碳()等对人体能够造成一定的危害。
(1)碘()的质量数是 ,中子数是 。在生活中,我们也会摄入含碘()的食品来补充人体所需的甲状腺激素,()与()互为 。
(2)从元素周期表查得氢元素的某一数值为1.008,该数值表示___________。
A.一种氢原子的质量数 B.氢元素的近似相对原子质量
C.三种氢原子的平均相对原子质量 D.氢元素的相对原子质量
(3)碳()由于其半衰期长达5730年,在考古发现中起到了一定的作用,请画出其电子式 。
(4)前20号元素中,有A,B,C,D四种元素,它们的质子数依次增大,C的原子序数是另外三种元素的K层电子数之和的两倍。A的负离子和B的正离子电子层数相同,A和D的原子的最外层电子数相同,D需要得一个电子才能达到稳定结构。请依次写出A.C原子,D离子的结构示意图 , , 。
17.卤素单质及化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)日前,日本悍然将含有、等多种放射性核素的核污染水排入大海,对海洋生态造成极大危害。
①与互称为 ,原子中含有中子数为 。
②常用作食盐中的补碘剂,其化学名称是 。
(2)①液溴极易挥发,实验室保存时为防止其挥发,通常会加入 液封(填字母)。
a.水 b.煤油 c.
②海水提取溴时,常利用热空气将溴吹入溶液,已知反应生成了两种盐,其中一种为。写出与反应的离子方程式: 。
(3)是现今最常用的自来水消毒剂,可利用反应制备,该反应中氧化剂与还原剂的物质的量之比为 ,每生成转移的电子数为 。
(4)①氟气具有极强的氧化性,可与所有金属反应,但在室温下与铁、铜等块状金属反应却并不明显,可能的原因是 。
②-40℃时,与冰反应生成HFO和HF,HFO的电子式是 ,请写出HFO与水发生反应生成两种化合物的化学方程式 。
三、解答题
18.下表是元素周期表的一部分,表中所列的每个序号分别代表某一元素。
(1)元素②在周期表中的位置为 ;②的一种核素常用于文物考古,该核素的符号为 (以形式表示)。
(2)元素①与④可以形成离子化合物,请用电子式表示其形成过程 。
(3)元素③、④、⑤简单离子半径由小到大的顺序是 (填离子符号)。
(4)手机、电脑、电视屏幕使用的都是含铟(In)的导电玻璃。已知In元素与元素⑤同主族,下列关于In的说法中正确的是__________。
A.最外层有5个电子 B.最高价氧化物对应的水化物碱性比⑤强
C.失电子能力比⑤弱 D.可与稀硫酸反应产生氢气
(5)①与③组成18电子物质中含有的化学键类型有 。
A.离子键 B.极性共价键 C.非极性共价键
(6)下列有关性质的比较,不能用元素周期律解释的是__________(填标号)。
A.酸性: B.得电子能力:
C.热稳定性: D.热稳定性:
19.磁性材料在很多领域具有应用前景,其制备过程如下(各步均在氛围中进行):①称取,配成溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入溶液。
③持续磁力搅拌,将溶液以的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:
回答下列问题:
(1)使用恒压滴液漏斗的原因是 。
(2)实验室制取有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和装置,选出一种可行的方法,化学方程式为 ,对应的装置为 (填标号)。可供选择的试剂:、、、、饱和、饱和 可供选择的发生装置(净化装置略去):
(3)三颈烧瓶中反应生成了Fe和,离子方程式为 。
(4)为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。
A.采用适宜的滴液速度 B.用盐酸代替KOH溶液,抑制水解
C.在空气氛围中制备 D.选择适宜的焙烧温度
(5)步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为 ;使用乙醇洗涤的目的是 。
(6)该实验所得磁性材料的产率为 (保留3位有效数字)。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】由单质N2转变为化合物,就属于氮的固定,由此可知只有D符合条件,其余选项都是由氮的化合物转变为氮的化合物,都不属于氮的固定,故选D。
2.C
【详解】A.硝化过程中实现转化,氮元素化合价不断升高,发生氧化反应,故A错误;
B.氮的固定是将游离态氮转化为化合态的氮,反硝化过程中实现转化,将氮的化合态转化为氮气,不属于氮的固定,故B错误;
C.加入甲醇(CH3OH)可实现反硝化过程,废水中氮元素化合价降低,则甲醇中某元素的化合价会升高,故C正确;
D.HNO3转化成N2时氮元素化合价降低了5,生成1molN2时得到10mol电子,转移的电子数为10NA,故D错误;
故选:C。
3.C
【详解】A.中子数为18的氯原子:,故A错误;
B.NaHCO3的电离方程式:NaHCO3=Na++H,故B错误;
C.Al3+的结构示意图:,故C正确;
D.H2还原CuO反应中应该氢气失去电子给铜,箭头指向铜,故D错误;
故选C。
4.C
【详解】A.C2H4的空间填充模型,A正确;
B.H2O的电子式:,B正确;
C.H2O和H2O2互为同素异形体,C错误;
D.C2H4的结构简式:CH2=CH2,D正确;
故选C。
5.A
【详解】A.HCl属于共价化合物,氢原子和氯原子共用1对电子,氯原子最外层符合8电子稳定结构,电子式是,故A错误;
B.NaOH是离子化合物,钠离子和氢氧根离子存在离子键,氢氧根内O与H原子共用1对电子对,电子式为,故B正确;
C.Na2S是离子化合物,钠离子和硫离子存在离子键,电子式为,故C正确;
D.Na2O2中钠离子和过氧根离子存在离子键,过氧根内O与O原子存在共价键,电子式为,故D正确;
故选A。
6.A
【分析】由实验装置图可知,装置戊用于加水排出装置中的空气;装置丁中盛有的碱石灰用于除去空气中的二氧化碳和水蒸气,防止二氧化碳和水蒸气进入装置丙中干扰实验;装置甲中盛有的还原铁粉用于除去空气中的氧气,防止二氧气进入装置丙中干扰实验;装置丙为氮气与钙共热反应制备氮化钙;装置乙中盛有的浓硫酸用于吸收空气中的水蒸气,防止水蒸气进入丙中导致氮化钙水解,则装置的连接顺序为戊→丁→甲→丙→乙,则接口的连接顺序为i→gh→ab→ef→d。
【详解】A.由分析可知,装置最合理的接口连接顺序为i→gh→ab→ef→d,故A正确;
B.由分析可知,装置丁中盛有的碱石灰用于除去空气中的二氧化碳和水蒸气,防止二氧化碳和水蒸气进入装置丙中干扰实验,故B错误;
C.由分析可知,装置乙中盛有的浓硫酸用于吸收空气中的水蒸气,防止水蒸气进入丙中导致氮化钙水解,故C错误;
D.由分析可知,装置甲中盛有的还原铁粉用于除去空气中的氧气,防止二氧气进入装置丙中干扰实验,故D错误;
故选A。
7.C
【分析】Z原子的电子层数为n,最外层电子数为2n+l,则Z为Cl,根据图示依次推出R、W、X、Y分别为C、O、F、S。
【详解】A.氢和C、O三种元素形成的阴离子有3种以上,绝大多数为有机酸酸根离子,故A正确;
B.CS2的结构类似于CO2,每个原子都达到了最外层8电子结构,故B正确;
C.F的非金属性强于Cl,HCl的还原性强于HF,故C错误;
D.C、S、Cl的非金属性依次增强,对应最高价氧化物水化物的酸性依次增强,故D正确;
故选C。
8.B
【详解】A.豆科植物等根部的根瘤菌吸收空气中的氮气转变为含氮化合物,属于自然固氮,选项A错误;
B.尿素含氮量为100%≈46.7%,属于含氮量较高的固态氮肥,选项B正确;
C.NO和NO2与氢氧化钠发生反应NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+ NaNO3+H2O,故NO过量不能被NaOH溶液吸收,选项C错误;
D.工业上利用反应NaCl(饱和)+NH3+CO2+H2O= NaHCO3↓+NH4Cl、2NaHCO3Na2CO3 + CO2↑+H2O来生产纯碱,选项D错误;
答案选B。
9.C
【分析】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,a位于第一周期,为H元素;b、c、d位于第二周期,e、f、g、h位于第三周期,结合各元素的化合价可知,b为C元素,c为N元素,d为O元素,e为Na元素,f为Al元素,g为S元素,h为Cl元素。
【详解】A. 电子层越多离子半径越大,电子层结构相同的离子,核电荷数越大离子半径越小,则离子半径:S2->Cl->Na+>Al3+,故A错误;
B. 周期表中同主族从下到上,同周期从左到右,元素的非金属性增强,最高价氧化物对应的水化物的酸性增强,元素的氢化物稳定性增强,与a形成简单化合物的稳定性:H2O >NH3 >CH4,故B错误;
C. H、N、O可以形成酸硝酸、亚硝酸,也可以形成碱一水合氨,还可以形成盐硝酸铵,故C正确;
D. 用电子式表示e和h形成化合物的过程:,故D错误;
故选C。
10.B
【详解】A.反应①、反应②及工业合成氨均是将游离态氮转化成化合态氮,均属于氮的固定,A正确;
B.反应④中,生成,N化合价升高失去8mol电子,而1mol氧气转移4mol电子,故至少需要提供,B错误;
C.反应③为NO被O2氧化生成硝酸,反应方程式为,C正确;
D.分析此过程中参与循环的元素有氮元素,还有氢和氧元素,D正确;
故选B。
11.C
【详解】A.Cl的荷电核数为17,原子结构示意图为,A正确;
B.分子为V形结构,且O原子的半径比H原子的半径大,B正确;
C.是缺电子化合物,B提供3个电子,与3个Cl分别共用1对电子,电子式应为,C错误;
D.的结构式为H—Cl,D正确;
答案选C。
12.B
【详解】A.聚碳酸酯类材料可被自然界中的微生物和酶降解成等小分子化合物,减少白色污染,A项正确;
B.用肥料施肥,利用作氮肥,与受热易分解无关,B项错误;
C.工业生产中人工固氮是指将游离态氮转化为化合态氮,涉及氧化还原反应,C项正确;
D.氢氟酸与二氧化硅反应,可用于雕刻玻璃,D项正确。
故选B。
13.B
【详解】A.由图可知,LDH方法为LDH做催化剂条件下,氮气和水反应生成氨气和氧气,反应的方程式为2N2+6H2O4NH3+3O2,反应中氧元素的化合价升高被氧化,水是反应的还原剂、氧气是氧化产物,故A错误;
B.与传统方法使用氮气与氢气作反应物制备氨气相比,LDH方法使用氮气与水作反应物, 所用原料便宜且易得,故B正确;
C.传统方法发生的反应为催化剂作用下氮气与氢气高温高压条件下发生反应生成氨气,反应的方程式为N2+3H22NH3,反应中氮元素的化合价降低被还原,氮气是反应的氧化剂,故C错误;
D.由图可知,LDH方法为LDH做催化剂条件下,氮气和水反应生成氨气和氧气,传统方法发生的反应为催化剂作用下氮气与氢气高温高压条件下发生反应生成氨气,则LDH方法产物为氨气与氧气,传统方法产物只有氨气,两者不完全一样,故D错误;
故选B。
14.B
【详解】A.b、c、d 三个过程的转化都可以与 O2 反应实现,A 正确;
B.NO2溶于水反应产生 HNO3和 NO,生成物中含有 ,在该过程中 N 元素化合价发生了变化,因此不能根据过程 h 说明 NO2为酸性氧化物,B 错误;
C.汽车尾气中含有 NO,在尾气排放时,在尾气排放管中发生反应:,实现了由 NO向 N2的转化,故过程 j 可能为汽车尾气的处理过程,C 正确;
D.氮的固定是指将氮气转化为氮的化合物的过程,反应 c、k 这两步转化都属于单质转变为化合物,D正确;
故答案选B。
15.B
【详解】A.自然固氮是自然界中把氮元素固定在化合物中的过程,豆科植物的根瘤菌、夏天的闪电都能进行自然固氮,故A正确;
B.镁和氮气会反应生成,故B错误;
C.浓氨水滴在生石灰上,会放热使氨气逸出,可以制取氨气,故C正确;
D.氨气极易溶于水,可以用来做喷泉实验,故D正确;
故选B。
16.(1) 131 78 同位素;
(2)D
(3)
(4)
【分析】C的原子序数是另外三种元素的K层电子数之和的两倍,则C的原子序数为12,则C为Mg;D的原子序数比C大,D需要得一个电子才能达到稳定结构,则D为Cl,A和D的原子的最外层电子数相同,则A为F,以此解题。
【详解】(1)碘()的质量数是131;中子数是131-53=78;与互为同位素;
(2)从元素周期表中查得氢元素的某一数值为1.008,该数值为氢元素的相对原子质量,氢元所有同位素相对原子质量与其自然界中原子个数百分数的乘积之和;
故选D;
(3)最外层有4个电子,其电子式为:;
(4)由分析可知,A.C原子,D离子的结构示意图分别为:、、。
17.(1) 同位素 76 碘酸钾
(2) a
(3) 5:1
(4) 在金属表面形成一层保护性的金属氟化物薄膜,阻止进一步反应
【详解】(1)①与是质子数相同而中子数不同的同一元素I元素的不同原子,互称为同位素;
原子中含有中子数为129-53=76;
②常用作食盐中的补碘剂,其化学名称是碘酸钾;
(2)①液溴极易挥发,密度大于水的密度,实验室保存时为防止其挥发,通常会加入水封,答案选a;
②海水提取溴时,常利用热空气将溴吹入溶液,反应生成了两种盐,其中一种为,溴元素化合价升高,为氧化还原反应,同时生成溴化钠和二氧化钠,则与反应的离子方程式为:;
(3)反应中,中氯元素由+5价降为+4价为氧化剂,HCl中氯元素由-1价升高为+4价为还原剂,HCl部分转化为KCl化合价不变起酸的作用,故该反应中氧化剂与还原剂HCl的物质的量之比为5:1,反应转移电子数为5生成6个,故每生成转移的电子数为;
(4)①氟气具有极强的氧化性,可与所有金属反应,但在室温下与铁、铜等块状金属反应却并不明显,可能的原因是在金属表面形成一层保护性的金属氟化物薄膜,阻止进一步反应;
②HFO中O分别与H、F形成一对共用电子对,其电子式是, HFO与水发生反应生成两种化合物HF和双氧水,反应的化学方程式。
18.(1) 第2周期ⅣA族
(2)
(3)、、
(4)BD
(5)BC
(6)AD
【分析】根据元素在周期表中的位置可知,①为H,②为C,③O,④Na,⑤为Al,以此解题。
【详解】(1)由分析可知,②为C,则②在周期表中的位置为第2周期ⅣA族;其中可用于文物考古;
(2)由分析可知,①为H,④Na,两者可以形成离子化合物NaH,用电子式表示其形成过程为:;
(3)由分析可知,③O,④Na,⑤为Al,对于离子当核外电子数相同时,原子序数越小,半径越大,则其简单离子半径由小到大的顺序是:、、;
(4)A.In元素与元素⑤同主族,即与Al元素都是ⅢA族元素,最外层是3个电子,故A错误;
B.同主族元素从上到下,金属性逐渐增强,对应的最高价氧化物对应的水化物碱性增强,故B正确;
C.同主族元素从上到下原子失电子能力越强,故C错误;
D.In元素比Al元素金属性强,失电子能力越强,所以可与稀硫酸反应产生氢气,故D正确;
故选BD;
(5)由分析可知,①为H,③O,两者形成的18电子物质为H2O2;其中H和O之间为极性共价键,O和O之间为非极性共价键,故选:BC;
(6)A.氢化物的酸性与非金属性强弱没有关系,不能用元素周期律解释,故A符合;
B.元素的非金属性越强,其原子的得电子能力越强,即得电子能力,能用元素周期律解释,故B不符合;
C.非金属性越强,简单氢化物的稳定性越强,非金属性N>P,所以热稳定性,能用元素周期律解释,故C不符合;
D.碳酸钠、碳酸氢钠的热稳定性与非金属性强弱没有关系,不能用元素周期律解释,故D符合;
故选AD。
19.(1)平衡气压,便于液体顺利流下
(2) A(或B)
(3)
(4)AD
(5) 稀硝酸和硝酸银溶液 除去晶体表面水分,便于快速干燥
(6)90.0%
【分析】实验室中制备少量氮气的基本原理是用适当的氧化剂将氨或铵盐氧化,常见的可以是将氨气通入灼热的氧化铜中反应,可选择气体通入硬质玻璃管与固体在加热条件下发生反应,还可利用饱和NaNO2(aq)和饱和NH4Cl(aq)在加热下发生氧化还原反应制备氮气,可选择液体与液体加热制备气体型;
【详解】(1)恒压滴液漏斗在使用过程中可保持气压平衡,使液体顺利流下。
(2)据分析,将氨气通入灼热的氧化铜中反应可制得氮气:2NH3+3CuO3Cu+N2+3H2O;可选择气体通入硬质玻璃管与固体在加热条件下发生反应,即选择A装置。还可利用饱和NaNO2(aq)和饱和NH4Cl (aq)在加热下发生氧化还原反应制备氮气,反应的化学方程式为:NH4Cl+NaNO2NaCl+2H2O+N2↑,可选择液体与液体加热制备气体型,所以选择B装置
(3)三颈烧瓶中FeCl2溶液与100mL14mol/LKOH溶液发生反应生成了Fe和Fe3O4,根据氧化还原反应的规律可知,该反应的离子方程式为4Fe2++8OH-=Fe↓+Fe3O4↓+4H2O
(4)为保证产品性能,需使其粒径适中、结晶度良好,结晶度受反应速率与温度的影响,则:
A. 采用适宜的滴液速度,可使其粒径适中、结晶度良好,A正确;
B. 用盐酸代替KOH溶液,生成的晶体为Fe和Fe3O4,均会溶解在盐酸中,因此得不到该晶粒, B错误;
C. 在空气氛围中制备,铁、亚铁离子容易被空气氧化, C错误;
D. 选择适宜的焙烧温度,可使其粒径适中、结晶度良好,D正确;
故选AD;
(5)因为反应后溶液中有氯离子,所以在步骤④中判断沉淀是否已经用水洗涤干净,需取最后一次洗涤液,加入稀硝酸酸化后,再加入硝酸银溶液,若无白色沉淀生成,则证明已洗涤干净;故所需试剂为稀硝酸、硝酸银溶液;水与乙醇互溶、乙醇易挥发,则使用乙醇洗涤的目的是:除去晶体表面水分,便于快速干燥。
(6)9.95gFeCl2 4H2O的物质的量为,根据发生反应的离子方程式:4Fe2++8OH-=Fe↓+Fe3O4↓+4H2O,可知理论上所得的Fe和Fe3O4的物质的量各自为0.0125mol,所以得到的黑色产品质量应为0.0125mol×(56g/mol+232g/mol)=3.6g,实际得到的产品3.24g,所以其产率为=90.0%。
答案第1页,共2页
答案第1页,共2页
