2.1原子核外电子的运动同步练习(含解析)2023——2024学年高中化学苏教版(2019)选择性必修2
文档属性
| 名称 | 2.1原子核外电子的运动同步练习(含解析)2023——2024学年高中化学苏教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-19 11:22:42 | ||
图片预览



文档简介
2.1原子核外电子的运动同步练习
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.2023年12月22日晚,随着朱令的去世,历时29年的“清华铊中毒事件”告一段落。健全品格,珍爱生命应当是每一个公民的基本素养。铊,符号为Tl,81号元素,位于元素周期表第六周期第IIIA族。下列有关说法错误的是
A.铊原子的原子结构示意图:
B.基态铊原子的价层电子排布式:
C.基态铊原子价层电子的轨道表示式
D.基态铊原子最高能层符号为P
2.下列化学用语表述错误的是
A.的电子式: B.的价层电子排布式为:
C.分子的模型: D.亚铁离子结构示意图:
3.反应可应用于铁质强化剂的制备。下列说法正确的是
A.晶体属于共价晶体 B.的电子式为
C.P原子的结构示意图为 D.基态核外电子排布式为
4.甲醛(结构如图所示)的水溶液(又称福尔马林)具有杀菌、防腐性能,可用于消毒和制作生物标本,下列说法正确的是
A.基态碳原子中,电子占据的最高能层符号为p
B.基态碳原子中,1s、2s电子的能量逐渐升高
C.氧元素位于元素周期表第二周期ⅣA族
D.基态氧原子中,1s、2s能级的轨道数依次增多
5.下列有关化学用语的表述正确的是
A.基态原子的价层电子排布式为
B.轨道表示式,不满足泡利原理
C.基态原子的电子在轨道中的表示式为
D.基态铍原子最外层电子的电子云轮廓图为
6.W、X、Y、Z为原子序数依次增大的短周期主族元素,W基态原子核外只有一个电子,X的最高能级不同轨道都有电子且自旋方向相同,Y的最外层电子数为偶数,Z的核外电子数等于X与Y的最外层电子数之和。下列说法不正确的是
A.Y单质的氧化性比X单质的强 B.基态X原子有7种不同运动状态的电子
C.Z是四种元素中原子半径最大的 D.W与Y形成的分子中原子个数比一定为2:1
7.一种高效电解质,其结构如图所示,其中W、Y、X、Z、Q均为短周期主族元素,且原子序数依次增大,X与Q同族,基态Y原子的s轨道比p轨道的电子数多1,Y和Z的原子序数之和与Q相等。下列说法正确的是
A.简单氢化物的沸点:X
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.2023年12月22日晚,随着朱令的去世,历时29年的“清华铊中毒事件”告一段落。健全品格,珍爱生命应当是每一个公民的基本素养。铊,符号为Tl,81号元素,位于元素周期表第六周期第IIIA族。下列有关说法错误的是
A.铊原子的原子结构示意图:
B.基态铊原子的价层电子排布式:
C.基态铊原子价层电子的轨道表示式
D.基态铊原子最高能层符号为P
2.下列化学用语表述错误的是
A.的电子式: B.的价层电子排布式为:
C.分子的模型: D.亚铁离子结构示意图:
3.反应可应用于铁质强化剂的制备。下列说法正确的是
A.晶体属于共价晶体 B.的电子式为
C.P原子的结构示意图为 D.基态核外电子排布式为
4.甲醛(结构如图所示)的水溶液(又称福尔马林)具有杀菌、防腐性能,可用于消毒和制作生物标本,下列说法正确的是
A.基态碳原子中,电子占据的最高能层符号为p
B.基态碳原子中,1s、2s电子的能量逐渐升高
C.氧元素位于元素周期表第二周期ⅣA族
D.基态氧原子中,1s、2s能级的轨道数依次增多
5.下列有关化学用语的表述正确的是
A.基态原子的价层电子排布式为
B.轨道表示式,不满足泡利原理
C.基态原子的电子在轨道中的表示式为
D.基态铍原子最外层电子的电子云轮廓图为
6.W、X、Y、Z为原子序数依次增大的短周期主族元素,W基态原子核外只有一个电子,X的最高能级不同轨道都有电子且自旋方向相同,Y的最外层电子数为偶数,Z的核外电子数等于X与Y的最外层电子数之和。下列说法不正确的是
A.Y单质的氧化性比X单质的强 B.基态X原子有7种不同运动状态的电子
C.Z是四种元素中原子半径最大的 D.W与Y形成的分子中原子个数比一定为2:1
7.一种高效电解质,其结构如图所示,其中W、Y、X、Z、Q均为短周期主族元素,且原子序数依次增大,X与Q同族,基态Y原子的s轨道比p轨道的电子数多1,Y和Z的原子序数之和与Q相等。下列说法正确的是
A.简单氢化物的沸点:X
C.元素第一电离能:X>Y>W D.Q的氧化物的水化物均为强酸
8.2023年诺贝尔化学奖授予对量子点的发现有突出贡献的科研工作者。量子点是指尺寸在纳米量级(通常2~20nm)的半导体晶体,其中铜铟硫(CuInS2)量子点被广泛用于光电探测、发光二极管以及光电化学电池领域。下列说法不正确的是
A.制备过程中得到的CuInS2量子点溶液能够产生丁达尔效应
B.硫离子的结构示意图:
C.已知In的原子序数为49,可推知In位于元素周期表第四周期
D.基态Cu+的价层电子排布式为3d10
9.石墨烯是由单层碳原子构成的新型材料(结构如图所示),使用石墨烯吸附催化剂,能增大催化剂的比表面积,使某些有机酸转化为酯的反应在常温常压下就能实现。下列说法正确的是
A.有机酸中的原子半径:
B.氢化物的沸点:
C.Cu属于过渡金属元素
D.石墨烯是仅由共价键形成的化合物
10.采用了氮化镓元件的充电器体积小、质量轻,在发热量、效率转换上相比普通充电器也有更大的优势,被称为“快充黑科技”,下图是氮化镓的三种晶体结构(NA表示阿伏加德罗常数的值)。下列有关说法错误的是
A.Ga、N均属于p区元素
B.图a晶体结构中含有6个Ga、6个N
C.图b晶体结构中若Ga和N的距离为xnm,则晶体的密度为
D.三种晶体结构中Ga原子的配位数之比为3∶2∶3
11.反应CaC2+2H2O=Ca(OH)2+C2H2个可用于制取乙炔。下列说法正确的是
A.C的电子式:
B.基态碳原子的价层电子轨道表示式:
C.C2H2的空间填充模型:
D.Ca(OH)2的电离方程式:Ca(OH)2Ca2++2OH-
12.在网络上流行这样一句话“遇事不决,量子力学”。量子力学的创立放在当时的整个物理学界是十分炸裂的存在,下列说法正确的是
A.基态钪原子中电子占据的最高能层符号为4s24p1
B.因为s轨道的形状是球形的,所以s电子做的是圆周运动
C.基态氧原子轨道表示式,违背了泡利原理
D.基态氧原子的核外电子有8种不同的空间运动状态
13.下列说法正确的是
A.空间结构模型 B.基态Si的价层电子排布图
C.硫酸钾的电子式 D.卤族元素电负性变化趋势
14.下列图示或化学用语表示正确的是
A.的电子式 B.基态的价层电子轨道表示式 C.的原子结构示意图 D.的轨道电子云轮廓图
A.A B.B C.C D.D
15.光敏太阳能电池是电池研发的新方向,一种钌(Ru)配合物光敏太阳能电池的工作原理及电池中发生的反应如图所示。下列说法正确的是
A.透明导电玻璃依靠Na+和的定向移动导电
B.电池工作时,光能转变为电能,因此两极不发生反应
C.电池工作结束后,无需充电,在光照条件下可再次使用
D.①RuⅡRuⅡ·(激发态)过程中,Ru内层电子被激发
二、填空题
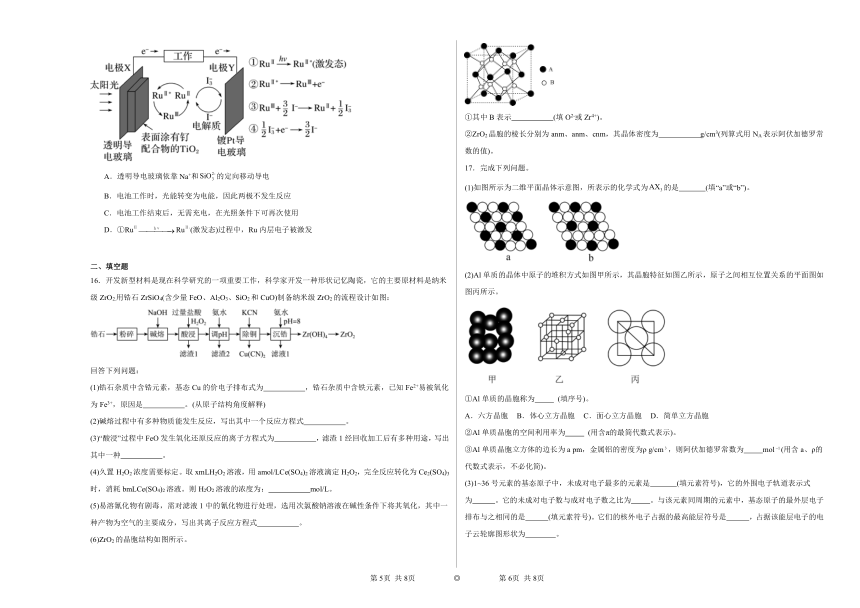
16.开发新型材料是现在科学研究的一项重要工作,科学家开发一种形状记忆陶瓷,它的主要原材料是纳米级ZrO2.用锆石ZrSiO4(含少量FeO、Al2O3、SiO2和CuO)制备纳米级ZrO2的流程设计如图:
回答下列问题:
(1)锆石杂质中含锆元素,基态Cu的价电子排布式为 ,锆石杂质中含铁元素,已知Fe2+易被氧化为Fe3+,原因是 。(从原子结构角度解释)
(2)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式 。
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为 ,滤渣1经回收加工后有多种用途,写出其中一种 。
(4)久置H2O2浓度需要标定。取xmLH2O2溶液,用amol/LCe(SO4)2溶液滴定H2O2,完全反应转化为Ce2(SO4)3时,消耗bmLCe(SO4)2溶液。则H2O2溶液的浓度为: mol/L。
(5)易溶氰化物有剧毒,需对滤液1中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分,写出其离子反应方程式 。
(6)ZrO2的晶胞结构如图所示。
①其中B表示 (填O2-或Zr4+)。
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为 g/cm3(列算式用NA表示阿伏加德罗常数的值)。
17.完成下列问题。
(1)如图所示为二维平面晶体示意图,所表示的化学式为的是 (填“a”或“b”)。
(2)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
①Al单质的晶胞称为 (填序号)。
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞 D.简单立方晶胞
②Al单质晶胞的空间利用率为 (用含π的最简代数式表示)。
③Al单质晶胞立方体的边长为a pm,金属铝的密度为ρ g/cm,则阿伏加德罗常数为 mol(用含a、ρ的代数式表示,不必化简)。
(3)1~36号元素的基态原子中,未成对电子最多的元素是 (填元素符号),它的外围电子轨道表示式为 。它的未成对电子数与成对电子数之比为 。与该元素同周期的元素中,基态原子的最外层电子排布与之相同的是 (填元素符号)。它们的核外电子占据的最高能层符号是 ,占据该能层电子的电子云轮廓图形状为 。
三、解答题
18.钴及其化合物在工业生产中有广阔的应用前景。已知:Co2+不易被氧化,Co3+具有强氧化性,[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
(1)从锂钴废料(主要成分为LiCoO2)分离Co2+。
①的电子排布式为 。
②“酸溶”时不选择浓的理由是: 。
③“净化”时,加固体是将转化为沉淀,“净化”后溶液中,若“过滤1”后溶液中浓度为1.0,则“净化”后c(Na+)= 。[溶液体积变化忽略不计,不考虑其他离子影响。25℃时Ksp(LiF)= 2.0×10-3]
(2)从由CoCl2制备[Co(NH3)6]Cl3。
实验过程:称取研细的10.0g和NH4Cl50g于烧杯中溶解,将溶液转入三颈烧瓶,分液漏斗中分别装有25浓氨水,530%的H2O2溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得[Co(NH3)6]Cl3溶液,实验装置如图所示:
①由制备[Co(NH3)6]Cl3溶液的离子方程式为 。
②分液漏斗中液体加入三颈烧瓶中的顺序为 。
(3)用CoSO4溶液为原料“沉钴”时,可先制得CoCO3再制备Co3O4.CoCO3在空气中受热分解,测得剩余固体的质量与起始CoCO3的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。
为获得较高产率的Co3O4,请补充实验方案:取CoSO4溶液 。(可选用的试剂:0.1 mol/L NH4HCO3溶液、空气、0.1 mol/L HCl溶液、0.1 mol/L BaCl2溶液)。
19.从炼锌厂废渣(含Zn、Co、Fe、ZnO、SiO2等)中回收钴并获得副产物ZnSO4的工艺流程如图:
已知:①常温下相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如表:
金属离子 Co2+ Fe2+ Fe3+ Zn2+
开始沉淀的pH 7.2 6.3 1.5 6.2
沉淀完全的pH 9.2 8.3 2.8 8.2
②酸浸后滤液中钴元素以Co2+形式存在
请回答下列问题:
(1)根据核外电子排布,钴元素位于周期表中 区;酸浸过程中,提高“浸出率”的措施有 (任写一条);滤渣1的成分为 (填化学式)。
(2)向酸浸后的滤液中加入H2O2的目的是 ;调pH除铁选择的试剂X可以是 (填下面的字母);调节的pH范围是 。
A.KOH B.Zn(OH)2 C.CoO D.Na2CO3
(3)操作1在实验室所用到的主要仪器为 ;该流程中可循环使用的物质是 。
(4)除去Zn2+后,工业上也可利用碱性的次氯酸钠溶液氧化Co2+生成Co(OH)3沉淀,实现钴的回收,该反应的离子方程式为 。
(5)已知Ksp(CoCO3)=1.5×10-13,Ksp(CoC2O4)=6.0×10-8,请判断能否利用如下反应CoCO3(s)+C2O(aq)CoC2O4(s)+CO(aq),将CoCO3转化为CoC2O4: (填“能”或“不能”),通过计算说明理由 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.根据铊,为81号元素,位于元素周期表第六周期第IIIA族,可知铊原子核内质子数为81,核外有81个电子,有6个电子层,最外层有3个电子,A正确;
B.铊与铝元素位于同主族,基态原子的价层电子排布式相似,基态铊原子的价层电子排布式为,B错误;
C.根据基态铊原子价层电子排布式为,其中s能级只有1个原子轨道,2个电子自旋运动方向相反,p能级3个原子轨道,只有1个电子,其轨道表示式是正确的,C正确;
D.基态铊原子最高能层为第6层,符号为P,D正确;
答案选B。
2.C
【详解】A.的结构为H-O-Cl,电子式为,故A正确;
B.是第25号元素,价层电子排布式为,故B正确;
C.分子的模型为四面体,故C错误;
D.亚铁离子为Fe失去2个电子,离子结构示意图为,故D正确;
故答案选C。
3.C
【详解】A.CH3COOH晶体属于分子晶体,A错误;
B.H2O的电子式为,B错误;
C.P是15号元素,原子的结构示意图为,C正确;
D.Fe2+基态核外电子排布式为 [ Ar ]3d6,D错误;
故选C。
4.B
【详解】A.碳元素的原子序数为6,基态C原子的价电子排布式为2s22p2,则电子占据的最高能层符号为L,故A错误;
B.由构造原理可知,基态碳原子中,1s、2s电子的能量逐渐升高,故B正确;
C.氧元素的原子序数为8,位于元素周期表第二周期ⅥA族,故C错误;
D.基态氧原子中,1s、2s能级的轨道数相同,都为1,故D错误;
故选B。
5.C
【详解】A.基态Se原子的价层电子排布式为,故A错误;
B.轨道表示式不满足洪特规则,故B错误;
C.基态Mn原子的电子在3d轨道中的表示式为,故C正确;
D.铍原子基态最外层电子轨道为2s,s轨道的电子云轮廓图为球形,,故D错误;
故答案为:C;
6.D
【分析】W、X、Y、Z为原子序数依次增大的短周期主族元素,W基态原子核外只有一个电子,则W为H元素;X的最高能级不同轨道都有电子且自旋方向相同,则X的电子排布式为1s22s22p3,X为N元素(排除P元素);Y的最外层电子数为偶数,则Y为O元素;Z的核外电子数等于X与Y的最外层电子数之和,则Z的核外电子数为5+6=11,Z为Na元素。从而得出W、X、Y、Z分别为H、N、O、Na。
【详解】A.X、Y分别为N、O,O元素的非金属性强于N元素,则单质的氧化性:O2>N2,故A正确;
B.X为N,核外共有7个电子,每个电子的运动状态都不同,故B正确;
C.W、X、Y、Z分别为H、N、O、Na,则Na的原子半径最大,故C正确;
D.W与Y分别为H和O,形成的化合物H2O2中原子个数比为1:1, 故D错误;
故答案为:D。
7.B
【分析】基态Y原子的s轨道比p轨道的电子数多1,所以Y为1s22s22p3或1s1,又W、Y、X、Z、Q均为短周期主族元素,且原子序数依次增大,所以Y为N,W为Li,X形成二价键、X与Q同族,X为O, Q为S,Z为F。
【详解】A.X为O、Q为S,由于水分子间存在氢键,简单氢化物的沸点:X>Q,故A错误;
B.W为Li、X为O,形成的化合物为Li2O,溶于水呈碱性,故B正确;
C.X为O、Y为N 、W为Li,N原子2p轨道半充满,元素第一电离能:Y>X> W,故C错误;
D.Q为S ,S的氧化物的水化物H2SO3为弱酸,故D错误;
故答案为:B。
8.C
【详解】A.铜铟硫(CuInS2)量子点是尺寸在纳米量级(通常2~20nm)的半导体晶体,则其溶液为胶体,能发生丁达尔效应,故A正确;
B.硫离子的核电荷数为16,最外层8个电子,硫离子的结构示意图:,故B正确;
C.In的原子序数为49,电子排布式为1s22s22p63s23p63d104s24p64d105s25p1,可推知In位于元素周期表第五周期,故C错误;
D.基态Cu原子的价层电子排布式为3d104s1,则基态Cu+的价层电子排布式为3d10,故D正确;
故选:C。
9.C
【详解】A.H只有一个电子层,C和O电子层数相同,核电荷数越大,原子半径越小,原子半径应为,A错误;
B.碳有多种氢化物,其沸点不一定低于氧的氢化物的沸点,如碳原子数较多的烃沸点高于水,B错误;
C.为ⅠB族,属于过渡元素,C正确;
D.石墨烯只含一种元素,不是化合物,D错误;
故答案选C。
10.D
【详解】A. Ga、N的价电子分别是4s24p1、2s22p3、Ga、N均属于p区元素,故A正确;
B. 图a晶体结构中含有12×+2×+3=6个Ga、6×+4=6个N,故B正确;
C. 图b晶体结构中若Ga和N的距离为xnm,取晶胞的八分之一作为一个小立方体,小立方体的对角线为2xnm,小立方体的边长为 nm,晶胞的边长为2 nm,则晶体的密度为ρ= =,故C正确;
D. a的晶胞为,Ga原子的配位数为4,三种晶体结构中Ga原子的配位数之比为4∶4∶6=2∶2∶3,故D错误;
故选D。
11.A
【详解】A.碳化钙为离子化合物通过离子键结合,电子式为:,故A正确;
B.碳原子价电子排布式为2s22p2,根据泡利原理和洪特规则,轨道表达式为:,故B错误;
C.乙炔的结构简式为CH≡CH,C原子半径大于H,故C错误;
D.氢氧化钙为强电解质,电离方程式为Ca(OH)2的电离方程式:Ca(OH)2=Ca2++2OH-,故D错误;
故选A。
12.C
【详解】A.基态钪原子的价电子排布式为4s24p1,电子占据的最高能层符号为N,故A错误;
B.s轨道是球形,描述的是电子云轮廓图,表示电子在单位体积内出现概率的大小,s电子不是做的是圆周运动,故B错误;
C.泡利不相容原理:一个原子轨道上最多可容纳两个电子,而这两个电子的自旋方向必须相反,所以基态氧原子轨道表示式应该为:,题给排布式违背了泡利不相容原理,2s轨道上的两个电子自旋方向应该相反,故C正确;
D.核外电子空间运动状态由能层、能级、原子轨道决定,氧原子核外有8个电子,有1s轨道、2s轨道、2p轨道,其中2p有3个轨道均填充电子,故核外有5种不同空间运动状态的电子,故D错误。
答案选C。
13.A
【详解】A.六氟化硫为正八面体构型,硫原子半径大于氟原子,故A正确;
B.基态Si的核外电子排布式为1s22s22p63s23p2,则价层电子排布图为,故B错误;
C.硫酸钾的电子式为,故C错误;
D.卤族元素电负性依次减小,F的电负性最大,故D错误。
故选A。
14.D
【详解】A.NaCl为离子化合物,其电子式为,A错误;
B.基态Cr的电子排布式为1s22s22p63s23p63d54s1,价层电子的轨道表示式: ,B错误;
C.Fe为26号元素,其原子结构示意图为:,C错误;
D.轨道的电子云轮廓图为沿X轴延展的纺锤状,D正确;
故选D。
15.C
【分析】由电子流向可知,X为原电池的负极、Y为正极;
【详解】A.玻璃为固态,玻璃中Na+和不能自由移动,A错误;
B.电池工作时,光能转变为电能,在氧化还原反应中形成电子的移动形成电离,两极发生反应,B错误;
C.由图电池的工作原理可知,电池电解液中、及钌(Ru)配合物均可以循环转化,故无需充电在光照条件下可再次使用,C正确;
D.Ru的外层电子能量高容易被激发,故①RuⅡRuⅡ·(激发态)过程中,Ru外层电子被激发,D错误;
故选C。
16.(1) 3dl04s1 Fe2+价电子排布式为3d6,失去一个电子形成更稳定的3d5半满结构
(2)或
(3) 做干燥剂(催化剂载体等)
(4)
(5)
(6) O2-
【分析】锆石粉碎后加NaOH进行碱熔,过程中氧化铝和二氧化硅与NaOH反应生成盐,碱熔后固体加足量盐酸溶解,此时硅酸钠与盐酸反应生成硅酸沉淀即滤渣1,加过氧化氢将亚铁离子氧化为三价铁,再加氨水调节pH值使三价铁转化为氢氧化铁,铝离子转化为氢氧化铝沉淀即滤渣2,滤液中甲KCN使铜离子沉淀,过滤后滤液中加氨水调节使锆沉淀,过滤后灼烧得到氧化锆,据此解答。
【详解】(1)Cu为29号元素,根据洪特规则特例,轨道全充满、半满结构更稳定,其价电子排布式为:3dl04s1;Fe2+价电子排布式为3d6,Fe为26号元素,其价电子排布式为:3d64s2,Fe2+价电子排布式为3d6,失去一个电子形成Fe3+,价电子排布为3d5,根据洪特规则特例,半满结构更稳定,因此Fe2+易被氧化成Fe3+,故答案为:3dl04s1;Fe2+价电子排布式为3d6,失去一个电子形成更稳定的3d5半满结构;
(2)碱熔过程中Al2O3 、SiO2能与NaOH发生反应,故答案为:或;
(3)“酸浸”过程中FeO与H2O2发生氧化还原反应,1molFeO失1mol电子,1mol H2O2得2mol电子,根据得失电子守恒可得反应方程式:;碱熔过程中二氧化硅与NaOH反应生成盐,碱熔后固体加足量盐酸溶解,此时硅酸钠与盐酸反应生成硅酸沉淀即滤渣1,硅酸经回收加工后有多种用途,可以做干燥剂(催化剂载体等),故答案为:;做干燥剂(催化剂载体等);
(4)Ce(SO4)2与H2O2完全反应转化为Ce2(SO4)3,根据电子守恒有如下关系,H2O2~2 Ce(SO4)2,则H2O2溶液的浓度为故答案为:;
(5)易溶氰化物有剧毒,需对滤液1中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分N2,故答案为:;
(6)根据ZrO2的晶胞结构,A的个数为8×+6×=4,B的个数为8,B表示O2-,故答案为:O2-;
ZrO2晶胞的质量为,ZrO2晶胞的棱长分别为anm、anm、cnm,ZrO2晶胞的体积为,晶体密度为,故答案为:。
17.(1)b
(2) C
(3) Cr 1∶3 K和Cu N 球形
【详解】(1)a中每个黑球周围有6个白球,每个白球周围有3个黑球,所以分子式应为AX2,b中每个黑球周围有6个白球,每个白球周围有2个黑球,分子式应为AX3,故答案为b;
(2)①由图甲可知,,Al原子采取的面心立方堆积,故选C;
②设晶胞的边长为a,铝原子半径为d,根据丙图可得a = 4d,则a=2d,晶胞含有4个Al原子,所以利用的体积为:,晶胞的体积为:a3=16 d3,所以空间利用率=;
③设晶胞的边长为a pm,则该晶体的密度,;
(3)Cr元素的电子排布式为:1s22s22p63s23p63d54s1,有6个为成对电子,则未成对电子最多的元素是Cr;其外围电子轨道表示式为:;根据其电子排布式可知,未成对电子数与成对电子数之比为6∶18=1∶3;Cr位于第4周期,则与该元素同周期的元素中,基态原子的最外层电子排布与之相同的是4s1,3d104s1,分别为K和Cu;它们的核外电子占据的最高能层都是N层;占据该能层电子的电子为4s能级,其电子云轮廓图形状为球形。
18.(1) 或 浓有还原性,与会发生反应产生,污染空气 0.99
(2) 先加浓氨水再加溶液
(3)边搅拌边滴加0.1mol/L NH4HCO3溶液,至不再产生沉淀,过滤、洗涤,取最后一次洗涤液加入0.1mol/L HCl溶液酸化,再加入0.1mol/L BaCl2溶液,无浑浊生成,得到CoCO3固体,将CoCO3固体置于热解装置中,通入空气气流,在400~600 ℃温度下高温煅烧至恒重即可
【分析】锂钴废料酸溶、过滤,得到酸溶渣和含有锂离子、亚钴离子的滤液,向滤液中加入氟化钠溶液,将锂离子转化为氟化锂沉淀,过滤,得到氟化锂溶渣和含有亚钴离子的溶液。
【详解】(1)①钴元素的原子序数为27,基态Co2+的电子排布式为或;
②钴酸锂中钴元素的化合价为+3价,由题意可知,+3价钴元素具有强氧化性,若酸溶时加入具有还原性的浓盐酸,钴酸锂会与浓盐酸反应生成有毒的氯气,污染空气,所以酸溶时不能选用浓盐酸;
③由氟化锂的溶度积可知,净化后溶液中的锂离子浓度为,则沉淀锂离子消耗的氟离子的浓度为1mol/L-0.05mol/L=0.95mol/L,由净化后溶液中氟离子浓度为0.04mol/L可知,溶液中钠离子的浓度为0.95mol/L+0.04mol/L=0.99 mol/L;
(2)①由题意可知制备[Co(NH3)6]Cl3的反应为,溶液中的Co2+与、氨水和过氧化氢溶液反应生成[Co(NH3)6]3+和水,反应的离子方程式为;
②分液漏斗中液体加入三颈烧瓶中的顺序为先加浓氨水,后加过氧化氢溶液;
(3)由于CoCO3难溶于水,取反萃取后得到的水相,加入0.1mol/L的NH4HCO3,将Co2+转化为CoCO3沉淀,过滤除去可溶性杂质,然后洗涤,为了保证杂质除净,加入0.1mol/L HCl溶液酸化,用0.1mol/L的BaCl2溶液检验洗涤液中有无,干燥后在空气中400~600℃温度下高温分解CoCO3至恒重得到Co3O4。
19.(1) d 将废渣粉碎、搅拌、适当提高酸浸温度、适当提高稀硫酸浓度等(任写一条即可) SiO2
(2) 把 Fe2+氧化成 Fe3+ BC 2.8≤pH<6.2
(3) 分液漏斗 有机溶剂 M
(4)ClO- +2Co2++4OH- +H2O=2Co(OH)3↓+Cl-
(5) 不能 该反应平衡常数 k= 2.5×10-6 <10-5,转化程度小,不能实现转化
【详解】(1)钴元素位于周期表中d区;酸浸过程中,提高“浸出率”的措施有适当提高硫酸浓度、升高温度、搅拌等;滤渣1的成分为SiO2;
(2)酸浸后的滤液中加入H2O2的目的是将Fe2+氧化为Fe3+,便于后续除铁;为了不引入新的杂质,调pH除铁选择的试剂X可以是Zn(OH)2或CoO,故选BC;要保证三价铁离子完全沉淀,而钴离子和锌离子不沉淀,pH范围是2.8~6.2;
(3)操作1为萃取分液,在实验室所用到的主要仪器为分液漏斗;该流程中可循环使用的物质是有机溶剂M;
(4)除去Zn2+后,工业上也可利用碱性的次氯酸钠溶液氧化Co2+生成Co(OH)3沉淀,实现钴的回收,该反应的离子方程式为ClO- +2Co2++4OH- +H2O=2Co(OH)3↓+Cl-;
(5)该反应的平衡常数, k= 2.5×10-6 <10-5,转化程度小,不能实现转化。
答案第1页,共2页
答案第1页,共2页
