专题4分子空间结构与物质性质综合复习训练(含解析)2023——2024学年高中化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题4分子空间结构与物质性质综合复习训练(含解析)2023——2024学年高中化学苏教版(2019)选择性必修2 | 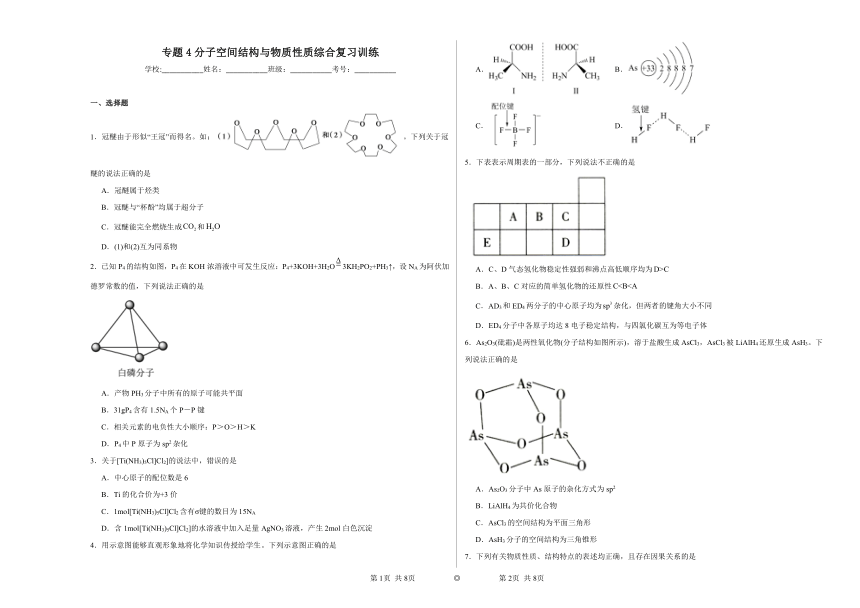 | |
| 格式 | docx | ||
| 文件大小 | 829.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-19 13:12:10 | ||
图片预览




文档简介
专题4分子空间结构与物质性质综合复习训练
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.冠醚由于形似“王冠”而得名。如; 。下列关于冠醚的说法正确的是
A.冠醚属于烃类
B.冠醚与“杯酚”均属于超分子
C.冠醚能完全燃烧生成和
D.(1)和(2)互为同系物
2.已知P4的结构如图,P4在KOH浓溶液中可发生反应:P4+3KOH+3H2O3KH2PO2+PH3↑,设NA为阿伏加德罗常数的值,下列说法正确的是
A.产物PH3分子中所有的原子可能共平面
B.31gP4含有1.5NA个P-P键
C.相关元素的电负性大小顺序:P>O>H>K
D.P4中P原子为sp2杂化
3.关于[Ti(NH3)5Cl]Cl2]的说法中,错误的是
A.中心原子的配位数是6
B.Ti的化合价为+3价
C.1mol[Ti(NH3)5Cl]Cl2含有σ键的数目为15NA
D.含1mol[Ti(NH3)5Cl]Cl2]的水溶液中加入足量AgNO3溶液,产生2mol白色沉淀
4.用示意图能够直观形象地将化学知识传授给学生。下列示意图正确的是
A. B.
C. D.
5.下表表示周期表的一部分,下列说法不正确的是
A.C、D气态氢化物稳定性强弱和沸点高低顺序均为
B.A、B、C对应的简单氢化物的还原性
C.AD3和ED4两分子的中心原子均为杂化,但两者的键角大小不同
D.ED4分子中各原子均达8电子稳定结构,与四氯化碳互为等电子体
6.As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成AsCl3,AsCl3被LiAlH4还原生成AsH3。下列说法正确的是
A.As2O3分子中As原子的杂化方式为sp2
B.LiAlH4为共价化合物
C.AsCl3的空间结构为平面三角形
D.AsH3分子的空间结构为三角锥形
7.下列有关物质性质、结构特点的表述均正确,且存在因果关系的是
表述1 表述2
A 向盛有硫酸铜溶液的试管里滴加氨水至过量,先形成难溶物,继而难溶物溶解,形成深蓝色溶液 反应后溶液中不存在任何沉淀,所以反应前后溶液中铜元素的存在形式均为
B 水的沸点比硫化氢高 键的键能比键的键能大
C 的空间结构是三角锥形 的中心原子S原子为杂化,且有一对电子对
D 、葡萄糖溶于水后均不导电 、葡萄糖均属于共价化合物
A.A B.B C.C D.D
8.分子是一种由60个碳原子构成的分子,它形似足球,因此又名足球烯,如图所示,在分子中每个碳原子均与周围相邻的其他3个碳原子相连,60个碳原子组成若干个正六边形和正五边形,碳均为价。则下列有关说法中不正确的是
A.的熔点比石墨的熔点低
B.分子中碳原子的杂化方式与甲烷中碳原子的不完全相同
C.分子中只含键、不含键
D.影响足球烯的熔、沸点的是分子间作用力
9.是一种强还原剂,能将乙酸直接还原成乙醇,下列有关说法不正确的是
A.第三周期元素中简单离子半径最小的是
B.的空间结构是正四面体形
C.分子中键角
D.乙酸→乙醇的反应中通过官能团间的转化实现了物质类别的转化
10.右丙氧芬具有镇痛作用,结构如图。下列说法错误的是
A.碳碳单键比碳氧单键键长长,键能小
B.第一电离能:
C.分子中氮原子对应键角与氨分子中键角相同
D.分子中含有两个手性碳原子
11.物质III(2,二氢苯并呋喃)是一种重要的精细化工原料。其合成的部分流程如下:
下列叙述正确的是
A.III的核磁共振氢谱图显示有6种不同环境的氢原子,它是一种芳香烃,难溶于水
B.III与足量加成所得产物分子中有2个手性碳原子
C.I中所有原子可能位于同一平面内,氧原子为杂化,碳原子为杂化
D.II有弱酸性,但不能使紫色石蕊溶液变红,可与碳酸钠溶液反应,但没有气泡产生
12.甲醛能与[Zn(CN)4]2-的水溶液发生反应:[Zn(CN)4]2-+4H++4HCHO+4H2O=4HOCH2CN+[Zn(H2O)4]2+,下列说法错误的是
A.[Zn(CN)4]2-中由Zn2+提供空轨道,CN-提供孤电子对
B.H2O分子中H—O—H的键角与HCHO分子中H—C—O的键角,前者大于后者
C.CN-和H2O与Zn2+的配位能力:CN->H2O
D.[Zn(CN)4]2-和[Zn(H2O)4]2+中σ键数目之比为2:3
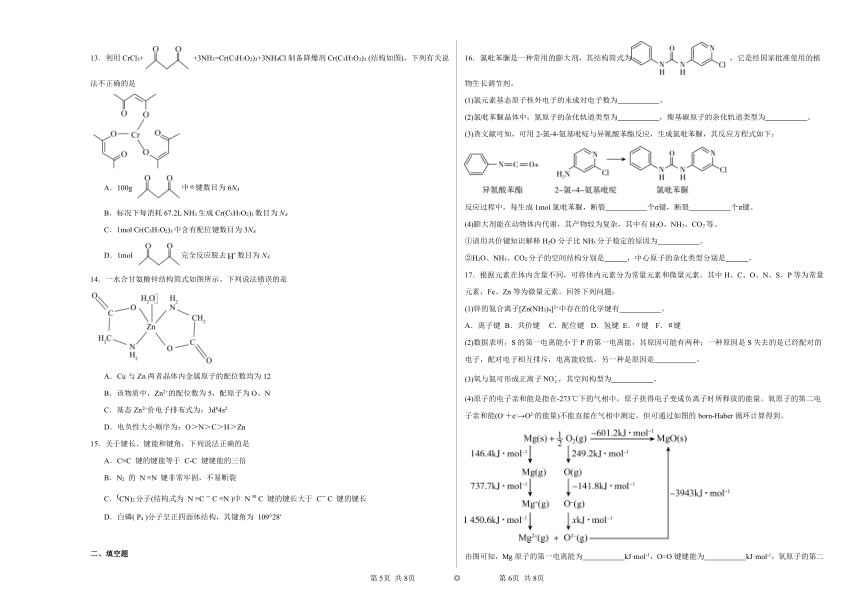
13.利用CrCl3+ +3NH3=Cr(C5H7O2)3+3NH4Cl制备降爆剂Cr(C5H7O2)3 (结构如图),下列有关说法不正确的是
A.100g 中键数目为6NA
B.标况下每消耗67.2L NH3生成Cr(C5H7O2)3数目为NA
C.1mol Cr(C5H7O2)3中含有配位键数目为3NA
D.1mol 完全反应脱去数目为NA
14.一水合甘氨酸锌结构简式如图所示。下列说法错误的是
A.Cu与Zn两者晶体内金属原子的配位数均为12
B.该物质中,Zn2+的配位数为5,配原子为O、N
C.基态Zn2+价电子排布式为:3d84s2
D.电负性大小顺序为:O>N>C>H>Zn
15.关于键长、键能和键角,下列说法正确的是
A.C≡C 键的键能等于 C-C 键键能的三倍
B.N2 的 N ≡N 键非常牢固,不易断裂
C.CN)2分子(结构式为 N ≡C C ≡N )中 N C 键的键长大于 C C 键的键长
D.白磷( P4 )分子呈正四面体结构,其键角为 109°28′
二、填空题
16.氯吡苯脲是一种常用的膨大剂,其结构简式为 ,它是经国家批准使用的植物生长调节剂。
(1)氯元素基态原子核外电子的未成对电子数为 。
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为 ,羰基碳原子的杂化轨道类型为 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如下:
反应过程中,每生成1mol氯吡苯脲,断裂 个σ键,断裂 个π键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为 。
②H2O、NH3、CO2分子的空间结构分别是 ,中心原子的杂化类型分别是 。
17.根据元素在体内含量不同,可将体内元素分为常量元素和微量元素。其中H、C、O、N、S、P等为常量元素,Fe、Zn等为微量元素。回答下列问题:
(1)锌的氨合离子[Zn(NH3)4]2+中存在的化学键有 。
A.离子键 B.共价键 C.配位键 D.氢键 E.键 F.键
(2)数据表明,S的第一电离能小于P的第一电离能,其原因可能有两种:一种原因是S失去的是已经配对的电子,配对电子相互排斥,电离能较低,另一种是原因是 。
(3)氧与氮可形成正离子,其空间构型为 。
(4)原子的电子亲和能是指在-273℃下的气相中,原子获得电子变成负离子时所释放的能量。氧原子的第二电子亲和能(O-+e-→O2-的能量)不能直接在气相中测定,但可通过如图的born-Haber循环计算得到。
由图可知,Mg原子的第一电离能为 kJ·mol-1,O=O键键能为 kJ·mol-1,氧原子的第二电子亲和能为 kJ·mol-1。
三、解答题
18.氮及其化合物在生产生活中有广泛的应用。回答下列问题:
(1)基态N原子的核外电子共有 种空间运动状态;第一电离能从大到小的顺序为 。
(2)标准状况下,1体积水最多能溶解0.024体积,1体积水最多能溶解0.485体积,在水中溶解度大于的原因是 。
(3)的VSEPR模型为 ,与互为等电子体的粒子有 (任意写出两种)。
(4)联氨可用于处理水中的溶解氧,其反应机理如下图所示:
①的沸点高于的原因为 。
②等物质的量的与中所含键数目之比为 。
(5)氮化钼晶胞如图所示,氮化钼的化学式为 ;若晶胞边长为,则晶体的密度为 为阿伏加德罗常数的值)。
19.如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:
①
② ③ ④ ⑤
⑥ ⑦ ⑧ ⑨
⑩
(1)表中元素⑩的价层电子排布式为 ,该元素基态原子核外未成对电子有 个。
(2)第二周期所有元素中第一电离能介于③与④之间的有 种,在标号的主族元素中,电负性最大的是 (填元素符号)。
(3)元素①和⑦能形成阴离子,其空间结构为 ;元素⑤和⑧所形成的阴离子中,P的杂化轨道类型是 。
(4)在元素周期表中存在对角线规则。如元素②与⑦在周期表中处于对角线位置,则化学性质相似,②的氧化物、氢氧化物也有两性,则②的氢氧化物与⑥的氢氧化物,以物质的量比1∶2反应时的化学方程式为 。
(5)元素 可形成的卤化物的熔点如下表:
卤化物 氟化物 氯化物 溴化物
熔点/℃ 1000 77.75 122.3
元素 的氟化物的化学式为 ,该元素氟化物的熔点比其氯化物熔点高很多的原因是 (已知该氟化物易溶于稀盐酸)。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.冠醚中除含有C、H元素外,还含有O元素,因此冠醚不属于烃,属于烃的衍生物,故A错误;
B.超分子是由两种或两种以上分子通过分子间相互作用形成的分子聚集体,因此冠醚和杯酚不属于超分子,故B错误;
C.冠醚是由C、H、O三种元素组成,完全燃烧生成CO2和H2O,故C正确;
D.(1)有5个氧原子,(2)中有6个氧原子,因此两者不属于同系物,故D错误;
答案为C。
2.B
【详解】A.PH3中P原子的价层电子对数为4,分子空间构型为三角锥形,所有原子不可能共平面,A错误;
B.1molP4中含6molP-P键,31gP4的物质的量为0.25mol,含P-P键数目为1.5NA,B正确;
C.同周期从左往右电负性逐渐增强,同主族从上往下电负性减弱,故电负性O>P>H>K,C错误;
D.根据P4的空间构型,P4中P原子为sp3杂化,D错误;
故选B。
3.C
【详解】A.配体为氨气和氯离子,故中心原子的配位数为6,A正确;
B.根据化合价代数和为0,Ti的化合价为+3价,B正确;
C.1mol[Ti(NH3)5Cl]Cl2含有σ键的数目为:(6+35)NA=21NA,C错误;
D.配合物中内界和外界之间为离子键,1mol配合物可电离出2mol氯离子,故可产生2molAgCl白色沉淀,D正确;
故选C。
4.A
【详解】A.A中分子为对映异构体,A正确;
B.As原子序数为33,位于第4周期,核外4个电子层,每层电子数由内而外为2、8、18、5,B错误;
C.配位键由F原子提供孤电子对,应由F原子指向B原子,C错误;
D.HF存在分子间氢键,“...”表示氢键,D错误;
故选A。
5.A
【分析】根据题目所给图象可推得,A为N元素、B为O元素、C为F元素、D为Cl元素、E为Si元素。
【详解】A.同主族从上到下元素非金属性递减,非金属性越强,简单氢化物越稳定,则F、Cl元素气态氢化物稳定性HCl < HF,HF分子间有氢键,沸点比HCl高,A错误;
B.同周期从左到右主族元素非金属性递增,非金属性越强,对应阴离子的还原性越弱,N、O、F对应的简单氢化物的还原性HF < H2O < NH3,B正确;
C.中心原子价电子对数,中心原子价电子对数,则两分子的中心原子均为即杂化,但中有孤电子对,两者的键角大小不同,C正确;
D.分子中各原子均达8电子稳定结构,具有相同价电子数和相同原子数的分子或离子互为等电子体,则与CCl4互为等电子体,D正确;
综上,本题选A。
6.D
【详解】A.As2O3中每个As原子价电子对数是4,且含有一对孤电子对,根据价层电子对互斥模型判断As原子杂化方式为sp3杂化,A错误;
B.只含共价键的化合物为共价化合物,含有离子键的化合物为离子化合物,该物质是由阳离子Li+和阴离子通过离子键构成的化合物,因此LiAlH4为离子化合物,B错误;
C.AsCl3中As原子价电子对数3+,且As原子上含有一对孤电子对,根据价层电子对互斥模型判断其空间结构为三角锥形,C错误;
D.AsH3中As原子价电子对数3+,且As原子含有一对孤电子对,根据价层电子对互斥模型判断其空间结构为三角锥形,D正确;
故合理选项是D。
7.C
【详解】A.与氨水反应首先生成沉淀,氨水过量后,溶解形成,故反应后铜元素以形式存在,表述2错误,A项错误;
B.水分子能形成分子间氢键,而不能,故沸点比高,两种表述不存在因果关系,B项错误;
C.中心S原子为杂化,说明中心S原子价电子对数为4,含1对孤电子对,的空间结构为三角锥形,两种表述正确且存在因果关系,C项正确;
D.溶于水与水反应生成,电离产生自由移动的离子从而导电,表述1错误,葡萄糖为非电解质,溶于水不电离,故不能导电,二者均属于共价化合物,D项错误;
故选C。
8.C
【详解】A.C60为分子晶体,三态变化破坏较弱的范德华力,熔点低;而石墨是混合型晶体,三态变化破坏共价键和分子间作用力,故其熔点高,则C60的熔点比石墨的熔点低,A项正确;
B.C60分子中碳原子的杂化方式为sp2和sp3,甲烷分子中只含有单键碳原子,碳原子的杂化方式为sp3,两者杂化方式不完全相同,B项正确;
C.由C60的结构可知,分子中既含σ键、又含π键,C项错误;
D.C60为分子晶体,影响足球烯的熔、沸点的是分子间作用力,D项正确;
故选C。
9.C
【详解】A.电子层数越多,离子半径越大,电子层数相同时,核电荷数越大,离子半径越小,第三周期元素的简单离子中,Na、Mg、Al原子对应的离子核外有2个电子层,从Si到Cl原子对应的简单离子核外有3个电子层,则离子半径最小的是,故A正确;
B.中Al原子价层电子对数为,不含孤电子对,空间结构是正四面体形,故B正确;
C.羧基中碳氧双键对单键的作用力大于单键之间的作用力,所以键角α<β,故C错误;
D.乙酸属于羧酸,含有的官能团为羧基,乙醇属于醇,含有的官能团为羟基,将乙酸直接还原成乙醇,通过官能团间的转化实现了物质类别的转化,故D正确;
故答案选C。
10.C
【详解】A.碳原子半径大于氧原子半径,键长越长,键能越小,所以碳碳单键比碳氧单键键长长,键能小,A正确;
B.同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能:,B正确;
C.该分子中N原子和氨气分子中N原子价电子对数都是4,且都含有1个孤电子对,N原子采用sp3杂化,则两个N原子都呈三角锥形结构,C-N之间成键电子离N较远,C-N键长比H-N长,所以键角比氨气分子中大,C错误;
D.手性碳原子是指碳原子周围连有4个不同的原子团,该分子中手性碳原子如图,所以该分子中含有2个手性碳原子,D正确;
故选C。
11.B
【详解】A.III的结构不对称,III的核磁共振氢谱显示有6种不同化学环境的氢原子,该分子中含有C、H、O三种元素且含有苯环,该分子不属于芳香烃,属于芳香族化合物,没有亲水基,只有憎水基,故不易溶于水,A错误;
B.III与足量的H2加成后产物的结构简式为:,两个环连接的碳原子为手性碳原子,共2个手性碳原子,B正确;
C.I中亚甲基具有甲烷结构特点,故所有原子不可能位于同一平面内,亚甲基上的碳原子、氧原子的价层电子对数均为4,则杂化方式均为sp3杂化,苯环上的碳原子杂化方式为sp2杂化,C错误;
D.II中含醇羟基,不含羧基和酚羟基,该物质无酸性,不能使紫色石蕊试液变红,不能与碳酸钠溶液反应,D错误;
故选B。
12.B
【详解】A. [Zn(CN)4]2-中由Zn2+提供空轨道,C原子提供电子对形成配位键,结构示意图表示为:,故A正确;
B. H2O分子中心原子O采用sp3杂化,有两对孤电子对,H—O—H的键角小于109.5°与HCHO分子中心原子C采用sp2杂化,H—C—O的键角为120°,前者小于后者,故B错误;
C.CN-中碳原子电负性小,更容易给出孤电子对, 则CN-和H2O与Zn2+的配位能力:CN->H2O,故C正确;
D. [Zn(CN)4]2-中含有4+4=8个σ键,[Zn(H2O)4]2+中含有4+4×2=12个σ键,σ键数目之比为2:3,故D正确;
故选B。
13.A
【详解】A.的结构简式为CH3COCH2COCH3,含有14个σ键,100g中,即1mol,σ键数目为14NA,A说法错误;
B.标况下每消耗67.2L NH3即3mol,生成1mol Cr(C5H7O2)3,其数目为NA,B说法正确;
C.Cr(C5H7O2)3中Cr3+与3个C5H7O中的碳原子形成3个配位键,则1mol Cr(C5H7O2)3中含有配位键数目为3NA,C说法正确;
D.1mol 完全反应生成C5H7O2,则脱去1mol H+,数目为NA,D说法正确;
答案为A。
14.C
【详解】A. Cu的晶体为面心立方最密堆积,配位数为12,Zn晶体为六方堆积,配位数为12,故A正确;
B. 由图知,该物质中,Zn2+的配位数为5,配原子为O、N,故B正确;
C.基态Zn价电子排布式为:3d104s2,基态Zn2+价电子排布式为:3d10,故C不正确;
D. 电负性强弱与非金属性相关,非金属性强则电负性大,同周期从左向右电负性增大,同主族从上到下电负性减小,电负性大小顺序为: ,故D正确;
答案选C。
15.B
【详解】A.碳碳三键中两个是π键,一个是σ键,碳碳单键是σ键,C≡C的键能小于C-C的键能的三倍,故A错误;
B.氮分子中的N≡N键的键能较大,使得N≡N键非常牢固,不易断裂,故B正确;
C.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其形成的共价键的键长越长,碳原子半径大于氮原子,所以氰分子中C≡N键长小于C≡C键长,而C≡C键长又小于C C 键的键长,因此N≡C 键的键长小于 C C 键的键长,故C错误;
D.白磷的分子的结构为,白磷分子呈正四面体,键角60°,故D错误;
故选B。
16.(1)1
(2) sp2、sp3 sp2
(3) NA NA
(4) H—O键的键能大于H—N键的键能 V形、三角锥形、直线形 sp3、sp3、sp
【详解】(1)根据构造原理可知,氯元素基态原子核外电子排布式是1s22s22p63s23p5,所以未成对电子数为1;
(2)根据氯吡苯脲的结构简式可知,有2个氮原子均形成3个单键,孤电子对数为1,属于sp3杂化;剩余1个氮原子形成1个双键和1个单键,孤电子对数为1,是sp2杂化;羰基碳原子形成2个单键和1个双键,为sp2杂化。
(3)由于σ键比π键更稳定,根据反应方程式可以看出,断裂的化学键为异氰酸苯酯分子中的N=C键中的π键和2-氯-4-氨基吡啶分子中的N—H键;故每生成1mol氯吡苯脲,断裂1mol σ键,断裂1mol π键,则断裂NA个σ键,断裂NA个π键。
(4)①O、N属于同周期元素,O的原子半径小于N,H—O键的键能大于H—N键的键能,所以H2O分子比NH3分子稳定。
②H2O分子中O原子的价层电子对数=2+=4,孤电子对数为2,所以为V形结构,O原子采用sp3杂化;
NH3分子中N原子的价层电子对数=3+=4,孤电子对数为1,所以为三角锥形结构,N原子采用sp3杂化;
CO2分子中C原子的价层电子对数=2+=2,不含孤电子对,所以是直线形结构,C原子采用sp杂化。
17. BCE 磷原子的3p轨道电子排布为半充满稳定结构,第一电离能较高 直线形 737.7 498.4 -899.7
【详解】(1)锌的氨合离子[Zn(NH3)4]2+是一个配合离子,锌离子和氨分子之间存在配位键、氨分子内氮原子氢原子之间是共价键,N-H属于键,故存在的化学键有BCE。
(2) 磷原子的3p轨道电子排布呈半充满、结构稳定,故另一种是原因是磷原子的3p轨道电子排布为半充满稳定结构,第一电离能较高。
(3) 价电子数和原子数分别都相等的是等电子体,氧与氮形成的正离子与二氧化碳互为等电子体,CO2是直线型结构,所以根据等电子原理,空间构型为直线形。
(4)Mg原子的第一电离能是气态的镁原子失去一个电子吸收的能量,由图可知,Mg原子的第一电离能为737.7kJ·mol-1,O=O键的键能是断开形成2个O原子吸收的能量,由图可知,O=O键键能为2×249.2kJ·mol-1=498.4kJ·mol-1;设O-+e-→O2-的释放的能量为a,根据盖斯定律,有-601.2kJ·mol-1=146.4kJ·mol-1+737.7kJ·mol-1+1450.6kJ·mol-1+249.2kJ·mol-1-141.8kJ·mol-1+xkJ·mol-1-3943kJ·mol-1,解得:x=899.7,因此氧原子的第二电子亲和能为-899.7kJ·mol-1
18.(1) 5 N>O>H
(2)NO为极性分子,氮气为非极性分子
(3) 平面三角形 O3、SO2等
(4) N2H4分子间氢键数目多于NH3分子间氢键数目 1∶2
(5) Mo2N
【详解】(1)基态N的电子排布式为1s22s22p3,共占据5个轨道,因此核外电子共有5种空间运动状态;同周期元素,第一电离能随着原子序数递增而呈增大趋势,但第ⅤA族元素最高能级轨道为半充满,比较稳定,第一电离能大于相邻元素,因此N的第一电离能大于O,所以三种元素的第一电离能:N>O>H;故答案为5;N>O>H;
(2)NO为极性分子,氮气为非极性分子,水分子为极性分子,根据“相似相溶”原理,NO在水中溶解度大于N2;故答案为NO为极性分子,氮气为非极性分子;
(3)NO中心N原子的价层电子对数为3+=3,VSEPR模型为平面三角形;价电子总数和原子总数相同的分子、离子或基团互称为等电子体,则与NO互为等电子体的微粒是O3、SO2等;故答案为平面三角形;O3、SO2等;
(4)①N2H4、NH3都是分子晶体,由于都含有N-H键,N元素的非金属性强、原子半径小,所以二者的分子之间还都存在氢键,由于N2H4分子间氢键数目多于NH3分子间氢键数目,因此克服氢键肼需要较高能量,因此肼的沸点高于氨气;故答案为N2H4分子间氢键数目多于NH3分子间氢键数目;
②1mol[Cu(NH3)2]+所含σ键数目为(2+2×3)NA=8NA,1mol[Cu(NH3)4]+所含σ键数目为(4+4×3)NA=16NA,因此两者所含σ键数目之比为8NA:16NA=1:2,故答案为1:2;
(5)晶胞中,Mo原子位于顶点和面心,个数为=4,N原子位于棱上和体心,个数为=2,因此化学式为Mo2N;晶胞的质量为g,晶胞的体积为(a×10-10)3cm3,根据密度定义,该晶体的密度为g/cm3=g/cm3;故答案为Mo2N;。
19.(1) 3d64s2 4
(2) 3 O
(3) 正四面体形 sp3
(4)Be(OH)2 + 2NaOH = Na2BeO2 + 2H2O
(5) 是离子晶体,是分子晶体
【分析】根据11种元素在周期表位置,11种元素分别为H、Be、B、N、O、Na、Al、P、Cl、Fe、Ga,据此分析;
【详解】(1)⑩号元素为Fe,价层电子包括最外层和次外层d能级上的电子,即基态Fe价层电子排布式为3d64s2,d能级有5个原子轨道,最多容纳10个电子,因此基态铁原子核外未成对电子有4个;故答案为3d64s2;4;
(2)③④元素分别为B、N,同周期从左向右第一电离能增大的趋势,但ⅡA>ⅢA,ⅣA>ⅥA,因此介于两者之间的元素为Be、C、O,有3种元素;同周期从左向右电负性逐渐增大,从上到下,电负性逐渐减小,因此所给元素中电负性最大的是O;故答案为3;O;
(3)AlH中Al的价层电子对数为4+=4,其空间构型为正四面体;PO中P的价层电子对数为4+=4,价层电子对数等于杂化轨道数,即P的杂化类型为sp3;故答案为正四面体;sp3;
(4)②的氢氧化物为Ba(OH)2,⑥的氢氧化物为NaOH,以物质的量之比为1∶2反应时的化学方程式为Ba(OH)2+2NaOH=Ba2BeO2+2H2O;故答案为Ba(OH)2+2NaOH=Ba2BeO2+2H2O;
(5)该元素为Ga,氟化镓的化学式为GaF3,根据表中数据,氟化镓的熔点比其余两种高很多,推出它们是不同晶体,即氟化镓为离子晶体,氯化镓、溴化镓为分子晶体;故答案为GaF3;GaF3是离子晶体,GaCl3是分子晶体。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.冠醚由于形似“王冠”而得名。如; 。下列关于冠醚的说法正确的是
A.冠醚属于烃类
B.冠醚与“杯酚”均属于超分子
C.冠醚能完全燃烧生成和
D.(1)和(2)互为同系物
2.已知P4的结构如图,P4在KOH浓溶液中可发生反应:P4+3KOH+3H2O3KH2PO2+PH3↑,设NA为阿伏加德罗常数的值,下列说法正确的是
A.产物PH3分子中所有的原子可能共平面
B.31gP4含有1.5NA个P-P键
C.相关元素的电负性大小顺序:P>O>H>K
D.P4中P原子为sp2杂化
3.关于[Ti(NH3)5Cl]Cl2]的说法中,错误的是
A.中心原子的配位数是6
B.Ti的化合价为+3价
C.1mol[Ti(NH3)5Cl]Cl2含有σ键的数目为15NA
D.含1mol[Ti(NH3)5Cl]Cl2]的水溶液中加入足量AgNO3溶液,产生2mol白色沉淀
4.用示意图能够直观形象地将化学知识传授给学生。下列示意图正确的是
A. B.
C. D.
5.下表表示周期表的一部分,下列说法不正确的是
A.C、D气态氢化物稳定性强弱和沸点高低顺序均为
B.A、B、C对应的简单氢化物的还原性
C.AD3和ED4两分子的中心原子均为杂化,但两者的键角大小不同
D.ED4分子中各原子均达8电子稳定结构,与四氯化碳互为等电子体
6.As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成AsCl3,AsCl3被LiAlH4还原生成AsH3。下列说法正确的是
A.As2O3分子中As原子的杂化方式为sp2
B.LiAlH4为共价化合物
C.AsCl3的空间结构为平面三角形
D.AsH3分子的空间结构为三角锥形
7.下列有关物质性质、结构特点的表述均正确,且存在因果关系的是
表述1 表述2
A 向盛有硫酸铜溶液的试管里滴加氨水至过量,先形成难溶物,继而难溶物溶解,形成深蓝色溶液 反应后溶液中不存在任何沉淀,所以反应前后溶液中铜元素的存在形式均为
B 水的沸点比硫化氢高 键的键能比键的键能大
C 的空间结构是三角锥形 的中心原子S原子为杂化,且有一对电子对
D 、葡萄糖溶于水后均不导电 、葡萄糖均属于共价化合物
A.A B.B C.C D.D
8.分子是一种由60个碳原子构成的分子,它形似足球,因此又名足球烯,如图所示,在分子中每个碳原子均与周围相邻的其他3个碳原子相连,60个碳原子组成若干个正六边形和正五边形,碳均为价。则下列有关说法中不正确的是
A.的熔点比石墨的熔点低
B.分子中碳原子的杂化方式与甲烷中碳原子的不完全相同
C.分子中只含键、不含键
D.影响足球烯的熔、沸点的是分子间作用力
9.是一种强还原剂,能将乙酸直接还原成乙醇,下列有关说法不正确的是
A.第三周期元素中简单离子半径最小的是
B.的空间结构是正四面体形
C.分子中键角
D.乙酸→乙醇的反应中通过官能团间的转化实现了物质类别的转化
10.右丙氧芬具有镇痛作用,结构如图。下列说法错误的是
A.碳碳单键比碳氧单键键长长,键能小
B.第一电离能:
C.分子中氮原子对应键角与氨分子中键角相同
D.分子中含有两个手性碳原子
11.物质III(2,二氢苯并呋喃)是一种重要的精细化工原料。其合成的部分流程如下:
下列叙述正确的是
A.III的核磁共振氢谱图显示有6种不同环境的氢原子,它是一种芳香烃,难溶于水
B.III与足量加成所得产物分子中有2个手性碳原子
C.I中所有原子可能位于同一平面内,氧原子为杂化,碳原子为杂化
D.II有弱酸性,但不能使紫色石蕊溶液变红,可与碳酸钠溶液反应,但没有气泡产生
12.甲醛能与[Zn(CN)4]2-的水溶液发生反应:[Zn(CN)4]2-+4H++4HCHO+4H2O=4HOCH2CN+[Zn(H2O)4]2+,下列说法错误的是
A.[Zn(CN)4]2-中由Zn2+提供空轨道,CN-提供孤电子对
B.H2O分子中H—O—H的键角与HCHO分子中H—C—O的键角,前者大于后者
C.CN-和H2O与Zn2+的配位能力:CN->H2O
D.[Zn(CN)4]2-和[Zn(H2O)4]2+中σ键数目之比为2:3
13.利用CrCl3+ +3NH3=Cr(C5H7O2)3+3NH4Cl制备降爆剂Cr(C5H7O2)3 (结构如图),下列有关说法不正确的是
A.100g 中键数目为6NA
B.标况下每消耗67.2L NH3生成Cr(C5H7O2)3数目为NA
C.1mol Cr(C5H7O2)3中含有配位键数目为3NA
D.1mol 完全反应脱去数目为NA
14.一水合甘氨酸锌结构简式如图所示。下列说法错误的是
A.Cu与Zn两者晶体内金属原子的配位数均为12
B.该物质中,Zn2+的配位数为5,配原子为O、N
C.基态Zn2+价电子排布式为:3d84s2
D.电负性大小顺序为:O>N>C>H>Zn
15.关于键长、键能和键角,下列说法正确的是
A.C≡C 键的键能等于 C-C 键键能的三倍
B.N2 的 N ≡N 键非常牢固,不易断裂
C.CN)2分子(结构式为 N ≡C C ≡N )中 N C 键的键长大于 C C 键的键长
D.白磷( P4 )分子呈正四面体结构,其键角为 109°28′
二、填空题
16.氯吡苯脲是一种常用的膨大剂,其结构简式为 ,它是经国家批准使用的植物生长调节剂。
(1)氯元素基态原子核外电子的未成对电子数为 。
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为 ,羰基碳原子的杂化轨道类型为 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如下:
反应过程中,每生成1mol氯吡苯脲,断裂 个σ键,断裂 个π键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为 。
②H2O、NH3、CO2分子的空间结构分别是 ,中心原子的杂化类型分别是 。
17.根据元素在体内含量不同,可将体内元素分为常量元素和微量元素。其中H、C、O、N、S、P等为常量元素,Fe、Zn等为微量元素。回答下列问题:
(1)锌的氨合离子[Zn(NH3)4]2+中存在的化学键有 。
A.离子键 B.共价键 C.配位键 D.氢键 E.键 F.键
(2)数据表明,S的第一电离能小于P的第一电离能,其原因可能有两种:一种原因是S失去的是已经配对的电子,配对电子相互排斥,电离能较低,另一种是原因是 。
(3)氧与氮可形成正离子,其空间构型为 。
(4)原子的电子亲和能是指在-273℃下的气相中,原子获得电子变成负离子时所释放的能量。氧原子的第二电子亲和能(O-+e-→O2-的能量)不能直接在气相中测定,但可通过如图的born-Haber循环计算得到。
由图可知,Mg原子的第一电离能为 kJ·mol-1,O=O键键能为 kJ·mol-1,氧原子的第二电子亲和能为 kJ·mol-1。
三、解答题
18.氮及其化合物在生产生活中有广泛的应用。回答下列问题:
(1)基态N原子的核外电子共有 种空间运动状态;第一电离能从大到小的顺序为 。
(2)标准状况下,1体积水最多能溶解0.024体积,1体积水最多能溶解0.485体积,在水中溶解度大于的原因是 。
(3)的VSEPR模型为 ,与互为等电子体的粒子有 (任意写出两种)。
(4)联氨可用于处理水中的溶解氧,其反应机理如下图所示:
①的沸点高于的原因为 。
②等物质的量的与中所含键数目之比为 。
(5)氮化钼晶胞如图所示,氮化钼的化学式为 ;若晶胞边长为,则晶体的密度为 为阿伏加德罗常数的值)。
19.如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:
①
② ③ ④ ⑤
⑥ ⑦ ⑧ ⑨
⑩
(1)表中元素⑩的价层电子排布式为 ,该元素基态原子核外未成对电子有 个。
(2)第二周期所有元素中第一电离能介于③与④之间的有 种,在标号的主族元素中,电负性最大的是 (填元素符号)。
(3)元素①和⑦能形成阴离子,其空间结构为 ;元素⑤和⑧所形成的阴离子中,P的杂化轨道类型是 。
(4)在元素周期表中存在对角线规则。如元素②与⑦在周期表中处于对角线位置,则化学性质相似,②的氧化物、氢氧化物也有两性,则②的氢氧化物与⑥的氢氧化物,以物质的量比1∶2反应时的化学方程式为 。
(5)元素 可形成的卤化物的熔点如下表:
卤化物 氟化物 氯化物 溴化物
熔点/℃ 1000 77.75 122.3
元素 的氟化物的化学式为 ,该元素氟化物的熔点比其氯化物熔点高很多的原因是 (已知该氟化物易溶于稀盐酸)。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.冠醚中除含有C、H元素外,还含有O元素,因此冠醚不属于烃,属于烃的衍生物,故A错误;
B.超分子是由两种或两种以上分子通过分子间相互作用形成的分子聚集体,因此冠醚和杯酚不属于超分子,故B错误;
C.冠醚是由C、H、O三种元素组成,完全燃烧生成CO2和H2O,故C正确;
D.(1)有5个氧原子,(2)中有6个氧原子,因此两者不属于同系物,故D错误;
答案为C。
2.B
【详解】A.PH3中P原子的价层电子对数为4,分子空间构型为三角锥形,所有原子不可能共平面,A错误;
B.1molP4中含6molP-P键,31gP4的物质的量为0.25mol,含P-P键数目为1.5NA,B正确;
C.同周期从左往右电负性逐渐增强,同主族从上往下电负性减弱,故电负性O>P>H>K,C错误;
D.根据P4的空间构型,P4中P原子为sp3杂化,D错误;
故选B。
3.C
【详解】A.配体为氨气和氯离子,故中心原子的配位数为6,A正确;
B.根据化合价代数和为0,Ti的化合价为+3价,B正确;
C.1mol[Ti(NH3)5Cl]Cl2含有σ键的数目为:(6+35)NA=21NA,C错误;
D.配合物中内界和外界之间为离子键,1mol配合物可电离出2mol氯离子,故可产生2molAgCl白色沉淀,D正确;
故选C。
4.A
【详解】A.A中分子为对映异构体,A正确;
B.As原子序数为33,位于第4周期,核外4个电子层,每层电子数由内而外为2、8、18、5,B错误;
C.配位键由F原子提供孤电子对,应由F原子指向B原子,C错误;
D.HF存在分子间氢键,“...”表示氢键,D错误;
故选A。
5.A
【分析】根据题目所给图象可推得,A为N元素、B为O元素、C为F元素、D为Cl元素、E为Si元素。
【详解】A.同主族从上到下元素非金属性递减,非金属性越强,简单氢化物越稳定,则F、Cl元素气态氢化物稳定性HCl < HF,HF分子间有氢键,沸点比HCl高,A错误;
B.同周期从左到右主族元素非金属性递增,非金属性越强,对应阴离子的还原性越弱,N、O、F对应的简单氢化物的还原性HF < H2O < NH3,B正确;
C.中心原子价电子对数,中心原子价电子对数,则两分子的中心原子均为即杂化,但中有孤电子对,两者的键角大小不同,C正确;
D.分子中各原子均达8电子稳定结构,具有相同价电子数和相同原子数的分子或离子互为等电子体,则与CCl4互为等电子体,D正确;
综上,本题选A。
6.D
【详解】A.As2O3中每个As原子价电子对数是4,且含有一对孤电子对,根据价层电子对互斥模型判断As原子杂化方式为sp3杂化,A错误;
B.只含共价键的化合物为共价化合物,含有离子键的化合物为离子化合物,该物质是由阳离子Li+和阴离子通过离子键构成的化合物,因此LiAlH4为离子化合物,B错误;
C.AsCl3中As原子价电子对数3+,且As原子上含有一对孤电子对,根据价层电子对互斥模型判断其空间结构为三角锥形,C错误;
D.AsH3中As原子价电子对数3+,且As原子含有一对孤电子对,根据价层电子对互斥模型判断其空间结构为三角锥形,D正确;
故合理选项是D。
7.C
【详解】A.与氨水反应首先生成沉淀,氨水过量后,溶解形成,故反应后铜元素以形式存在,表述2错误,A项错误;
B.水分子能形成分子间氢键,而不能,故沸点比高,两种表述不存在因果关系,B项错误;
C.中心S原子为杂化,说明中心S原子价电子对数为4,含1对孤电子对,的空间结构为三角锥形,两种表述正确且存在因果关系,C项正确;
D.溶于水与水反应生成,电离产生自由移动的离子从而导电,表述1错误,葡萄糖为非电解质,溶于水不电离,故不能导电,二者均属于共价化合物,D项错误;
故选C。
8.C
【详解】A.C60为分子晶体,三态变化破坏较弱的范德华力,熔点低;而石墨是混合型晶体,三态变化破坏共价键和分子间作用力,故其熔点高,则C60的熔点比石墨的熔点低,A项正确;
B.C60分子中碳原子的杂化方式为sp2和sp3,甲烷分子中只含有单键碳原子,碳原子的杂化方式为sp3,两者杂化方式不完全相同,B项正确;
C.由C60的结构可知,分子中既含σ键、又含π键,C项错误;
D.C60为分子晶体,影响足球烯的熔、沸点的是分子间作用力,D项正确;
故选C。
9.C
【详解】A.电子层数越多,离子半径越大,电子层数相同时,核电荷数越大,离子半径越小,第三周期元素的简单离子中,Na、Mg、Al原子对应的离子核外有2个电子层,从Si到Cl原子对应的简单离子核外有3个电子层,则离子半径最小的是,故A正确;
B.中Al原子价层电子对数为,不含孤电子对,空间结构是正四面体形,故B正确;
C.羧基中碳氧双键对单键的作用力大于单键之间的作用力,所以键角α<β,故C错误;
D.乙酸属于羧酸,含有的官能团为羧基,乙醇属于醇,含有的官能团为羟基,将乙酸直接还原成乙醇,通过官能团间的转化实现了物质类别的转化,故D正确;
故答案选C。
10.C
【详解】A.碳原子半径大于氧原子半径,键长越长,键能越小,所以碳碳单键比碳氧单键键长长,键能小,A正确;
B.同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能:,B正确;
C.该分子中N原子和氨气分子中N原子价电子对数都是4,且都含有1个孤电子对,N原子采用sp3杂化,则两个N原子都呈三角锥形结构,C-N之间成键电子离N较远,C-N键长比H-N长,所以键角比氨气分子中大,C错误;
D.手性碳原子是指碳原子周围连有4个不同的原子团,该分子中手性碳原子如图,所以该分子中含有2个手性碳原子,D正确;
故选C。
11.B
【详解】A.III的结构不对称,III的核磁共振氢谱显示有6种不同化学环境的氢原子,该分子中含有C、H、O三种元素且含有苯环,该分子不属于芳香烃,属于芳香族化合物,没有亲水基,只有憎水基,故不易溶于水,A错误;
B.III与足量的H2加成后产物的结构简式为:,两个环连接的碳原子为手性碳原子,共2个手性碳原子,B正确;
C.I中亚甲基具有甲烷结构特点,故所有原子不可能位于同一平面内,亚甲基上的碳原子、氧原子的价层电子对数均为4,则杂化方式均为sp3杂化,苯环上的碳原子杂化方式为sp2杂化,C错误;
D.II中含醇羟基,不含羧基和酚羟基,该物质无酸性,不能使紫色石蕊试液变红,不能与碳酸钠溶液反应,D错误;
故选B。
12.B
【详解】A. [Zn(CN)4]2-中由Zn2+提供空轨道,C原子提供电子对形成配位键,结构示意图表示为:,故A正确;
B. H2O分子中心原子O采用sp3杂化,有两对孤电子对,H—O—H的键角小于109.5°与HCHO分子中心原子C采用sp2杂化,H—C—O的键角为120°,前者小于后者,故B错误;
C.CN-中碳原子电负性小,更容易给出孤电子对, 则CN-和H2O与Zn2+的配位能力:CN->H2O,故C正确;
D. [Zn(CN)4]2-中含有4+4=8个σ键,[Zn(H2O)4]2+中含有4+4×2=12个σ键,σ键数目之比为2:3,故D正确;
故选B。
13.A
【详解】A.的结构简式为CH3COCH2COCH3,含有14个σ键,100g中,即1mol,σ键数目为14NA,A说法错误;
B.标况下每消耗67.2L NH3即3mol,生成1mol Cr(C5H7O2)3,其数目为NA,B说法正确;
C.Cr(C5H7O2)3中Cr3+与3个C5H7O中的碳原子形成3个配位键,则1mol Cr(C5H7O2)3中含有配位键数目为3NA,C说法正确;
D.1mol 完全反应生成C5H7O2,则脱去1mol H+,数目为NA,D说法正确;
答案为A。
14.C
【详解】A. Cu的晶体为面心立方最密堆积,配位数为12,Zn晶体为六方堆积,配位数为12,故A正确;
B. 由图知,该物质中,Zn2+的配位数为5,配原子为O、N,故B正确;
C.基态Zn价电子排布式为:3d104s2,基态Zn2+价电子排布式为:3d10,故C不正确;
D. 电负性强弱与非金属性相关,非金属性强则电负性大,同周期从左向右电负性增大,同主族从上到下电负性减小,电负性大小顺序为: ,故D正确;
答案选C。
15.B
【详解】A.碳碳三键中两个是π键,一个是σ键,碳碳单键是σ键,C≡C的键能小于C-C的键能的三倍,故A错误;
B.氮分子中的N≡N键的键能较大,使得N≡N键非常牢固,不易断裂,故B正确;
C.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其形成的共价键的键长越长,碳原子半径大于氮原子,所以氰分子中C≡N键长小于C≡C键长,而C≡C键长又小于C C 键的键长,因此N≡C 键的键长小于 C C 键的键长,故C错误;
D.白磷的分子的结构为,白磷分子呈正四面体,键角60°,故D错误;
故选B。
16.(1)1
(2) sp2、sp3 sp2
(3) NA NA
(4) H—O键的键能大于H—N键的键能 V形、三角锥形、直线形 sp3、sp3、sp
【详解】(1)根据构造原理可知,氯元素基态原子核外电子排布式是1s22s22p63s23p5,所以未成对电子数为1;
(2)根据氯吡苯脲的结构简式可知,有2个氮原子均形成3个单键,孤电子对数为1,属于sp3杂化;剩余1个氮原子形成1个双键和1个单键,孤电子对数为1,是sp2杂化;羰基碳原子形成2个单键和1个双键,为sp2杂化。
(3)由于σ键比π键更稳定,根据反应方程式可以看出,断裂的化学键为异氰酸苯酯分子中的N=C键中的π键和2-氯-4-氨基吡啶分子中的N—H键;故每生成1mol氯吡苯脲,断裂1mol σ键,断裂1mol π键,则断裂NA个σ键,断裂NA个π键。
(4)①O、N属于同周期元素,O的原子半径小于N,H—O键的键能大于H—N键的键能,所以H2O分子比NH3分子稳定。
②H2O分子中O原子的价层电子对数=2+=4,孤电子对数为2,所以为V形结构,O原子采用sp3杂化;
NH3分子中N原子的价层电子对数=3+=4,孤电子对数为1,所以为三角锥形结构,N原子采用sp3杂化;
CO2分子中C原子的价层电子对数=2+=2,不含孤电子对,所以是直线形结构,C原子采用sp杂化。
17. BCE 磷原子的3p轨道电子排布为半充满稳定结构,第一电离能较高 直线形 737.7 498.4 -899.7
【详解】(1)锌的氨合离子[Zn(NH3)4]2+是一个配合离子,锌离子和氨分子之间存在配位键、氨分子内氮原子氢原子之间是共价键,N-H属于键,故存在的化学键有BCE。
(2) 磷原子的3p轨道电子排布呈半充满、结构稳定,故另一种是原因是磷原子的3p轨道电子排布为半充满稳定结构,第一电离能较高。
(3) 价电子数和原子数分别都相等的是等电子体,氧与氮形成的正离子与二氧化碳互为等电子体,CO2是直线型结构,所以根据等电子原理,空间构型为直线形。
(4)Mg原子的第一电离能是气态的镁原子失去一个电子吸收的能量,由图可知,Mg原子的第一电离能为737.7kJ·mol-1,O=O键的键能是断开形成2个O原子吸收的能量,由图可知,O=O键键能为2×249.2kJ·mol-1=498.4kJ·mol-1;设O-+e-→O2-的释放的能量为a,根据盖斯定律,有-601.2kJ·mol-1=146.4kJ·mol-1+737.7kJ·mol-1+1450.6kJ·mol-1+249.2kJ·mol-1-141.8kJ·mol-1+xkJ·mol-1-3943kJ·mol-1,解得:x=899.7,因此氧原子的第二电子亲和能为-899.7kJ·mol-1
18.(1) 5 N>O>H
(2)NO为极性分子,氮气为非极性分子
(3) 平面三角形 O3、SO2等
(4) N2H4分子间氢键数目多于NH3分子间氢键数目 1∶2
(5) Mo2N
【详解】(1)基态N的电子排布式为1s22s22p3,共占据5个轨道,因此核外电子共有5种空间运动状态;同周期元素,第一电离能随着原子序数递增而呈增大趋势,但第ⅤA族元素最高能级轨道为半充满,比较稳定,第一电离能大于相邻元素,因此N的第一电离能大于O,所以三种元素的第一电离能:N>O>H;故答案为5;N>O>H;
(2)NO为极性分子,氮气为非极性分子,水分子为极性分子,根据“相似相溶”原理,NO在水中溶解度大于N2;故答案为NO为极性分子,氮气为非极性分子;
(3)NO中心N原子的价层电子对数为3+=3,VSEPR模型为平面三角形;价电子总数和原子总数相同的分子、离子或基团互称为等电子体,则与NO互为等电子体的微粒是O3、SO2等;故答案为平面三角形;O3、SO2等;
(4)①N2H4、NH3都是分子晶体,由于都含有N-H键,N元素的非金属性强、原子半径小,所以二者的分子之间还都存在氢键,由于N2H4分子间氢键数目多于NH3分子间氢键数目,因此克服氢键肼需要较高能量,因此肼的沸点高于氨气;故答案为N2H4分子间氢键数目多于NH3分子间氢键数目;
②1mol[Cu(NH3)2]+所含σ键数目为(2+2×3)NA=8NA,1mol[Cu(NH3)4]+所含σ键数目为(4+4×3)NA=16NA,因此两者所含σ键数目之比为8NA:16NA=1:2,故答案为1:2;
(5)晶胞中,Mo原子位于顶点和面心,个数为=4,N原子位于棱上和体心,个数为=2,因此化学式为Mo2N;晶胞的质量为g,晶胞的体积为(a×10-10)3cm3,根据密度定义,该晶体的密度为g/cm3=g/cm3;故答案为Mo2N;。
19.(1) 3d64s2 4
(2) 3 O
(3) 正四面体形 sp3
(4)Be(OH)2 + 2NaOH = Na2BeO2 + 2H2O
(5) 是离子晶体,是分子晶体
【分析】根据11种元素在周期表位置,11种元素分别为H、Be、B、N、O、Na、Al、P、Cl、Fe、Ga,据此分析;
【详解】(1)⑩号元素为Fe,价层电子包括最外层和次外层d能级上的电子,即基态Fe价层电子排布式为3d64s2,d能级有5个原子轨道,最多容纳10个电子,因此基态铁原子核外未成对电子有4个;故答案为3d64s2;4;
(2)③④元素分别为B、N,同周期从左向右第一电离能增大的趋势,但ⅡA>ⅢA,ⅣA>ⅥA,因此介于两者之间的元素为Be、C、O,有3种元素;同周期从左向右电负性逐渐增大,从上到下,电负性逐渐减小,因此所给元素中电负性最大的是O;故答案为3;O;
(3)AlH中Al的价层电子对数为4+=4,其空间构型为正四面体;PO中P的价层电子对数为4+=4,价层电子对数等于杂化轨道数,即P的杂化类型为sp3;故答案为正四面体;sp3;
(4)②的氢氧化物为Ba(OH)2,⑥的氢氧化物为NaOH,以物质的量之比为1∶2反应时的化学方程式为Ba(OH)2+2NaOH=Ba2BeO2+2H2O;故答案为Ba(OH)2+2NaOH=Ba2BeO2+2H2O;
(5)该元素为Ga,氟化镓的化学式为GaF3,根据表中数据,氟化镓的熔点比其余两种高很多,推出它们是不同晶体,即氟化镓为离子晶体,氯化镓、溴化镓为分子晶体;故答案为GaF3;GaF3是离子晶体,GaCl3是分子晶体。
答案第1页,共2页
答案第1页,共2页
