微主题6 沉淀溶解平衡 热练(含解析)—2024年高考化学二轮复习
文档属性
| 名称 | 微主题6 沉淀溶解平衡 热练(含解析)—2024年高考化学二轮复习 |  | |
| 格式 | doc | ||
| 文件大小 | 217.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-19 13:39:16 | ||
图片预览



文档简介
微主题6 沉淀溶解平衡
1 (2023泰州姜堰中学阶段练习)向10 .00 mL 0.50 mol·L-1 NaHCO3溶液中滴加不同浓度的CaCl2溶液,观察到产生明显浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法正确的是( )
实验 序号 c(CaCl2)/(mol·L-1) 滴加CaCl2溶液时的实验现象 加热浑浊液时的实验现象
① 0.05 至1.32 mL时产生明显浑浊,但无气泡产生 有较多气泡生成
② 0.005 至15.60 mL时产生明显浑浊,但无气泡产生 有少量气泡生成
③ 0.000 5 至20 mL时未见浑浊
A. ①中产生浑浊的原因是c(Ca2+)·c(CO)B. 未加热前①和②中均发生反应:2HCO+Ca2+===CaCO3↓+H2CO3
C. 加热浑浊液产生气泡主要是因为CaCO3受热分解产生了更多的CO2
D. 向上述NaHCO3溶液中逐滴滴加0.5 mol·L-1 CaCl2溶液,一定会同时产生浑浊和气泡
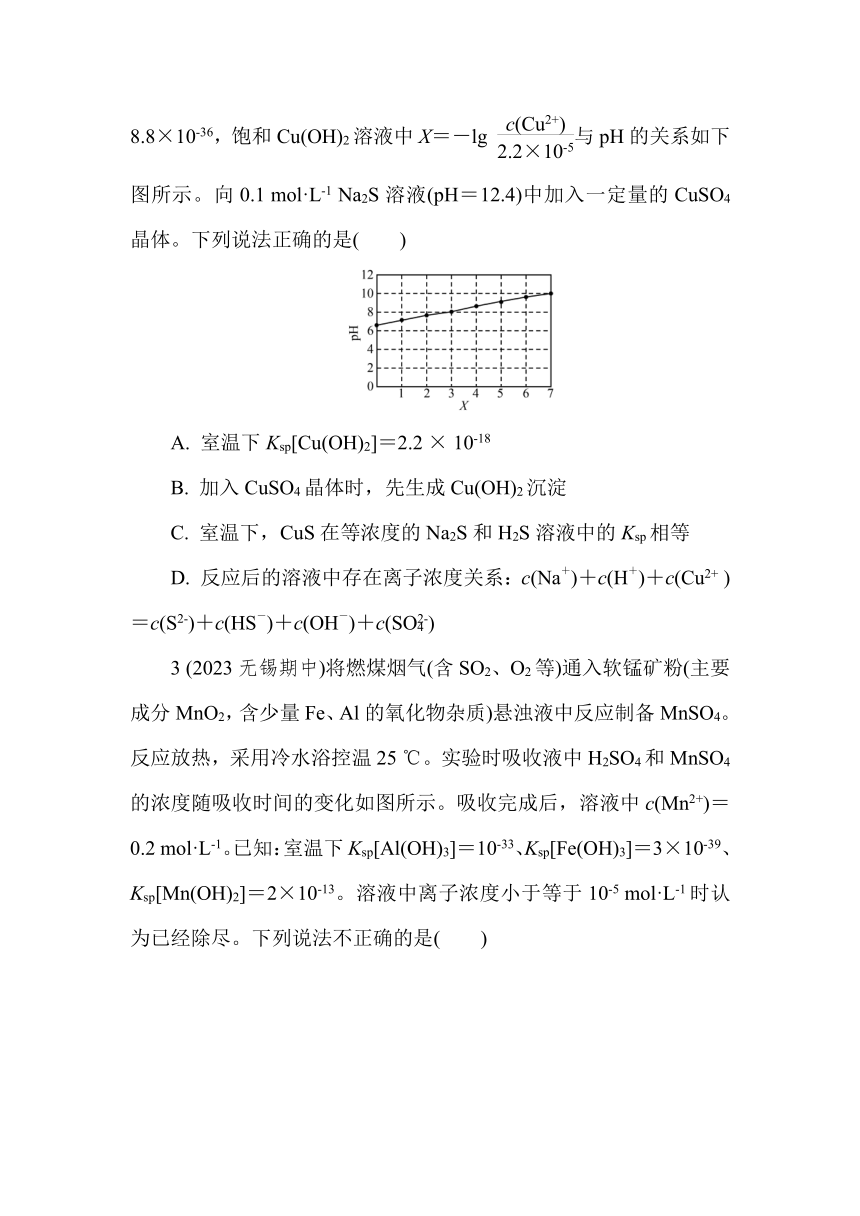
2 (2023常州前黄高级中学适应性考试)室温下,已知Ksp(CuS)=8.8×10-36,饱和Cu(OH)2溶液中X=-lg 与pH的关系如下图所示。向0.1 mol·L-1 Na2S溶液(pH=12.4)中加入一定量的CuSO4晶体。下列说法正确的是( )
A. 室温下Ksp[Cu(OH)2]=2.2 × 10-18
B. 加入CuSO4晶体时,先生成Cu(OH)2沉淀
C. 室温下,CuS在等浓度的Na2S和H2S溶液中的Ksp相等
D. 反应后的溶液中存在离子浓度关系:c(Na+)+c(H+)+c(Cu2+ )=c(S2-)+c(HS-)+c(OH-)+c(SO)
3 (2023无锡期中)将燃煤烟气(含SO2、O2等)通入软锰矿粉(主要成分MnO2,含少量Fe、Al的氧化物杂质)悬浊液中反应制备MnSO4。反应放热,采用冷水浴控温25 ℃。实验时吸收液中H2SO4和MnSO4的浓度随吸收时间的变化如图所示。吸收完成后,溶液中c(Mn2+)=0.2 mol·L-1。已知:室温下Ksp[Al(OH)3]=10-33、Ksp[Fe(OH)3]=3×10-39、Ksp[Mn(OH)2]=2×10-13。溶液中离子浓度小于等于10-5 mol·L-1时认为已经除尽。下列说法不正确的是( )
A. MnO2和SO2的反应为MnO2+SO2===MnSO4
B. 控温25 ℃有利于提高悬浊液对SO2的吸收率
C. MnO2对该体系中的副反应具有催化作用
D. 调节吸收液pH为5,可除去Fe3+、Al3+杂质
4 (2023常州调研)已知室温下Ka1(H2S)=10-7,Ka2(H2S)=10-12.9。通过下列实验探究含硫化合物的性质。
实验1:测得0.1 mol·L-1H2S溶液pH=4.1;
实验2:向10 mL 0.1 mol·L-1NaHS溶液中逐滴加入5 mL水,用pH计监测过程中pH变化;
实验3:向10 mL 0.1 mol·L-1H2S溶液中逐滴加入0.1 mol·L-1NaOH溶液,直至pH=7;
实验4:向5 mL 0.1 mol·L-1Na2S中滴加10 mL 0.1 mol·L-1MnSO4溶液,产生粉色沉淀,再加几滴0.1 mol·L-1CuSO4溶液,产生黑色沉淀。
下列说法不正确的是( )
A. 由实验1可知:0.1 mol·L-1 H2S溶液中c(S2-)B. 实验2加水过程中,监测结果为溶液的pH不断减小
C. 实验3所得溶液中存在:c(H2S)+c(Na+)-c(S2- )=0.1 mol·L-1
D. 由实验4 可知:Ksp(MnS)>Ksp(CuS)
5 (2023南通通州质量监测)室温下:Ka1(H2C2O4)=5×10-2、Ka2(H2C2O4)=1×10-4、Ksp(CaC2O4)=2.5×10-9。通过下列实验探究某些草酸盐的性质。
实验①:用pH计测得0.100 mol·L-1 K2C2O4溶液的pH=8;
实验②:向0.10 mol·L-1 KHC2O4溶液中滴入少量酸性高锰酸钾溶液,振荡后溶液紫色褪去;
实验③:向0.10 mol·L-1 K2C2O4溶液中滴加一定浓度的稀盐酸后,混合溶液的pH=7;
实验④:向0.10 mol·L-1 KHC2O4溶液中加入一定体积等浓度CaCl2 溶液产生白色沉淀,测得上层清液的pH=4,c(Ca2+)=10-4 mol·L-1。
下列说法正确的是( )
A. 实验①溶液中: eq \f(c(H2C2O4),c(C2O))=2×10-3
B. 实验②说明KHC2O4溶液具有漂白性
C. 实验③反应所得溶液中存在:c(K+)=2c(C2O)+c(HC2O)
D. 实验④所得上层清液中的c(HC2O)=2.5×10-5 mol·L-1
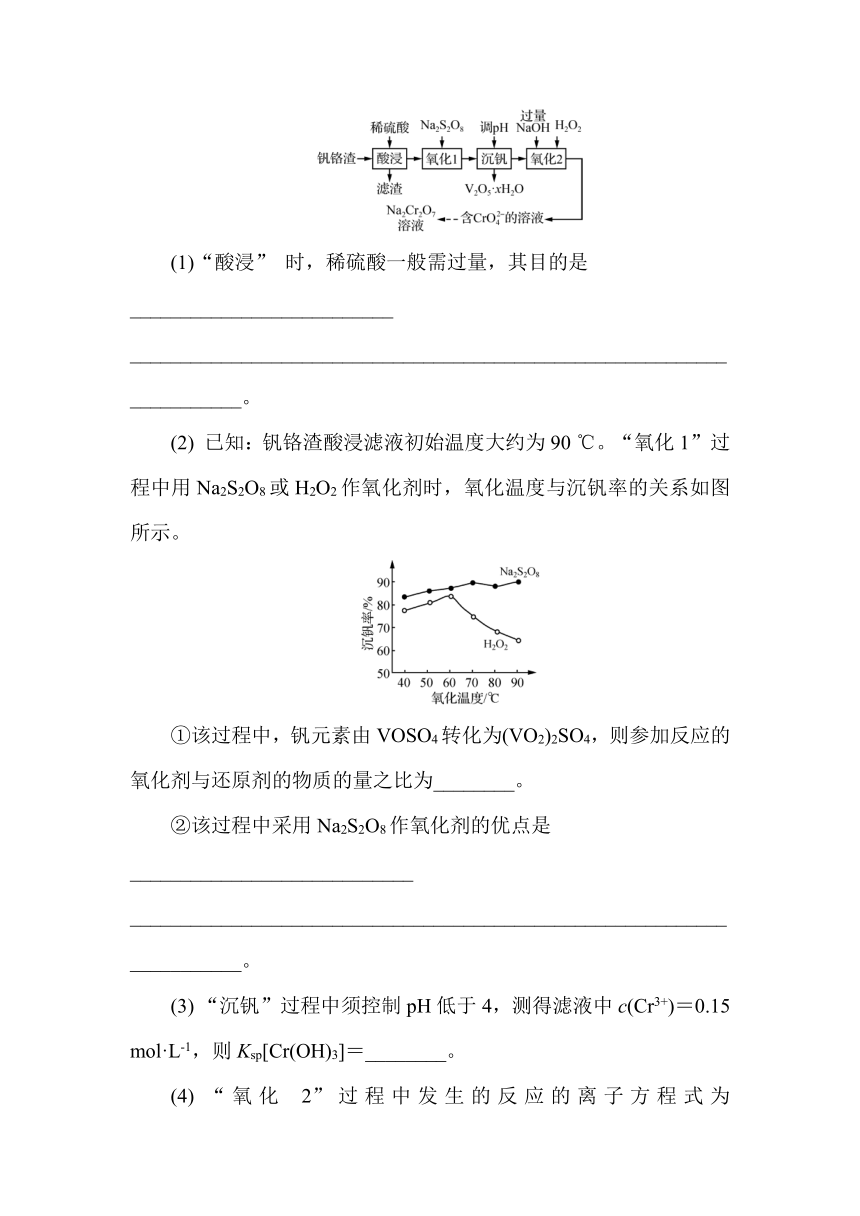
6 (2023南通通州期中)利用钒铬渣[主要成分为VO2·xH2O、Cr(OH)3及少量的SiO2]制取Na2Cr2O7的工艺流程如图所示。
(1)“酸浸” 时,稀硫酸一般需过量,其目的是__________________________
______________________________________________________________________。
(2) 已知:钒铬渣酸浸滤液初始温度大约为90 ℃。“氧化1”过程中用Na2S2O8或H2O2作氧化剂时,氧化温度与沉钒率的关系如图所示。
①该过程中,钒元素由VOSO4转化为(VO2)2SO4,则参加反应的氧化剂与还原剂的物质的量之比为________。
②该过程中采用Na2S2O8作氧化剂的优点是____________________________
______________________________________________________________________。
(3) “沉钒”过程中须控制pH低于4,测得滤液中c(Cr3+)=0.15 mol·L-1,则Ksp[Cr(OH)3]=________。
(4) “氧化 2”过程中发生的反应的离子方程式为_______________________。
(5) 通过上述流程制取的Na2Cr2O7可测定钒铬渣中Cr(OH)3含量。取由2.06 g钒铬渣样品转化获得的Na2Cr2O7(含少量Na2CrO4)溶液,向其中加入2 mol·L-1 H2SO4溶液和足量KI溶液(铬元素的还原产物为Cr3+),放于暗处5 min,再加入几滴淀粉溶液,用0.100 mol·L-1 Na2S2O3标准溶液滴定(I2+2S2O===2I-+S4O),共用去标准液15.00 mL,求钒铬渣中Cr(OH)3的含量(其他杂质不参与反应,写出计算过程)。
微主题6 沉淀溶解平衡
1. B 根据溶度积规则,①中能产生CaCO3沉淀,说明c(Ca2+)·c(CO)>Ksp(CaCO3),A错误;未加热前①和②不放出CO2,说明碳酸没有达到饱和,加热后碳酸分解放出CO2,所以未加热前①和②中均发生反应:2HCO+Ca2+===CaCO3↓+H2CO3,B正确;加热前①和②中发生了反应:2HCO+Ca2+===CaCO3↓+H2CO3,CaCO3在溶液中受热不分解,加热浑浊液产生气泡主要是因为H2CO3受热分解产生了更多的CO2,C错误;实验中是否产生浑浊和气泡与加入的CaCl2溶液的浓度和体积有关,所以向上述NaHCO3溶液中逐滴滴加0.5 mol·L-1 CaCl2溶液,开始滴加时CaCl2溶液量少,可能不会产生浑浊和气泡,D错误。
2. C 当X=7时,溶液pH=10,则室温下Ksp[Cu(OH)2]=c(Cu2+)·c2(OH— )=2.2 × 10-12×(1×10—4)2=2.2 × 10-20,A错误;向0.1 mol·L-1 Na2S溶液中加入CuSO4晶体时,Na2S溶液与CuSO4溶液反应生成溶度积小的CuS沉淀,不可能生成Cu(OH)2沉淀,B错误;CuS的溶度积是温度函数,温度不变,溶度积的大小不变,所以室温下,CuS在等浓度的Na2S和H2S溶液中的溶解度不同,但溶度积相等,C正确;Na2S溶液与CuSO4溶液反应生成CuS沉淀和Na2SO4,所以反应后的溶液中存在的电荷守恒关系为c(Na+)+ c(H+)+2c(Cu2+ )=2c(S2-)+c(HS-)+c(OH- )+2c(SO),D错误。
3. C MnO2有氧化性,能与还原性气体SO2发生氧化还原反应,MnO2和SO2反应为MnO2+SO2===MnSO4,A正确;反应本身放热,采用冷水浴控温25 ℃,降低温度可提高含硫烟气中SO2的吸收率,B正确;由实验时吸收液中H2SO4和MnSO4的浓度随吸收时间的变化图像可知,MnO2对该体系中的副反应不具有催化作用,C错误;Ksp[Fe(OH)3]=3×10-39=c(Fe3+)·c3(OH-)=1×10-5×c3(OH-),Fe3+完全除去时pH约为2.7,同理Ksp[Al(OH)3]=10-33=c(Al3+)·c3(OH-)=1×10-5×c3(OH-),Al3+完全沉淀的pH约为4.7,调节吸收液pH为5,可除去Fe3+、Al3+杂质,且此时c(Mn2+)·c2(OH-)=0.2×(10-9)2=2×10-194. C pH=4.1,则c(H+)=10-4.1 mol·L-1,c(OH-)===10-9.9 mol·L-1,H2S的电离以一级电离为主,c(H+)≈c(HS-)=10-4.1 mol·L-1,根据二级电离常数Ka2=,可得c(S2-)=Ka2=10-12.9 mol·L-1,A正确;NaHS溶液中存在HS-的电离和水解,其中Kh===10-7,其电离常数小于水解常数,可知以水解为主,溶液显碱性,稀释过程中溶液碱性减弱,pH减小,B正确;向10 mL 0.1 mol·L-1 H2S溶液中逐滴加入0.1 mol·L-1 NaOH溶液,直至pH=7,则c(H+)=c(OH-),根据电荷守恒,可得①c(Na+)=c(HS-)+2c(S2-),由于溶液体积增大,根据元素质量守恒可得②c(S2-)+c(HS-)+c(H2S)<0.1 mol·L-1,联立①、②可得c(H2S)+c(Na+)-c(S2-)<0.1 mol·L-1,C错误;向5 mL 0.1 mol·L-1 Na2S中滴加10 mL 0.1 mol·L-1 MnSO4溶液,产生粉色沉淀,其中0.1 mol·L-1 MnSO4溶液过量,S2-全部沉淀,再加几滴0.1 mol·L-1 CuSO4溶液,产生黑色沉淀,说明粉色沉淀转化成黑色沉淀,即Ksp(MnS)>Ksp(CuS),由难溶向更难溶转化,D正确。
5. D 溶液的pH=8,则c(H+)=10-8 mol·L-1,Ka1(H2C2O4)= eq \f(c(H+)·c(HC2O),c(H2C2O4)),Ka2(H2C2O4)= eq \f(c(H+)·c(C2O),c(HC2O)),Ka1·Ka2= eq \f(c2(H+)·c(C2O),c(H2C2O4)),所以 eq \f(c(H2C2O4),c(C2O))===2×10-11,A错误;实验②说明KHC2O4溶液具有还原性,不是漂白性,B错误;溶液中存在电荷守恒c(K+)+c(H+)=c(Cl-)+c(OH-)+2c(C2O)+c(HC2O),溶液显中性,则c(H+)=c(OH-),所以c(K+)=c(Cl-)+2c(C2O)+c(HC2O),C错误;上层清液的pH=4,则c(H+)=10-4 mol·L-1,c(Ca2+)=10-4 mol·L-1,则c(C2O)===2.5×10-5 mol·L-1,c(HC2O)= eq \f(c(H+)·c(C2O),Ka2)==2.5×10-5 mol·L-1,D正确。
6. (1) 提高浸取率、抑制Cr3+水解 (2) ①1∶2
②相同温度时沉钒率高;在90 ℃时可直接使用,无需降温,节约能耗 (3) 1.5×10-31
(4) 2Cr3++3H2O2+10OH-===2CrO+8H2O
(5) 六价铬和碘离子反应生成碘单质和三价铬,碘单质被Na2S2O3标准溶液滴定;根据电子守恒可知,2Cr3+~3I2~6S2O,根据铬元素守恒可知,Cr(OH)3的物质的量=0.100 mol·L-1×15.00 ×10-3L×=5×10-4 mol,钒铬渣中Cr(OH)3的含量=×100%=2.5%
解析:(1) “酸浸” 时,稀硫酸一般需过量,其目的是增大反应物浓度、提高浸取率,同时使溶液显酸性,抑制Cr3+水解。(2) ①该过程中,钒元素由VOSO4转化为(VO2)2SO4,V的化合价由+4变为+5,VOSO4作为还原剂转移1个电子,Na2S2O8或H2O2作氧化剂,Na2S2O8中硫元素化合价由+7变为+6、H2O2中氧元素化合价由-1变为-2,作为氧化剂均转移2个电子,则根据电子守恒可知,参加反应的氧化剂与还原剂的物质的量之比为1∶2。②由图可知,采用Na2S2O8作氧化剂,在相同温度时沉钒率高,且在90 ℃时可直接使用无需降温,节约能耗;而对过氧化氢而言,温度过高会导致过氧化氢分解而降低反应效率。(3) “沉钒” 过程中须控制pH低于4,此时pOH=10,氢氧根离子浓度为10-10 mol·L-1,测得滤液中c(Cr3+)=0.15 mol·L-1,则Ksp[Cr(OH)3]=(10-10)3×0.15=1.5×10-31。(4) “氧化 2”过程中三价铬在碱性条件下被过氧化氢氧化为CrO,发生反应的离子方程式见答案。
1 (2023泰州姜堰中学阶段练习)向10 .00 mL 0.50 mol·L-1 NaHCO3溶液中滴加不同浓度的CaCl2溶液,观察到产生明显浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法正确的是( )
实验 序号 c(CaCl2)/(mol·L-1) 滴加CaCl2溶液时的实验现象 加热浑浊液时的实验现象
① 0.05 至1.32 mL时产生明显浑浊,但无气泡产生 有较多气泡生成
② 0.005 至15.60 mL时产生明显浑浊,但无气泡产生 有少量气泡生成
③ 0.000 5 至20 mL时未见浑浊
A. ①中产生浑浊的原因是c(Ca2+)·c(CO)
C. 加热浑浊液产生气泡主要是因为CaCO3受热分解产生了更多的CO2
D. 向上述NaHCO3溶液中逐滴滴加0.5 mol·L-1 CaCl2溶液,一定会同时产生浑浊和气泡
2 (2023常州前黄高级中学适应性考试)室温下,已知Ksp(CuS)=8.8×10-36,饱和Cu(OH)2溶液中X=-lg 与pH的关系如下图所示。向0.1 mol·L-1 Na2S溶液(pH=12.4)中加入一定量的CuSO4晶体。下列说法正确的是( )
A. 室温下Ksp[Cu(OH)2]=2.2 × 10-18
B. 加入CuSO4晶体时,先生成Cu(OH)2沉淀
C. 室温下,CuS在等浓度的Na2S和H2S溶液中的Ksp相等
D. 反应后的溶液中存在离子浓度关系:c(Na+)+c(H+)+c(Cu2+ )=c(S2-)+c(HS-)+c(OH-)+c(SO)
3 (2023无锡期中)将燃煤烟气(含SO2、O2等)通入软锰矿粉(主要成分MnO2,含少量Fe、Al的氧化物杂质)悬浊液中反应制备MnSO4。反应放热,采用冷水浴控温25 ℃。实验时吸收液中H2SO4和MnSO4的浓度随吸收时间的变化如图所示。吸收完成后,溶液中c(Mn2+)=0.2 mol·L-1。已知:室温下Ksp[Al(OH)3]=10-33、Ksp[Fe(OH)3]=3×10-39、Ksp[Mn(OH)2]=2×10-13。溶液中离子浓度小于等于10-5 mol·L-1时认为已经除尽。下列说法不正确的是( )
A. MnO2和SO2的反应为MnO2+SO2===MnSO4
B. 控温25 ℃有利于提高悬浊液对SO2的吸收率
C. MnO2对该体系中的副反应具有催化作用
D. 调节吸收液pH为5,可除去Fe3+、Al3+杂质
4 (2023常州调研)已知室温下Ka1(H2S)=10-7,Ka2(H2S)=10-12.9。通过下列实验探究含硫化合物的性质。
实验1:测得0.1 mol·L-1H2S溶液pH=4.1;
实验2:向10 mL 0.1 mol·L-1NaHS溶液中逐滴加入5 mL水,用pH计监测过程中pH变化;
实验3:向10 mL 0.1 mol·L-1H2S溶液中逐滴加入0.1 mol·L-1NaOH溶液,直至pH=7;
实验4:向5 mL 0.1 mol·L-1Na2S中滴加10 mL 0.1 mol·L-1MnSO4溶液,产生粉色沉淀,再加几滴0.1 mol·L-1CuSO4溶液,产生黑色沉淀。
下列说法不正确的是( )
A. 由实验1可知:0.1 mol·L-1 H2S溶液中c(S2-)
C. 实验3所得溶液中存在:c(H2S)+c(Na+)-c(S2- )=0.1 mol·L-1
D. 由实验4 可知:Ksp(MnS)>Ksp(CuS)
5 (2023南通通州质量监测)室温下:Ka1(H2C2O4)=5×10-2、Ka2(H2C2O4)=1×10-4、Ksp(CaC2O4)=2.5×10-9。通过下列实验探究某些草酸盐的性质。
实验①:用pH计测得0.100 mol·L-1 K2C2O4溶液的pH=8;
实验②:向0.10 mol·L-1 KHC2O4溶液中滴入少量酸性高锰酸钾溶液,振荡后溶液紫色褪去;
实验③:向0.10 mol·L-1 K2C2O4溶液中滴加一定浓度的稀盐酸后,混合溶液的pH=7;
实验④:向0.10 mol·L-1 KHC2O4溶液中加入一定体积等浓度CaCl2 溶液产生白色沉淀,测得上层清液的pH=4,c(Ca2+)=10-4 mol·L-1。
下列说法正确的是( )
A. 实验①溶液中: eq \f(c(H2C2O4),c(C2O))=2×10-3
B. 实验②说明KHC2O4溶液具有漂白性
C. 实验③反应所得溶液中存在:c(K+)=2c(C2O)+c(HC2O)
D. 实验④所得上层清液中的c(HC2O)=2.5×10-5 mol·L-1
6 (2023南通通州期中)利用钒铬渣[主要成分为VO2·xH2O、Cr(OH)3及少量的SiO2]制取Na2Cr2O7的工艺流程如图所示。
(1)“酸浸” 时,稀硫酸一般需过量,其目的是__________________________
______________________________________________________________________。
(2) 已知:钒铬渣酸浸滤液初始温度大约为90 ℃。“氧化1”过程中用Na2S2O8或H2O2作氧化剂时,氧化温度与沉钒率的关系如图所示。
①该过程中,钒元素由VOSO4转化为(VO2)2SO4,则参加反应的氧化剂与还原剂的物质的量之比为________。
②该过程中采用Na2S2O8作氧化剂的优点是____________________________
______________________________________________________________________。
(3) “沉钒”过程中须控制pH低于4,测得滤液中c(Cr3+)=0.15 mol·L-1,则Ksp[Cr(OH)3]=________。
(4) “氧化 2”过程中发生的反应的离子方程式为_______________________。
(5) 通过上述流程制取的Na2Cr2O7可测定钒铬渣中Cr(OH)3含量。取由2.06 g钒铬渣样品转化获得的Na2Cr2O7(含少量Na2CrO4)溶液,向其中加入2 mol·L-1 H2SO4溶液和足量KI溶液(铬元素的还原产物为Cr3+),放于暗处5 min,再加入几滴淀粉溶液,用0.100 mol·L-1 Na2S2O3标准溶液滴定(I2+2S2O===2I-+S4O),共用去标准液15.00 mL,求钒铬渣中Cr(OH)3的含量(其他杂质不参与反应,写出计算过程)。
微主题6 沉淀溶解平衡
1. B 根据溶度积规则,①中能产生CaCO3沉淀,说明c(Ca2+)·c(CO)>Ksp(CaCO3),A错误;未加热前①和②不放出CO2,说明碳酸没有达到饱和,加热后碳酸分解放出CO2,所以未加热前①和②中均发生反应:2HCO+Ca2+===CaCO3↓+H2CO3,B正确;加热前①和②中发生了反应:2HCO+Ca2+===CaCO3↓+H2CO3,CaCO3在溶液中受热不分解,加热浑浊液产生气泡主要是因为H2CO3受热分解产生了更多的CO2,C错误;实验中是否产生浑浊和气泡与加入的CaCl2溶液的浓度和体积有关,所以向上述NaHCO3溶液中逐滴滴加0.5 mol·L-1 CaCl2溶液,开始滴加时CaCl2溶液量少,可能不会产生浑浊和气泡,D错误。
2. C 当X=7时,溶液pH=10,则室温下Ksp[Cu(OH)2]=c(Cu2+)·c2(OH— )=2.2 × 10-12×(1×10—4)2=2.2 × 10-20,A错误;向0.1 mol·L-1 Na2S溶液中加入CuSO4晶体时,Na2S溶液与CuSO4溶液反应生成溶度积小的CuS沉淀,不可能生成Cu(OH)2沉淀,B错误;CuS的溶度积是温度函数,温度不变,溶度积的大小不变,所以室温下,CuS在等浓度的Na2S和H2S溶液中的溶解度不同,但溶度积相等,C正确;Na2S溶液与CuSO4溶液反应生成CuS沉淀和Na2SO4,所以反应后的溶液中存在的电荷守恒关系为c(Na+)+ c(H+)+2c(Cu2+ )=2c(S2-)+c(HS-)+c(OH- )+2c(SO),D错误。
3. C MnO2有氧化性,能与还原性气体SO2发生氧化还原反应,MnO2和SO2反应为MnO2+SO2===MnSO4,A正确;反应本身放热,采用冷水浴控温25 ℃,降低温度可提高含硫烟气中SO2的吸收率,B正确;由实验时吸收液中H2SO4和MnSO4的浓度随吸收时间的变化图像可知,MnO2对该体系中的副反应不具有催化作用,C错误;Ksp[Fe(OH)3]=3×10-39=c(Fe3+)·c3(OH-)=1×10-5×c3(OH-),Fe3+完全除去时pH约为2.7,同理Ksp[Al(OH)3]=10-33=c(Al3+)·c3(OH-)=1×10-5×c3(OH-),Al3+完全沉淀的pH约为4.7,调节吸收液pH为5,可除去Fe3+、Al3+杂质,且此时c(Mn2+)·c2(OH-)=0.2×(10-9)2=2×10-19
5. D 溶液的pH=8,则c(H+)=10-8 mol·L-1,Ka1(H2C2O4)= eq \f(c(H+)·c(HC2O),c(H2C2O4)),Ka2(H2C2O4)= eq \f(c(H+)·c(C2O),c(HC2O)),Ka1·Ka2= eq \f(c2(H+)·c(C2O),c(H2C2O4)),所以 eq \f(c(H2C2O4),c(C2O))===2×10-11,A错误;实验②说明KHC2O4溶液具有还原性,不是漂白性,B错误;溶液中存在电荷守恒c(K+)+c(H+)=c(Cl-)+c(OH-)+2c(C2O)+c(HC2O),溶液显中性,则c(H+)=c(OH-),所以c(K+)=c(Cl-)+2c(C2O)+c(HC2O),C错误;上层清液的pH=4,则c(H+)=10-4 mol·L-1,c(Ca2+)=10-4 mol·L-1,则c(C2O)===2.5×10-5 mol·L-1,c(HC2O)= eq \f(c(H+)·c(C2O),Ka2)==2.5×10-5 mol·L-1,D正确。
6. (1) 提高浸取率、抑制Cr3+水解 (2) ①1∶2
②相同温度时沉钒率高;在90 ℃时可直接使用,无需降温,节约能耗 (3) 1.5×10-31
(4) 2Cr3++3H2O2+10OH-===2CrO+8H2O
(5) 六价铬和碘离子反应生成碘单质和三价铬,碘单质被Na2S2O3标准溶液滴定;根据电子守恒可知,2Cr3+~3I2~6S2O,根据铬元素守恒可知,Cr(OH)3的物质的量=0.100 mol·L-1×15.00 ×10-3L×=5×10-4 mol,钒铬渣中Cr(OH)3的含量=×100%=2.5%
解析:(1) “酸浸” 时,稀硫酸一般需过量,其目的是增大反应物浓度、提高浸取率,同时使溶液显酸性,抑制Cr3+水解。(2) ①该过程中,钒元素由VOSO4转化为(VO2)2SO4,V的化合价由+4变为+5,VOSO4作为还原剂转移1个电子,Na2S2O8或H2O2作氧化剂,Na2S2O8中硫元素化合价由+7变为+6、H2O2中氧元素化合价由-1变为-2,作为氧化剂均转移2个电子,则根据电子守恒可知,参加反应的氧化剂与还原剂的物质的量之比为1∶2。②由图可知,采用Na2S2O8作氧化剂,在相同温度时沉钒率高,且在90 ℃时可直接使用无需降温,节约能耗;而对过氧化氢而言,温度过高会导致过氧化氢分解而降低反应效率。(3) “沉钒” 过程中须控制pH低于4,此时pOH=10,氢氧根离子浓度为10-10 mol·L-1,测得滤液中c(Cr3+)=0.15 mol·L-1,则Ksp[Cr(OH)3]=(10-10)3×0.15=1.5×10-31。(4) “氧化 2”过程中三价铬在碱性条件下被过氧化氢氧化为CrO,发生反应的离子方程式见答案。
同课章节目录
