第九单元溶液学习单-2023-2024学年九年级化学人教版下册(无答案)
文档属性
| 名称 | 第九单元溶液学习单-2023-2024学年九年级化学人教版下册(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 637.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-19 17:58:15 | ||
图片预览




文档简介
化学学科九年级下册9单元《溶液的形成》第1课时学习单
学习目标:
学习目标 学习任务 学习自评
认识溶解现象,知道溶液、溶剂、溶质等概念; 探究任务1
知道溶液是一类重要的物质,在生产和生活中有重要的应用。 探究任务2
一、课前预学单-(5分钟 )
[问题1]溶液的概念是什么?
一种或几种物质 到另一种物质里,形成 、 的 ,叫做溶液。
溶液由 和 组成。
(3)溶剂是 。
(4)溶质是 。
(5)质量关系:
溶液的质量= +
[问题2] 从溶液的概念中可以发现它的特征有哪些?
溶液的特征是 、 。
二、课中共学单-(30分钟 )
(一)探究深化-(18分钟 )
1. 探究任务1
[问题3]如何从微观上理解溶解这一现象?
阅读P27-28,回答下列问题。
[问题4]同种溶质在不同溶剂中的溶解能力相同吗?
[问题5]不种溶质在相同溶剂中的溶解能力相同吗?
探究任务2
[问题6]如何确定溶液中的溶质和溶剂?
阅读P28,回答下列问题。
乙醇能否溶于水?
溶质、溶剂分别是什么物质?
教师点拨释疑
(二)当堂反馈-( 5分钟 )
1.将下列物质分别放入或通入水中,不能形成溶液的是( )
A.食用油 B.酒精
C.食盐 D.氯化氢气体
2. 抗击“新型冠状病毒”,学以致用。75%的酒精溶液可杀灭“新冠病毒”,酒精溶液中的溶剂是( )
水 B.乙醇 C.酒精 D.白酒
(三)总结迁移-( 5分钟 )
绘制思维导图总结本课的主要内容?
三、课后续学单-( 15分钟 )
1.结合生活经验,判断下列物质属于溶液是( )
A.油和水的混合物 B.含有果粒的果粒橙饮料 C.汽水 D.冰水混合物
2.关于溶质、溶剂、溶液的关系,说法有误的一项是( )
A.溶质可以是固体、或气体、或液体 B.溶液一定是无色的液体
C.溶液是均一、稳定的混合物 D.溶液长时间放置不会分层
3.下列关于溶液成分的判断正确的是( )
A.稀硫酸——溶质为HCl B.生理盐水——溶质为NaCl
C.碘酒——溶剂为水 D.75%酒精——溶剂为酒精
4. 如果你想除去衣服上的油渍,下列哪种办法不可行( )
A.用水直接冲洗 B.用洗洁精洗再清洗
C.用酒精先溶解再清洗 D.用汽油溶解再清洗
5.在下列空格上写出下列溶液中的溶质和溶剂(均用化学式表示):
(1)医用酒精溶液中,溶质是 ,溶剂是 ;
(2)碘酒溶液中,溶质是 ,溶剂是 ;
(3)在含硫的二硫化碳溶液中,溶质是 ,溶剂是 ;
(4)锌和稀硫酸恰好完全反应后的溶液中,溶质是 ,溶剂是 ;
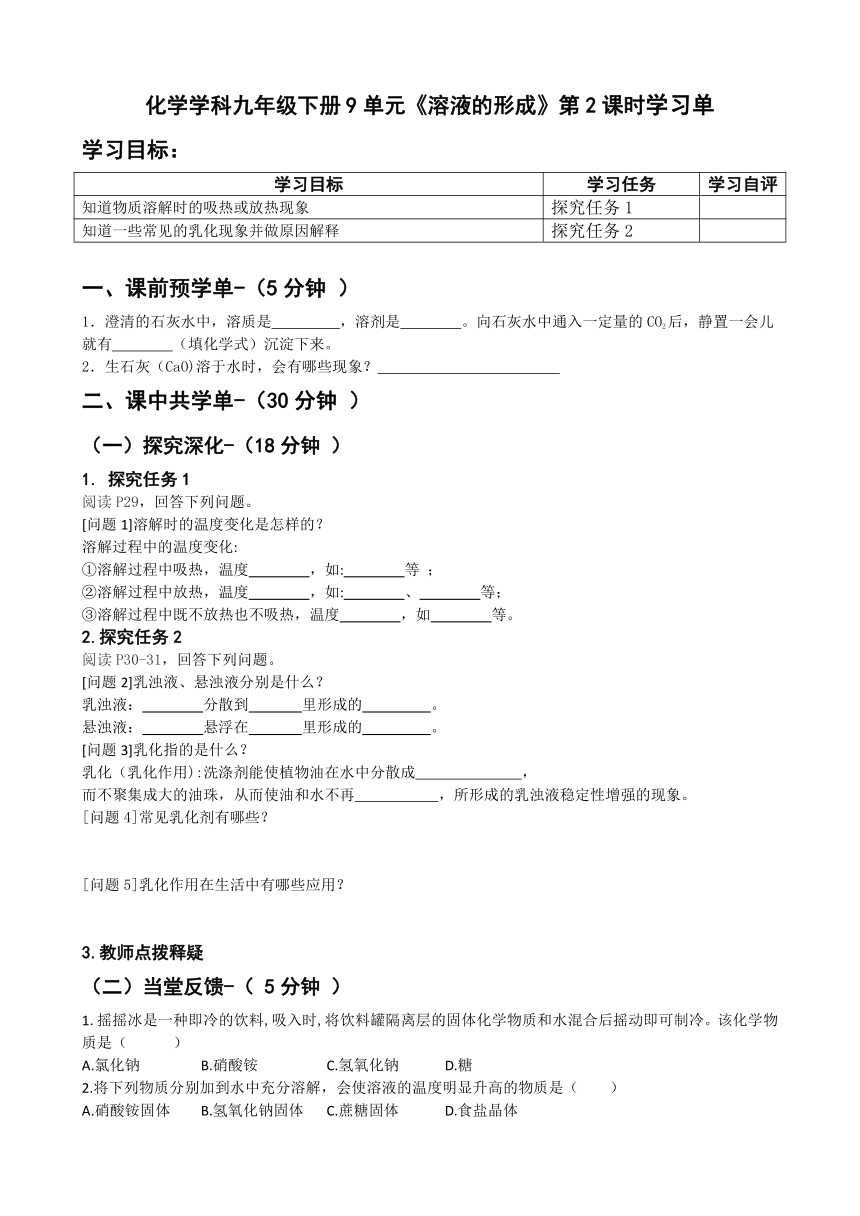
化学学科九年级下册9单元《溶液的形成》第2课时学习单
学习目标:
学习目标 学习任务 学习自评
知道物质溶解时的吸热或放热现象 探究任务1
知道一些常见的乳化现象并做原因解释 探究任务2
一、课前预学单-(5分钟 )
澄清的石灰水中,溶质是 ,溶剂是 。向石灰水中通入一定量的CO2后,静置一会儿就有 (填化学式)沉淀下来。
生石灰(CaO)溶于水时,会有哪些现象?
二、课中共学单-(30分钟 )
(一)探究深化-(18分钟 )
1. 探究任务1
阅读P29,回答下列问题。
[问题1]溶解时的温度变化是怎样的?
溶解过程中的温度变化:
①溶解过程中吸热,温度 ,如: 等 ;
②溶解过程中放热,温度 ,如: 、 等;
③溶解过程中既不放热也不吸热,温度 ,如 等。
2.探究任务2
阅读P30-31,回答下列问题。
[问题2]乳浊液、悬浊液分别是什么?
乳浊液: 分散到 里形成的 。
悬浊液: 悬浮在 里形成的 。
[问题3]乳化指的是什么?
乳化(乳化作用):洗涤剂能使植物油在水中分散成 ,
而不聚集成大的油珠,从而使油和水不再 ,所形成的乳浊液稳定性增强的现象。
[问题4]常见乳化剂有哪些?
[问题5]乳化作用在生活中有哪些应用?
3.教师点拨释疑
(二)当堂反馈-( 5分钟 )
1.摇摇冰是一种即冷的饮料,吸入时,将饮料罐隔离层的固体化学物质和水混合后摇动即可制冷。该化学物质是( )
A.氯化钠 B.硝酸铵 C.氢氧化钠 D.糖
2.将下列物质分别加到水中充分溶解,会使溶液的温度明显升高的物质是( )
A.硝酸铵固体 B.氢氧化钠固体 C.蔗糖固体 D.食盐晶体
3.各种洗涤剂广泛进入人们的生活中,下列洗涤中所用洗涤剂具有乳化功能的是( )
A.用汽油除去衣服上的油污
B.用餐具洗洁精清洗餐具上的油污
C.用水洗去盘子中的水果渣
D.用盐酸洗去水壶的水垢(含CaCO3)
(三)总结迁移-( 5分钟 )
绘制思维导图总结本课的主要内容?
三、课后续学单-( 15分钟 )
1.溶液是自然界中常见的物质。下列有关溶液的说法正确的是( )
A.溶液的上层浓度小,下层浓度大
B.溶液蒸干后,均能得到固体溶质
C.溶液中只有一种溶质时,溶液为纯净物
D.物质在溶解得到溶液的过程中,通常有放热或吸热的现象出现
2.小华在实验室帮老师整理药品时,发现一瓶失去标签的白色固体,老师告知是NaOH 、CuSO4、NaCl、 CaCO3。中的一种。小华思考片刻后,认为取少量白色固体放入水中就能确定其成分,她的理由是:
(1)若不溶于水,则是 。
(2)若溶于水形成蓝色溶液,则是 。
(3)若溶于水,溶液温度升高,则是 。
(4)若溶于水,得到无色透明溶液,溶液温度无明显变化,则是 。
3.下列关于溶液、悬浊液、乳浊液的说法:
①溶液一定是无色透明的液体;②溶液是纯净物,而浊液是混合物;③在溶液中化学反应通常进行得比较快;④浊液对生产有害无利;⑤浊液中分散的都是固体小颗粒;⑥浊液都是不均一、不稳定的;⑦在条件不变的情况下,溶液静置多久都不分层;
⑧由水和酒精构成的溶液中,酒精既可作溶质,也可作溶剂。
其中正确的是( )
A.①③④⑤⑥⑧ B.②⑤⑥⑧ C.③⑥⑦ D.全正确
4.用如图所示装置研究“活性炭吸附能力与温度变化的关系”。
将NH4NO3固体加入到水中搅拌,观察到两侧玻璃管中液面上升的高度不同。
(1)由于试管内气体的压强________(填“增大”或“减小”),
使得玻璃管内液面上升。
(2)NH4NO3固体溶于水_______(填“放出”或“吸收”)热量。
(3)活性炭吸附气体的能力随温度________而增强。
化学学科九年级下册9单元《溶解度》第1课时学习单
学习目标:
学习目标 学习任务 学习自评
理解饱和溶液的概念;认识饱和溶液与不饱和溶液的关系 探究任务1
了解结晶现象 探究任务2
一、课前预学单-(3分钟 )
1.下列有关溶液的说法正确的是( )
A.具有均一性、稳定性的液体一定是溶液
B.配制溶液时,搅拌可以增大固体溶质的溶解能力
C.对于同一溶质的溶液,相同温度下,饱和溶液的一定比不饱和溶液浓
D.溶液中溶质只能是一种
2.阅读P33-35,回答下列问题。
[问题1]什么是饱和溶液?
, , 叫做饱和溶液; ,叫做不饱和溶液。
二、课中共学单-(30分钟 )
(一)探究深化-(25分钟 )
1. 探究任务1
阅读P35,回答下列问题。
[问题2]饱和溶液与不饱和溶液之间如何进行转化?
饱和溶液和不饱和溶液的相互转化:
不饱和溶液 饱和溶液
饱和溶液 结晶
2.探究任务2
[问题3]热的KNO3溶液冷却后,烧杯底部出现了固体,这是为什么呢?
溶解在溶液中的溶质从溶液中以晶体的形式析出,这一过程叫做 ,常见的结晶方法有 符合 特征的溶质用这种方法结晶、 (也叫冷却热饱和溶液〉符合 特征的溶质用这种方法结晶。
[问题3]海水晒盐的流程图:
该流程图中①是 ,②是_______。该过程属于 变化(填“物理”或“化学”)。
教师点拨释疑
(二)当堂反馈-( 5分钟 )
1.欲将某温度下的KNO3饱和溶液转化为不饱和溶液,下列方法可行的是( )
A.加入KNO3晶体 B.加水 C.降低温度 D.恒温蒸发水分
2.一杯10℃硝酸钾溶液,能证明它是饱和溶液的方法是( )
A.蒸发5克水有固体溶质析出 B.加入少许硝酸钾晶体不溶
C.把溶液降温至0℃有固体析出 D.上述三种方法都要行
(三)总结迁移-( 5分钟 )
绘制思维导图总结本课的主要内容?
三、课后续学单-( 15分钟 )
1.能证明硝酸铵溶液在30℃时已达到饱和状态的叙述是( )
A.取少量该溶液,升温后硝酸铵晶体析出
B.取少量该溶液,降温到10℃时,有硝酸铵晶体析出
C.在条件不改变的情况下,该溶液始终是稳定的
D.温度不变时,向该溶液中加入少量硝酸铵晶体,晶体不再溶解
2.室温条件下,小昕在实验室里分别配制氯化钠的饱和溶液和不饱和溶液,并分别取等量样品于试管中,由于未贴标签放在一起搞混了,为了分清哪一支装有的是饱和溶液,他进行了如下操作,其中能达到目的的是( )
A.各加少量室温下的蒸馏水 B.各加少量氯化钠 C.各加少量热水 D.分别进行搅拌
3.25 ℃时,向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是( )
4.*A、B、C、D四个烧杯中分别盛有质量相等的同种溶剂,在相同的温度下,分别向4个烧杯中加入 20 g、15 g、10 g、5g 的某溶质,充分溶解后,如下图所示,回答下列各题。(填序号)
盛的一定是饱和溶液; 中盛的可能是饱和溶液; 中盛的一定是不饱和溶液。
(2)若固体溶质为KNO3,对A、B两个烧杯同时升高温度(均匀加热),固体物质先消失的是 。
(3)在一定温度下,在A、B中分别加入相同质量的水,B中固体刚好溶解,A中固体 (填“会”或“不会”)全溶。
化学学科九年级下册9单元《溶解度》第2课时学习单
学习目标:
学习目标 学习任务 学习自评
理解固体溶解度的概念,了解温度对一些固体物质溶解度的影响 探究任务1
了解溶解度曲线的涵义;会利用溶解度曲线获得相关信息 探究任务2
理解气体溶解度的概念,了解温度和压强对一些气体物质溶解度的影响 探究任务3
一、课前预学单-(5分钟 )
阅读P35-36,回答下列问题。
[问题1]什么是固体溶解度?
固体的溶解度表示在 ,某固态物质在 里达到 时所溶解的 。
阅读P38,回答下列问题。
[问题2]什么是气体溶解度?
1.由于称量气体的质量比较困难,所以气体的溶解度常用
来表示。
2.气体的溶解度是指该气体的压强为 和 时,溶解在 里达到 时的气体 。
二、课中共学单-(30分钟 )
(一)探究深化-(18分钟 )
1. 探究任务1
1.“在20℃时,NaCl的溶解度为 36g”,这句话所表达的含义是?
2.影响固体的溶解度的因素有
①内因: ,
②外因:
2.探究任务2
阅读P36-37,回答下列问题。
[问题2]固体溶解度的表示方法?
:由实验测出不同物质在不同温度下的溶解度,制成表格。
(2) 曲线。
(3)变化规律:
(4)溶解度曲线上的点的意义
3.探究任务3
影响气体的溶解度的因素有:
、
4.教师点拨释疑
(二)当堂反馈-( 5分钟 )
1.升高温度,下列物质中溶解度降低的是( )
A.氢氧化钙 B.硝酸钾 C.氢氧化钠 D.氯化钠
2.20℃时,食盐的溶解度为36g,20℃时将20g食盐放入50g水中,所得溶液的质量最多为( )
A.70g B.69g C.68g D.67g
3.要使CO2气体的溶解度增大,可采用的方法是( )
A.增加水的质量 B.升高温度 C.降低温度 D.减小压强
(三)总结迁移-( 5分钟 )
绘制思维导图总结本课的主要内容?
三、课后续学单-( 15分钟 )
1、下列说法中正确的是( )
A.100g水中最多能溶解某物质40g,则该物质的溶解度为40g
B.4℃时,溶质N的饱和溶液120g 中含N 20g,所以4℃时,溶质N的溶解度为20g
C.一定温度下,物质M的饱和溶液 100g中含M物质30g,则物质M在该温度时的溶解度为30g
D.20℃时,50g水中溶有溶质P 20g, 则物质P在20℃时的溶解度为 40g
2.生活中的下列现象不能说明气体的溶解度随温度升高而减小的是( )
A.烧开水时,水沸腾前有气泡冒出 B.喝下汽水时,容易打嗝
C.打开啤酒时,有大量的泡沫溢出 D.夏季黄昏池塘里的鱼常跃出水面
3.请根据下图中a、b、c三种物质的溶解度曲线,回答下列问题。
(1)t2 ℃时,30 g a物质加入到50 g水中不断搅拌,能形成80 g溶液吗 (填“能”或“不能”)。
(2)将t2 ℃时的a、b、c三种物质的饱和溶液降温到t1 ℃时,析出晶体最多的是 (填写物质序号)。
(3)现有a、b、c三种物质的浓溶液,适用于海水晒盐原理进行结晶的是 (填写物质序号)。
化学学科九年级下册9单元《溶解度曲线的应用》培优
1、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )
A.溶剂的质量 B.溶质的质量
C.溶液中溶质的质量分数 D.食盐的溶解度
2、有关如图溶解度曲线,下列说法正确的是( )
A.甲、乙、丙三种物质的溶解度关系为S甲>S乙>S丙
B.乙物质的溶解度随温度变化最大
C.27℃时,往26g丙里加100g水,形成不饱和溶液
D.33℃时,甲乙两种物质溶解度相等
3、已知 A、B、C 三种物质的溶解度随温度的变化情况如图所示,现将 a gA、b gB、c gC 分别在 10℃。20℃、30℃时加入 100g 水中,分析正确的是( )
A. a、b、c 三点表示的溶液均为饱和溶液
B. 三种溶液中溶质质量分数最大的是A
C. c 点恰好形成无色、均一、稳定的溶液
D. 升温至 30℃时,三种溶液的溶质质量分数关系为:A=C>B
4、氯化铵常用作铁制品的除锈剂。不同温度时,氢化铵固体的溶解度曲线如图所示。20℃时,将50g氯化铵固体加入到盛有100g水的烧杯中,搅拌使其充分溶解。下列说法不正确的是( )
A. 烧杯中剩余固体的质量为13g
B. 再加入100g水,充分溶解后烧杯中仍有固体剩余
C. 升温至40℃,溶液的质量分数约为31.5%
D. 升温至60℃,溶液变为不饱和溶液
5、溶液与人类的生活息息相关。
(1)下列少量物质分别放入水中,充分搅拌,能得到溶液的是___ ____(填序号)。
a.面粉 b.硝酸钾 c.泥沙 d.花生油
(2)下表是氯化钠和氯化钾在不同温度时的溶解度。
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KCl 27.6 34.0 40.0 45.5 51.1
①20℃时,氯化钠的溶解度为____ ___g。
②20℃时,将20g氯化钠固体加入到50g水中,充分溶解,所得氯化钠溶液的质量为_____g。
③某同学进行实验如下图所示,得到相应的A、B、C三种溶液,C中析出的氯化钾固体质量为_____g。
6、溶液是日常生活中的常见物质。20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。
(1)图1中一定为饱和溶液的是______(填“甲”或“乙”)。
(2)图3中表示乙的溶解度曲线是______,P点表示的含义是__________________。
(3)在图4所示的实验中,小烧杯内盛放的是50℃时甲物质的饱和溶液。某同学要使小烧杯内有固体析出时,他向大烧杯的水中可加入下列物质是______(填字母)。
A.氧化钙 B.氯化钠 C.氢氧化钠 D.硝酸铵
(4)若M中混有少量N,提纯M可用____________结晶。
7、营口盐场是辽宁省最大的盐场,利用传统的海水晒盐工艺,可得到氯化钠和氯化镁等物质。如图是氯化钠和氯化镁的溶解度曲线。
(1)两种物质中,________的溶解度受温度的影响较大。
(2)t℃时,氯化镁饱和溶液中溶质与溶剂的质量比为________。
(3)t℃时,将40g氯化镁放入50g水中,所得溶液的质量__________。
(4)将接近饱和的氯化钠溶液变为饱和溶液,可采用的一种方法是________。
(5)海水晒盐是利用________的方法获得晶体。
8、工农业的发展离不开化学科学的应用。我国著名化学家侯德榜在氨碱法的基础上,创立更为先进的联合制碱法(侯氏制碱法)。Na2CO3和NH4Cl的溶解度曲线如图1所示,请回答下列问题:
①t1°C时,Na2CO3的溶解度是______g。
②t2°C时,将不同质量的NH4Cl饱和溶液和Na2CO3饱和溶液均降温至t1°C,此时,NH4Cl溶液的溶质质量分数_____ Na2CO3溶液的溶质质量分数(填写“大于”.等于”“小于”.“无法判断”之一)。
③t1°C时,将5g Na2CO3放入试管中,加入20g水充分振荡后,所得溶液的质量是_______g;然后将试管放入盛有水的烧杯中 (如图2所示),再取适量氢氧化钠固体放入烧杯中,用玻璃棒搅拌 碳酸钠溶解,此时试管内可观察到的现象是__________________,请结合溶解度相关知识进行解释:___________________。
化学学科九年级下册9单元《溶液的浓度》第1课时学习单
学习目标:
学习目标 学习任务 学习自评
知道溶质的质量分数及基本计算 探究任务1
了解影响溶质质量分数的因素 探究任务2
一、课前预学单-(5分钟 )
1.医用酒精为75%浓度的酒精溶液,这里的75%指的是什么?
2.阅读P42-43,回答下列问题。
[问题1]用什么来表示溶液的浓度?
二、课中共学单-(30分钟 )
(一)探究深化-(18分钟 )
1. 探究任务1
[问题2]溶质的质量分数具体指的是什么?
溶液中溶质的质量分数是指________与_______之比,计算公式为:溶质的质量分数=×100%,其中溶液质量包括________质量和_________质量。
[问题3]溶质质量分数与溶解度有什么关系?
在一定温度下的饱和溶液中,溶质的质量分数=×100%,物质溶解度越大,其饱和溶液的溶质质量分数_________。
2.探究任务2
影响因素 溶质质量 溶剂质量 溶液质量 溶质质量分数 溶解度 溶液状态
恒温蒸发一定量溶剂
添加溶质
升温至50℃
降温至10℃
【交流与讨论】现有20℃时的硝酸钾饱和溶液,进行以下操作,溶质质量、溶剂质量、溶液质量、溶质质量分数、溶解度以及溶液状态怎么改变?
3.教师点拨释疑
(二)当堂反馈-( 5分钟 )
1.关于100 g 5%的氯化钠溶液,下列叙述正确的是( )
A.100 g水中溶有5 g氯化钠
B.将5 g氯化钠溶于95 g水中,可制得该溶液
C溶液中氯化钠与水的质量比为1:20
D.105 g该溶液中溶有5 g氯化钠
2.某溶液中溶质的质量分数为20%,则下列质量比关系不正确的是( )
A.溶质:溶剂=1:4 B.溶质:溶剂=1:5
C.溶剂:溶液=4:5 D.溶质:溶液=1:5
(三)总结迁移-( 5分钟 )
绘制思维导图总结本课的主要内容?
三、课后续学单-( 15分钟 )
1、20℃时,取四份一定质量的饱和硝酸钾溶液进行如下实验后,所得结论正确的是( )
A.保持温度不变,减少10g溶剂后,溶液中溶质的质量分数增大
B.保持温度不变,加入10g溶质后,溶液中溶质的质量分数增大
C.保持温度不变,加入10g溶剂后,溶质的溶解度减小
D.降温至10℃后,溶质的溶解度减小
2、 A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.阴影区域中,A、C均处于不饱和状态
B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯B
C.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>B
D.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数约为16.7%
3、(1〉在t℃时,某物质的饱和溶液中,溶质与溶剂的质量比为1∶4,则此溶液中溶质的质量分数是 ,t℃时,该物质的溶解度为 。
(2)目前市场上出售的汽水饮料大多是碳酸饮料,其中溶有二氧化碳气体。打开汽水瓶盖时汽水会自动喷出来,这说明气体在水中的溶解度与 有关。
(3〉在一定温度下将a g氯化钠放入于b g水中,充分溶解后得到c g食盐水,则该溶液的溶质质量分数的计算式为 。
(4)小伟对“物质的溶解性受哪些因素影响 ”这一课题进行探究。小伟从日常的事实:①食盐易溶于水,难溶于植物油;②硝酸钾易溶于水,碳酸钙难溶于水。分析得出:物质溶解性由 、
决定。
化学学科九年级下册9单元《溶液的浓度》第2课时学习单
学习目标:
学习目标 学习任务 学习自评
初步掌握溶液稀释和方程式综合计算,加深对溶质质量分数的理解 探究任务1、2、3
练习配制溶质质量分数一定的溶液 探究任务4
一、课前预学单-(5分钟 )
1.在实验室中,配制溶质质量分数为10%的氯化钠溶液45 g,需要氯化钠固体的质量是______g。
将45 g 10%的氯化钠溶液配成含氯化钠为0.9%的溶液,得到氯化钠溶液的质量是______g。
二、课中共学单-(30分钟 )
(一)探究深化-(18分钟 )
1. 探究任务1
【例题1】在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg的这种溶液,需要氯化钠和水的质量各是多少
2.探究任务2
【例题2】化学实验室现有质量分数98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
3.探究任务3
【例题3】100g某硫酸恰好与13g锌完全反应。试计算这种硫酸中溶质的质量分数。(Zn-65,O-16,S-32)
【变式】100g某硫酸恰好与13g锌完全反应。试计算反应后溶液中溶质的质量分数。
4.探究任务4
偏大
偏小
【误差分析】:
3.教师点拨释疑
(二)当堂反馈-( 5分钟 )
1.制药厂用质量分数为9%的氯化钠溶液100g配制质量分数为0.9%的生理盐水,需蒸馏水( )
A.90g B.100g C.900g D.200g
2.实验室配制一定溶质质量分数的氯化钠溶液时,所需氯化钠固体应放在托盘天平的__________(填“左盘”或“右盘”)。上进行称量;若所配制溶质溶液的质量分数偏大,则可能是量取水时__________( 填“俯视”或“仰视”)量筒读数所致。
(三)总结迁移-( 5分钟 )
绘制思维导图总结本课的主要内容?
三、课后续学单-( 15分钟 )
1.海水淡化可采用膜分离技术。如右图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是( )
A.溶质质量增加 B.溶剂质量减少 C.溶液质量不变 D.溶质质量分数减少
2.CuSO4溶液对过氧化氢的分解有催化作用。取溶质质量分数为8.5%的过氧化氢溶液20g倒入小烧杯中,向其中加入所含溶质质量为0.75g的CuSO4溶液10.8g,使过氧化氢完全分解。试计算:
(1)产生氧气的质量。
(2)反应后所得溶液中CuSO4的质量分数。
学习目标:
学习目标 学习任务 学习自评
认识溶解现象,知道溶液、溶剂、溶质等概念; 探究任务1
知道溶液是一类重要的物质,在生产和生活中有重要的应用。 探究任务2
一、课前预学单-(5分钟 )
[问题1]溶液的概念是什么?
一种或几种物质 到另一种物质里,形成 、 的 ,叫做溶液。
溶液由 和 组成。
(3)溶剂是 。
(4)溶质是 。
(5)质量关系:
溶液的质量= +
[问题2] 从溶液的概念中可以发现它的特征有哪些?
溶液的特征是 、 。
二、课中共学单-(30分钟 )
(一)探究深化-(18分钟 )
1. 探究任务1
[问题3]如何从微观上理解溶解这一现象?
阅读P27-28,回答下列问题。
[问题4]同种溶质在不同溶剂中的溶解能力相同吗?
[问题5]不种溶质在相同溶剂中的溶解能力相同吗?
探究任务2
[问题6]如何确定溶液中的溶质和溶剂?
阅读P28,回答下列问题。
乙醇能否溶于水?
溶质、溶剂分别是什么物质?
教师点拨释疑
(二)当堂反馈-( 5分钟 )
1.将下列物质分别放入或通入水中,不能形成溶液的是( )
A.食用油 B.酒精
C.食盐 D.氯化氢气体
2. 抗击“新型冠状病毒”,学以致用。75%的酒精溶液可杀灭“新冠病毒”,酒精溶液中的溶剂是( )
水 B.乙醇 C.酒精 D.白酒
(三)总结迁移-( 5分钟 )
绘制思维导图总结本课的主要内容?
三、课后续学单-( 15分钟 )
1.结合生活经验,判断下列物质属于溶液是( )
A.油和水的混合物 B.含有果粒的果粒橙饮料 C.汽水 D.冰水混合物
2.关于溶质、溶剂、溶液的关系,说法有误的一项是( )
A.溶质可以是固体、或气体、或液体 B.溶液一定是无色的液体
C.溶液是均一、稳定的混合物 D.溶液长时间放置不会分层
3.下列关于溶液成分的判断正确的是( )
A.稀硫酸——溶质为HCl B.生理盐水——溶质为NaCl
C.碘酒——溶剂为水 D.75%酒精——溶剂为酒精
4. 如果你想除去衣服上的油渍,下列哪种办法不可行( )
A.用水直接冲洗 B.用洗洁精洗再清洗
C.用酒精先溶解再清洗 D.用汽油溶解再清洗
5.在下列空格上写出下列溶液中的溶质和溶剂(均用化学式表示):
(1)医用酒精溶液中,溶质是 ,溶剂是 ;
(2)碘酒溶液中,溶质是 ,溶剂是 ;
(3)在含硫的二硫化碳溶液中,溶质是 ,溶剂是 ;
(4)锌和稀硫酸恰好完全反应后的溶液中,溶质是 ,溶剂是 ;
化学学科九年级下册9单元《溶液的形成》第2课时学习单
学习目标:
学习目标 学习任务 学习自评
知道物质溶解时的吸热或放热现象 探究任务1
知道一些常见的乳化现象并做原因解释 探究任务2
一、课前预学单-(5分钟 )
澄清的石灰水中,溶质是 ,溶剂是 。向石灰水中通入一定量的CO2后,静置一会儿就有 (填化学式)沉淀下来。
生石灰(CaO)溶于水时,会有哪些现象?
二、课中共学单-(30分钟 )
(一)探究深化-(18分钟 )
1. 探究任务1
阅读P29,回答下列问题。
[问题1]溶解时的温度变化是怎样的?
溶解过程中的温度变化:
①溶解过程中吸热,温度 ,如: 等 ;
②溶解过程中放热,温度 ,如: 、 等;
③溶解过程中既不放热也不吸热,温度 ,如 等。
2.探究任务2
阅读P30-31,回答下列问题。
[问题2]乳浊液、悬浊液分别是什么?
乳浊液: 分散到 里形成的 。
悬浊液: 悬浮在 里形成的 。
[问题3]乳化指的是什么?
乳化(乳化作用):洗涤剂能使植物油在水中分散成 ,
而不聚集成大的油珠,从而使油和水不再 ,所形成的乳浊液稳定性增强的现象。
[问题4]常见乳化剂有哪些?
[问题5]乳化作用在生活中有哪些应用?
3.教师点拨释疑
(二)当堂反馈-( 5分钟 )
1.摇摇冰是一种即冷的饮料,吸入时,将饮料罐隔离层的固体化学物质和水混合后摇动即可制冷。该化学物质是( )
A.氯化钠 B.硝酸铵 C.氢氧化钠 D.糖
2.将下列物质分别加到水中充分溶解,会使溶液的温度明显升高的物质是( )
A.硝酸铵固体 B.氢氧化钠固体 C.蔗糖固体 D.食盐晶体
3.各种洗涤剂广泛进入人们的生活中,下列洗涤中所用洗涤剂具有乳化功能的是( )
A.用汽油除去衣服上的油污
B.用餐具洗洁精清洗餐具上的油污
C.用水洗去盘子中的水果渣
D.用盐酸洗去水壶的水垢(含CaCO3)
(三)总结迁移-( 5分钟 )
绘制思维导图总结本课的主要内容?
三、课后续学单-( 15分钟 )
1.溶液是自然界中常见的物质。下列有关溶液的说法正确的是( )
A.溶液的上层浓度小,下层浓度大
B.溶液蒸干后,均能得到固体溶质
C.溶液中只有一种溶质时,溶液为纯净物
D.物质在溶解得到溶液的过程中,通常有放热或吸热的现象出现
2.小华在实验室帮老师整理药品时,发现一瓶失去标签的白色固体,老师告知是NaOH 、CuSO4、NaCl、 CaCO3。中的一种。小华思考片刻后,认为取少量白色固体放入水中就能确定其成分,她的理由是:
(1)若不溶于水,则是 。
(2)若溶于水形成蓝色溶液,则是 。
(3)若溶于水,溶液温度升高,则是 。
(4)若溶于水,得到无色透明溶液,溶液温度无明显变化,则是 。
3.下列关于溶液、悬浊液、乳浊液的说法:
①溶液一定是无色透明的液体;②溶液是纯净物,而浊液是混合物;③在溶液中化学反应通常进行得比较快;④浊液对生产有害无利;⑤浊液中分散的都是固体小颗粒;⑥浊液都是不均一、不稳定的;⑦在条件不变的情况下,溶液静置多久都不分层;
⑧由水和酒精构成的溶液中,酒精既可作溶质,也可作溶剂。
其中正确的是( )
A.①③④⑤⑥⑧ B.②⑤⑥⑧ C.③⑥⑦ D.全正确
4.用如图所示装置研究“活性炭吸附能力与温度变化的关系”。
将NH4NO3固体加入到水中搅拌,观察到两侧玻璃管中液面上升的高度不同。
(1)由于试管内气体的压强________(填“增大”或“减小”),
使得玻璃管内液面上升。
(2)NH4NO3固体溶于水_______(填“放出”或“吸收”)热量。
(3)活性炭吸附气体的能力随温度________而增强。
化学学科九年级下册9单元《溶解度》第1课时学习单
学习目标:
学习目标 学习任务 学习自评
理解饱和溶液的概念;认识饱和溶液与不饱和溶液的关系 探究任务1
了解结晶现象 探究任务2
一、课前预学单-(3分钟 )
1.下列有关溶液的说法正确的是( )
A.具有均一性、稳定性的液体一定是溶液
B.配制溶液时,搅拌可以增大固体溶质的溶解能力
C.对于同一溶质的溶液,相同温度下,饱和溶液的一定比不饱和溶液浓
D.溶液中溶质只能是一种
2.阅读P33-35,回答下列问题。
[问题1]什么是饱和溶液?
, , 叫做饱和溶液; ,叫做不饱和溶液。
二、课中共学单-(30分钟 )
(一)探究深化-(25分钟 )
1. 探究任务1
阅读P35,回答下列问题。
[问题2]饱和溶液与不饱和溶液之间如何进行转化?
饱和溶液和不饱和溶液的相互转化:
不饱和溶液 饱和溶液
饱和溶液 结晶
2.探究任务2
[问题3]热的KNO3溶液冷却后,烧杯底部出现了固体,这是为什么呢?
溶解在溶液中的溶质从溶液中以晶体的形式析出,这一过程叫做 ,常见的结晶方法有 符合 特征的溶质用这种方法结晶、 (也叫冷却热饱和溶液〉符合 特征的溶质用这种方法结晶。
[问题3]海水晒盐的流程图:
该流程图中①是 ,②是_______。该过程属于 变化(填“物理”或“化学”)。
教师点拨释疑
(二)当堂反馈-( 5分钟 )
1.欲将某温度下的KNO3饱和溶液转化为不饱和溶液,下列方法可行的是( )
A.加入KNO3晶体 B.加水 C.降低温度 D.恒温蒸发水分
2.一杯10℃硝酸钾溶液,能证明它是饱和溶液的方法是( )
A.蒸发5克水有固体溶质析出 B.加入少许硝酸钾晶体不溶
C.把溶液降温至0℃有固体析出 D.上述三种方法都要行
(三)总结迁移-( 5分钟 )
绘制思维导图总结本课的主要内容?
三、课后续学单-( 15分钟 )
1.能证明硝酸铵溶液在30℃时已达到饱和状态的叙述是( )
A.取少量该溶液,升温后硝酸铵晶体析出
B.取少量该溶液,降温到10℃时,有硝酸铵晶体析出
C.在条件不改变的情况下,该溶液始终是稳定的
D.温度不变时,向该溶液中加入少量硝酸铵晶体,晶体不再溶解
2.室温条件下,小昕在实验室里分别配制氯化钠的饱和溶液和不饱和溶液,并分别取等量样品于试管中,由于未贴标签放在一起搞混了,为了分清哪一支装有的是饱和溶液,他进行了如下操作,其中能达到目的的是( )
A.各加少量室温下的蒸馏水 B.各加少量氯化钠 C.各加少量热水 D.分别进行搅拌
3.25 ℃时,向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是( )
4.*A、B、C、D四个烧杯中分别盛有质量相等的同种溶剂,在相同的温度下,分别向4个烧杯中加入 20 g、15 g、10 g、5g 的某溶质,充分溶解后,如下图所示,回答下列各题。(填序号)
盛的一定是饱和溶液; 中盛的可能是饱和溶液; 中盛的一定是不饱和溶液。
(2)若固体溶质为KNO3,对A、B两个烧杯同时升高温度(均匀加热),固体物质先消失的是 。
(3)在一定温度下,在A、B中分别加入相同质量的水,B中固体刚好溶解,A中固体 (填“会”或“不会”)全溶。
化学学科九年级下册9单元《溶解度》第2课时学习单
学习目标:
学习目标 学习任务 学习自评
理解固体溶解度的概念,了解温度对一些固体物质溶解度的影响 探究任务1
了解溶解度曲线的涵义;会利用溶解度曲线获得相关信息 探究任务2
理解气体溶解度的概念,了解温度和压强对一些气体物质溶解度的影响 探究任务3
一、课前预学单-(5分钟 )
阅读P35-36,回答下列问题。
[问题1]什么是固体溶解度?
固体的溶解度表示在 ,某固态物质在 里达到 时所溶解的 。
阅读P38,回答下列问题。
[问题2]什么是气体溶解度?
1.由于称量气体的质量比较困难,所以气体的溶解度常用
来表示。
2.气体的溶解度是指该气体的压强为 和 时,溶解在 里达到 时的气体 。
二、课中共学单-(30分钟 )
(一)探究深化-(18分钟 )
1. 探究任务1
1.“在20℃时,NaCl的溶解度为 36g”,这句话所表达的含义是?
2.影响固体的溶解度的因素有
①内因: ,
②外因:
2.探究任务2
阅读P36-37,回答下列问题。
[问题2]固体溶解度的表示方法?
:由实验测出不同物质在不同温度下的溶解度,制成表格。
(2) 曲线。
(3)变化规律:
(4)溶解度曲线上的点的意义
3.探究任务3
影响气体的溶解度的因素有:
、
4.教师点拨释疑
(二)当堂反馈-( 5分钟 )
1.升高温度,下列物质中溶解度降低的是( )
A.氢氧化钙 B.硝酸钾 C.氢氧化钠 D.氯化钠
2.20℃时,食盐的溶解度为36g,20℃时将20g食盐放入50g水中,所得溶液的质量最多为( )
A.70g B.69g C.68g D.67g
3.要使CO2气体的溶解度增大,可采用的方法是( )
A.增加水的质量 B.升高温度 C.降低温度 D.减小压强
(三)总结迁移-( 5分钟 )
绘制思维导图总结本课的主要内容?
三、课后续学单-( 15分钟 )
1、下列说法中正确的是( )
A.100g水中最多能溶解某物质40g,则该物质的溶解度为40g
B.4℃时,溶质N的饱和溶液120g 中含N 20g,所以4℃时,溶质N的溶解度为20g
C.一定温度下,物质M的饱和溶液 100g中含M物质30g,则物质M在该温度时的溶解度为30g
D.20℃时,50g水中溶有溶质P 20g, 则物质P在20℃时的溶解度为 40g
2.生活中的下列现象不能说明气体的溶解度随温度升高而减小的是( )
A.烧开水时,水沸腾前有气泡冒出 B.喝下汽水时,容易打嗝
C.打开啤酒时,有大量的泡沫溢出 D.夏季黄昏池塘里的鱼常跃出水面
3.请根据下图中a、b、c三种物质的溶解度曲线,回答下列问题。
(1)t2 ℃时,30 g a物质加入到50 g水中不断搅拌,能形成80 g溶液吗 (填“能”或“不能”)。
(2)将t2 ℃时的a、b、c三种物质的饱和溶液降温到t1 ℃时,析出晶体最多的是 (填写物质序号)。
(3)现有a、b、c三种物质的浓溶液,适用于海水晒盐原理进行结晶的是 (填写物质序号)。
化学学科九年级下册9单元《溶解度曲线的应用》培优
1、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )
A.溶剂的质量 B.溶质的质量
C.溶液中溶质的质量分数 D.食盐的溶解度
2、有关如图溶解度曲线,下列说法正确的是( )
A.甲、乙、丙三种物质的溶解度关系为S甲>S乙>S丙
B.乙物质的溶解度随温度变化最大
C.27℃时,往26g丙里加100g水,形成不饱和溶液
D.33℃时,甲乙两种物质溶解度相等
3、已知 A、B、C 三种物质的溶解度随温度的变化情况如图所示,现将 a gA、b gB、c gC 分别在 10℃。20℃、30℃时加入 100g 水中,分析正确的是( )
A. a、b、c 三点表示的溶液均为饱和溶液
B. 三种溶液中溶质质量分数最大的是A
C. c 点恰好形成无色、均一、稳定的溶液
D. 升温至 30℃时,三种溶液的溶质质量分数关系为:A=C>B
4、氯化铵常用作铁制品的除锈剂。不同温度时,氢化铵固体的溶解度曲线如图所示。20℃时,将50g氯化铵固体加入到盛有100g水的烧杯中,搅拌使其充分溶解。下列说法不正确的是( )
A. 烧杯中剩余固体的质量为13g
B. 再加入100g水,充分溶解后烧杯中仍有固体剩余
C. 升温至40℃,溶液的质量分数约为31.5%
D. 升温至60℃,溶液变为不饱和溶液
5、溶液与人类的生活息息相关。
(1)下列少量物质分别放入水中,充分搅拌,能得到溶液的是___ ____(填序号)。
a.面粉 b.硝酸钾 c.泥沙 d.花生油
(2)下表是氯化钠和氯化钾在不同温度时的溶解度。
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KCl 27.6 34.0 40.0 45.5 51.1
①20℃时,氯化钠的溶解度为____ ___g。
②20℃时,将20g氯化钠固体加入到50g水中,充分溶解,所得氯化钠溶液的质量为_____g。
③某同学进行实验如下图所示,得到相应的A、B、C三种溶液,C中析出的氯化钾固体质量为_____g。
6、溶液是日常生活中的常见物质。20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。
(1)图1中一定为饱和溶液的是______(填“甲”或“乙”)。
(2)图3中表示乙的溶解度曲线是______,P点表示的含义是__________________。
(3)在图4所示的实验中,小烧杯内盛放的是50℃时甲物质的饱和溶液。某同学要使小烧杯内有固体析出时,他向大烧杯的水中可加入下列物质是______(填字母)。
A.氧化钙 B.氯化钠 C.氢氧化钠 D.硝酸铵
(4)若M中混有少量N,提纯M可用____________结晶。
7、营口盐场是辽宁省最大的盐场,利用传统的海水晒盐工艺,可得到氯化钠和氯化镁等物质。如图是氯化钠和氯化镁的溶解度曲线。
(1)两种物质中,________的溶解度受温度的影响较大。
(2)t℃时,氯化镁饱和溶液中溶质与溶剂的质量比为________。
(3)t℃时,将40g氯化镁放入50g水中,所得溶液的质量__________。
(4)将接近饱和的氯化钠溶液变为饱和溶液,可采用的一种方法是________。
(5)海水晒盐是利用________的方法获得晶体。
8、工农业的发展离不开化学科学的应用。我国著名化学家侯德榜在氨碱法的基础上,创立更为先进的联合制碱法(侯氏制碱法)。Na2CO3和NH4Cl的溶解度曲线如图1所示,请回答下列问题:
①t1°C时,Na2CO3的溶解度是______g。
②t2°C时,将不同质量的NH4Cl饱和溶液和Na2CO3饱和溶液均降温至t1°C,此时,NH4Cl溶液的溶质质量分数_____ Na2CO3溶液的溶质质量分数(填写“大于”.等于”“小于”.“无法判断”之一)。
③t1°C时,将5g Na2CO3放入试管中,加入20g水充分振荡后,所得溶液的质量是_______g;然后将试管放入盛有水的烧杯中 (如图2所示),再取适量氢氧化钠固体放入烧杯中,用玻璃棒搅拌 碳酸钠溶解,此时试管内可观察到的现象是__________________,请结合溶解度相关知识进行解释:___________________。
化学学科九年级下册9单元《溶液的浓度》第1课时学习单
学习目标:
学习目标 学习任务 学习自评
知道溶质的质量分数及基本计算 探究任务1
了解影响溶质质量分数的因素 探究任务2
一、课前预学单-(5分钟 )
1.医用酒精为75%浓度的酒精溶液,这里的75%指的是什么?
2.阅读P42-43,回答下列问题。
[问题1]用什么来表示溶液的浓度?
二、课中共学单-(30分钟 )
(一)探究深化-(18分钟 )
1. 探究任务1
[问题2]溶质的质量分数具体指的是什么?
溶液中溶质的质量分数是指________与_______之比,计算公式为:溶质的质量分数=×100%,其中溶液质量包括________质量和_________质量。
[问题3]溶质质量分数与溶解度有什么关系?
在一定温度下的饱和溶液中,溶质的质量分数=×100%,物质溶解度越大,其饱和溶液的溶质质量分数_________。
2.探究任务2
影响因素 溶质质量 溶剂质量 溶液质量 溶质质量分数 溶解度 溶液状态
恒温蒸发一定量溶剂
添加溶质
升温至50℃
降温至10℃
【交流与讨论】现有20℃时的硝酸钾饱和溶液,进行以下操作,溶质质量、溶剂质量、溶液质量、溶质质量分数、溶解度以及溶液状态怎么改变?
3.教师点拨释疑
(二)当堂反馈-( 5分钟 )
1.关于100 g 5%的氯化钠溶液,下列叙述正确的是( )
A.100 g水中溶有5 g氯化钠
B.将5 g氯化钠溶于95 g水中,可制得该溶液
C溶液中氯化钠与水的质量比为1:20
D.105 g该溶液中溶有5 g氯化钠
2.某溶液中溶质的质量分数为20%,则下列质量比关系不正确的是( )
A.溶质:溶剂=1:4 B.溶质:溶剂=1:5
C.溶剂:溶液=4:5 D.溶质:溶液=1:5
(三)总结迁移-( 5分钟 )
绘制思维导图总结本课的主要内容?
三、课后续学单-( 15分钟 )
1、20℃时,取四份一定质量的饱和硝酸钾溶液进行如下实验后,所得结论正确的是( )
A.保持温度不变,减少10g溶剂后,溶液中溶质的质量分数增大
B.保持温度不变,加入10g溶质后,溶液中溶质的质量分数增大
C.保持温度不变,加入10g溶剂后,溶质的溶解度减小
D.降温至10℃后,溶质的溶解度减小
2、 A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.阴影区域中,A、C均处于不饱和状态
B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯B
C.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>B
D.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数约为16.7%
3、(1〉在t℃时,某物质的饱和溶液中,溶质与溶剂的质量比为1∶4,则此溶液中溶质的质量分数是 ,t℃时,该物质的溶解度为 。
(2)目前市场上出售的汽水饮料大多是碳酸饮料,其中溶有二氧化碳气体。打开汽水瓶盖时汽水会自动喷出来,这说明气体在水中的溶解度与 有关。
(3〉在一定温度下将a g氯化钠放入于b g水中,充分溶解后得到c g食盐水,则该溶液的溶质质量分数的计算式为 。
(4)小伟对“物质的溶解性受哪些因素影响 ”这一课题进行探究。小伟从日常的事实:①食盐易溶于水,难溶于植物油;②硝酸钾易溶于水,碳酸钙难溶于水。分析得出:物质溶解性由 、
决定。
化学学科九年级下册9单元《溶液的浓度》第2课时学习单
学习目标:
学习目标 学习任务 学习自评
初步掌握溶液稀释和方程式综合计算,加深对溶质质量分数的理解 探究任务1、2、3
练习配制溶质质量分数一定的溶液 探究任务4
一、课前预学单-(5分钟 )
1.在实验室中,配制溶质质量分数为10%的氯化钠溶液45 g,需要氯化钠固体的质量是______g。
将45 g 10%的氯化钠溶液配成含氯化钠为0.9%的溶液,得到氯化钠溶液的质量是______g。
二、课中共学单-(30分钟 )
(一)探究深化-(18分钟 )
1. 探究任务1
【例题1】在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg的这种溶液,需要氯化钠和水的质量各是多少
2.探究任务2
【例题2】化学实验室现有质量分数98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
3.探究任务3
【例题3】100g某硫酸恰好与13g锌完全反应。试计算这种硫酸中溶质的质量分数。(Zn-65,O-16,S-32)
【变式】100g某硫酸恰好与13g锌完全反应。试计算反应后溶液中溶质的质量分数。
4.探究任务4
偏大
偏小
【误差分析】:
3.教师点拨释疑
(二)当堂反馈-( 5分钟 )
1.制药厂用质量分数为9%的氯化钠溶液100g配制质量分数为0.9%的生理盐水,需蒸馏水( )
A.90g B.100g C.900g D.200g
2.实验室配制一定溶质质量分数的氯化钠溶液时,所需氯化钠固体应放在托盘天平的__________(填“左盘”或“右盘”)。上进行称量;若所配制溶质溶液的质量分数偏大,则可能是量取水时__________( 填“俯视”或“仰视”)量筒读数所致。
(三)总结迁移-( 5分钟 )
绘制思维导图总结本课的主要内容?
三、课后续学单-( 15分钟 )
1.海水淡化可采用膜分离技术。如右图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是( )
A.溶质质量增加 B.溶剂质量减少 C.溶液质量不变 D.溶质质量分数减少
2.CuSO4溶液对过氧化氢的分解有催化作用。取溶质质量分数为8.5%的过氧化氢溶液20g倒入小烧杯中,向其中加入所含溶质质量为0.75g的CuSO4溶液10.8g,使过氧化氢完全分解。试计算:
(1)产生氧气的质量。
(2)反应后所得溶液中CuSO4的质量分数。
同课章节目录
