化学人教版(2019)选择性必修1 4.1.1原电池的工作原理(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.1.1原电池的工作原理(共22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 102.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-19 16:15:43 | ||
图片预览








文档简介
(共22张PPT)
原电池的工作原理
【学习目标】
1、初步了解火力发电过程中的能量转化
2、通过实验探究,掌握原电池工作原理及构成原电池的条件
3、了解化学电源在实际生活中的应用及废旧电池的处理和利用
目录
02
原电池
01
化学能与电能
智能手机
充电公交汽车
电灯
家用电器
生活离不开电
【情境引入】
一、化学能与电能
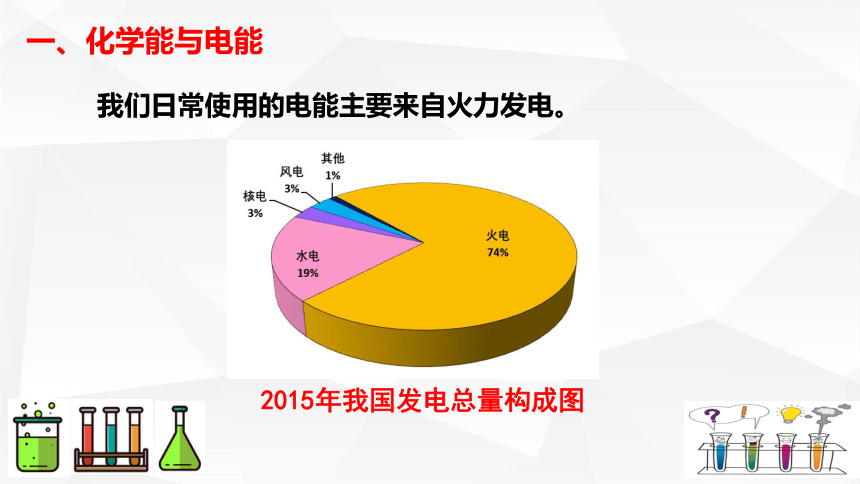
我们日常使用的电能主要来自火力发电。
2015年我国发电总量构成图
化学能
燃料燃烧
热能
蒸汽轮机
机械能
发电机
电能
直接?
【活动1】阅读火力发电原理及过程,思考火力发电的过程能量是怎样转化的?
火力发电存在的问题:
①使用的化石燃料属于不可再生资源;
②化石燃料的燃烧会产生大量的有害气体(如SO2、CO等)及粉尘,污染环境;
③能量经过多次转化,能量利用率低。
电子定向移动
氧化还原反应
写出锌和稀硫酸反应的化学方程式并用单线桥分析
【思考1】电流是怎样产生的?
【思考2】什么反应中有电子的转移?
【问题】探究把化学能直接转变为电能的装置?
Zn+2H+=Zn2++H2 ↑
2e-
什么方法可使Zn与H+分开,从而让电子定向移动呢?
探究实验 讨论与交流
实验一:分别将锌片和铜片插入 稀硫酸溶液中 观察锌片和铜片上现象和差别?
实验二:锌片和铜片先接触插入稀硫酸 溶液中,然后再用导线连接 观察锌片和铜片上有何现象?推测原因
实验三:锌片和铜片通过导线接电流表 插入稀硫酸溶液中 观察电流表上有何现象?
注意电流表指针偏转方向
【实验探究】
【实验一】
铜锌未连接时,锌片表面有气泡,铜片无明显变化。
原因是与金属活动性顺序有关。
铜锌未连接时
反应的离子方程式:
Zn+2H+ = Zn2++ H2↑
0
+1
0
+2
失 2e-
得 2×e-
【实验二】
铜锌连接时,铜表面.出现大量气泡,锌表面也有气泡。
【实验三】
电流表指针发生偏转,说明导线中有电流产生
科学探究 宏观辨识
实验操作
实验现象
实验结论
铜片上:无气泡
锌片上:逐渐溶解,有气泡
铜片上:有气泡
锌片上:逐渐溶解
电流表:指针偏转
锌与稀硫酸反应生成氢气,而铜不反应
装置中发生反应生成氢气,导线中有电流通过
1.概念:将化学能直接转变为电能的装置
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
2.本质:氧化反应和还原反应分别
在两个不同的区域进行。
锌片:Zn-2e- = Zn2+ (氧化反应)
铜片:2H++2e- = H2↑(还原反应)
二、原电池
Cu
Zn
-
-
-
Zn2+
H+
H+
Zn-2e-=Zn2+
2H++2e-=H2↑
氧化反应
还原反应
负极
正极
阳离子
阴离子
SO42-
发生溶解
产生气泡
原电池总反应:Zn+2H+=Zn2++H2↑
电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
外电路
内电路
阴离子 负极
阳离子 正极
外电路
内电路
e-
I
3.原电池工作原理
【思考】若把Zn – Cu原电池装置改动如下,能形成原电池吗?观察电流表指针,总结形成原电池的条件。
能
不能
不能
条件2:活泼性不同的两个电极
Ag
Cu
条件1:有自发氧化还原反应
【学习任务】探究构成原电池的组成
4.简单原电池构成条件
能
能
不能
条件3:电极必须插入电解质溶液中
不能
能
条件4:两极相连形成闭合回路
① 两种活泼性不同的金属作电极
(或其中一种为能导电的非金属,如“碳棒”)
② 电解质溶液
③ 形成闭合回路
④ 能自发进行氧化还原反应
两极一液一线一反应
4.简单原电池构成条件
5.原电池正、负极的判断
①比较金属活泼性
④保护金属材料
③设计电池
②加快反应速率
(注意:选择合适电解质)
一般:负极>正极
如:制氢气加入少量硫酸铜溶液
如:船体镶锌块
稀硫酸
Al
Mg
A
Al
Mg
A
NaOH
盐水动力车
6.原电池的应用
1、原电池的概念
2、原电池的本质
3、原电池的工作原理
4、原电池的构成条件
课堂小结
谢谢聆听 敬请指导
原电池的工作原理
【学习目标】
1、初步了解火力发电过程中的能量转化
2、通过实验探究,掌握原电池工作原理及构成原电池的条件
3、了解化学电源在实际生活中的应用及废旧电池的处理和利用
目录
02
原电池
01
化学能与电能
智能手机
充电公交汽车
电灯
家用电器
生活离不开电
【情境引入】
一、化学能与电能
我们日常使用的电能主要来自火力发电。
2015年我国发电总量构成图
化学能
燃料燃烧
热能
蒸汽轮机
机械能
发电机
电能
直接?
【活动1】阅读火力发电原理及过程,思考火力发电的过程能量是怎样转化的?
火力发电存在的问题:
①使用的化石燃料属于不可再生资源;
②化石燃料的燃烧会产生大量的有害气体(如SO2、CO等)及粉尘,污染环境;
③能量经过多次转化,能量利用率低。
电子定向移动
氧化还原反应
写出锌和稀硫酸反应的化学方程式并用单线桥分析
【思考1】电流是怎样产生的?
【思考2】什么反应中有电子的转移?
【问题】探究把化学能直接转变为电能的装置?
Zn+2H+=Zn2++H2 ↑
2e-
什么方法可使Zn与H+分开,从而让电子定向移动呢?
探究实验 讨论与交流
实验一:分别将锌片和铜片插入 稀硫酸溶液中 观察锌片和铜片上现象和差别?
实验二:锌片和铜片先接触插入稀硫酸 溶液中,然后再用导线连接 观察锌片和铜片上有何现象?推测原因
实验三:锌片和铜片通过导线接电流表 插入稀硫酸溶液中 观察电流表上有何现象?
注意电流表指针偏转方向
【实验探究】
【实验一】
铜锌未连接时,锌片表面有气泡,铜片无明显变化。
原因是与金属活动性顺序有关。
铜锌未连接时
反应的离子方程式:
Zn+2H+ = Zn2++ H2↑
0
+1
0
+2
失 2e-
得 2×e-
【实验二】
铜锌连接时,铜表面.出现大量气泡,锌表面也有气泡。
【实验三】
电流表指针发生偏转,说明导线中有电流产生
科学探究 宏观辨识
实验操作
实验现象
实验结论
铜片上:无气泡
锌片上:逐渐溶解,有气泡
铜片上:有气泡
锌片上:逐渐溶解
电流表:指针偏转
锌与稀硫酸反应生成氢气,而铜不反应
装置中发生反应生成氢气,导线中有电流通过
1.概念:将化学能直接转变为电能的装置
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
2.本质:氧化反应和还原反应分别
在两个不同的区域进行。
锌片:Zn-2e- = Zn2+ (氧化反应)
铜片:2H++2e- = H2↑(还原反应)
二、原电池
Cu
Zn
-
-
-
Zn2+
H+
H+
Zn-2e-=Zn2+
2H++2e-=H2↑
氧化反应
还原反应
负极
正极
阳离子
阴离子
SO42-
发生溶解
产生气泡
原电池总反应:Zn+2H+=Zn2++H2↑
电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
外电路
内电路
阴离子 负极
阳离子 正极
外电路
内电路
e-
I
3.原电池工作原理
【思考】若把Zn – Cu原电池装置改动如下,能形成原电池吗?观察电流表指针,总结形成原电池的条件。
能
不能
不能
条件2:活泼性不同的两个电极
Ag
Cu
条件1:有自发氧化还原反应
【学习任务】探究构成原电池的组成
4.简单原电池构成条件
能
能
不能
条件3:电极必须插入电解质溶液中
不能
能
条件4:两极相连形成闭合回路
① 两种活泼性不同的金属作电极
(或其中一种为能导电的非金属,如“碳棒”)
② 电解质溶液
③ 形成闭合回路
④ 能自发进行氧化还原反应
两极一液一线一反应
4.简单原电池构成条件
5.原电池正、负极的判断
①比较金属活泼性
④保护金属材料
③设计电池
②加快反应速率
(注意:选择合适电解质)
一般:负极>正极
如:制氢气加入少量硫酸铜溶液
如:船体镶锌块
稀硫酸
Al
Mg
A
Al
Mg
A
NaOH
盐水动力车
6.原电池的应用
1、原电池的概念
2、原电池的本质
3、原电池的工作原理
4、原电池的构成条件
课堂小结
谢谢聆听 敬请指导
