化学人教版(2019)选择性必修2 1.2原子结构与元素的性质(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.2原子结构与元素的性质(共20张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-19 00:00:00 | ||
图片预览







文档简介
(共20张PPT)
原子半径、电离能、电负性的周期性变化
原子结构与元素的性质
人教版选择性必修2第一章第二节
外界条件对化学反应
的速率和平衡的影响,如下图所示:
图像的丰富内涵需要有相应的方法和视角才能解读出来
方法导引
图像认知模型
——来自选必一P31
口诀:两轴、三点加趋势
方法导引
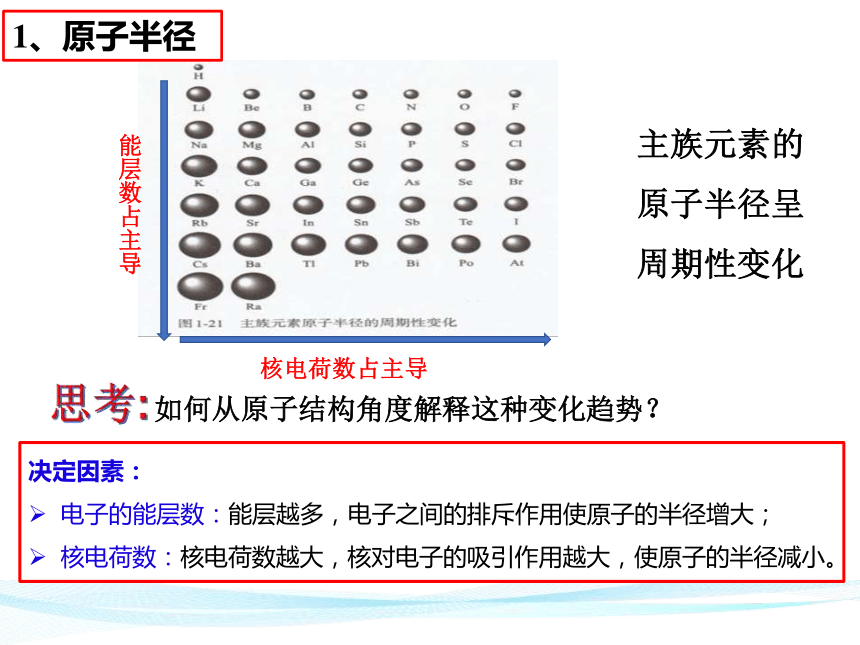
1、原子半径
原子序数-原子半径图
两轴、三点加趋势
思考:同周期主族元素从左到右,原子半径的变化趋势如何?
同主族元素从上到下,原子半径的变化趋势如何?
如何从原子结构角度解释这种变化趋势?
1、原子半径
思考:
能层数占主导
核电荷数占主导
主族元素的原子半径呈
周期性变化
决定因素:
电子的能层数:能层越多,电子之间的排斥作用使原子的半径增大;
核电荷数:核电荷数越大,核对电子的吸引作用越大,使原子的半径减小。
第一电离能:(符号:I1,单位:kJ /mol)
气态基态原子失去一个电子转化为气态基态正离子所需要的最低能量。A(g) - e- → A+(g) I1
——电离能可以定量地衡量或比较原子失电子的能力
A+(g) - e-→ A2+(g) I2
A2+(g) - e-→ A3+(g) I3
......
2、电离能 I
原子半径大小可定性比较原子得失电子能力的大小。
原子得失电子能力的大小可以定量比较吗?
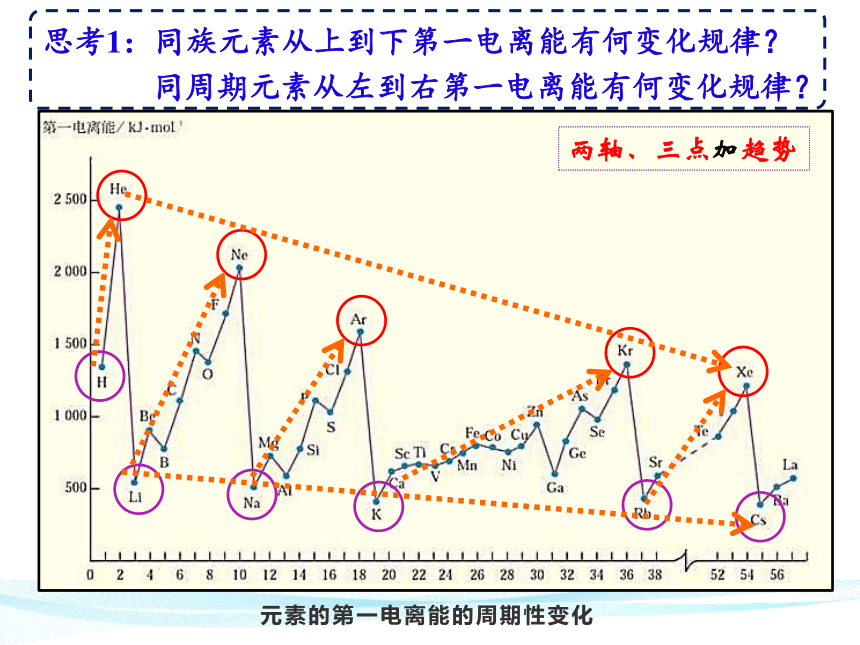
元素的第一电离能的周期性变化
两轴、三点加趋势
思考1:同族元素从上到下第一电离能有何变化规律?
同周期元素从左到右第一电离能有何变化规律?
(1)同族元素的原子,随着核电荷数的增大,I1逐渐减小。
(2)同周期元素的原子,随着核电荷数的增大,I1呈增大趋势。
思考2:从原子结构角度解释为何呈现这样的规律?
(1)同族元素随着核电荷数的增大,原子半径增大,核对最外层电子的吸引力减小,I1逐渐减小。
(2)同周期元素随着核电荷数的增大,原子半径减小,核对最外层电子的吸引力增大,I1呈增大趋势。
2、电离能 I
元素的第一电离能的周期性变化
思考3:观察同一周期中,ⅡA、ⅢA族元素的第一电离能;ⅤA、ⅥA族元素的第一电离能,请从核外价层电子排布分析突变的原因。
2、P的I1特殊的原因是?
Mg
1、Mg的I1特殊的原因是?
Al
P
S
Al
S
金属活泼性越强,I1越小。
形成正离子后,原子核对电子的束缚力整体提升,且越后电离的电子可能处于距离原子核更近的轨道之上,因此对于同一元素,电离能逐级增加。
跨越不同能层失去电子时,电离能出现突跃,可据此判断原子价层电子数,推测其最高化合价。
电离能解决了定量衡量原子失去电子的能力,那如何定量衡量原子吸引电子的能力呢?
——电负性:用来描述不同元素的原子对键合电子吸引力的大小。电负性越大的原子,对键合电子的吸引力越大。
电负性大小标准:电负性是相对值,无单位。
以氟的电负性为4.0和锂的电负性为1.0作为相对标准,得出各元素的电负性。
键合电子:原子中用于形成化学键的电子称为键合电子
3、电负性
思考与交流:观察图片,分析元素电负性随原子序数递增有什么变化规律?
角度1(纵向)
角度2(横向)
角度3(对角线)
角度4 (数值)
3、电负性
②金属元素的电负性一般小于1.8;非金属元素的电负性一般大于1.8。电负性在1.8左右的“类金属”既有金属性,又有非金属性。
①电负性越大,元素的非金属性越强;电负性越小,元素的金属性越强。
电负性的应用
③元素电负性相差很大(>1.7),形成离子键;
元素电负性相差不大(<1.7),形成共价键,且电负性相差越大的共价键,键的极性越大。
但也有特例(如NaH、HF)
请结合表格数据判断化合价:
(1)NaBH4中氢的化合价_____;
CH4中C的化合价为______; SiH4中Si的化合价为______ 。
(2)CH3CH2OH中两个C化合价一样吗
④判断化合物中各元素的化合价。
归纳总结
原子半径
电离能
电负性
呈周期
性变化
定性衡量原子得失电子能力
定量衡量原子失电子能力
定量衡量原子对键合电子的吸引能力
1.下列选项中的各组元素(从左到右)同时满足下列三个条件的是( )
①原子半径依次减小 ②第一电离能逐渐升高 ③电负性逐渐增大
A.Na、Mg、Al B.C、O、N C.Li、Na、K D.I、Cl、F
D
2.已知短周期元素的离子aA2+、bB+、cC3-、dD-具有相同的能层结构,则下列叙述正确的是( )
A.原子半径:A>B>D>C
B.原子序数:d>c>b>a
C.离子半径:C3->D->B+>A2+
D.单质的还原性:A>B>D>C
C
3.已知X、Y两元素同周期,且电负性:X>Y,下列说法错误的是( )
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应酸的酸性弱于Y对应酸的酸性
D.气态氢化物的稳定性:HmY<HnX
C
4.下列四种粒子中,半径按由大到小的顺序排列的是( )
①基态X的原子结构示意图:
②基态Y的价电子排布式:3s23p5
③基态Z2-的轨道表示式:
④W基态原子有2个能层,电子式:
A.③>①>②>④ B.③>②>①>④
C.①>③>④>② D.①>④>③>②
A
5. A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大。其中,元素A的一种核素无中子,B的单质既可以由分子组成也可以形成空间网状结构,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10。
请回答下列问题:
(1)基态G原子的电子排布式是 ____________________________,M在元素周期表中的位置是 。
(2)元素B、D、E的第一电离能由大到小的顺序为 ____________(用元素符号表示),电负性由大到小的顺序为_______________。
1s22s22p63s23p64s1或[Ar]4s1
第四周期第ⅠB族
N>O>C
O>N>C
原子半径、电离能、电负性的周期性变化
原子结构与元素的性质
人教版选择性必修2第一章第二节
外界条件对化学反应
的速率和平衡的影响,如下图所示:
图像的丰富内涵需要有相应的方法和视角才能解读出来
方法导引
图像认知模型
——来自选必一P31
口诀:两轴、三点加趋势
方法导引
1、原子半径
原子序数-原子半径图
两轴、三点加趋势
思考:同周期主族元素从左到右,原子半径的变化趋势如何?
同主族元素从上到下,原子半径的变化趋势如何?
如何从原子结构角度解释这种变化趋势?
1、原子半径
思考:
能层数占主导
核电荷数占主导
主族元素的原子半径呈
周期性变化
决定因素:
电子的能层数:能层越多,电子之间的排斥作用使原子的半径增大;
核电荷数:核电荷数越大,核对电子的吸引作用越大,使原子的半径减小。
第一电离能:(符号:I1,单位:kJ /mol)
气态基态原子失去一个电子转化为气态基态正离子所需要的最低能量。A(g) - e- → A+(g) I1
——电离能可以定量地衡量或比较原子失电子的能力
A+(g) - e-→ A2+(g) I2
A2+(g) - e-→ A3+(g) I3
......
2、电离能 I
原子半径大小可定性比较原子得失电子能力的大小。
原子得失电子能力的大小可以定量比较吗?
元素的第一电离能的周期性变化
两轴、三点加趋势
思考1:同族元素从上到下第一电离能有何变化规律?
同周期元素从左到右第一电离能有何变化规律?
(1)同族元素的原子,随着核电荷数的增大,I1逐渐减小。
(2)同周期元素的原子,随着核电荷数的增大,I1呈增大趋势。
思考2:从原子结构角度解释为何呈现这样的规律?
(1)同族元素随着核电荷数的增大,原子半径增大,核对最外层电子的吸引力减小,I1逐渐减小。
(2)同周期元素随着核电荷数的增大,原子半径减小,核对最外层电子的吸引力增大,I1呈增大趋势。
2、电离能 I
元素的第一电离能的周期性变化
思考3:观察同一周期中,ⅡA、ⅢA族元素的第一电离能;ⅤA、ⅥA族元素的第一电离能,请从核外价层电子排布分析突变的原因。
2、P的I1特殊的原因是?
Mg
1、Mg的I1特殊的原因是?
Al
P
S
Al
S
金属活泼性越强,I1越小。
形成正离子后,原子核对电子的束缚力整体提升,且越后电离的电子可能处于距离原子核更近的轨道之上,因此对于同一元素,电离能逐级增加。
跨越不同能层失去电子时,电离能出现突跃,可据此判断原子价层电子数,推测其最高化合价。
电离能解决了定量衡量原子失去电子的能力,那如何定量衡量原子吸引电子的能力呢?
——电负性:用来描述不同元素的原子对键合电子吸引力的大小。电负性越大的原子,对键合电子的吸引力越大。
电负性大小标准:电负性是相对值,无单位。
以氟的电负性为4.0和锂的电负性为1.0作为相对标准,得出各元素的电负性。
键合电子:原子中用于形成化学键的电子称为键合电子
3、电负性
思考与交流:观察图片,分析元素电负性随原子序数递增有什么变化规律?
角度1(纵向)
角度2(横向)
角度3(对角线)
角度4 (数值)
3、电负性
②金属元素的电负性一般小于1.8;非金属元素的电负性一般大于1.8。电负性在1.8左右的“类金属”既有金属性,又有非金属性。
①电负性越大,元素的非金属性越强;电负性越小,元素的金属性越强。
电负性的应用
③元素电负性相差很大(>1.7),形成离子键;
元素电负性相差不大(<1.7),形成共价键,且电负性相差越大的共价键,键的极性越大。
但也有特例(如NaH、HF)
请结合表格数据判断化合价:
(1)NaBH4中氢的化合价_____;
CH4中C的化合价为______; SiH4中Si的化合价为______ 。
(2)CH3CH2OH中两个C化合价一样吗
④判断化合物中各元素的化合价。
归纳总结
原子半径
电离能
电负性
呈周期
性变化
定性衡量原子得失电子能力
定量衡量原子失电子能力
定量衡量原子对键合电子的吸引能力
1.下列选项中的各组元素(从左到右)同时满足下列三个条件的是( )
①原子半径依次减小 ②第一电离能逐渐升高 ③电负性逐渐增大
A.Na、Mg、Al B.C、O、N C.Li、Na、K D.I、Cl、F
D
2.已知短周期元素的离子aA2+、bB+、cC3-、dD-具有相同的能层结构,则下列叙述正确的是( )
A.原子半径:A>B>D>C
B.原子序数:d>c>b>a
C.离子半径:C3->D->B+>A2+
D.单质的还原性:A>B>D>C
C
3.已知X、Y两元素同周期,且电负性:X>Y,下列说法错误的是( )
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应酸的酸性弱于Y对应酸的酸性
D.气态氢化物的稳定性:HmY<HnX
C
4.下列四种粒子中,半径按由大到小的顺序排列的是( )
①基态X的原子结构示意图:
②基态Y的价电子排布式:3s23p5
③基态Z2-的轨道表示式:
④W基态原子有2个能层,电子式:
A.③>①>②>④ B.③>②>①>④
C.①>③>④>② D.①>④>③>②
A
5. A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大。其中,元素A的一种核素无中子,B的单质既可以由分子组成也可以形成空间网状结构,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10。
请回答下列问题:
(1)基态G原子的电子排布式是 ____________________________,M在元素周期表中的位置是 。
(2)元素B、D、E的第一电离能由大到小的顺序为 ____________(用元素符号表示),电负性由大到小的顺序为_______________。
1s22s22p63s23p64s1或[Ar]4s1
第四周期第ⅠB族
N>O>C
O>N>C
