吉林省延边州2023-2024学年高一上学期期末学业质量检测化学试题(含答案)
文档属性
| 名称 | 吉林省延边州2023-2024学年高一上学期期末学业质量检测化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-20 09:23:43 | ||
图片预览


文档简介
延边州2023—2024学年度第一学期期末学业质量检测
高一化学
考试时间:11:15-12:30 总分:100分
本试卷共8页,考试结束后,将本试卷和答题卡一并交回。
注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂,非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.做图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 Fe:56
一、选择题(本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
1.化学与生活、社会发展息息相关,下列说法不合理的是( )
A.作补血剂时可与维生素同时服用
B.雾是一种气溶胶,光束透过大雾可观察到丁达尔效应
C.生活中常备杀菌消毒试剂有“84”消毒液、漂白粉
D.磁性氧化铁可用作红色油漆和涂料
2.下列化学用语使用正确的是( )
A.和互为同位素
B.中质子数和中子数相差147
C.用电子式表示的形成过程:
D.的结构式:
3.下列离子方程式正确的是( )
A.化工生产中漂白粉的制备:
B.过氧化钠溶于水:
C.铁与氯化铁溶液的反应:
D.用小苏打治疗胃酸过多:
4.分类能让我们的学习更高效,对下列物质的分类正确的是( )
选项 纯净物 酸 碱 盐 碱性氧化物 电解质
A 火碱
B 冰水混合物
C
D 液氯 纯碱 铜
A.A B.B C.C D.D
5.下列各组离子在对应条件下一定能大量共存的是( )
A.澄清溶液中:
B.加入金属铝能放出氢气的溶液:
C.大量存在的溶液中:
D.遇石落变红的溶液:
6.下列“实验操作及事实”与“实验结论”相符的一组是( )
A.蓝色石蕊试纸上滴加新制氯水先变红后褪色,则新制氯水无酸性只有漂白性
B.向溶液中加入少量铜粉固体溶解,则氧化性:
C.金属钠在空气中燃烧后生成淡黄色固体,该淡黄色固体是
D.向某固体中加入稀盐酸产生气泡,该固体一定是碳酸盐
7.古文献《洗冤集录》记载的“银针验毒”的原理为。下列有关该原理说法正确的是( )
A.被还原 B.是还原产物
C.是氧化剂 D.生成时,转移电子
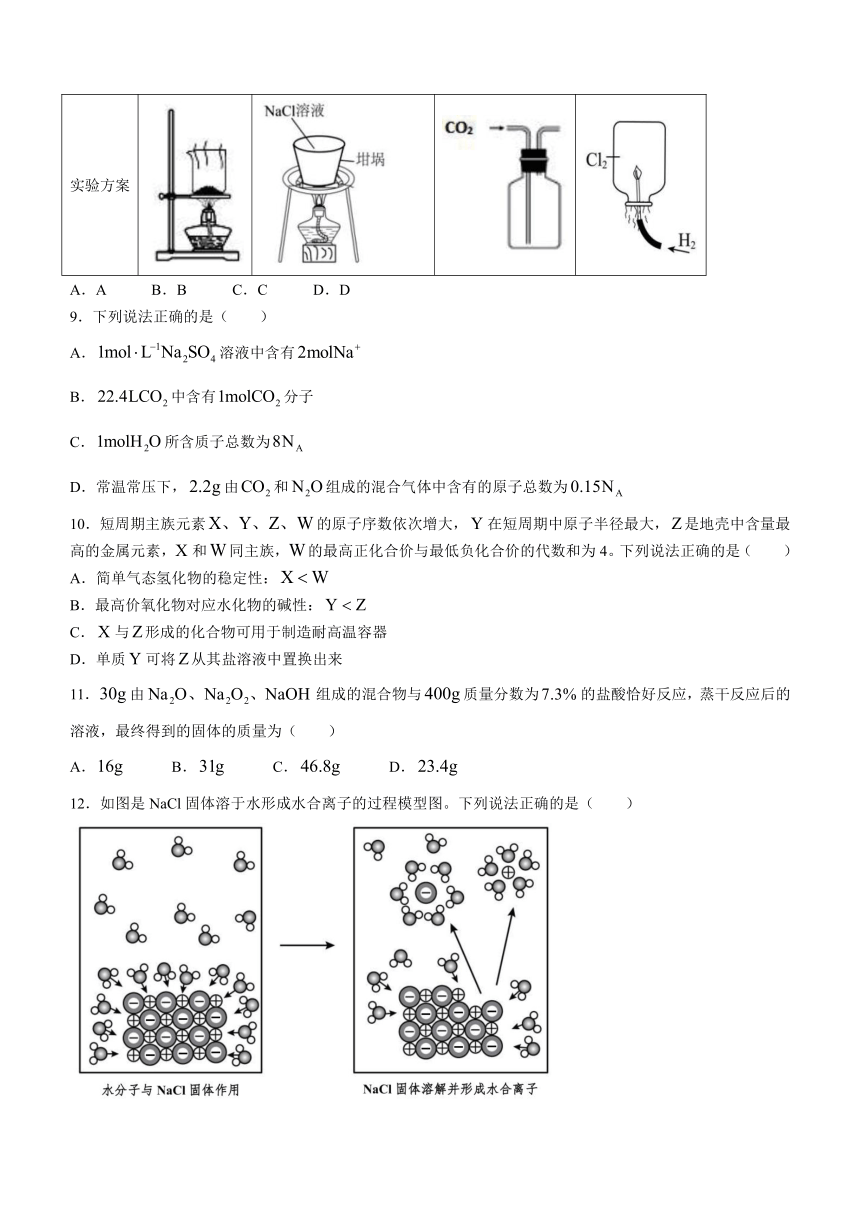
8.下列实验方案能达到实验目的的是( )
选项 A B C D
目的 干燥 蒸发结晶得到氯化钠晶体 收集 在中燃烧
实验方案
A.A B.B C.C D.D
9.下列说法正确的是( )
A.溶液中含有
B.中含有分子
C.所含质子总数为
D.常温常压下,由和组成的混合气体中含有的原子总数为
10.短周期主族元素的原子序数依次增大,在短周期中原子半径最大,是地壳中含量最高的金属元素,和同主族,的最高正化合价与最低负化合价的代数和为4。下列说法正确的是( )
A.简单气态氢化物的稳定性:
B.最高价氧化物对应水化物的碱性:
C.与形成的化合物可用于制造耐高温容器
D.单质可将从其盐溶液中置换出来
11.由组成的混合物与质量分数为的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体的质量为( )
A. B. C. D.
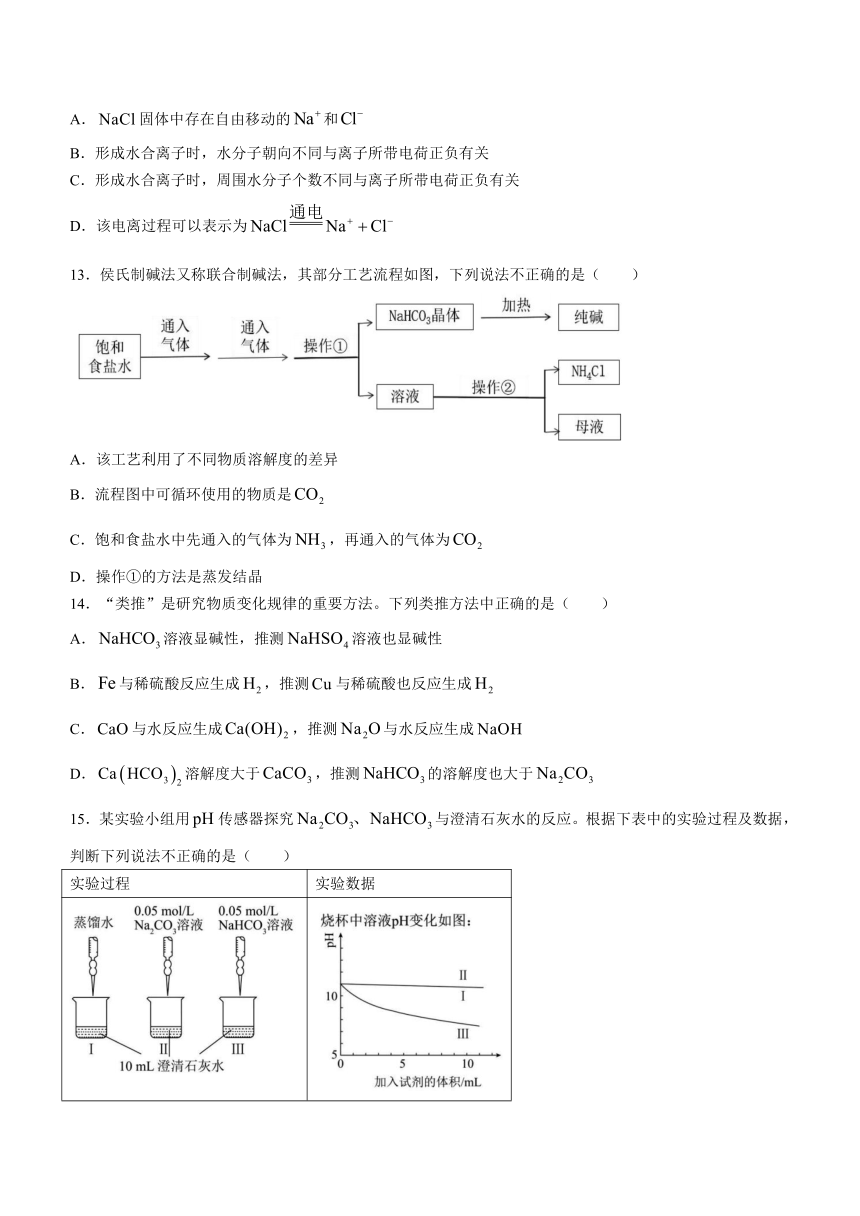
12.如图是NaCl固体溶于水形成水合离子的过程模型图。下列说法正确的是( )
A.固体中存在自由移动的和
B.形成水合离子时,水分子朝向不同与离子所带电荷正负有关
C.形成水合离子时,周围水分子个数不同与离子所带电荷正负有关
D.该电离过程可以表示为
13.侯氏制碱法又称联合制碱法,其部分工艺流程如图,下列说法不正确的是( )
A.该工艺利用了不同物质溶解度的差异
B.流程图中可循环使用的物质是
C.饱和食盐水中先通入的气体为,再通入的气体为
D.操作①的方法是蒸发结晶
14.“类推”是研究物质变化规律的重要方法。下列类推方法中正确的是( )
A.溶液显碱性,推测溶液也显碱性
B.与稀硫酸反应生成,推测与稀硫酸也反应生成
C.与水反应生成,推测与水反应生成
D.溶解度大于,推测的溶解度也大于
15.某实验小组用传感器探究与澄清石灰水的反应。根据下表中的实验过程及数据,判断下列说法不正确的是( )
实验过程 实验数据
A.Ⅰ是空白实验,排除因体积变化对Ⅱ、Ⅲ溶液pH的影响
B.Ⅱ的烧杯中因发生反应而产生白色沉淀
C.Ⅱ和Ⅰ的曲线基本重合,说明Ⅱ中没有参加反应
D.Ⅲ初期发生反应:,导致溶液下降
16.某化学小组欲通过测定混合气体中的含量来计算已变质的样品中(只含一种杂质)的含量。实验装置如下图(为弹性良好的气囊)。
已知:①过氧化钠与硫酸反应的总化学方程式为:②忽略气体在Ⅰ和Ⅳ中的溶解。
下列说法正确的是( )
A.测定气体总体积必须关闭,打开
B.的作用是除去气体中的,故中应装有无水
C.量筒Ⅰ用于测量产生的体积,量筒Ⅱ用于测量产生的体积
D.若量筒Ⅱ收集的气体折算为标准状况下是,则已变质的样品中的质量分数为
二、非选择题(本题共4小题,共52分。)
17.(13分)
现有下列六种物质:① ②过氧化钠 ③ ④溶液 ⑤碳酸氢钠 ⑥。请根据上述物质回答下列问题:
(1)在上述物质中属于酸性氧化物的有_______(填①~⑥序号)。
(2)含有氧原子的②与足量①反应,产生的气体在标准状况下的体积为_______L。
(3)写出⑥在水溶液中的电离方程式_______.
(4)②所含化学键类型为_______.
(5)某同学帮助水质检测站配制④以备使用。
①该同学应用托盘天平称取固体_______g。
②配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_______.
③定容时仰视刻度线,则所配制的溶液的浓度会_______(填“偏高”、“偏低”、“不变”)。
(6)4和⑤的溶液混合,发生反应的离子方程式为_______。
18.(13分)
现有A~G七种中学常见物质,它们之间能发生如下反应(图中部分反应物、产物及反应条件未标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B_______、C_______、乙_______。
(2)借助KSCN溶液检验物质F中金属阳离子的方法是_______。
(3)写出反应③和⑤的离子方程式:_______、_______。
(4)将物质F少许,置于试管中,并加入NaOH溶液,其现象为_______,发生反应的化学方程式为_______、_______。
19.(13分)
氯酸锶白色结晶粉末,可溶于水,微溶于酒精,主要用于制造红色焰火。可溶于水,是一种常见的可溶性强碱。实验室制取氯酸锶的实验装置如图,反应的化学方程式为。已知将浓盐酸滴入高锰酸钾固体中,产生黄绿色气体,溶液的紫红色褪去。请回答下列问题:
(1)仪器M的名称是_______。
(2)仪器接口的连接顺序a→_______。
(3)A中发生反应的离子方程式为_______。
(4)装置D中所装试剂名称为_______,其作用是_______。
(5)装置B中发生反应的离子方程式为_______。
(6)某兴趣小组在40℃条件下,将一定量的通入一定量的溶液中,恰好反应完全,得到的产物中含有,其中和的物质的量之比为5∶1,则此过程中氧化剂和还原剂的质量比为_______。
20.(13分)
家中的食品、调味品、洗涤剂和药品等都含有化学物质,以下是胃药和加碘食盐的标签,请回答下列问题。
铝镁咀嚼片 【药品名】铝镁咀嚼片 【成分】氢氧化镁、氢氧化铝、二甲基硅油 【适应症】胃酸过多引起的胃痛、烧心等胃胀气的治疗 食用盐 【配料表】精制盐、碘酸钾 【碘含量(以I计)】21mg/kg~39mg/kg 【保质期】36个月
(1)标签中涉及到的金属元素有_______,非金属元素有;在元素周期表中的位置是_______,的结构示意图为_______。
(2)写出由两种元素组成的常见温室气体的电子式_______。
(3)比较下列性质,用“>”、“=”或“<”填空。
①酸性:_______
②还原性:_______
③离子半径:_______
(4)用以下对比实验探究的金属性强弱以及的非金属性强弱。
比较Mg、Al金属性强弱 比较Cl、I非金属性强弱
选择的试剂:溶液、溶液、氨水、溶液 选择的试剂:新制氯水、溶液
操作:向两支试管中分别加入少许溶液和溶液,然后滴加氨水,直到不再产生白色沉淀和白色沉淀为止,再向两支试管中分别加入溶液,边加边振荡,观察现象。 操作:向盛有溶液的试管中加入新制氯水,振荡
现象:_______ 现象:溶液由无色变为棕黄色 化学方程式:_______
结论:金属性强于 结论:非金属性Cl强于I
2023-2024学年度高一统考(化学)参考答案和评分标准
1-16题【答案】DCBCA BCCDC CBDCD D
17题(13分)【答案】(1)①③ (2)2.24
(3) (4)离子键、共价键(非极性共价键)
(5)①2.0 ②容量瓶 ③偏低
(6)
18题(13分)【答案】(1)
(2)取一定体积的F溶液于试管中,加入KSCN溶液,溶液无明显变化,加入氯水后,溶液变为红色。(答案合理即可)(2分)
(3)
(4)先生成白色絮状沉淀,迅速变成灰绿色沉淀,一段时间后变为红褐色沉淀。
19(13分)【答案】(1)分液漏斗 (2)
(3)
(4)饱和食盐水 除去氯气中的氯化氢同时降低氯气的溶解度(降低氯气的溶解度不写也给分)
(5) (6)5∶3
20题(13分)【答案】(1) 第三周期(或第3周期)第ⅦA族
(2) (3)> < >
(3)白色沉淀不溶解,白色沉淀溶解
(4)
高一化学
考试时间:11:15-12:30 总分:100分
本试卷共8页,考试结束后,将本试卷和答题卡一并交回。
注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂,非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.做图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 Fe:56
一、选择题(本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
1.化学与生活、社会发展息息相关,下列说法不合理的是( )
A.作补血剂时可与维生素同时服用
B.雾是一种气溶胶,光束透过大雾可观察到丁达尔效应
C.生活中常备杀菌消毒试剂有“84”消毒液、漂白粉
D.磁性氧化铁可用作红色油漆和涂料
2.下列化学用语使用正确的是( )
A.和互为同位素
B.中质子数和中子数相差147
C.用电子式表示的形成过程:
D.的结构式:
3.下列离子方程式正确的是( )
A.化工生产中漂白粉的制备:
B.过氧化钠溶于水:
C.铁与氯化铁溶液的反应:
D.用小苏打治疗胃酸过多:
4.分类能让我们的学习更高效,对下列物质的分类正确的是( )
选项 纯净物 酸 碱 盐 碱性氧化物 电解质
A 火碱
B 冰水混合物
C
D 液氯 纯碱 铜
A.A B.B C.C D.D
5.下列各组离子在对应条件下一定能大量共存的是( )
A.澄清溶液中:
B.加入金属铝能放出氢气的溶液:
C.大量存在的溶液中:
D.遇石落变红的溶液:
6.下列“实验操作及事实”与“实验结论”相符的一组是( )
A.蓝色石蕊试纸上滴加新制氯水先变红后褪色,则新制氯水无酸性只有漂白性
B.向溶液中加入少量铜粉固体溶解,则氧化性:
C.金属钠在空气中燃烧后生成淡黄色固体,该淡黄色固体是
D.向某固体中加入稀盐酸产生气泡,该固体一定是碳酸盐
7.古文献《洗冤集录》记载的“银针验毒”的原理为。下列有关该原理说法正确的是( )
A.被还原 B.是还原产物
C.是氧化剂 D.生成时,转移电子
8.下列实验方案能达到实验目的的是( )
选项 A B C D
目的 干燥 蒸发结晶得到氯化钠晶体 收集 在中燃烧
实验方案
A.A B.B C.C D.D
9.下列说法正确的是( )
A.溶液中含有
B.中含有分子
C.所含质子总数为
D.常温常压下,由和组成的混合气体中含有的原子总数为
10.短周期主族元素的原子序数依次增大,在短周期中原子半径最大,是地壳中含量最高的金属元素,和同主族,的最高正化合价与最低负化合价的代数和为4。下列说法正确的是( )
A.简单气态氢化物的稳定性:
B.最高价氧化物对应水化物的碱性:
C.与形成的化合物可用于制造耐高温容器
D.单质可将从其盐溶液中置换出来
11.由组成的混合物与质量分数为的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体的质量为( )
A. B. C. D.
12.如图是NaCl固体溶于水形成水合离子的过程模型图。下列说法正确的是( )
A.固体中存在自由移动的和
B.形成水合离子时,水分子朝向不同与离子所带电荷正负有关
C.形成水合离子时,周围水分子个数不同与离子所带电荷正负有关
D.该电离过程可以表示为
13.侯氏制碱法又称联合制碱法,其部分工艺流程如图,下列说法不正确的是( )
A.该工艺利用了不同物质溶解度的差异
B.流程图中可循环使用的物质是
C.饱和食盐水中先通入的气体为,再通入的气体为
D.操作①的方法是蒸发结晶
14.“类推”是研究物质变化规律的重要方法。下列类推方法中正确的是( )
A.溶液显碱性,推测溶液也显碱性
B.与稀硫酸反应生成,推测与稀硫酸也反应生成
C.与水反应生成,推测与水反应生成
D.溶解度大于,推测的溶解度也大于
15.某实验小组用传感器探究与澄清石灰水的反应。根据下表中的实验过程及数据,判断下列说法不正确的是( )
实验过程 实验数据
A.Ⅰ是空白实验,排除因体积变化对Ⅱ、Ⅲ溶液pH的影响
B.Ⅱ的烧杯中因发生反应而产生白色沉淀
C.Ⅱ和Ⅰ的曲线基本重合,说明Ⅱ中没有参加反应
D.Ⅲ初期发生反应:,导致溶液下降
16.某化学小组欲通过测定混合气体中的含量来计算已变质的样品中(只含一种杂质)的含量。实验装置如下图(为弹性良好的气囊)。
已知:①过氧化钠与硫酸反应的总化学方程式为:②忽略气体在Ⅰ和Ⅳ中的溶解。
下列说法正确的是( )
A.测定气体总体积必须关闭,打开
B.的作用是除去气体中的,故中应装有无水
C.量筒Ⅰ用于测量产生的体积,量筒Ⅱ用于测量产生的体积
D.若量筒Ⅱ收集的气体折算为标准状况下是,则已变质的样品中的质量分数为
二、非选择题(本题共4小题,共52分。)
17.(13分)
现有下列六种物质:① ②过氧化钠 ③ ④溶液 ⑤碳酸氢钠 ⑥。请根据上述物质回答下列问题:
(1)在上述物质中属于酸性氧化物的有_______(填①~⑥序号)。
(2)含有氧原子的②与足量①反应,产生的气体在标准状况下的体积为_______L。
(3)写出⑥在水溶液中的电离方程式_______.
(4)②所含化学键类型为_______.
(5)某同学帮助水质检测站配制④以备使用。
①该同学应用托盘天平称取固体_______g。
②配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_______.
③定容时仰视刻度线,则所配制的溶液的浓度会_______(填“偏高”、“偏低”、“不变”)。
(6)4和⑤的溶液混合,发生反应的离子方程式为_______。
18.(13分)
现有A~G七种中学常见物质,它们之间能发生如下反应(图中部分反应物、产物及反应条件未标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B_______、C_______、乙_______。
(2)借助KSCN溶液检验物质F中金属阳离子的方法是_______。
(3)写出反应③和⑤的离子方程式:_______、_______。
(4)将物质F少许,置于试管中,并加入NaOH溶液,其现象为_______,发生反应的化学方程式为_______、_______。
19.(13分)
氯酸锶白色结晶粉末,可溶于水,微溶于酒精,主要用于制造红色焰火。可溶于水,是一种常见的可溶性强碱。实验室制取氯酸锶的实验装置如图,反应的化学方程式为。已知将浓盐酸滴入高锰酸钾固体中,产生黄绿色气体,溶液的紫红色褪去。请回答下列问题:
(1)仪器M的名称是_______。
(2)仪器接口的连接顺序a→_______。
(3)A中发生反应的离子方程式为_______。
(4)装置D中所装试剂名称为_______,其作用是_______。
(5)装置B中发生反应的离子方程式为_______。
(6)某兴趣小组在40℃条件下,将一定量的通入一定量的溶液中,恰好反应完全,得到的产物中含有,其中和的物质的量之比为5∶1,则此过程中氧化剂和还原剂的质量比为_______。
20.(13分)
家中的食品、调味品、洗涤剂和药品等都含有化学物质,以下是胃药和加碘食盐的标签,请回答下列问题。
铝镁咀嚼片 【药品名】铝镁咀嚼片 【成分】氢氧化镁、氢氧化铝、二甲基硅油 【适应症】胃酸过多引起的胃痛、烧心等胃胀气的治疗 食用盐 【配料表】精制盐、碘酸钾 【碘含量(以I计)】21mg/kg~39mg/kg 【保质期】36个月
(1)标签中涉及到的金属元素有_______,非金属元素有;在元素周期表中的位置是_______,的结构示意图为_______。
(2)写出由两种元素组成的常见温室气体的电子式_______。
(3)比较下列性质,用“>”、“=”或“<”填空。
①酸性:_______
②还原性:_______
③离子半径:_______
(4)用以下对比实验探究的金属性强弱以及的非金属性强弱。
比较Mg、Al金属性强弱 比较Cl、I非金属性强弱
选择的试剂:溶液、溶液、氨水、溶液 选择的试剂:新制氯水、溶液
操作:向两支试管中分别加入少许溶液和溶液,然后滴加氨水,直到不再产生白色沉淀和白色沉淀为止,再向两支试管中分别加入溶液,边加边振荡,观察现象。 操作:向盛有溶液的试管中加入新制氯水,振荡
现象:_______ 现象:溶液由无色变为棕黄色 化学方程式:_______
结论:金属性强于 结论:非金属性Cl强于I
2023-2024学年度高一统考(化学)参考答案和评分标准
1-16题【答案】DCBCA BCCDC CBDCD D
17题(13分)【答案】(1)①③ (2)2.24
(3) (4)离子键、共价键(非极性共价键)
(5)①2.0 ②容量瓶 ③偏低
(6)
18题(13分)【答案】(1)
(2)取一定体积的F溶液于试管中,加入KSCN溶液,溶液无明显变化,加入氯水后,溶液变为红色。(答案合理即可)(2分)
(3)
(4)先生成白色絮状沉淀,迅速变成灰绿色沉淀,一段时间后变为红褐色沉淀。
19(13分)【答案】(1)分液漏斗 (2)
(3)
(4)饱和食盐水 除去氯气中的氯化氢同时降低氯气的溶解度(降低氯气的溶解度不写也给分)
(5) (6)5∶3
20题(13分)【答案】(1) 第三周期(或第3周期)第ⅦA族
(2) (3)> < >
(3)白色沉淀不溶解,白色沉淀溶解
(4)
同课章节目录
