化学人教版(2019)必修第一册1.3.3氧化还原反应配平计算(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.3氧化还原反应配平计算(共35张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 18.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-20 09:24:45 | ||
图片预览








文档简介
(共35张PPT)
氧化还原反应的分类及其配平
(升失氧化还原剂,降得还原氧化剂)
化合价升高→失电子→被氧化→发生氧化反应→生成氧化产物→是还原剂
化合价降低→得电子→被还原→发生还原反应→生成还原产物→是氧化剂
记忆口诀:升失氧,降得还;若问剂,两相反。
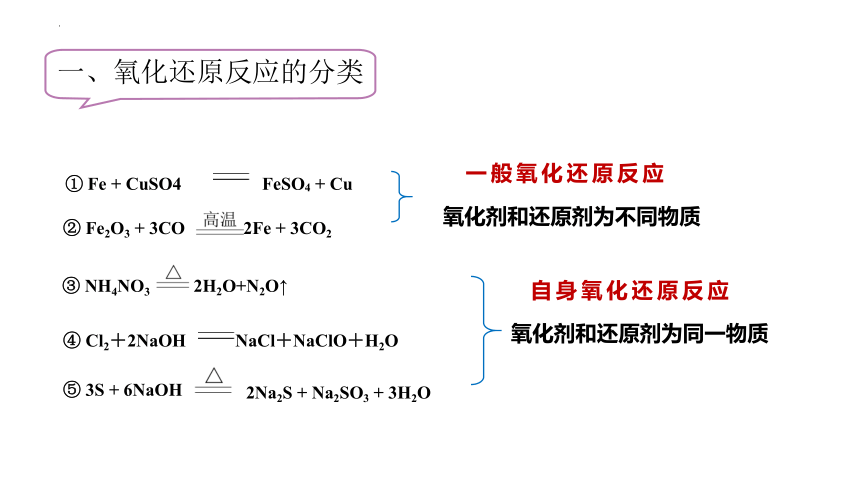
1.氧化还原反应的分类
一、氧化还原反应的分类
① Fe + CuSO4 FeSO4 + Cu
⑤ 3S + 6NaOH
2Na2S + Na2SO3 + 3H2O
② Fe2O3 + 3CO 2Fe + 3CO2
③ NH4NO3
2H2O+N2O↑
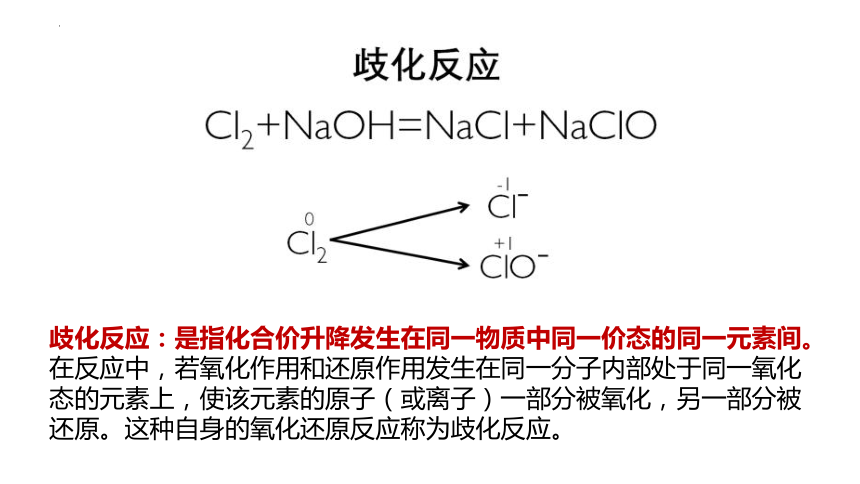
④ Cl2+2NaOH NaCl+NaClO+H2O
氧化剂和还原剂为不同物质
氧化剂和还原剂为同一物质
一般氧化还原反应
自身氧化还原反应
歧化反应:是指化合价升降发生在同一物质中同一价态的同一元素间。在反应中,若氧化作用和还原作用发生在同一分子内部处于同一氧化态的元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。
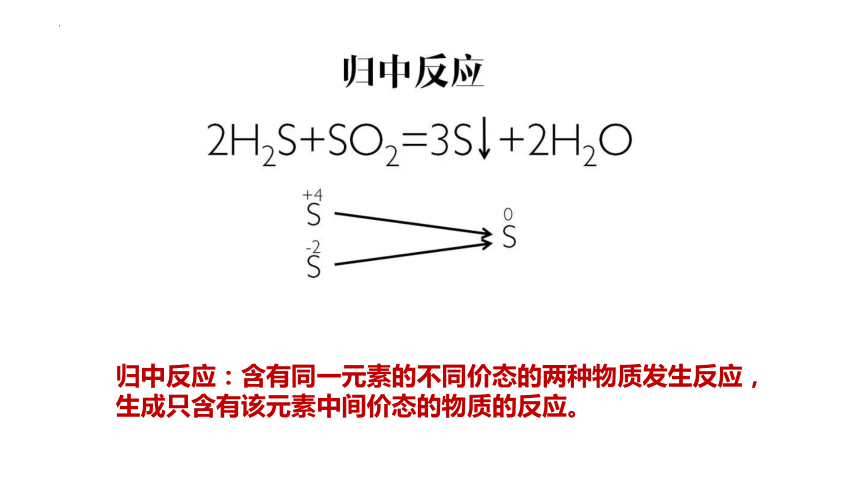
归中反应:含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应。
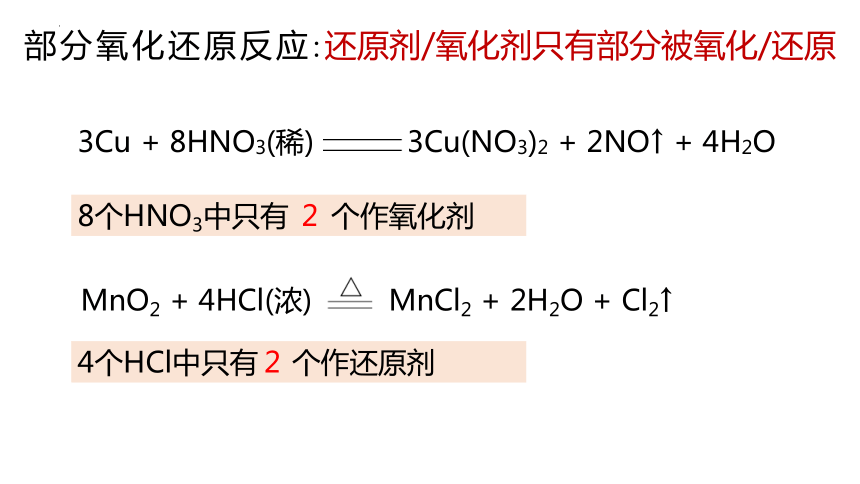
3Cu + 8HNO3(稀) 3Cu(NO3)2 + 2NO↑ + 4H2O
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
部分氧化还原反应:还原剂/氧化剂只有部分被氧化/还原
8个HNO3中只有 个作氧化剂
2
4个HCl中只有 个作还原剂
2
2.书写氧化还原反应方程式
初中书写化学方程式要符合哪些原则?
1.客观规律
2.质量守恒定律
初中书写化学方程式的过程?
1.写(确定反应物、生成物)
2.配(配平)
3.注(标注反应条件、气体符号、沉淀符号等)
练一练
思:碳和浓硝酸在加热条件下反应反应,产物有二氧化氮、二氧化碳、水三种,请写出该反应的化学方程式?
(1)得失电子守恒:
氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数。
(2)质量守恒:反应前后原子的种类和个数不变。
(3)电荷守恒:离子反应前后,阴、阳离子所带电荷总数相等。
1.氧化还原反应方程式配平的基本原则
(1)标价态:写出反应物和生成物的化学式,标出发生氧化反应和还原反应的元素的化合价。
(2)列变化:标出反应前后元素化合价的变化。
2.氧化还原反应方程式配平的一般步骤
(3)求总数:依据电子得失守恒,使化合价升高和降低的总数相等。
(4)配系数:确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,再用观察法配平其他物质的化学计量数。
C+4HNO3(浓)——4NO2↑+CO2↑+2H2O
(5)查守恒:检查电荷是否守恒,原子个数是否守恒,配平后,把单线改成等号,标注反应条件。
配平技巧:四步配平。
依据 得失电子守恒
具体步骤:
①查变价原子守恒
②查电荷守恒(缺项配平时)
③查整体守恒
1.标价态
2.列升降
3.求总数
4.配系数
5.查守恒
____ FeCl3 + _____ H2S ===_____ FeCl2 + ___ HCl + _____S↓
_____S + _____NaOH === ____Na2S + ___Na2SO3 + ___H2O
____NH3 + _____NO === _____N2 + _____H2O
___Fe + ___HNO3(稀) === ___Fe(NO3)3 + ___NO↑+ ____H2O
21221;36213;4656;14112
①__ +__H2O2+____===__Mn2++__O2↑+__H2O
②__Fe3++__SO2+__H2O===__Fe2++__ +____
2
5
6H+
2
5
8
2
1
1
2
2
4H+
1、一般从左配:对于一般氧化还原反应,从左边氧化剂、还原剂着手配平。
2、自变从右配:对于自身氧化还原反应,一般从右边氧化产物、还原产物配平。
3、归中从左配:对于归中反应,一般从左边氧化剂、还原剂着手配平。
4、部分别忘加:对于部分氧化还原反应,一般先配平得失电子,再加上没有变价的部分。
5、对于缺项的离子方程式,酸性环境配氢离子、碱性环境配氢氧根、没有明确说明条件,反应物配水,生成氢离子或氢氧根。
无法确定化合物中元素化合价时,根据化合物中各元素化合价代数和为零,令该物质中各元素化合价均为零价,然后利用整体法计算出化合价总升降值,进行配平。
类型一 零价法
(1)___FeS2+___O2=====___Fe2O3+___SO2
(2)___FeC3+___HNO3=___Fe(NO3)3+___CO2+___NO+___H2O
高温
6.陌生氧化还原反应配平
4 11 2 8
1 8 1 3 5 4
一般设组成元素较多的物质的化学计量数为1,其他物质的化学计量数为a.b.c...根据原子个数守恒列等式求解。此法适用于一切氧化还原反应。主要用于变价元素在三种或三种以上的复杂氧化还原反应。
类型二 待定系数法
(1) CuSO4+ FeS2+ H2O= Cu2S+ FeSO4+ H2SO4
(2) NaClO + H2O + Ag= AgCl+ NaOH+ O2
6.陌生氧化还原反应配平
二、氧化还原反应的计算
1.计算依据
(1)氧化剂获得电子总数等于还原剂失去电子总数,即得失电子守恒。
(2)氧化剂中元素降价总数等于还原剂中元素升价总数,即化合价升降守恒。
2.计算方法
(1)找出氧化剂、还原剂及对应的还原产物、氧化产物。
(2)标准确变价元素的化合价。
(3)找准每个氧化剂、还原剂中变价的原子个数。
(4)列出等式并计算:
N(氧化剂)×变价原子个数×|化合价变化值|=N(还原剂)×变价原子个数×|化合价变化值|。
练习1、用正向配平法配平下列氧化还原反应
KMnO4+ HCl KCl+ MnCl2+ H2O+ Cl2↑
2;16;2 ;2;8;5
① Fe2+ + MnO4— + H+ → Mn2+ + Fe3+ + H2O
5;1;8 ;1;5;4
② Cl2+I2+ H2O= HIO3+ HCl
5;1;6 ;2;10
③ Cr2O72-+ H2O2+ H+= CrO5+ H2O.
④ K2S+K2SO3+HCl—S↓+ KCl+H2O
1;4;2 ;2;5
2;1;6 ;3;6;3
【例2】按要求完成下列问题:
(1)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:_____________________________________。
(3)水中的溶解氧是水生生物生存不可缺少的条件。将水样与Mn(OH)2碱性悬浊液混合,反应生成MnO(OH)2,实现氧的固定。“氧的固定”中发生反应的化学方程式为______________________________。
题型二:氧化还原方程式的书写
+4H2O
2HNO2+(NH2)2CO=2N2+CO2+3H2O
2Mn(OH)2+O2=2MnO(OH)2
1.在反应3Cl2+8NH3===6NH4Cl+N2中,被氧化的NH3与未被氧化的NH3质量比为
A.3∶8 B.1∶4 C.3∶4 D.1∶3
D
2.在氧化还原反应:3S+6KOH===K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数比是
A.1∶2 B.2∶1 C.1∶1 D.3∶2
A
3.在一定条件下,
2F-+H2O,从而可知在 中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
B
[例3]当溶液中 离子数之比为1∶3时,正好完全发生氧化还原反应,X在还原产物中的化合价为
A.+7 B.+2 C.+3 D.+4
C
题型三:氧化还原方程式的计算
练习2:
① I2 + KOH — KI + KIO3 + H2O
② NH3 + NO2 — N2 + H2O
③ C2H6 + O2 — CO2 + H2O
④ KMnO4 + HCl — KCl + MnCl2 + H2O + Cl2↑
答案:
① 1 I2 + 6 KOH — 5 KI +1 KIO3 + 3 H2O
② 8 NH3 + 6 NO2 —7 N2 + 12 H2O
③ 2 C2H6 +7 O2 — 4 CO2 + 6 H2O
④2KMnO4 +16HCl —2KCl + 2MnCl2 +8H2O +5Cl2↑
【例1】配平下列化学反应。
(1)____HCl(浓)+____MnO2 ____Cl2↑+____MnCl2+______H2O
(2)___ Cu+______HNO3(稀) = ____Cu(NO3)2+______NO↑+____H2O
(3)___ S+______KOH = ______K2S+_______K2SO3+_______H2O
题型一:氧化还原方程式的配平
△
4
1
1
2
1
3
8
3
2
4
2
1
3
6
3
2
1
2
1
1
1
2
2
2
2
____ FeCl3 + _____ H2S —— _____ FeCl2 + ___ HCl + _____S↓
_____C + _____H2SO4(浓) —— ____CO2↑+ __H2O + __SO2↑
——
——
【总结】对于一般氧化还原反应,一般从左边氧化剂、还原剂着手配平。
1.一般氧化还原反应
_____HNO3 —— _____NO2↑+ _____O2↑+ _____H2O
4
4
1
2
3
1
1
2
3
6
2
1
3
_____NO2 + _____H2O —— _____HNO3 + _____NO
_____S + _____NaOH —— ____Na2S + ___Na2SO3 + ___H2O
——
——
——
【总结】对于自身氧化还原反应,一般从右边氧化产物、还原产物配平。
2.自身氧化还原反应
_____NH3 + _____NO —— _____N2 + _____H2O
4
6
5
6
5
3
3
___KI + __KIO3 + ___H2SO4 —— ___K2SO4 + ___I2 + __H2O
——
——
1
3
3
【总结】对于归中反应,一般从左边氧化剂、还原剂着手配平。
3.归中反应
___ Cu + ___H2SO4(浓) —— ___ CuSO4 + ___SO2↑+ ____H2O
1
2
1
4
1
2
1
2
1
1
___Fe + ___HNO3(稀) —— ___Fe(NO3)3 + ___NO↑+ ____H2O
——
——
【总结】
对于部分氧化还原反应,一般先配平得失电子,再加上没有变价的部分
(或从完全变价的一侧配)
4.部分氧化还原反应
【总结】离子方程式中,若电荷不守恒,
[一般缺的为酸(H+)、碱(OH-)、水]配平电荷。
①__ +__H2O2+____===__Mn2++__O2↑+__H2O
②__Fe3++__SO2+__H2O===__Fe2++__ +____
2
5
6H+
2
5
8
2
1
1
2
2
4H+
条件 补项原则
酸性条件下 缺 (氢)或多 (氧)补 ,少 (氧)补 (水)
碱性条件下 缺 (氢)或多 (氧)补 (水),少 (氧)补
补项原则:
5.氧化还原离子方程式
氧化还原反应的分类及其配平
(升失氧化还原剂,降得还原氧化剂)
化合价升高→失电子→被氧化→发生氧化反应→生成氧化产物→是还原剂
化合价降低→得电子→被还原→发生还原反应→生成还原产物→是氧化剂
记忆口诀:升失氧,降得还;若问剂,两相反。
1.氧化还原反应的分类
一、氧化还原反应的分类
① Fe + CuSO4 FeSO4 + Cu
⑤ 3S + 6NaOH
2Na2S + Na2SO3 + 3H2O
② Fe2O3 + 3CO 2Fe + 3CO2
③ NH4NO3
2H2O+N2O↑
④ Cl2+2NaOH NaCl+NaClO+H2O
氧化剂和还原剂为不同物质
氧化剂和还原剂为同一物质
一般氧化还原反应
自身氧化还原反应
歧化反应:是指化合价升降发生在同一物质中同一价态的同一元素间。在反应中,若氧化作用和还原作用发生在同一分子内部处于同一氧化态的元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。
归中反应:含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应。
3Cu + 8HNO3(稀) 3Cu(NO3)2 + 2NO↑ + 4H2O
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
部分氧化还原反应:还原剂/氧化剂只有部分被氧化/还原
8个HNO3中只有 个作氧化剂
2
4个HCl中只有 个作还原剂
2
2.书写氧化还原反应方程式
初中书写化学方程式要符合哪些原则?
1.客观规律
2.质量守恒定律
初中书写化学方程式的过程?
1.写(确定反应物、生成物)
2.配(配平)
3.注(标注反应条件、气体符号、沉淀符号等)
练一练
思:碳和浓硝酸在加热条件下反应反应,产物有二氧化氮、二氧化碳、水三种,请写出该反应的化学方程式?
(1)得失电子守恒:
氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数。
(2)质量守恒:反应前后原子的种类和个数不变。
(3)电荷守恒:离子反应前后,阴、阳离子所带电荷总数相等。
1.氧化还原反应方程式配平的基本原则
(1)标价态:写出反应物和生成物的化学式,标出发生氧化反应和还原反应的元素的化合价。
(2)列变化:标出反应前后元素化合价的变化。
2.氧化还原反应方程式配平的一般步骤
(3)求总数:依据电子得失守恒,使化合价升高和降低的总数相等。
(4)配系数:确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,再用观察法配平其他物质的化学计量数。
C+4HNO3(浓)——4NO2↑+CO2↑+2H2O
(5)查守恒:检查电荷是否守恒,原子个数是否守恒,配平后,把单线改成等号,标注反应条件。
配平技巧:四步配平。
依据 得失电子守恒
具体步骤:
①查变价原子守恒
②查电荷守恒(缺项配平时)
③查整体守恒
1.标价态
2.列升降
3.求总数
4.配系数
5.查守恒
____ FeCl3 + _____ H2S ===_____ FeCl2 + ___ HCl + _____S↓
_____S + _____NaOH === ____Na2S + ___Na2SO3 + ___H2O
____NH3 + _____NO === _____N2 + _____H2O
___Fe + ___HNO3(稀) === ___Fe(NO3)3 + ___NO↑+ ____H2O
21221;36213;4656;14112
①__ +__H2O2+____===__Mn2++__O2↑+__H2O
②__Fe3++__SO2+__H2O===__Fe2++__ +____
2
5
6H+
2
5
8
2
1
1
2
2
4H+
1、一般从左配:对于一般氧化还原反应,从左边氧化剂、还原剂着手配平。
2、自变从右配:对于自身氧化还原反应,一般从右边氧化产物、还原产物配平。
3、归中从左配:对于归中反应,一般从左边氧化剂、还原剂着手配平。
4、部分别忘加:对于部分氧化还原反应,一般先配平得失电子,再加上没有变价的部分。
5、对于缺项的离子方程式,酸性环境配氢离子、碱性环境配氢氧根、没有明确说明条件,反应物配水,生成氢离子或氢氧根。
无法确定化合物中元素化合价时,根据化合物中各元素化合价代数和为零,令该物质中各元素化合价均为零价,然后利用整体法计算出化合价总升降值,进行配平。
类型一 零价法
(1)___FeS2+___O2=====___Fe2O3+___SO2
(2)___FeC3+___HNO3=___Fe(NO3)3+___CO2+___NO+___H2O
高温
6.陌生氧化还原反应配平
4 11 2 8
1 8 1 3 5 4
一般设组成元素较多的物质的化学计量数为1,其他物质的化学计量数为a.b.c...根据原子个数守恒列等式求解。此法适用于一切氧化还原反应。主要用于变价元素在三种或三种以上的复杂氧化还原反应。
类型二 待定系数法
(1) CuSO4+ FeS2+ H2O= Cu2S+ FeSO4+ H2SO4
(2) NaClO + H2O + Ag= AgCl+ NaOH+ O2
6.陌生氧化还原反应配平
二、氧化还原反应的计算
1.计算依据
(1)氧化剂获得电子总数等于还原剂失去电子总数,即得失电子守恒。
(2)氧化剂中元素降价总数等于还原剂中元素升价总数,即化合价升降守恒。
2.计算方法
(1)找出氧化剂、还原剂及对应的还原产物、氧化产物。
(2)标准确变价元素的化合价。
(3)找准每个氧化剂、还原剂中变价的原子个数。
(4)列出等式并计算:
N(氧化剂)×变价原子个数×|化合价变化值|=N(还原剂)×变价原子个数×|化合价变化值|。
练习1、用正向配平法配平下列氧化还原反应
KMnO4+ HCl KCl+ MnCl2+ H2O+ Cl2↑
2;16;2 ;2;8;5
① Fe2+ + MnO4— + H+ → Mn2+ + Fe3+ + H2O
5;1;8 ;1;5;4
② Cl2+I2+ H2O= HIO3+ HCl
5;1;6 ;2;10
③ Cr2O72-+ H2O2+ H+= CrO5+ H2O.
④ K2S+K2SO3+HCl—S↓+ KCl+H2O
1;4;2 ;2;5
2;1;6 ;3;6;3
【例2】按要求完成下列问题:
(1)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:_____________________________________。
(3)水中的溶解氧是水生生物生存不可缺少的条件。将水样与Mn(OH)2碱性悬浊液混合,反应生成MnO(OH)2,实现氧的固定。“氧的固定”中发生反应的化学方程式为______________________________。
题型二:氧化还原方程式的书写
+4H2O
2HNO2+(NH2)2CO=2N2+CO2+3H2O
2Mn(OH)2+O2=2MnO(OH)2
1.在反应3Cl2+8NH3===6NH4Cl+N2中,被氧化的NH3与未被氧化的NH3质量比为
A.3∶8 B.1∶4 C.3∶4 D.1∶3
D
2.在氧化还原反应:3S+6KOH===K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数比是
A.1∶2 B.2∶1 C.1∶1 D.3∶2
A
3.在一定条件下,
2F-+H2O,从而可知在 中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
B
[例3]当溶液中 离子数之比为1∶3时,正好完全发生氧化还原反应,X在还原产物中的化合价为
A.+7 B.+2 C.+3 D.+4
C
题型三:氧化还原方程式的计算
练习2:
① I2 + KOH — KI + KIO3 + H2O
② NH3 + NO2 — N2 + H2O
③ C2H6 + O2 — CO2 + H2O
④ KMnO4 + HCl — KCl + MnCl2 + H2O + Cl2↑
答案:
① 1 I2 + 6 KOH — 5 KI +1 KIO3 + 3 H2O
② 8 NH3 + 6 NO2 —7 N2 + 12 H2O
③ 2 C2H6 +7 O2 — 4 CO2 + 6 H2O
④2KMnO4 +16HCl —2KCl + 2MnCl2 +8H2O +5Cl2↑
【例1】配平下列化学反应。
(1)____HCl(浓)+____MnO2 ____Cl2↑+____MnCl2+______H2O
(2)___ Cu+______HNO3(稀) = ____Cu(NO3)2+______NO↑+____H2O
(3)___ S+______KOH = ______K2S+_______K2SO3+_______H2O
题型一:氧化还原方程式的配平
△
4
1
1
2
1
3
8
3
2
4
2
1
3
6
3
2
1
2
1
1
1
2
2
2
2
____ FeCl3 + _____ H2S —— _____ FeCl2 + ___ HCl + _____S↓
_____C + _____H2SO4(浓) —— ____CO2↑+ __H2O + __SO2↑
——
——
【总结】对于一般氧化还原反应,一般从左边氧化剂、还原剂着手配平。
1.一般氧化还原反应
_____HNO3 —— _____NO2↑+ _____O2↑+ _____H2O
4
4
1
2
3
1
1
2
3
6
2
1
3
_____NO2 + _____H2O —— _____HNO3 + _____NO
_____S + _____NaOH —— ____Na2S + ___Na2SO3 + ___H2O
——
——
——
【总结】对于自身氧化还原反应,一般从右边氧化产物、还原产物配平。
2.自身氧化还原反应
_____NH3 + _____NO —— _____N2 + _____H2O
4
6
5
6
5
3
3
___KI + __KIO3 + ___H2SO4 —— ___K2SO4 + ___I2 + __H2O
——
——
1
3
3
【总结】对于归中反应,一般从左边氧化剂、还原剂着手配平。
3.归中反应
___ Cu + ___H2SO4(浓) —— ___ CuSO4 + ___SO2↑+ ____H2O
1
2
1
4
1
2
1
2
1
1
___Fe + ___HNO3(稀) —— ___Fe(NO3)3 + ___NO↑+ ____H2O
——
——
【总结】
对于部分氧化还原反应,一般先配平得失电子,再加上没有变价的部分
(或从完全变价的一侧配)
4.部分氧化还原反应
【总结】离子方程式中,若电荷不守恒,
[一般缺的为酸(H+)、碱(OH-)、水]配平电荷。
①__ +__H2O2+____===__Mn2++__O2↑+__H2O
②__Fe3++__SO2+__H2O===__Fe2++__ +____
2
5
6H+
2
5
8
2
1
1
2
2
4H+
条件 补项原则
酸性条件下 缺 (氢)或多 (氧)补 ,少 (氧)补 (水)
碱性条件下 缺 (氢)或多 (氧)补 (水),少 (氧)补
补项原则:
5.氧化还原离子方程式
