化学人教版(2019)必修第二册5.2.4铵盐 氨的制法(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.2.4铵盐 氨的制法(共31张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 19.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-20 14:13:09 | ||
图片预览










文档简介
(共31张PPT)
必修第二册(人教版2019)
第五章
化工生产中的重要非金属
第二节
氮及其化合物
氮——植物生长的守护神
植物缺氮症状:
叶片黄化,植株瘦弱
缺氮小麦麦穗发育不良
铵盐是农业上常用的化肥,如(NH4)2SO4、NH4HCO3、NH4NO3、 CO(NH2)2等。
学习
目标
第4课时
铵盐 氨气的制法
PART
01
PART
02
掌握铵盐的性质和铵根离子的检验。
掌握氨气的实验室制法,了解氨的工业制法及实验室中其他简易方法。
1、物理性质
铵盐的形成:
NH3 + H+ = NH4+
NH4+
铵盐是农业上常用的化肥,绝大多数易溶于水,溶于水时吸热
【思考】氨水为什么不能成为氮肥的主角?
【思考】如何实现氨气到铵盐的转化?
[学习任务一] 铵盐
碳酸氢铵
氯化铵
施用铵态氮肥时,应埋在土下,避免强光,且不能和草木灰等碱性肥料共同施用,这是为什么?
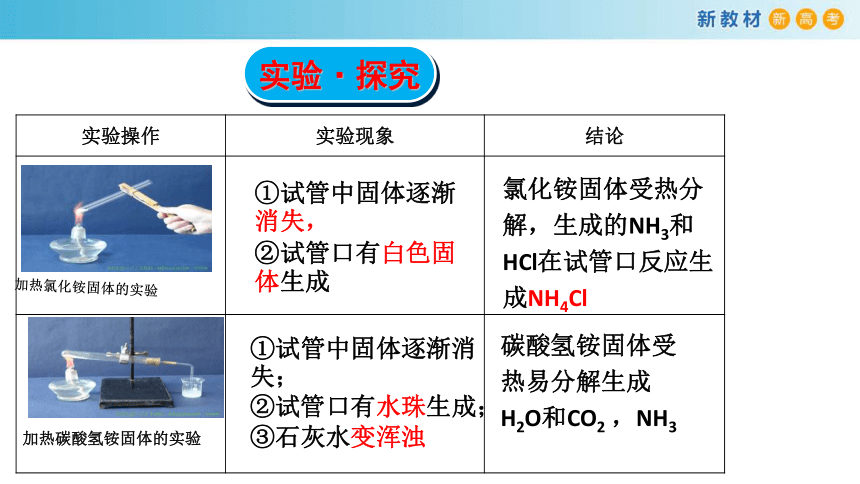
实验操作 实验现象 结论
①试管中固体逐渐消失,
②试管口有白色固体生成
氯化铵固体受热分解,生成的NH3和HCl在试管口反应生成NH4Cl
①试管中固体逐渐消失;
②试管口有水珠生成;
③石灰水变浑浊
碳酸氢铵固体受热易分解生成H2O和CO2 ,NH3
加热氯化铵固体的实验
加热碳酸氢铵固体的实验
实验·探究
2、铵盐的化学性质
NH4Cl = NH3↑ + HCl
Δ
NH4HCO3 = NH3↑ + H2O + CO2↑
Δ
(NH4)2CO3 = 2NH3↑ + H2O + CO2↑
Δ
注意:并不是所有的铵盐都能受热分解得到氨气
NH4NO3 = N2O↑ + H2O
Δ
2NH4NO3 = 2N2↑ + 4H2O + O2↑
Δ
思考:怎样存放铵态氮肥?
密封包装并放在阴凉通风干燥处
NH4+
(1)铵盐都不稳定,受热易分解
两者遇冷又马上化合成NH4Cl
【特别提示】
(1)铵盐受热分解都有氨生成,但硝酸铵受热分解最终生成氮气或氮氧化物。
(2)分别用试管加热氯化铵和单质碘时,都由固体变为气体,而在试管口遇冷又凝结为固体,其本质不同,前者为化学变化,后者为物理变化。
(3)检验溶液中含有NH 时,需要加入浓碱溶液并加热,其目的是利用氨气的生成与检验。
【相关链接】
铵盐受热分解的产物
(1)如果组成铵盐的酸是易挥发或易分解的酸,则固体铵盐受热分解时,氨气与酸一起挥发,冷却时又重新结合成铵盐。如NH4Cl、NH4HCO3等。
(2)如果组成铵盐的酸是难挥发性酸,则固体铵盐受热分解时,只有氨呈气态逸出,而难挥发性酸残留在容器中,如(NH4)2SO4分解的化学方程式为(NH4)2SO4 NH3↑+NH4HSO4或(NH4)2SO4 2NH3↑+H2SO4。
(3)如果组成铵盐的酸是具有强氧化性的酸,则在较低的温度下慢慢分解可得到NH3和相应的酸,如NH4NO3。由于生成的氨气具有还原性,硝酸具有氧化性,生成的NH3易被HNO3氧化,则反应时的温度不同,形成氮的化合物也不同,如将NH4NO3在不同的温度下加热分解分别可得到N2O、NO2、N2O3、N2等。
NH4NO3+NaOH== NaNO3+NH3↑+H2O
△
规律:铵盐都与强碱在加热条件下反应放出氨气。
(2) 与强碱反应
实验现象:
实验结论:
【实验5-7】
试管中有气泡产生,湿润的红色石蕊试纸变蓝。
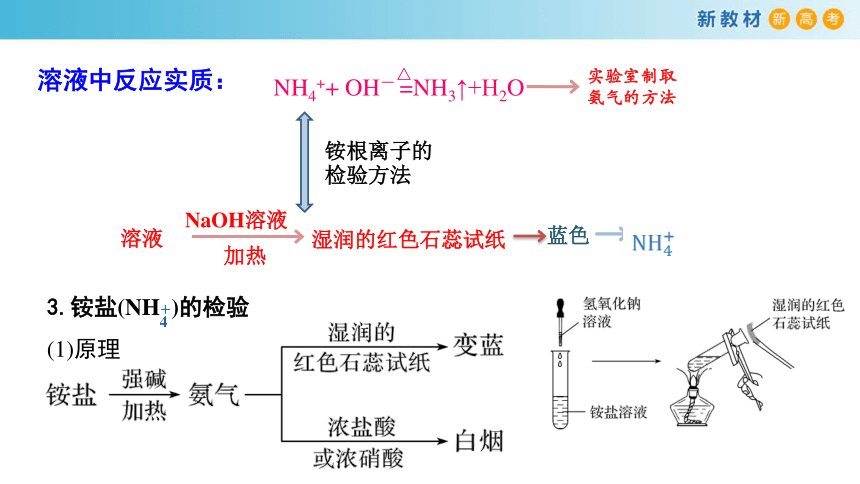
溶液中反应实质:
NH4++ OH- =NH3↑+H2O
△
铵根离子的检验方法
溶液
NaOH溶液
加热
湿润的红色石蕊试纸
蓝色
实验室制取氨气的方法
3.铵盐(NH )的检验
(1)原理
(2)方法
①NaOH溶液法
取少量固体样品或溶液于试管中,再加入浓的NaOH溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体(或将蘸有浓盐酸的玻璃棒靠近管口,有白烟产生),证明固体样品或溶液中含有NH 。
②碱石灰法
把碱石灰与某物质的固体混合物在研钵里研磨,产生的气体能使湿润的红色石蕊试纸变蓝(或将蘸有浓盐酸的玻璃棒靠近研钵口,有白烟产生),则可以判断该物质是铵盐。
1.【巧判断】
①向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶
液中一定无NH4+ 。( )
提示:×。某溶液中加入稀NaOH溶液,可能生成NH3·H2O,没有加热,也不会放
出氨气。
②NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl。( )
提示:√。NH4Cl受热分解生成NH3和HCl脱离固体,到达温度低的部位两者再反
应生成NH4Cl,达到分离NH4Cl和NaCl的目的。
典题精练
③NH4HCO3溶液与足量NaOH共热时,发生反应的离子方程式为
NH4++OH- NH3↑+H2O。( )
分析:错误。NH4HCO3与足量NaOH溶液共热时,NH4+、HCO3-均与OH-发生反应,正确的离子方程式为NH4++HCO3-+2OH- NH3↑+2H2O+CO32-。
△
====
△
====
2.能鉴别Na2SO4、NH4NO3、KCl、(NH4)2SO4四种溶液(可以加热)的一种试剂是( )
A.BaCl2溶液 B.Ba(NO3)2溶液
C.Ba(OH)2溶液 D.AgNO3溶液
3.一种盐X与氢氧化钠共热,可放出无色气体Y,Y经过一系列氧化后再溶于水可得Z溶液,Y和Z溶液反应又生成X,则X可能是下列中的( )
A.(NH4)2SO4 B.NH4NO3
C.NH4Cl D.NH4HCO3
【解析】能与NaOH反应生成的气体一定是NH3,NH3经过连续的氧化最终生成NO2,NO2溶于水即生成HNO3,所以该物质是NH4NO3。
【方法规律】含氮物质连续氧化
(1)N2→NO→NO2 HNO3
(2)NH3→NO→NO2 HNO3
B
C
4.检验铵盐的一般方法是将待测物取少许置于试管中,然后
A.加水溶解后,再滴入酚酞溶液
B.加强碱溶液加热后,用湿润的红色石蕊试纸在试管口检验
C.加入强酸溶液加热后,再滴入酚酞溶液
D.加入强碱溶液加热后,再滴入酚酞溶液
解析 将固体放入试管中,加强碱溶液加热后,用湿润的红色石蕊试纸放在试管口,湿润的红色石蕊试纸会变蓝色,证明产生的气体是氨,则该盐中含有铵根离子,B正确。
C
解析 A项,该反应属于固体间的加热反应,不能写成离子形式,错误;
C项,符合反应原理及离子方程式书写要求,正确;
[学习任务二] 氨气的实验室制法
1.实验装置
【思考与讨论】
图为实验室制取氨的简易装置示意图。请仔细观察实验装置,思考如何检验试管中已收集满氨,如何吸收处理实验中多余的氨。
2.实验操作
反应原理
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
制备装置
固+固→气
净化装置
用碱石灰干燥
(不能用浓硫酸,无水CaCl2干燥)
收集装置
向下排空气法
验满方法
①把湿润的红色石蕊试纸置于试管口
②将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生
尾气处理
可在导管口放一团用水或稀硫酸浸湿的棉花
(可以减小NH3与空气对流速度,收集到纯净的NH3)
还有别的制取氨气的方法吗
【相关链接】
快速制取氨气的方法
方法 化学方程式(或原理) 气体发生装置
加热 浓氨水 NH3·H2O H2O+NH3↑
浓氨水+固体NaOH NaOH溶于水放热,促使氨水分解,且OH-浓度的增大有利于NH3的放出
浓氨水+固体CaO NH3·H2O+CaO===NH3↑+Ca(OH)2 CaO的作用:①吸水后放热促进NH3的放出;②增加溶液中OH-的浓度,减小NH3的溶解度 (3)装置:
(5)收集:
(6)验满:
(7)尾气吸收:
(1)试剂:
(2)原理:
固+固→加热型
向下排空气法
湿润的红色石蕊试纸变蓝
或蘸浓盐酸的玻璃棒
(与氧气的制取装置相同)
酸溶液或水(防倒吸装置处理)
氯化铵晶体、消石灰固体
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑
(4)干燥:
碱石灰(固体氧化钙、固体氢氧化钠)
氨气的实验室制法
1.
注意:无水CaCl2不能干燥NH3(形成CaCl2· 8NH3)
【特别提示】
(1)制取氨时,不能用硝酸铵代替氯化铵。因为硝酸铵在加热过程中可能发生爆炸性的反应,发生危险。
(2)制取氨时,不能用氢氧化钠代替熟石灰。因为氢氧化钠具有吸湿性,易结块,不利于产生NH3,且在加热条件下易腐蚀试管。
(3)氨气是碱性气体,不能用酸性干燥剂(浓硫酸等)干燥,也不能用无水CaCl2干燥,因为它们均能与氨气发生反应,常用碱石灰作干燥剂。
1.在实验室里,某学习小组设计了下列制取纯净干燥氨气的方案,简易、可行的方案是
A.加热氯化铵固体,再通过碱石灰
B.在氮气和氢气的混合气体中加入铁触媒,并加热至500 ℃,再通过碱石灰
C.加热浓氨水,再通过浓硫酸
D.在生石灰中加入浓氨水,再通过碱石灰
课堂检测
D
2.实验室制取少量干燥的氨气涉及下列装置,其中正确的是
A.①是氨气发生装置 B.②是氨气吸收装置
C.③是氨气发生装置 D.④是氨气收集、检验装置
C
3.氨气是化学实验室常需制取的气体。实验室制取氨气通常有两种方法:
①用固体氢氧化钙与氯化铵共热反应;
②在常温下用固体氢氧化钠与浓氨水混合反应。
(1)下面的发生装置图中,方法①应选用装置 (填“A”或“B”,下同),方法②应选用装置 。
A
B
解析 装置A适用于固固混合加热制取气体,装置B适用于固液混合不加热制取气体,故方法①选A装置,方法②选B装置。
(2)在制取氨气后,如果要干燥氨气,应选用的干燥剂是 (填字母)。
A.浓硫酸 B.固体氢氧化钠
C.五氧化二磷 D.稀硫酸
B
解析 氨气是碱性气体,可与硫酸、P2O5反应。
(3)如图是收集氨气的几种装置,其中可行的是 ,集气的原理是________
。
解析 氨气极易溶于水,且密度小于空气,故采用向下排空气法收集,其中B装置排不出空气。
D
利用氨气
的密度小于空气,采用短管进氨气,长管出空气,即可收集氨气
4、氨气与灼热的氧化铜反应生成铜、氮气和水。利用如下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题:
(1)写出氨气与氧化铜反应的化学方程:___________________________
(2)在干燥管B和D里应选用的干燥剂都是_____________。
A.碱石灰 B.无水CuSO4 C.五氧化二磷 D.无水CaCl2
A
2NH3+3CuO === N2+3Cu+3H2O
△
(3) 在C的玻璃管中观察到的现象是______________________________。
(4) E装置中盛装浓硫酸的目的是______________________________。
粉末由黑色变为红色
吸收剩余的氨气
(5)待实验完毕后,若实验测得N2的体积(折算成标准状况)为a L,则被还原的氧化铜的物质的量为________mol;若测得干燥管D增重b g,则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)________。
(6)上述实验中,如果省去B装置,测定氨分子组成的N、H原子个数的比值将会(填“增大”、“减小”或“无影响”)______,理由是_____________________________。
3a
22.4
9a
11.2 b
减小
D装置吸收的水中包含了从A中带出的水分
【课堂小结】
必修第二册(人教版2019)
第五章
化工生产中的重要非金属
第二节
氮及其化合物
氮——植物生长的守护神
植物缺氮症状:
叶片黄化,植株瘦弱
缺氮小麦麦穗发育不良
铵盐是农业上常用的化肥,如(NH4)2SO4、NH4HCO3、NH4NO3、 CO(NH2)2等。
学习
目标
第4课时
铵盐 氨气的制法
PART
01
PART
02
掌握铵盐的性质和铵根离子的检验。
掌握氨气的实验室制法,了解氨的工业制法及实验室中其他简易方法。
1、物理性质
铵盐的形成:
NH3 + H+ = NH4+
NH4+
铵盐是农业上常用的化肥,绝大多数易溶于水,溶于水时吸热
【思考】氨水为什么不能成为氮肥的主角?
【思考】如何实现氨气到铵盐的转化?
[学习任务一] 铵盐
碳酸氢铵
氯化铵
施用铵态氮肥时,应埋在土下,避免强光,且不能和草木灰等碱性肥料共同施用,这是为什么?
实验操作 实验现象 结论
①试管中固体逐渐消失,
②试管口有白色固体生成
氯化铵固体受热分解,生成的NH3和HCl在试管口反应生成NH4Cl
①试管中固体逐渐消失;
②试管口有水珠生成;
③石灰水变浑浊
碳酸氢铵固体受热易分解生成H2O和CO2 ,NH3
加热氯化铵固体的实验
加热碳酸氢铵固体的实验
实验·探究
2、铵盐的化学性质
NH4Cl = NH3↑ + HCl
Δ
NH4HCO3 = NH3↑ + H2O + CO2↑
Δ
(NH4)2CO3 = 2NH3↑ + H2O + CO2↑
Δ
注意:并不是所有的铵盐都能受热分解得到氨气
NH4NO3 = N2O↑ + H2O
Δ
2NH4NO3 = 2N2↑ + 4H2O + O2↑
Δ
思考:怎样存放铵态氮肥?
密封包装并放在阴凉通风干燥处
NH4+
(1)铵盐都不稳定,受热易分解
两者遇冷又马上化合成NH4Cl
【特别提示】
(1)铵盐受热分解都有氨生成,但硝酸铵受热分解最终生成氮气或氮氧化物。
(2)分别用试管加热氯化铵和单质碘时,都由固体变为气体,而在试管口遇冷又凝结为固体,其本质不同,前者为化学变化,后者为物理变化。
(3)检验溶液中含有NH 时,需要加入浓碱溶液并加热,其目的是利用氨气的生成与检验。
【相关链接】
铵盐受热分解的产物
(1)如果组成铵盐的酸是易挥发或易分解的酸,则固体铵盐受热分解时,氨气与酸一起挥发,冷却时又重新结合成铵盐。如NH4Cl、NH4HCO3等。
(2)如果组成铵盐的酸是难挥发性酸,则固体铵盐受热分解时,只有氨呈气态逸出,而难挥发性酸残留在容器中,如(NH4)2SO4分解的化学方程式为(NH4)2SO4 NH3↑+NH4HSO4或(NH4)2SO4 2NH3↑+H2SO4。
(3)如果组成铵盐的酸是具有强氧化性的酸,则在较低的温度下慢慢分解可得到NH3和相应的酸,如NH4NO3。由于生成的氨气具有还原性,硝酸具有氧化性,生成的NH3易被HNO3氧化,则反应时的温度不同,形成氮的化合物也不同,如将NH4NO3在不同的温度下加热分解分别可得到N2O、NO2、N2O3、N2等。
NH4NO3+NaOH== NaNO3+NH3↑+H2O
△
规律:铵盐都与强碱在加热条件下反应放出氨气。
(2) 与强碱反应
实验现象:
实验结论:
【实验5-7】
试管中有气泡产生,湿润的红色石蕊试纸变蓝。
溶液中反应实质:
NH4++ OH- =NH3↑+H2O
△
铵根离子的检验方法
溶液
NaOH溶液
加热
湿润的红色石蕊试纸
蓝色
实验室制取氨气的方法
3.铵盐(NH )的检验
(1)原理
(2)方法
①NaOH溶液法
取少量固体样品或溶液于试管中,再加入浓的NaOH溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体(或将蘸有浓盐酸的玻璃棒靠近管口,有白烟产生),证明固体样品或溶液中含有NH 。
②碱石灰法
把碱石灰与某物质的固体混合物在研钵里研磨,产生的气体能使湿润的红色石蕊试纸变蓝(或将蘸有浓盐酸的玻璃棒靠近研钵口,有白烟产生),则可以判断该物质是铵盐。
1.【巧判断】
①向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶
液中一定无NH4+ 。( )
提示:×。某溶液中加入稀NaOH溶液,可能生成NH3·H2O,没有加热,也不会放
出氨气。
②NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl。( )
提示:√。NH4Cl受热分解生成NH3和HCl脱离固体,到达温度低的部位两者再反
应生成NH4Cl,达到分离NH4Cl和NaCl的目的。
典题精练
③NH4HCO3溶液与足量NaOH共热时,发生反应的离子方程式为
NH4++OH- NH3↑+H2O。( )
分析:错误。NH4HCO3与足量NaOH溶液共热时,NH4+、HCO3-均与OH-发生反应,正确的离子方程式为NH4++HCO3-+2OH- NH3↑+2H2O+CO32-。
△
====
△
====
2.能鉴别Na2SO4、NH4NO3、KCl、(NH4)2SO4四种溶液(可以加热)的一种试剂是( )
A.BaCl2溶液 B.Ba(NO3)2溶液
C.Ba(OH)2溶液 D.AgNO3溶液
3.一种盐X与氢氧化钠共热,可放出无色气体Y,Y经过一系列氧化后再溶于水可得Z溶液,Y和Z溶液反应又生成X,则X可能是下列中的( )
A.(NH4)2SO4 B.NH4NO3
C.NH4Cl D.NH4HCO3
【解析】能与NaOH反应生成的气体一定是NH3,NH3经过连续的氧化最终生成NO2,NO2溶于水即生成HNO3,所以该物质是NH4NO3。
【方法规律】含氮物质连续氧化
(1)N2→NO→NO2 HNO3
(2)NH3→NO→NO2 HNO3
B
C
4.检验铵盐的一般方法是将待测物取少许置于试管中,然后
A.加水溶解后,再滴入酚酞溶液
B.加强碱溶液加热后,用湿润的红色石蕊试纸在试管口检验
C.加入强酸溶液加热后,再滴入酚酞溶液
D.加入强碱溶液加热后,再滴入酚酞溶液
解析 将固体放入试管中,加强碱溶液加热后,用湿润的红色石蕊试纸放在试管口,湿润的红色石蕊试纸会变蓝色,证明产生的气体是氨,则该盐中含有铵根离子,B正确。
C
解析 A项,该反应属于固体间的加热反应,不能写成离子形式,错误;
C项,符合反应原理及离子方程式书写要求,正确;
[学习任务二] 氨气的实验室制法
1.实验装置
【思考与讨论】
图为实验室制取氨的简易装置示意图。请仔细观察实验装置,思考如何检验试管中已收集满氨,如何吸收处理实验中多余的氨。
2.实验操作
反应原理
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
制备装置
固+固→气
净化装置
用碱石灰干燥
(不能用浓硫酸,无水CaCl2干燥)
收集装置
向下排空气法
验满方法
①把湿润的红色石蕊试纸置于试管口
②将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生
尾气处理
可在导管口放一团用水或稀硫酸浸湿的棉花
(可以减小NH3与空气对流速度,收集到纯净的NH3)
还有别的制取氨气的方法吗
【相关链接】
快速制取氨气的方法
方法 化学方程式(或原理) 气体发生装置
加热 浓氨水 NH3·H2O H2O+NH3↑
浓氨水+固体NaOH NaOH溶于水放热,促使氨水分解,且OH-浓度的增大有利于NH3的放出
浓氨水+固体CaO NH3·H2O+CaO===NH3↑+Ca(OH)2 CaO的作用:①吸水后放热促进NH3的放出;②增加溶液中OH-的浓度,减小NH3的溶解度 (3)装置:
(5)收集:
(6)验满:
(7)尾气吸收:
(1)试剂:
(2)原理:
固+固→加热型
向下排空气法
湿润的红色石蕊试纸变蓝
或蘸浓盐酸的玻璃棒
(与氧气的制取装置相同)
酸溶液或水(防倒吸装置处理)
氯化铵晶体、消石灰固体
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑
(4)干燥:
碱石灰(固体氧化钙、固体氢氧化钠)
氨气的实验室制法
1.
注意:无水CaCl2不能干燥NH3(形成CaCl2· 8NH3)
【特别提示】
(1)制取氨时,不能用硝酸铵代替氯化铵。因为硝酸铵在加热过程中可能发生爆炸性的反应,发生危险。
(2)制取氨时,不能用氢氧化钠代替熟石灰。因为氢氧化钠具有吸湿性,易结块,不利于产生NH3,且在加热条件下易腐蚀试管。
(3)氨气是碱性气体,不能用酸性干燥剂(浓硫酸等)干燥,也不能用无水CaCl2干燥,因为它们均能与氨气发生反应,常用碱石灰作干燥剂。
1.在实验室里,某学习小组设计了下列制取纯净干燥氨气的方案,简易、可行的方案是
A.加热氯化铵固体,再通过碱石灰
B.在氮气和氢气的混合气体中加入铁触媒,并加热至500 ℃,再通过碱石灰
C.加热浓氨水,再通过浓硫酸
D.在生石灰中加入浓氨水,再通过碱石灰
课堂检测
D
2.实验室制取少量干燥的氨气涉及下列装置,其中正确的是
A.①是氨气发生装置 B.②是氨气吸收装置
C.③是氨气发生装置 D.④是氨气收集、检验装置
C
3.氨气是化学实验室常需制取的气体。实验室制取氨气通常有两种方法:
①用固体氢氧化钙与氯化铵共热反应;
②在常温下用固体氢氧化钠与浓氨水混合反应。
(1)下面的发生装置图中,方法①应选用装置 (填“A”或“B”,下同),方法②应选用装置 。
A
B
解析 装置A适用于固固混合加热制取气体,装置B适用于固液混合不加热制取气体,故方法①选A装置,方法②选B装置。
(2)在制取氨气后,如果要干燥氨气,应选用的干燥剂是 (填字母)。
A.浓硫酸 B.固体氢氧化钠
C.五氧化二磷 D.稀硫酸
B
解析 氨气是碱性气体,可与硫酸、P2O5反应。
(3)如图是收集氨气的几种装置,其中可行的是 ,集气的原理是________
。
解析 氨气极易溶于水,且密度小于空气,故采用向下排空气法收集,其中B装置排不出空气。
D
利用氨气
的密度小于空气,采用短管进氨气,长管出空气,即可收集氨气
4、氨气与灼热的氧化铜反应生成铜、氮气和水。利用如下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题:
(1)写出氨气与氧化铜反应的化学方程:___________________________
(2)在干燥管B和D里应选用的干燥剂都是_____________。
A.碱石灰 B.无水CuSO4 C.五氧化二磷 D.无水CaCl2
A
2NH3+3CuO === N2+3Cu+3H2O
△
(3) 在C的玻璃管中观察到的现象是______________________________。
(4) E装置中盛装浓硫酸的目的是______________________________。
粉末由黑色变为红色
吸收剩余的氨气
(5)待实验完毕后,若实验测得N2的体积(折算成标准状况)为a L,则被还原的氧化铜的物质的量为________mol;若测得干燥管D增重b g,则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)________。
(6)上述实验中,如果省去B装置,测定氨分子组成的N、H原子个数的比值将会(填“增大”、“减小”或“无影响”)______,理由是_____________________________。
3a
22.4
9a
11.2 b
减小
D装置吸收的水中包含了从A中带出的水分
【课堂小结】
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
