安徽省合肥市肥东县八斗学校2023~2024学年九年级下学期开学模拟化学试题(含解析)
文档属性
| 名称 | 安徽省合肥市肥东县八斗学校2023~2024学年九年级下学期开学模拟化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 412.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-20 15:06:14 | ||
图片预览




文档简介
2023~2024学年九年级下学期开学模拟化学试题
一、选择题(12题,12分)
1.2023年6月5日我们将迎来第53个“世界环境日”,主题是“建设人与自然和谐共生的现代化”。下列做法符合这一主题的是
A.工业废水直接排放 B.大量使用化石能源
C.废金属回收利用 D.露天焚烧塑料垃圾
2.下列变化属于化学变化的是( )
A.冰雪融化 B.石蜡熔化 C.粮食酿酒 D.玻璃破碎
3.碘是人体必需的微量元素之一。如图是元素周期表中提供的碘元素的部分信息。下列说法错误的是
A.碘原子核内共有53个中子 B.碘的相对原子质量为126.9
C.碘元素属于非金属元素 D.碘的元素符号为I
4.化学实验过程中,下列操作或处理方法错误的是
A.洒在桌面上的酒精燃烧起来,立即用湿抹布或沙子盖灭
B.稀酸飞溅到皮肤上,立即用大量的水冲洗,再涂上3%~5%的小苏打溶液
C.碱液洒在衣服上,用水冲洗后,再涂上硫酸溶液
D.给试管里的液体加热,液体体积不超过试管容积的1/3
5.下列关于水的说法错误的是
A.水分子是由两个氢元素和一个氧元素构成的
B.水是由氢元素和氧元素组成的
C.每个水分子是由两个氢原子和一个氧原子构成的
D.水分子是由氢原子和氧原子构成的
6.下列有关实验现象的叙述中,正确的是
A.铁丝在氧气中燃烧观察到火星四射,生成一种黑色固体四氧化三铁
B.氢氧化钠溶液与硫酸铜溶液混合观察到有白色沉淀生成
C.二氧化碳通入紫色石蕊溶液中会观察到溶液变成红色
D.打开浓盐酸的瓶塞会看到有白烟冒出
7.下列客观事实的微观解释正确的是( )
选项 客观事实 微观解释
A 品红在热水中扩散比在冷水中快 水分子间存在间隙
B 水通电生成氢气和氧气 水中含有氢分子和氧分子
C 搅拌能加快蔗糖在水中的溶解 搅拌使扩散到水中的蔗糖分子更多
D 一氧化碳能燃烧,二氧化碳能灭火 二者分子构成不同
A.A B.B C.C D.D
8.为了缓解碳排放引起的温室效应,我国科学家成功合成新型催化剂,将二氧化碳转化为甲醇,该过程的微观示意图如图,下列说法正确的是
A.该反应属于置换反应 B.反应前后氢元素的化合价不变
C.反应前后原子的种类和数目都不变 D.参加反应的甲和乙分子个数比为1:1
9.逻辑推理是化学常用的思维方法,下列推理正确的是
A.单质由同种元素组成,所以由同种元素组成的物质一定是单质
B.阳离子是带正电荷的粒子,所以带正电荷的粒子一定是阳离子
C.氧气是由氧元素组成的,所以制取氧气的反应物中一定含有氧元素
D.氧化物中一定含氧元素,含氧元素的化合物一定是氧化物
10.学习化学要用化学观念认识世界。下列选项正确的是
A.变化与守恒:依据X+2O2= 2CO2+2H2O可知,X是C2H4O
B.模型与推理:离子是带电的粒子,所以带电的粒子一定是离子
C.宏观与微观:金刚石和石墨的组成元素相同,但其原子的排列方式不同
D.实验与探究:证明CuO是H2O2分解的催化剂,只需验证CuO能加快反应速率
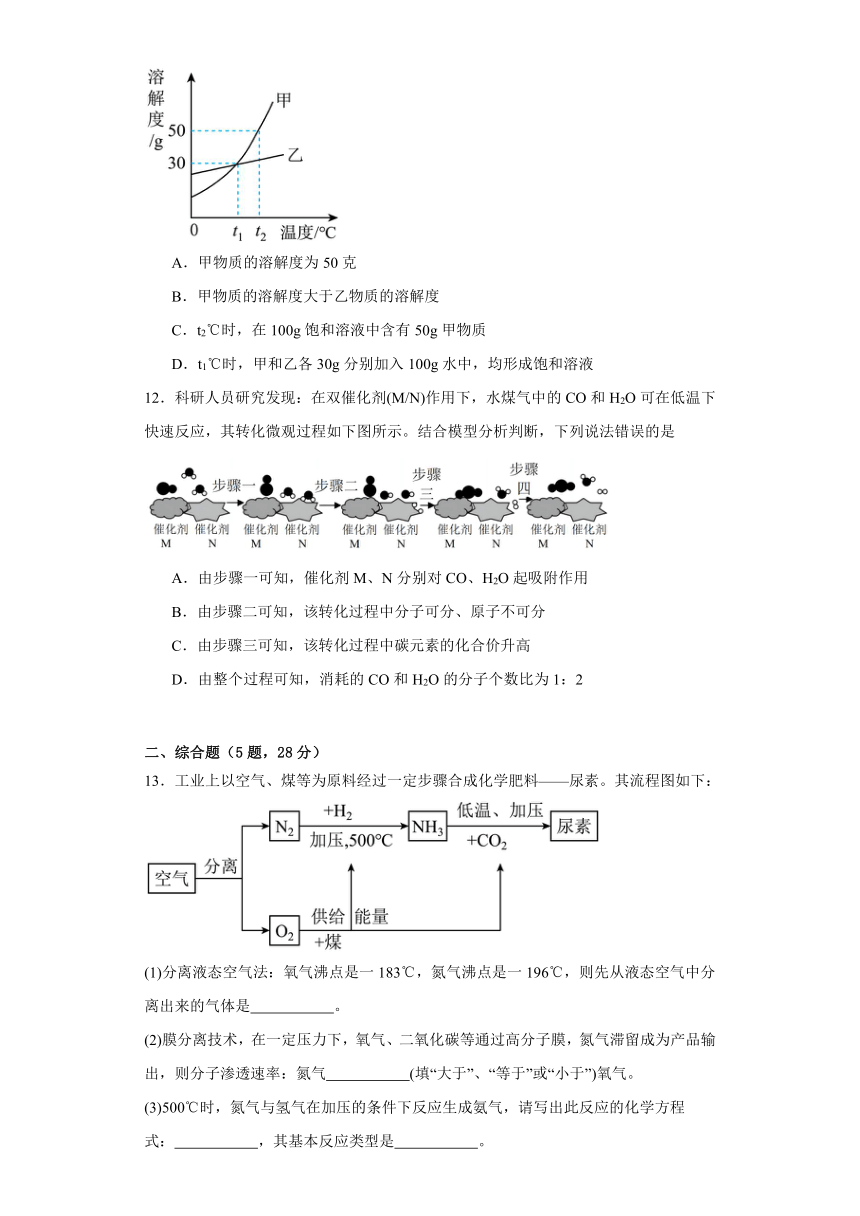
11.如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
A.甲物质的溶解度为50克
B.甲物质的溶解度大于乙物质的溶解度
C.t2℃时,在100g饱和溶液中含有50g甲物质
D.t1℃时,甲和乙各30g分别加入100g水中,均形成饱和溶液
12.科研人员研究发现:在双催化剂(M/N)作用下,水煤气中的CO和H2O可在低温下快速反应,其转化微观过程如下图所示。结合模型分析判断,下列说法错误的是
A.由步骤一可知,催化剂M、N分别对CO、H2O起吸附作用
B.由步骤二可知,该转化过程中分子可分、原子不可分
C.由步骤三可知,该转化过程中碳元素的化合价升高
D.由整个过程可知,消耗的CO和H2O的分子个数比为1:2
二、综合题(5题,28分)
13.工业上以空气、煤等为原料经过一定步骤合成化学肥料——尿素。其流程图如下:
(1)分离液态空气法:氧气沸点是一183℃,氮气沸点是一196℃,则先从液态空气中分离出来的气体是 。
(2)膜分离技术,在一定压力下,氧气、二氧化碳等通过高分子膜,氮气滞留成为产品输出,则分子渗透速率:氮气 (填“大于”、“等于”或“小于”)氧气。
(3)500℃时,氮气与氢气在加压的条件下反应生成氨气,请写出此反应的化学方程式: ,其基本反应类型是 。
(4)根据流程图中信息,尿素中含有的元素种类有 。(填元素符号)
14.强健的体魄,强大的免疫力,才能低抗新冠病毒的侵袭。请结合生活实际回答下列问题:
(1)人体缺 元素能导致佝偻病或骨质疏松。
(2)某同学的午餐:炖排骨、炒芹菜、米饭,其中富含糖类的食物是 。
(3)某品牌加碘盐中添加的是碘酸钾(KIO3),KIO3中碘元素的化合价是 。
(4)甲醛(CH2O)为室内装修产生的有害物质之一。为去除污染,科学家研制出一种新型的催化剂,在其催化作用下,甲醛与空气中的氧气反应生成两种最常见的氧化物,该反应的化学方程式为 。
15.在实验室利用以下装置制取气体。
(1)用装置A加热氯酸钾和二氧化锰的混合物制氧气的化学方程式为 ;用装置B制二氧化碳的的化学方程式为 ;选择气体的发生装置要考虑的因素是 。
(2)装置B中仪器a的名称是 ;装置C中的导管尽可能伸到集气瓶底部的原因是 ;用装置C收集二氧化碳,验满的操作方法是 。
16.某兴趣小组在学习氧气的化学性质时,发现不同物质在氧气中燃烧的现象不同。
(1)下列物质在氧气中燃烧产物有气体的是 (填序号)。
A镁条B.铁丝C.蜡烛D.硫粉
(2)铁丝在氧气中燃烧的化学方程式: 。
(3)铁丝在氧气中燃烧没有火焰,而蜡烛在氧气中燃烧却有明亮的火焰。该小组同学进行了如下探究。
【探究一】蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由 (填“固态”或“气态”)物质燃烧形成的。
【探究二】物质燃烧产生火焰的根本原因是什么?
【查阅资料】
物质 熔点/℃ 沸点/℃ 燃烧时温度/℃
石蜡 50~70 300~550 约600
铁 1535 2750 约1800
钠 97.8 883 约1400
由上表可知:物质燃烧能否产生火焰与其 (填“熔点”或“沸点”)和燃烧时温度有关。通过上表中石蜡、铁的数据对比,你认为物质燃烧时,什么情况下能产生火焰 。
由此推测:钠在燃烧时, (填“有”或“没有”)火焰产生。
【拓展应用】①根据硫在空气燃烧产生淡蓝色火焰或在氧气中燃烧产生明亮的蓝紫色火焰的实验事实,请你推测硫的沸点 硫燃烧时的温度(填“>”或“<”或“=”)。
②木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时会产生火焰,其原因可能是 。
17.某中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。
依据以上信息计算:
(1)生成二氧化碳的质量为 g。
(2)样品中碳酸钙的质量分数是多少?(写出计算过程)
试卷第4页,共5页
参考答案:
1.C
【详解】A、工业废水直接排放,会造成水体污染,故A不正确;
B、大量使用化石能源会造成环境污染,如空气污染等,要合理使用,故B不正确;
C、废金属回收利用,可以减少环境污染,避免其污染土地,故C正确;
D、露天焚烧塑料垃圾,会造成空气和土壤污染,故D不正确。
故选C。
2.C
【分析】物理变化和化学变化的根本区别在于是否有新物质生成,如果有新物质生成,则属于化学变化; 反之,则是物理变化。
【详解】A. 冰雪融只有物质状态的改变,没有新的物质生成,是物理变化;
B. 石蜡熔化只有物质状态的改变,没有新的物质生成,是物理变化;
C. 粮食酿酒有酒精等新的物质生成,是化学变化;
D. 玻璃破碎只有物质形状的改变,没有新的物质生成,是物理变化。故选C。
3.A
【详解】根据元素周期表中提供的碘元素的信息可知,碘的原子序数是53,则碘原子核内共有53个质子,相对原质量为126.9,属于非金属元素,元素符号为I,故A错误;故选A。
4.C
【详解】硫酸有腐蚀性,不能用硫酸,可以涂上硼酸。故C的说法错误。
5.A
【详解】A、分子是由原子构成的,且元素只讲种类、不讲个数,故选项说法错误;B、水是由氢元素和氧元素组成的,故选项说法正确;C、1个水分子是由两个氢原子和一个氧原子构成的,故选项说法正确;D、水分子是由氢原子和氧原子构成的,故选项说法正确。故选A。
6.C
【详解】A、铁丝在氧气中燃烧观察到火星四射,生成一种黑色固体四氧化三铁,是实验结论而不是实验现象,不符合题意;
B、氢氧化钠溶液与硫酸铜溶液反应生成氢氧化铜蓝色沉淀和硫酸钠,氢氧化钠溶液加入硫酸铜溶液中产生蓝色沉淀,不符合题意;
C、二氧化碳通入紫色石蕊溶液中,二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊溶液变红色,会观察到溶液变成红色,符合题意;
D、浓盐酸具有挥发性,打开浓盐酸的瓶塞,瓶口出现白雾,而不是白烟,不符合题意。故选C。
7.D
【详解】A、品红在热水中扩散比在冷水中快,是因为温度越高分子的运动速率越大,与水分子间的间隙无关,选项A不正确;
B、水通电生成氢气和氧气,只能证明水是由氢元素和氧元素组成的,水是由水分子构成的。水分解时,水分子首先分成氢原子和氧原子,然后氢原子和氧原子各自两两重新组合生成氢分子和氧分子,许多氢分子聚集成氢气,许多氧分子聚集成氧气,因此水中不含氢分子和氧分子,选项B不正确;
C、搅拌能加快蔗糖在水中的溶解,是因为搅拌使得蔗糖和水充分接触,加快了蔗糖分子在水中的扩散速度,选项C不正确;
D、物质的结构决定物质的性质。一氧化碳能燃烧,二氧化碳能灭火,其原因就是一氧化碳和二氧化碳的分子构成不同,选项D正确。故选D。
8.C
【分析】根据微观示意图可知,该反应为二氧化碳和氢气反应生成甲醇和水,反应的化学方程式为:。
【详解】A、置换反应为一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,该反应生成物中没有单质,故不是置换反应,故A选项错误;
B、该反应的反应物中有单质氢气参加,单质中氢元素化合价为0价,反应后生成化合物,氢元素的化合价不再是0,化合价发生了改变,故B选项错误;
C、化学变化的微观实质是分子分裂为原子,原子重新的过程,在重组的过程中,原子种类和数目都不变,故C选项正确;
D、由分析中反应的化学方程式可以看出,参加反应的二氧化碳和氢气的分子个数比为:1:3,故D选项错误;
故选C。
9.C
【详解】A、由同种元素组成的物质不一定是单质,例如红磷和白磷组成的混合物中只含有磷元素,选项A不正确;
B、带正电荷的粒子不一定是阳离子,例如质子带正电荷,不是阳离子,选项B不正确;
C、氧气是由氧元素组成的,根据质量守恒定律,制取氧气的反应物中一定含有氧元素,选项C正确;
D、氧化物是由两种元素组成,其中一种元素是氧元素的化合物,含有氧元素的化合物不一定是氧化物,如氯酸钾中含有钾、氯、氧三种元素,不属于氧化物,选项D不正确。
故选C。
10.C
【详解】A、变化与守恒:在反应X+2O2=2CO2+2H2O中,根据质量守恒定律可知,反应前后的元素种类和原子的种类和个数不变,已知反应前:4个氧原子;反应后:2个碳原子、4个氢原子,6个氧原子,则反应前X中有2个碳原子、4个氢原子,2个氧原子,则X的化学式为C2H4O2,选项说法错误;
B、模型与推理:离子都是带电的粒子,但是带电的粒子不一定是离子,例如原子核是带电的微粒,选项说法错误;
C、宏观与微观:金刚石和石墨的组成元素相同,但其原子的排列方式不同,选项说法正确;
D、实验与探究:探究氧化铜是否为过氧化氢分解的催化剂,不仅需设计实验证明氧化铜能改变化学反应速率,还必须设计实验证明氧化铜本身的质量和化学性质不改变,选项说法错误。
故选C。
11.D
【详解】A..不知道温度范围,不能确定物质的溶解度大小,该选项说法不正确;
B.不知道温度范围,不能比较物质的溶解度大小,该选项说法不正确;
C.t2℃时甲的溶解度是50g,在150g饱和溶液中含有50g 甲物质,该选项说法不正确;
D.t1℃时甲和乙的溶解度都是30g,甲和乙各30g分别加入100g水中,均形成饱和溶液,该选项说法正确。
故选:D。
12.D
【详解】A. 一氧化碳是由一氧化碳分子构成的,水是由水分子构成的;由步骤一图示可知,催化剂M、N分别对CO、H2O起吸附作用,正确;
B. 由步骤二可知,水分子在催化剂N表面分解出氢原子,故该转化过程中分子可分、原子不可分,正确;
C. 由步骤三可知,该转化过程一氧化碳生成二氧化碳,一氧化碳、二氧化碳中碳元素的化合价分别为+2、+4价,故碳元素的化合价升高,正确;
D. 由整个过程可知,1个一氧化碳分子和1个水分子反应生成1个二氧化碳分子和1个氢分子,故反应的CO和H2O的分子个数比为1:1,错误。
故选D。
13.(1)氮气
(2)小于
(3) 化合反应
(4)C、N、O、H
【详解】(1)氮气沸点-196℃,氧气沸点-183℃,沸点低的先分离出来,液态空气汽化时首先分离出氮气;
(2)膜分离技术,在一定压力下,氧气、二氧化碳等通过高分子膜,氮气滞留成为产品输出,则分子渗透速率:氮气小于氧气;
(3)氮气和氢气在加压、500℃时反应生成氨气,反应的化学方程式:,此反应的特征是“多变一”,属于化合反应;
(4)根据流程图中信息,氨气和二氧化碳合成尿素,根据质量守恒定律,化学变化前后,元素的种类不变,因此尿素含有的元素种类有C、N、O、H。
14.(1)钙/Ca
(2)米饭
(3)+5
(4)
【详解】(1)人体缺钙元素能导致佝偻病或骨质疏松;
(2)炖排骨富含蛋白质、炒芹菜富含维生素、米饭富含糖类,其中富含糖类的食物是米饭;
(3)KIO3中碘元素的化合价是,钾元素化合价为+1价,氧元素化合价为-2价,依据化合物中各元素正负化合价代数和为0可知:,,KIO3中碘元素的化合价是+5价;
(4)甲醛(CH2O)与氧气在催化剂条件下反应生成二氧化碳和水,该反应化学方程式:。
15.(1) 反应物的状态和反应条件
(2) 长颈漏斗 为了排净集气瓶内的空气 将燃着的木条放在集气瓶口处,若木条熄灭则说明二氧化碳已集满
【详解】(1)氯酸钾与二氧化锰混合加热后得到氯化钾和氧气,其中二氧化锰作催化剂,该反应的化学方程式为:;实验室制取二氧化碳常用稀盐酸和碳酸钙,反应后生成氯化钙、水和二氧化碳,反应的化学方程式为:;实验室选择制取气体的发生装置时需要考虑反应物的状态和反应条件,反应物的状态是指反应物是固体还是液体,反应条件一般是指是否需要加热,如果需要加热,则应选择带酒精灯的装置。
(2)仪器a的名称是长颈漏斗,常用于添加液体药品。在用排空气法收集气体时,导管要尽可能的伸到集气瓶的底部,这样就可以最大限度的将集气瓶内的空气排净,以便收集到较纯净的气体。二氧化碳不能燃烧,也不能支持燃烧,故验满时可将一燃着的木条放在集气瓶口处,若木条熄灭,则说明二氧化碳已集满。
16. CD 气态 沸点 燃烧温度高于物质的沸点 有 < 木炭燃烧过程中产生的气体继续燃烧产生了火焰
【详解】(1)A、镁条燃烧生成氧化镁固体;
B、铁丝燃烧生成四氧化三铁固体;
C、蜡烛燃烧生成二氧化碳气体和水;
D、硫粉燃烧生成二氧化硫气体;
故选:CD;
(2)铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式为:;
(3)[探究一]
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生,由此可知:蜡烛燃烧产生的火焰是由气态物质燃烧形成的;
[探究二]
由上表可知:物质燃烧能否产生火焰与其沸点和燃烧时温度有关,即燃烧时的温度高于沸点的,燃烧时能够产生火焰;通过上表中石蜡、铁的数据对比可知,能产生火焰的条件是;由此推测:钠燃烧时的温度高于其沸点,因此钠在燃烧时,有火焰产生;
[拓展应用]
①硫在空气或氧气中燃烧时产生火焰,说明硫的沸点小于硫燃烧时的温度;
②探究木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时会产生火焰的真正原因:木炭在氧气中能充分燃烧没有火焰,而木炭在空气中燃烧不充分,在此过程中产生的CO等可燃性气体继续燃烧产生了火焰。
17.(1)4.4
(2)解:设样品中碳酸钙的质量分数是x。
x=80%。
答:样品中碳酸钙的质量分数为80% 。
【详解】(1)根据质量守恒定律,化学反应前后,物质的总质量不变,则生成二氧化碳的质量为:12.5g+100g-108.1g=4.4g;
(2)详见答案。
答案第6页,共6页
答案第5页,共6页
一、选择题(12题,12分)
1.2023年6月5日我们将迎来第53个“世界环境日”,主题是“建设人与自然和谐共生的现代化”。下列做法符合这一主题的是
A.工业废水直接排放 B.大量使用化石能源
C.废金属回收利用 D.露天焚烧塑料垃圾
2.下列变化属于化学变化的是( )
A.冰雪融化 B.石蜡熔化 C.粮食酿酒 D.玻璃破碎
3.碘是人体必需的微量元素之一。如图是元素周期表中提供的碘元素的部分信息。下列说法错误的是
A.碘原子核内共有53个中子 B.碘的相对原子质量为126.9
C.碘元素属于非金属元素 D.碘的元素符号为I
4.化学实验过程中,下列操作或处理方法错误的是
A.洒在桌面上的酒精燃烧起来,立即用湿抹布或沙子盖灭
B.稀酸飞溅到皮肤上,立即用大量的水冲洗,再涂上3%~5%的小苏打溶液
C.碱液洒在衣服上,用水冲洗后,再涂上硫酸溶液
D.给试管里的液体加热,液体体积不超过试管容积的1/3
5.下列关于水的说法错误的是
A.水分子是由两个氢元素和一个氧元素构成的
B.水是由氢元素和氧元素组成的
C.每个水分子是由两个氢原子和一个氧原子构成的
D.水分子是由氢原子和氧原子构成的
6.下列有关实验现象的叙述中,正确的是
A.铁丝在氧气中燃烧观察到火星四射,生成一种黑色固体四氧化三铁
B.氢氧化钠溶液与硫酸铜溶液混合观察到有白色沉淀生成
C.二氧化碳通入紫色石蕊溶液中会观察到溶液变成红色
D.打开浓盐酸的瓶塞会看到有白烟冒出
7.下列客观事实的微观解释正确的是( )
选项 客观事实 微观解释
A 品红在热水中扩散比在冷水中快 水分子间存在间隙
B 水通电生成氢气和氧气 水中含有氢分子和氧分子
C 搅拌能加快蔗糖在水中的溶解 搅拌使扩散到水中的蔗糖分子更多
D 一氧化碳能燃烧,二氧化碳能灭火 二者分子构成不同
A.A B.B C.C D.D
8.为了缓解碳排放引起的温室效应,我国科学家成功合成新型催化剂,将二氧化碳转化为甲醇,该过程的微观示意图如图,下列说法正确的是
A.该反应属于置换反应 B.反应前后氢元素的化合价不变
C.反应前后原子的种类和数目都不变 D.参加反应的甲和乙分子个数比为1:1
9.逻辑推理是化学常用的思维方法,下列推理正确的是
A.单质由同种元素组成,所以由同种元素组成的物质一定是单质
B.阳离子是带正电荷的粒子,所以带正电荷的粒子一定是阳离子
C.氧气是由氧元素组成的,所以制取氧气的反应物中一定含有氧元素
D.氧化物中一定含氧元素,含氧元素的化合物一定是氧化物
10.学习化学要用化学观念认识世界。下列选项正确的是
A.变化与守恒:依据X+2O2= 2CO2+2H2O可知,X是C2H4O
B.模型与推理:离子是带电的粒子,所以带电的粒子一定是离子
C.宏观与微观:金刚石和石墨的组成元素相同,但其原子的排列方式不同
D.实验与探究:证明CuO是H2O2分解的催化剂,只需验证CuO能加快反应速率
11.如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
A.甲物质的溶解度为50克
B.甲物质的溶解度大于乙物质的溶解度
C.t2℃时,在100g饱和溶液中含有50g甲物质
D.t1℃时,甲和乙各30g分别加入100g水中,均形成饱和溶液
12.科研人员研究发现:在双催化剂(M/N)作用下,水煤气中的CO和H2O可在低温下快速反应,其转化微观过程如下图所示。结合模型分析判断,下列说法错误的是
A.由步骤一可知,催化剂M、N分别对CO、H2O起吸附作用
B.由步骤二可知,该转化过程中分子可分、原子不可分
C.由步骤三可知,该转化过程中碳元素的化合价升高
D.由整个过程可知,消耗的CO和H2O的分子个数比为1:2
二、综合题(5题,28分)
13.工业上以空气、煤等为原料经过一定步骤合成化学肥料——尿素。其流程图如下:
(1)分离液态空气法:氧气沸点是一183℃,氮气沸点是一196℃,则先从液态空气中分离出来的气体是 。
(2)膜分离技术,在一定压力下,氧气、二氧化碳等通过高分子膜,氮气滞留成为产品输出,则分子渗透速率:氮气 (填“大于”、“等于”或“小于”)氧气。
(3)500℃时,氮气与氢气在加压的条件下反应生成氨气,请写出此反应的化学方程式: ,其基本反应类型是 。
(4)根据流程图中信息,尿素中含有的元素种类有 。(填元素符号)
14.强健的体魄,强大的免疫力,才能低抗新冠病毒的侵袭。请结合生活实际回答下列问题:
(1)人体缺 元素能导致佝偻病或骨质疏松。
(2)某同学的午餐:炖排骨、炒芹菜、米饭,其中富含糖类的食物是 。
(3)某品牌加碘盐中添加的是碘酸钾(KIO3),KIO3中碘元素的化合价是 。
(4)甲醛(CH2O)为室内装修产生的有害物质之一。为去除污染,科学家研制出一种新型的催化剂,在其催化作用下,甲醛与空气中的氧气反应生成两种最常见的氧化物,该反应的化学方程式为 。
15.在实验室利用以下装置制取气体。
(1)用装置A加热氯酸钾和二氧化锰的混合物制氧气的化学方程式为 ;用装置B制二氧化碳的的化学方程式为 ;选择气体的发生装置要考虑的因素是 。
(2)装置B中仪器a的名称是 ;装置C中的导管尽可能伸到集气瓶底部的原因是 ;用装置C收集二氧化碳,验满的操作方法是 。
16.某兴趣小组在学习氧气的化学性质时,发现不同物质在氧气中燃烧的现象不同。
(1)下列物质在氧气中燃烧产物有气体的是 (填序号)。
A镁条B.铁丝C.蜡烛D.硫粉
(2)铁丝在氧气中燃烧的化学方程式: 。
(3)铁丝在氧气中燃烧没有火焰,而蜡烛在氧气中燃烧却有明亮的火焰。该小组同学进行了如下探究。
【探究一】蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由 (填“固态”或“气态”)物质燃烧形成的。
【探究二】物质燃烧产生火焰的根本原因是什么?
【查阅资料】
物质 熔点/℃ 沸点/℃ 燃烧时温度/℃
石蜡 50~70 300~550 约600
铁 1535 2750 约1800
钠 97.8 883 约1400
由上表可知:物质燃烧能否产生火焰与其 (填“熔点”或“沸点”)和燃烧时温度有关。通过上表中石蜡、铁的数据对比,你认为物质燃烧时,什么情况下能产生火焰 。
由此推测:钠在燃烧时, (填“有”或“没有”)火焰产生。
【拓展应用】①根据硫在空气燃烧产生淡蓝色火焰或在氧气中燃烧产生明亮的蓝紫色火焰的实验事实,请你推测硫的沸点 硫燃烧时的温度(填“>”或“<”或“=”)。
②木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时会产生火焰,其原因可能是 。
17.某中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。
依据以上信息计算:
(1)生成二氧化碳的质量为 g。
(2)样品中碳酸钙的质量分数是多少?(写出计算过程)
试卷第4页,共5页
参考答案:
1.C
【详解】A、工业废水直接排放,会造成水体污染,故A不正确;
B、大量使用化石能源会造成环境污染,如空气污染等,要合理使用,故B不正确;
C、废金属回收利用,可以减少环境污染,避免其污染土地,故C正确;
D、露天焚烧塑料垃圾,会造成空气和土壤污染,故D不正确。
故选C。
2.C
【分析】物理变化和化学变化的根本区别在于是否有新物质生成,如果有新物质生成,则属于化学变化; 反之,则是物理变化。
【详解】A. 冰雪融只有物质状态的改变,没有新的物质生成,是物理变化;
B. 石蜡熔化只有物质状态的改变,没有新的物质生成,是物理变化;
C. 粮食酿酒有酒精等新的物质生成,是化学变化;
D. 玻璃破碎只有物质形状的改变,没有新的物质生成,是物理变化。故选C。
3.A
【详解】根据元素周期表中提供的碘元素的信息可知,碘的原子序数是53,则碘原子核内共有53个质子,相对原质量为126.9,属于非金属元素,元素符号为I,故A错误;故选A。
4.C
【详解】硫酸有腐蚀性,不能用硫酸,可以涂上硼酸。故C的说法错误。
5.A
【详解】A、分子是由原子构成的,且元素只讲种类、不讲个数,故选项说法错误;B、水是由氢元素和氧元素组成的,故选项说法正确;C、1个水分子是由两个氢原子和一个氧原子构成的,故选项说法正确;D、水分子是由氢原子和氧原子构成的,故选项说法正确。故选A。
6.C
【详解】A、铁丝在氧气中燃烧观察到火星四射,生成一种黑色固体四氧化三铁,是实验结论而不是实验现象,不符合题意;
B、氢氧化钠溶液与硫酸铜溶液反应生成氢氧化铜蓝色沉淀和硫酸钠,氢氧化钠溶液加入硫酸铜溶液中产生蓝色沉淀,不符合题意;
C、二氧化碳通入紫色石蕊溶液中,二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊溶液变红色,会观察到溶液变成红色,符合题意;
D、浓盐酸具有挥发性,打开浓盐酸的瓶塞,瓶口出现白雾,而不是白烟,不符合题意。故选C。
7.D
【详解】A、品红在热水中扩散比在冷水中快,是因为温度越高分子的运动速率越大,与水分子间的间隙无关,选项A不正确;
B、水通电生成氢气和氧气,只能证明水是由氢元素和氧元素组成的,水是由水分子构成的。水分解时,水分子首先分成氢原子和氧原子,然后氢原子和氧原子各自两两重新组合生成氢分子和氧分子,许多氢分子聚集成氢气,许多氧分子聚集成氧气,因此水中不含氢分子和氧分子,选项B不正确;
C、搅拌能加快蔗糖在水中的溶解,是因为搅拌使得蔗糖和水充分接触,加快了蔗糖分子在水中的扩散速度,选项C不正确;
D、物质的结构决定物质的性质。一氧化碳能燃烧,二氧化碳能灭火,其原因就是一氧化碳和二氧化碳的分子构成不同,选项D正确。故选D。
8.C
【分析】根据微观示意图可知,该反应为二氧化碳和氢气反应生成甲醇和水,反应的化学方程式为:。
【详解】A、置换反应为一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,该反应生成物中没有单质,故不是置换反应,故A选项错误;
B、该反应的反应物中有单质氢气参加,单质中氢元素化合价为0价,反应后生成化合物,氢元素的化合价不再是0,化合价发生了改变,故B选项错误;
C、化学变化的微观实质是分子分裂为原子,原子重新的过程,在重组的过程中,原子种类和数目都不变,故C选项正确;
D、由分析中反应的化学方程式可以看出,参加反应的二氧化碳和氢气的分子个数比为:1:3,故D选项错误;
故选C。
9.C
【详解】A、由同种元素组成的物质不一定是单质,例如红磷和白磷组成的混合物中只含有磷元素,选项A不正确;
B、带正电荷的粒子不一定是阳离子,例如质子带正电荷,不是阳离子,选项B不正确;
C、氧气是由氧元素组成的,根据质量守恒定律,制取氧气的反应物中一定含有氧元素,选项C正确;
D、氧化物是由两种元素组成,其中一种元素是氧元素的化合物,含有氧元素的化合物不一定是氧化物,如氯酸钾中含有钾、氯、氧三种元素,不属于氧化物,选项D不正确。
故选C。
10.C
【详解】A、变化与守恒:在反应X+2O2=2CO2+2H2O中,根据质量守恒定律可知,反应前后的元素种类和原子的种类和个数不变,已知反应前:4个氧原子;反应后:2个碳原子、4个氢原子,6个氧原子,则反应前X中有2个碳原子、4个氢原子,2个氧原子,则X的化学式为C2H4O2,选项说法错误;
B、模型与推理:离子都是带电的粒子,但是带电的粒子不一定是离子,例如原子核是带电的微粒,选项说法错误;
C、宏观与微观:金刚石和石墨的组成元素相同,但其原子的排列方式不同,选项说法正确;
D、实验与探究:探究氧化铜是否为过氧化氢分解的催化剂,不仅需设计实验证明氧化铜能改变化学反应速率,还必须设计实验证明氧化铜本身的质量和化学性质不改变,选项说法错误。
故选C。
11.D
【详解】A..不知道温度范围,不能确定物质的溶解度大小,该选项说法不正确;
B.不知道温度范围,不能比较物质的溶解度大小,该选项说法不正确;
C.t2℃时甲的溶解度是50g,在150g饱和溶液中含有50g 甲物质,该选项说法不正确;
D.t1℃时甲和乙的溶解度都是30g,甲和乙各30g分别加入100g水中,均形成饱和溶液,该选项说法正确。
故选:D。
12.D
【详解】A. 一氧化碳是由一氧化碳分子构成的,水是由水分子构成的;由步骤一图示可知,催化剂M、N分别对CO、H2O起吸附作用,正确;
B. 由步骤二可知,水分子在催化剂N表面分解出氢原子,故该转化过程中分子可分、原子不可分,正确;
C. 由步骤三可知,该转化过程一氧化碳生成二氧化碳,一氧化碳、二氧化碳中碳元素的化合价分别为+2、+4价,故碳元素的化合价升高,正确;
D. 由整个过程可知,1个一氧化碳分子和1个水分子反应生成1个二氧化碳分子和1个氢分子,故反应的CO和H2O的分子个数比为1:1,错误。
故选D。
13.(1)氮气
(2)小于
(3) 化合反应
(4)C、N、O、H
【详解】(1)氮气沸点-196℃,氧气沸点-183℃,沸点低的先分离出来,液态空气汽化时首先分离出氮气;
(2)膜分离技术,在一定压力下,氧气、二氧化碳等通过高分子膜,氮气滞留成为产品输出,则分子渗透速率:氮气小于氧气;
(3)氮气和氢气在加压、500℃时反应生成氨气,反应的化学方程式:,此反应的特征是“多变一”,属于化合反应;
(4)根据流程图中信息,氨气和二氧化碳合成尿素,根据质量守恒定律,化学变化前后,元素的种类不变,因此尿素含有的元素种类有C、N、O、H。
14.(1)钙/Ca
(2)米饭
(3)+5
(4)
【详解】(1)人体缺钙元素能导致佝偻病或骨质疏松;
(2)炖排骨富含蛋白质、炒芹菜富含维生素、米饭富含糖类,其中富含糖类的食物是米饭;
(3)KIO3中碘元素的化合价是,钾元素化合价为+1价,氧元素化合价为-2价,依据化合物中各元素正负化合价代数和为0可知:,,KIO3中碘元素的化合价是+5价;
(4)甲醛(CH2O)与氧气在催化剂条件下反应生成二氧化碳和水,该反应化学方程式:。
15.(1) 反应物的状态和反应条件
(2) 长颈漏斗 为了排净集气瓶内的空气 将燃着的木条放在集气瓶口处,若木条熄灭则说明二氧化碳已集满
【详解】(1)氯酸钾与二氧化锰混合加热后得到氯化钾和氧气,其中二氧化锰作催化剂,该反应的化学方程式为:;实验室制取二氧化碳常用稀盐酸和碳酸钙,反应后生成氯化钙、水和二氧化碳,反应的化学方程式为:;实验室选择制取气体的发生装置时需要考虑反应物的状态和反应条件,反应物的状态是指反应物是固体还是液体,反应条件一般是指是否需要加热,如果需要加热,则应选择带酒精灯的装置。
(2)仪器a的名称是长颈漏斗,常用于添加液体药品。在用排空气法收集气体时,导管要尽可能的伸到集气瓶的底部,这样就可以最大限度的将集气瓶内的空气排净,以便收集到较纯净的气体。二氧化碳不能燃烧,也不能支持燃烧,故验满时可将一燃着的木条放在集气瓶口处,若木条熄灭,则说明二氧化碳已集满。
16. CD 气态 沸点 燃烧温度高于物质的沸点 有 < 木炭燃烧过程中产生的气体继续燃烧产生了火焰
【详解】(1)A、镁条燃烧生成氧化镁固体;
B、铁丝燃烧生成四氧化三铁固体;
C、蜡烛燃烧生成二氧化碳气体和水;
D、硫粉燃烧生成二氧化硫气体;
故选:CD;
(2)铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式为:;
(3)[探究一]
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生,由此可知:蜡烛燃烧产生的火焰是由气态物质燃烧形成的;
[探究二]
由上表可知:物质燃烧能否产生火焰与其沸点和燃烧时温度有关,即燃烧时的温度高于沸点的,燃烧时能够产生火焰;通过上表中石蜡、铁的数据对比可知,能产生火焰的条件是;由此推测:钠燃烧时的温度高于其沸点,因此钠在燃烧时,有火焰产生;
[拓展应用]
①硫在空气或氧气中燃烧时产生火焰,说明硫的沸点小于硫燃烧时的温度;
②探究木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时会产生火焰的真正原因:木炭在氧气中能充分燃烧没有火焰,而木炭在空气中燃烧不充分,在此过程中产生的CO等可燃性气体继续燃烧产生了火焰。
17.(1)4.4
(2)解:设样品中碳酸钙的质量分数是x。
x=80%。
答:样品中碳酸钙的质量分数为80% 。
【详解】(1)根据质量守恒定律,化学反应前后,物质的总质量不变,则生成二氧化碳的质量为:12.5g+100g-108.1g=4.4g;
(2)详见答案。
答案第6页,共6页
答案第5页,共6页
同课章节目录
