化学人教版(2019)选择性必修2 1.2.1原子结构与元素的性质(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.2.1原子结构与元素的性质(共26张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 23.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-20 00:00:00 | ||
图片预览



文档简介
(共26张PPT)
第一章
第2节 原子结构与元素的性质
物质的结构
和性质
第1课时 原子结构与元素周期表
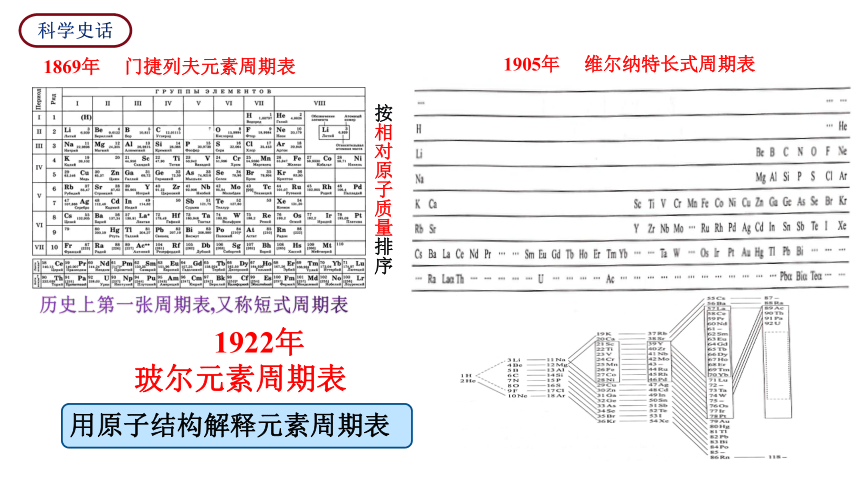
科学史话
1869年 门捷列夫元素周期表
按相对原子质量排序
1905年 维尔纳特长式周期表
1922年
玻尔元素周期表
用原子结构解释元素周期表
历史上第一张周期表,又称短式周期表
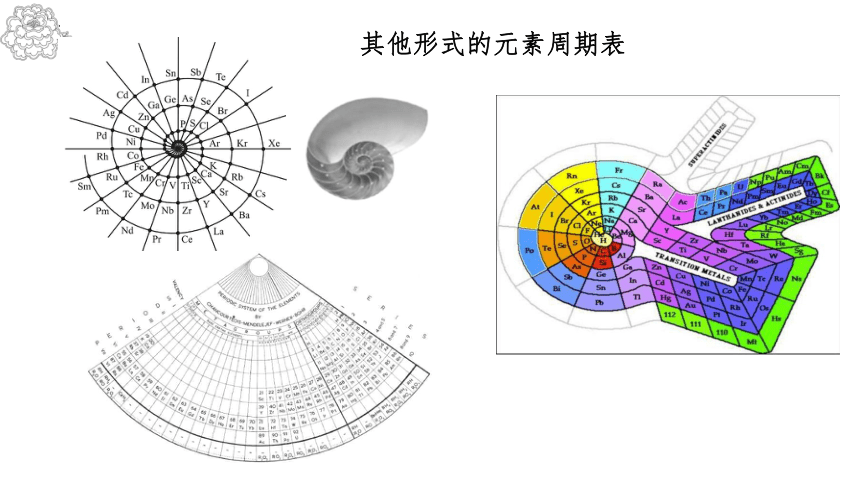
其他形式的元素周期表
战
01
元素周期律、元素周期系、元素周期表
门捷列夫周期表
原子序数
核电荷数
=
=
质子数
=
核外电子数
按相对原子质量从小到大的顺序将元素排列起来,得到一个元素序列,并从最轻的元素氢开始进行编号,称为原子序数。
1913年,英国物理学家莫塞莱证明原子序数不是相对原子质量而是核电荷数
元素周期律: 。
元素周期系: 。
元素周期表: 。
元素周期律、元素周期系
元素的性质随着元素核电荷数的递增而呈周期性变化
元素按其原子核电荷数递增排列的序列
呈现周期系的表格
01
元素周期律、元素周期系、元素周期表
02
构造原理与元素周期表
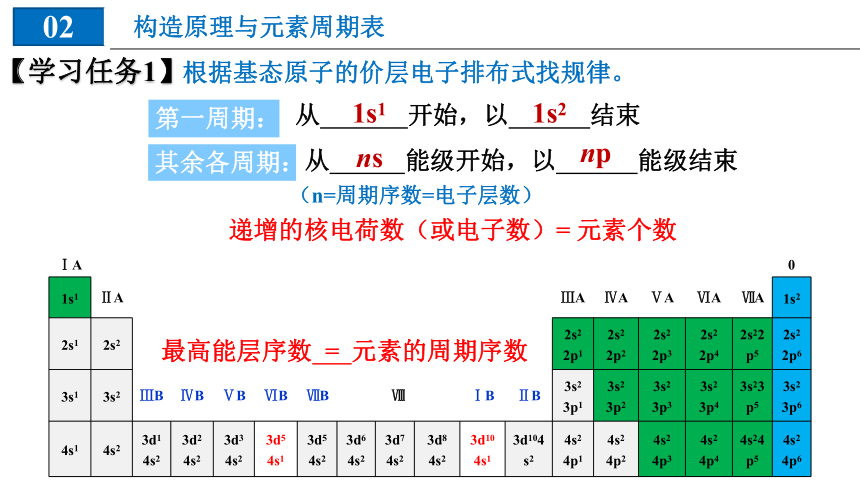
根据基态原子的价层电子排布式找规律。
【学习任务1】
第一周期:
从 开始,以 结束
1s1
1s2
其余各周期:
从 能级开始,以 能级结束
ns
np
(n=周期序数=电子层数)
最高能层序数 = 元素的周期序数
递增的核电荷数(或电子数)= 元素个数
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s2 2p1 2s2 2p2 2s2 2p3 2s2 2p4 2s22p5 2s2
2p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s2 3p1 3s2 3p2 3s2 3p3 3s2 3p4 3s23p5 3s2
3p6
4s1 4s2 3d1 4s2 3d2 4s2 3d3 4s2 3d5 4s1 3d5 4s2 3d6 4s2 3d7 4s2 3d8 4s2 3d10 4s1 3d104s2 4s2 4p1 4s2 4p2 4s2 4p3 4s2 4p4 4s24p5 4s2
4p6
结构
位置
02
构造原理与元素周期表
【学习任务2】
探究原子核外电子排布与周期的关系
能级组
能量相近的合并成一组
共七个能级组,也就形成了7个周期 。
各能级能量相差较小,
各能级组之间能量相差较大
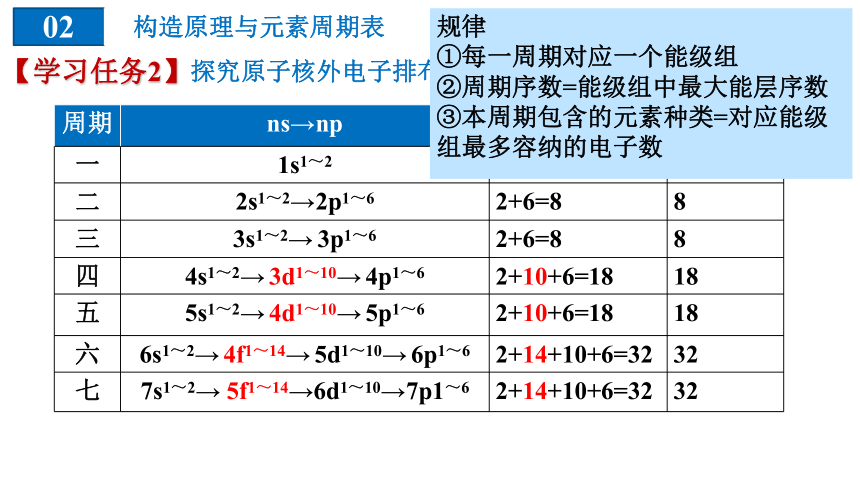
周期 ns→np 电子数 元素数目
一 1s1~2 2 2
二 2s1~2→2p1~6 2+6=8 8
三 3s1~2→ 3p1~6 2+6=8 8
四 4s1~2→ 3d1~10→ 4p1~6 2+10+6=18 18
五 5s1~2→ 4d1~10→ 5p1~6 2+10+6=18 18
六 6s1~2→ 4f1~14→ 5d1~10→ 6p1~6 2+14+10+6=32 32
七 7s1~2→ 5f1~14→6d1~10→7p1~6 2+14+10+6=32 32
02
构造原理与元素周期表
【学习任务2】
探究原子核外电子排布与周期的关系
规律
①每一周期对应一个能级组
②周期序数=能级组中最大能层序数
③本周期包含的元素种类=对应能级组最多容纳的电子数
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s22p1 2s22p2 2s22p3 2s22p4 2s22p5 2s22p6
3s1 3s2 3s23p1 3s23p2 3s23p3 3s23p4 3s23p5 3s23p6
4s1 4s2 4s24p1 4s24p2 4s24p3 3s23p4 4s24p5 4s24p6
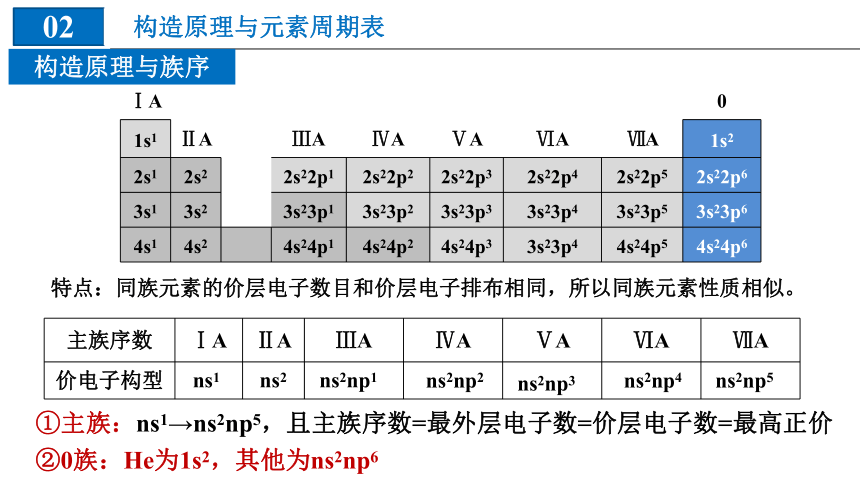
主族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
价电子构型
①主族:ns1→ns2np5,且主族序数=最外层电子数=价层电子数=最高正价
②0族:He为1s2,其他为ns2np6
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
02
构造原理与元素周期表
构造原理与族序
特点:同族元素的价层电子数目和价层电子排布相同,所以同族元素性质相似。
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
3d14s2 3d24s2 3d34s2 3d54s1 3d54s2 3d64s2 3d74s2 3d84s2 3d104s1 3d104s2
族序数 ⅢB ⅣB … ⅦB
价电子构型 …
Ⅷ ⅠB ⅡB
(n-1)d1ns2
(n-1)d2ns2
(n-1)d5ns2
(n-1)d6~9ns1~2
(n-1)d10ns1
(n-1)d10ns2
ⅢB ~ⅦB族:
(n-1)d1-5ns1-2
ⅠB 、ⅡB族:
(镧系、锕系除外)
(n-1)d10ns1-2
(Pd:4d10除外)
③副族
[(n-1)d轨道为全充满状态]
价层电子数=族序数
族序数=最外层电子数
副族最外层电子数都是1~2(Pd除外),全都是金属元素。
构造原理与族序
列序数=价层电子数
Ⅷ族(8、9、10列):
(n-1)d6-9ns1-2
若价层电子数分别为8、9、10,则是第Ⅷ族的。
例题
已知某元素的原子序数是25,写出该元素的价层电子层结构式,并指出该元素所属的周期和族?
1.某元素基态原子的电子排布式为[Ar]3d74s2,它在元素周期表中的位置是( )
A.第三周期ⅡB族 B.第四周期ⅡB族
C.第四周期ⅦB族 D.第四周期Ⅷ族
D
练一练
族 按族分类 价层电子排布式 价层电子数 特点
I A 主族 ns1 1 族序数=最外层电子数=价层电子数
ⅡA ns2 2 ⅢA ns2np1 3 IVA ns2np2 4 VA ns2np3 5 ⅥA ns2np4 6 ⅦA ns2np5 7 ⅢB 副族(镧系、 锕系除外) (n-1)d1-10ns1-2 3 价层电子数=族序数
ⅣB 4 VB 5 VIB 6 VIIB 7 I B 11 (n-1)d轨道为全充满状态,族序数=最外层ns轨道上的电子数
ⅡB 12 Ⅷ Ⅷ族 (n-1)d6-10ns0-2 8 Ⅷ族第1列元素的价电子数=族序数
Ⅷ族第2列元素的价电子数为9
Ⅷ族第3列元素的价电子数为10
9 10 0 0族 1s2或ns2np6(n>1) 2或8 为原子轨道全充满的稳定结构
核外电子排布与族的关系
1.元素周期表共有几个周期、几个主族、几个副族?
2.Ⅷ族在元素周期表中占几列?
回忆思考
7个周期
7个主族
7个副族
Ⅷ族
占三列
03
再探元素周期表
周期
短周期
长周期
第1周期:2 种元素
第2周期:8 种元素
第3周期:8 种元素
第4周期:18 种元素
第5周期:18 种元素
第6周期:32 种元素
第7周期:32 种元素
镧57La – 镥71Lu 共15 种元素称镧系元素
锕89Ac – 铹103Lr 共15 种元素称锕系元素
(7横行)
周期序数 = 电子层数(能层数)
元素周期表的结构
再探元素周期表
03
3短4长
族
(18纵行)
主族:
副族:
第VIII 族:
零族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
共7个主族
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
共7个副族
三个纵行(8、9、10),位于Ⅶ B 与ⅠB中间
He Ne Ar Kr Xe Rn Og
元素周期表的结构
03
再探元素周期表
原子结构与元素周期表分区
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s2 2p1 2s2 2p2 2s2 2p3 2s2 2p4 2s22p5 2s2
2p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s2 3p1 3s2 3p2 3s2 3p3 3s2 3p4 3s23p5 3s2
3p6
4s1 4s2 3d1 4s2 3d2 4s2 3d3 4s2 3d5 4s1 3d5 4s2 3d6 4s2 3d7 4s2 3d8 4s2 3d10 4s1 3d104s2 4s2 4p1 4s2 4p2 4s2 4p3 4s2 4p4 4s24p5 4s2
4p6
ns1~2
ns2np6
(n-1)d1~10ns1~2
金属元素,也称过渡元素
ns2np1~5
多数是非金属元素
金属元素
(1)根据元素的金属性和非金属性分区
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
s
d
ds
p
f
ns1
ns2
ns2np1
ns2np5
ns2np6
(n-1)d1~9ns1~2(除镧系和锕系)
(n-1)d10ns1~2
过渡金属(n-1)d1~10ns1~2(除镧系和锕系)
(2)根据元素原子的核外电子排布分区
以最后填入的电子的能级符号作为该区的符号。
元素周期表可分为5个区。
s区有2列,d区有8列,ds区有2列、 p区有6列。
原子结构与元素周期表分区
f区 (n-2)f0~14(n-2)d0~2ns2
s区
ns1~2
p区
ns2np1~6
d区
(n-1)d1~9ns1~2
Pd除外(4d10)
ds区
(n-1)d10ns1~2
(n-2)f0~14(n-2)d0~2ns2
d区、ds区、f区的元素全是金属元素;s区的元素除H外,也全是金属元素。
Ti
Zr
Hf
Rf
V
Nb
Ta
Db
Cr
Mo
W
Sg
Mn
Tc
Re
Bh
Fe
Ru
Os
Hs
Co
Rh
Ir
Mt
Ni
Pd
Pt
Uun
Cu
Ag
Au
Uuu
Zn
Cd
Hg
Uub
Ga
In
Tl
He
B
Al
Ge
Sn
Pb
C
Si
As
Sb
Bi
N
P
Se
Te
Po
O
S
Br
I
At
F
Cl
Kr
Xe
Rn
Ne
Ar
Li
Na
K
Rb
Cs
Fr
Ca
Sr
Ba
Ra
Be
Mg
Sc
Y
La
Ac
H
由于第11列铜、银、金按构造原理进行电子排布时,电子排布式中最后两个能级的电子排布应该为(n-1)d9ns2,而事实上却是(n-1)d10ns1,可理解为先填满了(n-1)d能级而后填ns能级,故称为ds区。
02
原子结构与元素周期表分区
【思考】第11列铜、银、金和第12列锌、镉、汞为什么被称为ds区?
Ti
Zr
Hf
Rf
V
Nb
Ta
Db
Cr
Mo
W
Sg
Mn
Tc
Re
Bh
Fe
Ru
Os
Hs
Co
Rh
Ir
Mt
Ni
Pd
Pt
Uun
Cu
Ag
Au
Uuu
Zn
Cd
Hg
Uub
Ga
In
Tl
He
B
Al
Ge
Sn
Pb
C
Si
As
Sb
Bi
N
P
Se
Te
Po
O
S
Br
I
At
F
Cl
Kr
Xe
Rn
Ne
Ar
Li
Na
K
Rb
Cs
Fr
Ca
Sr
Ba
Ra
Be
Mg
Sc
Y
La
Ac
H
02
原子结构与元素周期表分区
【思考】为什么处于非金属三角区边缘的元素常被称为半金属或类金属?
由于元素金属性和非金属性间没严格的界限,处于非金属三角边缘的元素既能表现出一定的金属性、又能表现出一定的非金属性。
Ti
Zr
Hf
Rf
V
Nb
Ta
Db
Cr
Mo
W
Sg
Mn
Tc
Re
Bh
Fe
Ru
Os
Hs
Co
Rh
Ir
Mt
Ni
Pd
Pt
Uun
Cu
Ag
Au
Uuu
Zn
Cd
Hg
Uub
Ga
In
Tl
He
B
Al
Ge
Sn
Pb
C
Si
As
Sb
Bi
N
P
Se
Te
Po
O
S
Br
I
At
F
Cl
Kr
Xe
Rn
Ne
Ar
Li
Na
K
Rb
Cs
Fr
Ca
Sr
Ba
Ra
Be
Mg
Sc
Y
La
Ac
H
在P区He原子最外层只有2个电子,故电子排布为2s2
02
原子结构与元素周期表分区
【思考】p区元素价电子都是ns2np1~6吗?价电子为ns1~2的元素都在s区吗?
总结:各区价层电子排布特点
分区 元素位置 价层电子排布
s区 ⅠA、ⅡA ns1~2
p区 ⅢA~ⅦA族及0族 ns2np1~6(He除外)
d区 ⅢB~ⅦB及Ⅷ族 (n-1)d1~9ns1~2(除钯外)
ds区 ⅠB、ⅡB (n-1)d10ns1~2
f区 镧系及锕系元素 (n-2)f0~14(n-1)d0~2ns2
例1.已知某基态原子的电子排布式为1s22s22p63s23p63d84s2,该元素在周期表中的位置和区分别是( )
A.第四周期第ⅡB族,s区
B.第四周期第ⅧB族,d区
C.第四周期第Ⅷ族,d区
D.第四周期第Ⅷ族,ds区
C
课堂练习
1. 已知某元素+3价离子的电子排布式为1s22s22p63s23p63d3,该元素在周期表中的位置和区域是( )
A.第三周期第ⅥB族;p区 B.第三周期第ⅢB族;ds区
C.第四周期第ⅥB族;d区 D.第四周期第ⅢB族;f区
C
2.价层电子排布式为5s25p1的元素,在周期表中的位置是( )
A.第四周期ⅤA族 B.第五周期ⅢA族
C.第五周期ⅠA族 D.第四周期ⅢA族
B
①对角线规则是从相关元素及其化合物的许多
性质中总结出来的经验规则,不是定理。
体现对角线规则的相关元素
对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的(如锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物),这种相似性被称为对角线规则.
②相似性:例如Li、Mg在空气中燃烧的产物分别为Li2O和MgO;铍和铝的氢氧化物均为两性氢氧化物;B和Si的含氧酸都是弱酸。
【真题引领】 (1)(2020·海南卷) Al在周期表中的位置_________________。
(2)(2019·天津卷)砷在元素周期表中的位置_________________。
(3)(2019·海南卷)Mn位于元素周期表中第四周期____________族。
(4)(2021·广东卷)汞的原子序数为80,位于元素周期表中的位置__________________。
教你一招 元素在周期表中位置的判断
第三周期第ⅢA族
第四周期第ⅤA族
ⅦB
第六周期第ⅡB族
大本P19
课堂小结
电子排布与周期
电子排布与族
周期序数=能层数
主族元素:族序数=价电子数
s区、d区、ds区、p区、f区
电子构型和元素的分区
副族元素:大多数族次=(n-1)d+ns的电子数=价电子数
原子结构与元素周期表
第一章
第2节 原子结构与元素的性质
物质的结构
和性质
第1课时 原子结构与元素周期表
科学史话
1869年 门捷列夫元素周期表
按相对原子质量排序
1905年 维尔纳特长式周期表
1922年
玻尔元素周期表
用原子结构解释元素周期表
历史上第一张周期表,又称短式周期表
其他形式的元素周期表
战
01
元素周期律、元素周期系、元素周期表
门捷列夫周期表
原子序数
核电荷数
=
=
质子数
=
核外电子数
按相对原子质量从小到大的顺序将元素排列起来,得到一个元素序列,并从最轻的元素氢开始进行编号,称为原子序数。
1913年,英国物理学家莫塞莱证明原子序数不是相对原子质量而是核电荷数
元素周期律: 。
元素周期系: 。
元素周期表: 。
元素周期律、元素周期系
元素的性质随着元素核电荷数的递增而呈周期性变化
元素按其原子核电荷数递增排列的序列
呈现周期系的表格
01
元素周期律、元素周期系、元素周期表
02
构造原理与元素周期表
根据基态原子的价层电子排布式找规律。
【学习任务1】
第一周期:
从 开始,以 结束
1s1
1s2
其余各周期:
从 能级开始,以 能级结束
ns
np
(n=周期序数=电子层数)
最高能层序数 = 元素的周期序数
递增的核电荷数(或电子数)= 元素个数
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s2 2p1 2s2 2p2 2s2 2p3 2s2 2p4 2s22p5 2s2
2p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s2 3p1 3s2 3p2 3s2 3p3 3s2 3p4 3s23p5 3s2
3p6
4s1 4s2 3d1 4s2 3d2 4s2 3d3 4s2 3d5 4s1 3d5 4s2 3d6 4s2 3d7 4s2 3d8 4s2 3d10 4s1 3d104s2 4s2 4p1 4s2 4p2 4s2 4p3 4s2 4p4 4s24p5 4s2
4p6
结构
位置
02
构造原理与元素周期表
【学习任务2】
探究原子核外电子排布与周期的关系
能级组
能量相近的合并成一组
共七个能级组,也就形成了7个周期 。
各能级能量相差较小,
各能级组之间能量相差较大
周期 ns→np 电子数 元素数目
一 1s1~2 2 2
二 2s1~2→2p1~6 2+6=8 8
三 3s1~2→ 3p1~6 2+6=8 8
四 4s1~2→ 3d1~10→ 4p1~6 2+10+6=18 18
五 5s1~2→ 4d1~10→ 5p1~6 2+10+6=18 18
六 6s1~2→ 4f1~14→ 5d1~10→ 6p1~6 2+14+10+6=32 32
七 7s1~2→ 5f1~14→6d1~10→7p1~6 2+14+10+6=32 32
02
构造原理与元素周期表
【学习任务2】
探究原子核外电子排布与周期的关系
规律
①每一周期对应一个能级组
②周期序数=能级组中最大能层序数
③本周期包含的元素种类=对应能级组最多容纳的电子数
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s22p1 2s22p2 2s22p3 2s22p4 2s22p5 2s22p6
3s1 3s2 3s23p1 3s23p2 3s23p3 3s23p4 3s23p5 3s23p6
4s1 4s2 4s24p1 4s24p2 4s24p3 3s23p4 4s24p5 4s24p6
主族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
价电子构型
①主族:ns1→ns2np5,且主族序数=最外层电子数=价层电子数=最高正价
②0族:He为1s2,其他为ns2np6
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
02
构造原理与元素周期表
构造原理与族序
特点:同族元素的价层电子数目和价层电子排布相同,所以同族元素性质相似。
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
3d14s2 3d24s2 3d34s2 3d54s1 3d54s2 3d64s2 3d74s2 3d84s2 3d104s1 3d104s2
族序数 ⅢB ⅣB … ⅦB
价电子构型 …
Ⅷ ⅠB ⅡB
(n-1)d1ns2
(n-1)d2ns2
(n-1)d5ns2
(n-1)d6~9ns1~2
(n-1)d10ns1
(n-1)d10ns2
ⅢB ~ⅦB族:
(n-1)d1-5ns1-2
ⅠB 、ⅡB族:
(镧系、锕系除外)
(n-1)d10ns1-2
(Pd:4d10除外)
③副族
[(n-1)d轨道为全充满状态]
价层电子数=族序数
族序数=最外层电子数
副族最外层电子数都是1~2(Pd除外),全都是金属元素。
构造原理与族序
列序数=价层电子数
Ⅷ族(8、9、10列):
(n-1)d6-9ns1-2
若价层电子数分别为8、9、10,则是第Ⅷ族的。
例题
已知某元素的原子序数是25,写出该元素的价层电子层结构式,并指出该元素所属的周期和族?
1.某元素基态原子的电子排布式为[Ar]3d74s2,它在元素周期表中的位置是( )
A.第三周期ⅡB族 B.第四周期ⅡB族
C.第四周期ⅦB族 D.第四周期Ⅷ族
D
练一练
族 按族分类 价层电子排布式 价层电子数 特点
I A 主族 ns1 1 族序数=最外层电子数=价层电子数
ⅡA ns2 2 ⅢA ns2np1 3 IVA ns2np2 4 VA ns2np3 5 ⅥA ns2np4 6 ⅦA ns2np5 7 ⅢB 副族(镧系、 锕系除外) (n-1)d1-10ns1-2 3 价层电子数=族序数
ⅣB 4 VB 5 VIB 6 VIIB 7 I B 11 (n-1)d轨道为全充满状态,族序数=最外层ns轨道上的电子数
ⅡB 12 Ⅷ Ⅷ族 (n-1)d6-10ns0-2 8 Ⅷ族第1列元素的价电子数=族序数
Ⅷ族第2列元素的价电子数为9
Ⅷ族第3列元素的价电子数为10
9 10 0 0族 1s2或ns2np6(n>1) 2或8 为原子轨道全充满的稳定结构
核外电子排布与族的关系
1.元素周期表共有几个周期、几个主族、几个副族?
2.Ⅷ族在元素周期表中占几列?
回忆思考
7个周期
7个主族
7个副族
Ⅷ族
占三列
03
再探元素周期表
周期
短周期
长周期
第1周期:2 种元素
第2周期:8 种元素
第3周期:8 种元素
第4周期:18 种元素
第5周期:18 种元素
第6周期:32 种元素
第7周期:32 种元素
镧57La – 镥71Lu 共15 种元素称镧系元素
锕89Ac – 铹103Lr 共15 种元素称锕系元素
(7横行)
周期序数 = 电子层数(能层数)
元素周期表的结构
再探元素周期表
03
3短4长
族
(18纵行)
主族:
副族:
第VIII 族:
零族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
共7个主族
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
共7个副族
三个纵行(8、9、10),位于Ⅶ B 与ⅠB中间
He Ne Ar Kr Xe Rn Og
元素周期表的结构
03
再探元素周期表
原子结构与元素周期表分区
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s2 2p1 2s2 2p2 2s2 2p3 2s2 2p4 2s22p5 2s2
2p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s2 3p1 3s2 3p2 3s2 3p3 3s2 3p4 3s23p5 3s2
3p6
4s1 4s2 3d1 4s2 3d2 4s2 3d3 4s2 3d5 4s1 3d5 4s2 3d6 4s2 3d7 4s2 3d8 4s2 3d10 4s1 3d104s2 4s2 4p1 4s2 4p2 4s2 4p3 4s2 4p4 4s24p5 4s2
4p6
ns1~2
ns2np6
(n-1)d1~10ns1~2
金属元素,也称过渡元素
ns2np1~5
多数是非金属元素
金属元素
(1)根据元素的金属性和非金属性分区
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
s
d
ds
p
f
ns1
ns2
ns2np1
ns2np5
ns2np6
(n-1)d1~9ns1~2(除镧系和锕系)
(n-1)d10ns1~2
过渡金属(n-1)d1~10ns1~2(除镧系和锕系)
(2)根据元素原子的核外电子排布分区
以最后填入的电子的能级符号作为该区的符号。
元素周期表可分为5个区。
s区有2列,d区有8列,ds区有2列、 p区有6列。
原子结构与元素周期表分区
f区 (n-2)f0~14(n-2)d0~2ns2
s区
ns1~2
p区
ns2np1~6
d区
(n-1)d1~9ns1~2
Pd除外(4d10)
ds区
(n-1)d10ns1~2
(n-2)f0~14(n-2)d0~2ns2
d区、ds区、f区的元素全是金属元素;s区的元素除H外,也全是金属元素。
Ti
Zr
Hf
Rf
V
Nb
Ta
Db
Cr
Mo
W
Sg
Mn
Tc
Re
Bh
Fe
Ru
Os
Hs
Co
Rh
Ir
Mt
Ni
Pd
Pt
Uun
Cu
Ag
Au
Uuu
Zn
Cd
Hg
Uub
Ga
In
Tl
He
B
Al
Ge
Sn
Pb
C
Si
As
Sb
Bi
N
P
Se
Te
Po
O
S
Br
I
At
F
Cl
Kr
Xe
Rn
Ne
Ar
Li
Na
K
Rb
Cs
Fr
Ca
Sr
Ba
Ra
Be
Mg
Sc
Y
La
Ac
H
由于第11列铜、银、金按构造原理进行电子排布时,电子排布式中最后两个能级的电子排布应该为(n-1)d9ns2,而事实上却是(n-1)d10ns1,可理解为先填满了(n-1)d能级而后填ns能级,故称为ds区。
02
原子结构与元素周期表分区
【思考】第11列铜、银、金和第12列锌、镉、汞为什么被称为ds区?
Ti
Zr
Hf
Rf
V
Nb
Ta
Db
Cr
Mo
W
Sg
Mn
Tc
Re
Bh
Fe
Ru
Os
Hs
Co
Rh
Ir
Mt
Ni
Pd
Pt
Uun
Cu
Ag
Au
Uuu
Zn
Cd
Hg
Uub
Ga
In
Tl
He
B
Al
Ge
Sn
Pb
C
Si
As
Sb
Bi
N
P
Se
Te
Po
O
S
Br
I
At
F
Cl
Kr
Xe
Rn
Ne
Ar
Li
Na
K
Rb
Cs
Fr
Ca
Sr
Ba
Ra
Be
Mg
Sc
Y
La
Ac
H
02
原子结构与元素周期表分区
【思考】为什么处于非金属三角区边缘的元素常被称为半金属或类金属?
由于元素金属性和非金属性间没严格的界限,处于非金属三角边缘的元素既能表现出一定的金属性、又能表现出一定的非金属性。
Ti
Zr
Hf
Rf
V
Nb
Ta
Db
Cr
Mo
W
Sg
Mn
Tc
Re
Bh
Fe
Ru
Os
Hs
Co
Rh
Ir
Mt
Ni
Pd
Pt
Uun
Cu
Ag
Au
Uuu
Zn
Cd
Hg
Uub
Ga
In
Tl
He
B
Al
Ge
Sn
Pb
C
Si
As
Sb
Bi
N
P
Se
Te
Po
O
S
Br
I
At
F
Cl
Kr
Xe
Rn
Ne
Ar
Li
Na
K
Rb
Cs
Fr
Ca
Sr
Ba
Ra
Be
Mg
Sc
Y
La
Ac
H
在P区He原子最外层只有2个电子,故电子排布为2s2
02
原子结构与元素周期表分区
【思考】p区元素价电子都是ns2np1~6吗?价电子为ns1~2的元素都在s区吗?
总结:各区价层电子排布特点
分区 元素位置 价层电子排布
s区 ⅠA、ⅡA ns1~2
p区 ⅢA~ⅦA族及0族 ns2np1~6(He除外)
d区 ⅢB~ⅦB及Ⅷ族 (n-1)d1~9ns1~2(除钯外)
ds区 ⅠB、ⅡB (n-1)d10ns1~2
f区 镧系及锕系元素 (n-2)f0~14(n-1)d0~2ns2
例1.已知某基态原子的电子排布式为1s22s22p63s23p63d84s2,该元素在周期表中的位置和区分别是( )
A.第四周期第ⅡB族,s区
B.第四周期第ⅧB族,d区
C.第四周期第Ⅷ族,d区
D.第四周期第Ⅷ族,ds区
C
课堂练习
1. 已知某元素+3价离子的电子排布式为1s22s22p63s23p63d3,该元素在周期表中的位置和区域是( )
A.第三周期第ⅥB族;p区 B.第三周期第ⅢB族;ds区
C.第四周期第ⅥB族;d区 D.第四周期第ⅢB族;f区
C
2.价层电子排布式为5s25p1的元素,在周期表中的位置是( )
A.第四周期ⅤA族 B.第五周期ⅢA族
C.第五周期ⅠA族 D.第四周期ⅢA族
B
①对角线规则是从相关元素及其化合物的许多
性质中总结出来的经验规则,不是定理。
体现对角线规则的相关元素
对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的(如锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物),这种相似性被称为对角线规则.
②相似性:例如Li、Mg在空气中燃烧的产物分别为Li2O和MgO;铍和铝的氢氧化物均为两性氢氧化物;B和Si的含氧酸都是弱酸。
【真题引领】 (1)(2020·海南卷) Al在周期表中的位置_________________。
(2)(2019·天津卷)砷在元素周期表中的位置_________________。
(3)(2019·海南卷)Mn位于元素周期表中第四周期____________族。
(4)(2021·广东卷)汞的原子序数为80,位于元素周期表中的位置__________________。
教你一招 元素在周期表中位置的判断
第三周期第ⅢA族
第四周期第ⅤA族
ⅦB
第六周期第ⅡB族
大本P19
课堂小结
电子排布与周期
电子排布与族
周期序数=能层数
主族元素:族序数=价电子数
s区、d区、ds区、p区、f区
电子构型和元素的分区
副族元素:大多数族次=(n-1)d+ns的电子数=价电子数
原子结构与元素周期表
