化学人教版(2019)选择性必修2 3.1.2晶胞、晶胞结构的测定(共48张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.1.2晶胞、晶胞结构的测定(共48张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-20 21:45:11 | ||
图片预览








文档简介
(共48张PPT)
第一节 物质的聚集状态和晶体的常识
第三章 晶体结构和性质
第二课时
晶胞、晶胞结构的测定
学习目标
1.认识简单的晶胞,通过典型晶胞的学习,类推其他晶胞的分析方法。
2.学会晶胞中微粒数的计算方法(均摊法),能根据晶胞的结构确定微粒个数和化学式。
3.知道X射线衍射实验是测定晶体结构的常用方法。
4.初步学习晶体密度计算的方法。
怎样描述晶体中的微粒在空间的排列规律?
氯化钠晶体结构
铜晶体结构
晶体:内部微粒(原子、离子或分子)在三维空间里呈周期性排列而构成的具有规则几何外形的固体。
金刚石结构
思路:“以小见大”
一、晶胞
1、概念:
描述晶体结构的基本单元叫晶胞。
铜晶胞
铜晶体结构
晶胞是晶体中最小的结构重复单元。
铜的晶体结构模型
铜的晶胞模型
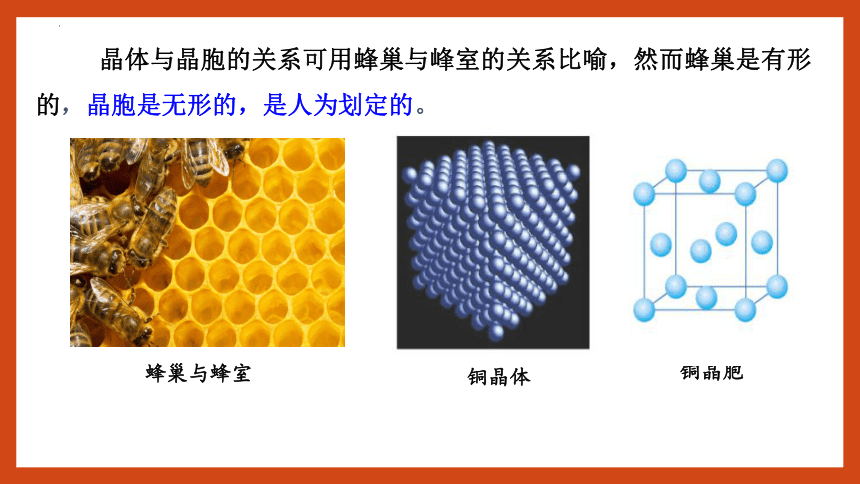
晶体与晶胞的关系可用蜂巢与峰室的关系比喻,然而蜂巢是有形的,晶胞是无形的,是人为划定的。
蜂巢与蜂室
铜晶胞
铜晶体
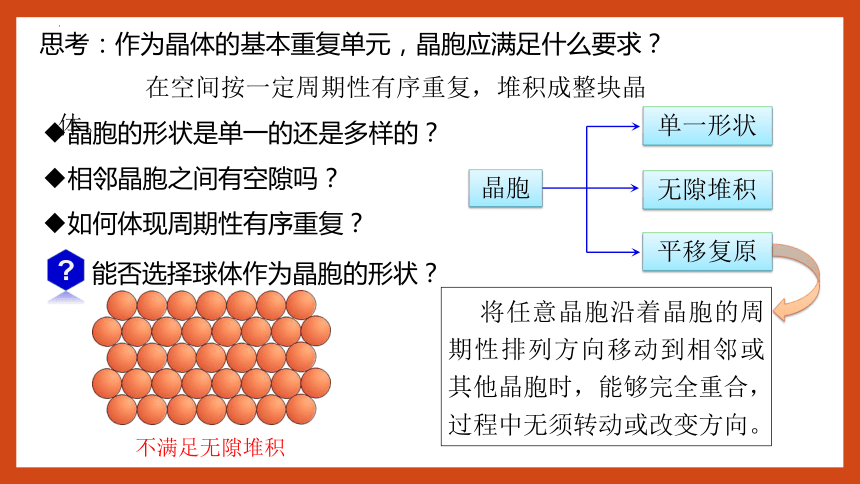
思考:作为晶体的基本重复单元,晶胞应满足什么要求?
在空间按一定周期性有序重复,堆积成整块晶体。
晶胞的形状是单一的还是多样的?
相邻晶胞之间有空隙吗?
如何体现周期性有序重复?
能否选择球体作为晶胞的形状?
单一形状
无隙堆积
平移复原
晶胞
将任意晶胞沿着晶胞的周期性排列方向移动到相邻或其他晶胞时,能够完全重合,过程中无须转动或改变方向。
不满足无隙堆积
晶胞堆积方式展示
晶胞
晶体
无隙并置
平移复原
将任意晶胞沿着晶胞的周期性排列方向移动到相邻或其他晶胞时,能够完全重合,过程中无须转动或改变方向。
各晶胞之间无缝隙
平行排列,取向相同
各个晶胞完全等同(组成和几何空间),
且晶胞间共顶角、共棱、共面
另一种表述
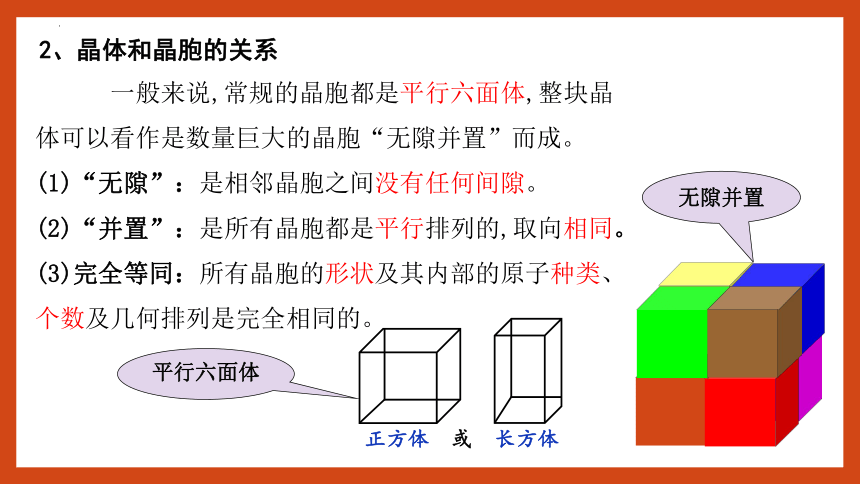
2、晶体和晶胞的关系
一般来说,常规的晶胞都是平行六面体,整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
(1)“无隙”:是相邻晶胞之间没有任何间隙。
(2)“并置”:是所有晶胞都是平行排列的,取向相同。
(3)完全等同:所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。
平行六面体
无隙并置
正方体 或 长方体
3、晶胞的特征:
注意:晶胞是无形的,是人为划定的。同一个晶体中,所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。
一般来说,晶胞都是平行六面体(其边长不一定相等也不一定垂直)。通过上、下、左、右、前、后的平移能与下一个晶胞完全重合。晶胞的形状和大小由具体晶体的结构所决定。
晶胞不是孤立存在的。
晶胞
平行六面体
8个顶角相同
3套各2个平行面分别相同
3套各4根平行棱分别相同
金刚石晶胞
CO2晶胞
NaCl晶胞
铜晶胞
Na+
Cl-
讨论:分析以下几种晶胞,总结平行六面体晶胞满足的条件:
练习:判断下列4个图中结构,属于晶胞的是
√
8个顶角不相同
3套各4根平行棱
不相同
3套各2个平行面
不相同
判断是否是晶胞的方法一:顶点/平行面/平行棱是否完全相同
练习:下面是从NaCl晶体最小平行六面体,是否可以作为晶胞?
8个顶角不相同
不能平移复原
判断是否是晶胞的方法二:能否平移复原
练习:若下图是某晶胞的残缺结构,要使其恢复晶胞资格,你认为应该如何改动?
4、判断是否是晶胞的方法:
①顶点/平行面/平行棱是否完全相同
②能否平移复原
课堂练习:判断下列六面体是否是晶胞?
A图中的晶体结构满足
晶胞的特点,是晶胞。
B图中的晶体结构,不满足晶胞“8个顶角相同”的要求,无法进行“无隙并置”,不是晶胞。
C图中的晶体结构,不满足晶胞“三套各4根平行棱分别相同”的要求,无法进行“无隙并置”,不是晶胞。
D图中的晶体结构,不满足“三套各两个平行面分别相同”的要求,无法进行“无隙并置”,不是晶胞。
59-2.下列各项是晶体结构中具有代表性的最小重复单元的排列方式,图中: —X, —Y, —Z。其中对应的化学式不正确的是
√
下图AC均不是晶胞,不能重复,题目本身就是错题
讨论:我们能计算出这个铜晶胞平均含有的铜原子数目吗?
每个顶点:1/8
每个面心:1/2
金属铜一个晶胞的铜原子数:
8×1/8+6×1/2=4
铜晶胞中含有8个顶点、6个面心
◆平行六面体晶胞中不同位置的粒子数的计算(如下图)
体心:1
8个晶胞共用一个顶点:每个分摊1/8
4个晶胞共用一条棱边:每个分摊1/4
2个晶胞共用一个面棱:每个分摊1/2
面心:1/2
体心:1
棱边:1/4
顶点:1/8
5、晶胞中粒子个数的计算—— 均摊法
“均摊法”是计算每个晶胞平均拥有的粒子数目的常用方法。其基本理念是每个粒子被n个晶胞所共用,则该粒子有1/n属于这个晶胞。
④顶点:由8个晶胞共同拥有,各晶胞各分享其1/8
③棱上:由4个晶胞共同拥有,各晶胞各分享其1/4
①体心:由1个晶胞拥有,该晶胞独自拥有该粒子
②面心:由2个晶胞共同拥有,各晶胞各分享其1/2
(1)平行六面体晶胞中粒子的计算方法
(2)六方(六棱柱)晶胞中粒子的计算方法
顶角:1/6
上、下棱:1/4
侧棱:1/3
面上:1/2
内部:1
六棱柱(六方)晶胞
(3)正三棱柱晶胞中粒子的计算方法
顶点:1/12
侧棱:1/6
内部:1
上下棱:1/4
三棱柱晶胞
练习:如图是NaCl 晶胞,数数Na+ 和 Cl-个数?
Cl-
Na+
8× + 6× =4
8
1
2
1
12× +1 =4
4
1
Cl- 位于_______和_________
Na+位于_______和_________
面心
顶角
体心
棱上
该晶胞中包含4个Na+和4个Cl-
步骤一:先明确微粒在晶胞中的位置关系
步骤二:采用均摊法计算
①明确微粒在晶胞中的位置关系(体、面、棱、顶)。
②基于位置采用均摊法进行计算。
方法技巧:计算晶胞中含有微粒数目--均摊法
顶角1/8
面1/2
棱1/4
内1
顶角1/6
面1/2
上、下棱1/4
侧棱1/3
内1
顶角1/12
面1/2
上、下棱1/4
侧棱1/6
内1
六棱柱
三棱柱
立方体
AB
A
B
A原子数
8× =1
8
1
1
B原子数
问:下列晶胞中A和B原子各有多少个 你能写出化学式吗?
球棍模型
比例填充模型
A原子数
B原子数
顶角
体心
晶胞1
晶胞2
X:6/12=1/2
Y:6/4+3/6=2
Z:1
Mg:12/6+2/2=3
B:(在体内) 6
计算下列晶胞中原子数目,确定化学式。
X2ZY4
MgB2
晶体化学式的确定:观察确认粒子种类→确定各粒子在晶胞中的位置→用均摊法求晶胞均摊各粒子的数目→求各粒子数目的最简比→确定化学式。
对点训练
科学家发现了一种由钛原子和碳原子构成的气态团簇分子。如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
A.Ti14C13 B.Ti4C4 C.TiC D.Ti13C14
A
特别注意:气态团簇分子和纳米小颗粒不采用无隙并置方式排列,
故不能采用均摊法来确定化学式!
一个气态团簇分子,其化学式就是其分子式,应直接数出原子数。
晶体化学式的含义:
一般地,晶体的化学式表示的是晶体(也可以说是每个晶胞)中各类原子或离子数目的最简整数比。
拓展训练
堆积图特点:
能展示粒子的相对大小,晶胞对粒子的占有率,粒子与粒子的堆积接触和空隙。
点阵图特点:
能清晰展示粒子在晶胞中的相对位置,有利于分析点、线、面、角的关系。
两种晶胞图
思考与讨论:
(1)晶胞有几套平行棱?有几套平行面?
(2)数一数,它们分别平均含有几个原子?
晶胞有三套各4根平行棱,有3套各两个平行面
金属钠(Na) 金属锌(Zn) 碘(I2) 金刚石(C)
晶胞不一定都取平行六面体
中学要求掌握平行六面体晶胞
1、晶体密度计算公式:
m:一个晶胞质量(g)
V:一个晶胞体积(cm3))
二、晶体的密度的计算
2、计算步骤
(1)晶胞质量m的计算
①选取一个晶胞。
②用“均摊法”确定晶胞(或所截取的结构单元)中所含的原子、分子或离子数目,进而确定组成单质或化合物“粒子”的数目,设为N。
③计算晶胞中所含“粒子”的物质的量
④计算晶胞的质量: (M为该微粒的摩尔质量)。
Na+
Cl-
(3)由
计算晶胞的密度,即晶体的密度。
(2)计算晶胞的体积V。
注意单位换算: 1m=102cm=109nm=1010 =1012pm
练习:该晶胞中,若两个距离最近的Na+核间距为a cm,则晶体的密度ρ = _______ g·cm-3。
晶胞的边长:
b=√2 a cm
晶胞分摊4个NaCl
ρ = =
N · M
b3 · NA
4×58·5
(√2 a)3 ×NA
=
58·5√2
a3 · NA
g·cm-3
课堂练习3:根据离子晶体的晶胞结构,判断下列离子晶体的化学式:(A表示阳离子)
A
B
化学式:
AB
化学式:
AB2
C
化学式:
ABC3
准晶是一种介于晶体和非晶体之间的固体。是一种特殊的聚集状态。
准晶具有完全有序的结构,然而又不具有晶体所应有的平移对称性,因而可以具有晶体所不允许的宏观对称性。
探究——准晶:
银铝准晶体的原子模型
准晶具有独特的属性,坚硬又有弹性、非常平滑,而且与大多数金属不同的是其导电性、导热性很差,因此在日常生活中大有用武之地。
晶体的平面点阵只能有二、三、四、六重轴(重轴n=360/α,α为旋转角度)而准晶可以有五、八、十、十二重轴。
课堂练习6:2011年诺贝尔化学奖授予以色列科学家达尼埃尔·谢赫特曼,以表彰他发现了准晶体。准晶体材料具有硬度高,不易损伤,使用寿命长等特点.下列叙述错误的是( )
A.自然界中的固体可分为晶体、准晶体和非晶态物质
B.准晶体是一种介于晶体和非晶态物质之间的固体
C.准晶体材料的应用具有较大的发展空间
D.化学式为Al63Cu24Fe13的准晶体不可与稀硝酸发生反应
D
X射线管
铅板
晶体
三、晶胞结构的测定
1、测定晶体结构仪器、方法及原理
X射线衍射原理:单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
最常用的仪器是X射线衍射仪
单晶衍射图
非晶态和晶态SiO2粉末X射线衍射图谱的对比
2、X射线衍射图谱的应用
①X射线衍射实验获得晶胞信息
②X射线衍射实验获得分子信息
衍射图
晶胞形状和大小
分子或原子在微观空间有序排列呈现的对称类型
原子在晶胞里的数目和位置
计算获得
结合晶体化学组成的信息推出原子之间的相互关系
根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
◆衍射方向
——晶胞的形状、大小与取向
◆衍射强度
——原子的种类与位置
1.X射线衍射原理
单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
【课堂小结】
2.X射线衍射实验获得晶胞信息
3.X射线衍射实验获得分子信息
晶体的X射线衍射实验图经过计算,可以获得包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等,以及结合晶体化学组成的信息推出原子之间的相互关系。
通过晶体X射线衍射实验,可以测定晶胞中各个原子的位置(坐标),根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
课堂练习7:下列有关说法正确的是( )
A.测定晶体结构最常用的仪器是X射线衍射仪
B.石英玻璃和水晶的衍射图谱相同
C.通过乙酸晶体的X射线衍射实验,只能测定晶胞中含有的乙酸分子数,
不能推出乙酸分子的空间结构
D.晶体的X射线衍射实验不能判断晶体中存在哪些化学键,也不能确定
键长和键角
A
Na+
Cl-
课堂练习8:(1)每个晶胞中平均有____个Na+,____个Cl-;
(2)在NaCl晶体中,每个Na+周围最近距离的Cl-有___个;每个Cl-周围最近距离的Na+有___个。
(3)在NaCl晶体中,每个Na+周围最近距离的Na+有____个。
(4)该晶胞中,若两个距离最近的Na+核间距为a cm,
则晶体的密度ρ = _______ g·cm-3。
4
4
6
6
12
课堂小结
晶胞
概念
计算原子个数—均摊法
特点
结构的测定—X射线衍射实验
晶体
晶胞是晶体中最小的结构重复单元。
整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
8个顶角相同、3套各4根平行棱分别相同、3套各2个平行面分别相同的最小平行六面体
1、下列各项是晶体结构中具有代表性的最小重复单元的排列方式,图中:○—X,●—Y,?—Z。其中对应的化学式不正确的是( )
课堂达标
B
2、某晶胞的结构如图所示,这种晶体中A、B、C三种粒子数之比是( )
A. 3:9:4 B. 1:4:2 C. 2:9:4 D. 3:8:4
B
3.话筒是声电转换的换能器,在话筒中有一种材料的结构如图所示,它的主要成分是钛酸钡,根据晶胞的结构示意图,可知它的化学式是( )
A.BaTi8O12 B.BaTi4O6
C.BaTi2O4 D.BaTiO3
D
4、2011年,以色列化学家谢赫特曼因发现准晶体获诺贝尔化学奖。由于准晶体原子排列不具有周期性,因此准晶体材料硬度很高,同时具有一定弹性,不易损伤,使用寿命长。这种材料的应用有较大发展空间。下列说法不正确的是 ( )
A.液晶不是准晶体
B.准晶体是一种介于晶体和非晶体之间的固体
C.自然界的固态物质分为晶体和非晶体
D.构成晶体的微粒在空间呈现有规则的重复排列
C
5、石墨晶体的层状结构,层内为平面正六边形结构(如图),图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个。碳原子数目与碳碳化学键数目之比为_____。
2 : 3
3
2
6、下图是超导化合物一钙钛矿晶体中晶胞的结构。请回答:
(1)该化合物的化学式为____________。
(2)在该化合物晶体中,与某个钛离子距离最近
且相等的其他钛离子共有____个。
(3)该晶体结构单元中,氧、钛、钙离子的个数比
是 ____________ 。
CaTiO3
6
Ca O Ti
3∶1∶1
7、(2018年全国Ⅲ卷)金属Zn晶体中的原子堆积方式如图,六棱柱底边边长为a cm,高为c cm,阿伏伽德罗常数的值为NA,Zn的密度为_______g·cm-3(列出计算式)。
ρ =
N · M
abc · NA
6×65
6× ×a2c×NA
3
4
√
=
第一节 物质的聚集状态和晶体的常识
第三章 晶体结构和性质
第二课时
晶胞、晶胞结构的测定
学习目标
1.认识简单的晶胞,通过典型晶胞的学习,类推其他晶胞的分析方法。
2.学会晶胞中微粒数的计算方法(均摊法),能根据晶胞的结构确定微粒个数和化学式。
3.知道X射线衍射实验是测定晶体结构的常用方法。
4.初步学习晶体密度计算的方法。
怎样描述晶体中的微粒在空间的排列规律?
氯化钠晶体结构
铜晶体结构
晶体:内部微粒(原子、离子或分子)在三维空间里呈周期性排列而构成的具有规则几何外形的固体。
金刚石结构
思路:“以小见大”
一、晶胞
1、概念:
描述晶体结构的基本单元叫晶胞。
铜晶胞
铜晶体结构
晶胞是晶体中最小的结构重复单元。
铜的晶体结构模型
铜的晶胞模型
晶体与晶胞的关系可用蜂巢与峰室的关系比喻,然而蜂巢是有形的,晶胞是无形的,是人为划定的。
蜂巢与蜂室
铜晶胞
铜晶体
思考:作为晶体的基本重复单元,晶胞应满足什么要求?
在空间按一定周期性有序重复,堆积成整块晶体。
晶胞的形状是单一的还是多样的?
相邻晶胞之间有空隙吗?
如何体现周期性有序重复?
能否选择球体作为晶胞的形状?
单一形状
无隙堆积
平移复原
晶胞
将任意晶胞沿着晶胞的周期性排列方向移动到相邻或其他晶胞时,能够完全重合,过程中无须转动或改变方向。
不满足无隙堆积
晶胞堆积方式展示
晶胞
晶体
无隙并置
平移复原
将任意晶胞沿着晶胞的周期性排列方向移动到相邻或其他晶胞时,能够完全重合,过程中无须转动或改变方向。
各晶胞之间无缝隙
平行排列,取向相同
各个晶胞完全等同(组成和几何空间),
且晶胞间共顶角、共棱、共面
另一种表述
2、晶体和晶胞的关系
一般来说,常规的晶胞都是平行六面体,整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
(1)“无隙”:是相邻晶胞之间没有任何间隙。
(2)“并置”:是所有晶胞都是平行排列的,取向相同。
(3)完全等同:所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。
平行六面体
无隙并置
正方体 或 长方体
3、晶胞的特征:
注意:晶胞是无形的,是人为划定的。同一个晶体中,所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。
一般来说,晶胞都是平行六面体(其边长不一定相等也不一定垂直)。通过上、下、左、右、前、后的平移能与下一个晶胞完全重合。晶胞的形状和大小由具体晶体的结构所决定。
晶胞不是孤立存在的。
晶胞
平行六面体
8个顶角相同
3套各2个平行面分别相同
3套各4根平行棱分别相同
金刚石晶胞
CO2晶胞
NaCl晶胞
铜晶胞
Na+
Cl-
讨论:分析以下几种晶胞,总结平行六面体晶胞满足的条件:
练习:判断下列4个图中结构,属于晶胞的是
√
8个顶角不相同
3套各4根平行棱
不相同
3套各2个平行面
不相同
判断是否是晶胞的方法一:顶点/平行面/平行棱是否完全相同
练习:下面是从NaCl晶体最小平行六面体,是否可以作为晶胞?
8个顶角不相同
不能平移复原
判断是否是晶胞的方法二:能否平移复原
练习:若下图是某晶胞的残缺结构,要使其恢复晶胞资格,你认为应该如何改动?
4、判断是否是晶胞的方法:
①顶点/平行面/平行棱是否完全相同
②能否平移复原
课堂练习:判断下列六面体是否是晶胞?
A图中的晶体结构满足
晶胞的特点,是晶胞。
B图中的晶体结构,不满足晶胞“8个顶角相同”的要求,无法进行“无隙并置”,不是晶胞。
C图中的晶体结构,不满足晶胞“三套各4根平行棱分别相同”的要求,无法进行“无隙并置”,不是晶胞。
D图中的晶体结构,不满足“三套各两个平行面分别相同”的要求,无法进行“无隙并置”,不是晶胞。
59-2.下列各项是晶体结构中具有代表性的最小重复单元的排列方式,图中: —X, —Y, —Z。其中对应的化学式不正确的是
√
下图AC均不是晶胞,不能重复,题目本身就是错题
讨论:我们能计算出这个铜晶胞平均含有的铜原子数目吗?
每个顶点:1/8
每个面心:1/2
金属铜一个晶胞的铜原子数:
8×1/8+6×1/2=4
铜晶胞中含有8个顶点、6个面心
◆平行六面体晶胞中不同位置的粒子数的计算(如下图)
体心:1
8个晶胞共用一个顶点:每个分摊1/8
4个晶胞共用一条棱边:每个分摊1/4
2个晶胞共用一个面棱:每个分摊1/2
面心:1/2
体心:1
棱边:1/4
顶点:1/8
5、晶胞中粒子个数的计算—— 均摊法
“均摊法”是计算每个晶胞平均拥有的粒子数目的常用方法。其基本理念是每个粒子被n个晶胞所共用,则该粒子有1/n属于这个晶胞。
④顶点:由8个晶胞共同拥有,各晶胞各分享其1/8
③棱上:由4个晶胞共同拥有,各晶胞各分享其1/4
①体心:由1个晶胞拥有,该晶胞独自拥有该粒子
②面心:由2个晶胞共同拥有,各晶胞各分享其1/2
(1)平行六面体晶胞中粒子的计算方法
(2)六方(六棱柱)晶胞中粒子的计算方法
顶角:1/6
上、下棱:1/4
侧棱:1/3
面上:1/2
内部:1
六棱柱(六方)晶胞
(3)正三棱柱晶胞中粒子的计算方法
顶点:1/12
侧棱:1/6
内部:1
上下棱:1/4
三棱柱晶胞
练习:如图是NaCl 晶胞,数数Na+ 和 Cl-个数?
Cl-
Na+
8× + 6× =4
8
1
2
1
12× +1 =4
4
1
Cl- 位于_______和_________
Na+位于_______和_________
面心
顶角
体心
棱上
该晶胞中包含4个Na+和4个Cl-
步骤一:先明确微粒在晶胞中的位置关系
步骤二:采用均摊法计算
①明确微粒在晶胞中的位置关系(体、面、棱、顶)。
②基于位置采用均摊法进行计算。
方法技巧:计算晶胞中含有微粒数目--均摊法
顶角1/8
面1/2
棱1/4
内1
顶角1/6
面1/2
上、下棱1/4
侧棱1/3
内1
顶角1/12
面1/2
上、下棱1/4
侧棱1/6
内1
六棱柱
三棱柱
立方体
AB
A
B
A原子数
8× =1
8
1
1
B原子数
问:下列晶胞中A和B原子各有多少个 你能写出化学式吗?
球棍模型
比例填充模型
A原子数
B原子数
顶角
体心
晶胞1
晶胞2
X:6/12=1/2
Y:6/4+3/6=2
Z:1
Mg:12/6+2/2=3
B:(在体内) 6
计算下列晶胞中原子数目,确定化学式。
X2ZY4
MgB2
晶体化学式的确定:观察确认粒子种类→确定各粒子在晶胞中的位置→用均摊法求晶胞均摊各粒子的数目→求各粒子数目的最简比→确定化学式。
对点训练
科学家发现了一种由钛原子和碳原子构成的气态团簇分子。如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
A.Ti14C13 B.Ti4C4 C.TiC D.Ti13C14
A
特别注意:气态团簇分子和纳米小颗粒不采用无隙并置方式排列,
故不能采用均摊法来确定化学式!
一个气态团簇分子,其化学式就是其分子式,应直接数出原子数。
晶体化学式的含义:
一般地,晶体的化学式表示的是晶体(也可以说是每个晶胞)中各类原子或离子数目的最简整数比。
拓展训练
堆积图特点:
能展示粒子的相对大小,晶胞对粒子的占有率,粒子与粒子的堆积接触和空隙。
点阵图特点:
能清晰展示粒子在晶胞中的相对位置,有利于分析点、线、面、角的关系。
两种晶胞图
思考与讨论:
(1)晶胞有几套平行棱?有几套平行面?
(2)数一数,它们分别平均含有几个原子?
晶胞有三套各4根平行棱,有3套各两个平行面
金属钠(Na) 金属锌(Zn) 碘(I2) 金刚石(C)
晶胞不一定都取平行六面体
中学要求掌握平行六面体晶胞
1、晶体密度计算公式:
m:一个晶胞质量(g)
V:一个晶胞体积(cm3))
二、晶体的密度的计算
2、计算步骤
(1)晶胞质量m的计算
①选取一个晶胞。
②用“均摊法”确定晶胞(或所截取的结构单元)中所含的原子、分子或离子数目,进而确定组成单质或化合物“粒子”的数目,设为N。
③计算晶胞中所含“粒子”的物质的量
④计算晶胞的质量: (M为该微粒的摩尔质量)。
Na+
Cl-
(3)由
计算晶胞的密度,即晶体的密度。
(2)计算晶胞的体积V。
注意单位换算: 1m=102cm=109nm=1010 =1012pm
练习:该晶胞中,若两个距离最近的Na+核间距为a cm,则晶体的密度ρ = _______ g·cm-3。
晶胞的边长:
b=√2 a cm
晶胞分摊4个NaCl
ρ = =
N · M
b3 · NA
4×58·5
(√2 a)3 ×NA
=
58·5√2
a3 · NA
g·cm-3
课堂练习3:根据离子晶体的晶胞结构,判断下列离子晶体的化学式:(A表示阳离子)
A
B
化学式:
AB
化学式:
AB2
C
化学式:
ABC3
准晶是一种介于晶体和非晶体之间的固体。是一种特殊的聚集状态。
准晶具有完全有序的结构,然而又不具有晶体所应有的平移对称性,因而可以具有晶体所不允许的宏观对称性。
探究——准晶:
银铝准晶体的原子模型
准晶具有独特的属性,坚硬又有弹性、非常平滑,而且与大多数金属不同的是其导电性、导热性很差,因此在日常生活中大有用武之地。
晶体的平面点阵只能有二、三、四、六重轴(重轴n=360/α,α为旋转角度)而准晶可以有五、八、十、十二重轴。
课堂练习6:2011年诺贝尔化学奖授予以色列科学家达尼埃尔·谢赫特曼,以表彰他发现了准晶体。准晶体材料具有硬度高,不易损伤,使用寿命长等特点.下列叙述错误的是( )
A.自然界中的固体可分为晶体、准晶体和非晶态物质
B.准晶体是一种介于晶体和非晶态物质之间的固体
C.准晶体材料的应用具有较大的发展空间
D.化学式为Al63Cu24Fe13的准晶体不可与稀硝酸发生反应
D
X射线管
铅板
晶体
三、晶胞结构的测定
1、测定晶体结构仪器、方法及原理
X射线衍射原理:单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
最常用的仪器是X射线衍射仪
单晶衍射图
非晶态和晶态SiO2粉末X射线衍射图谱的对比
2、X射线衍射图谱的应用
①X射线衍射实验获得晶胞信息
②X射线衍射实验获得分子信息
衍射图
晶胞形状和大小
分子或原子在微观空间有序排列呈现的对称类型
原子在晶胞里的数目和位置
计算获得
结合晶体化学组成的信息推出原子之间的相互关系
根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
◆衍射方向
——晶胞的形状、大小与取向
◆衍射强度
——原子的种类与位置
1.X射线衍射原理
单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
【课堂小结】
2.X射线衍射实验获得晶胞信息
3.X射线衍射实验获得分子信息
晶体的X射线衍射实验图经过计算,可以获得包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等,以及结合晶体化学组成的信息推出原子之间的相互关系。
通过晶体X射线衍射实验,可以测定晶胞中各个原子的位置(坐标),根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
课堂练习7:下列有关说法正确的是( )
A.测定晶体结构最常用的仪器是X射线衍射仪
B.石英玻璃和水晶的衍射图谱相同
C.通过乙酸晶体的X射线衍射实验,只能测定晶胞中含有的乙酸分子数,
不能推出乙酸分子的空间结构
D.晶体的X射线衍射实验不能判断晶体中存在哪些化学键,也不能确定
键长和键角
A
Na+
Cl-
课堂练习8:(1)每个晶胞中平均有____个Na+,____个Cl-;
(2)在NaCl晶体中,每个Na+周围最近距离的Cl-有___个;每个Cl-周围最近距离的Na+有___个。
(3)在NaCl晶体中,每个Na+周围最近距离的Na+有____个。
(4)该晶胞中,若两个距离最近的Na+核间距为a cm,
则晶体的密度ρ = _______ g·cm-3。
4
4
6
6
12
课堂小结
晶胞
概念
计算原子个数—均摊法
特点
结构的测定—X射线衍射实验
晶体
晶胞是晶体中最小的结构重复单元。
整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
8个顶角相同、3套各4根平行棱分别相同、3套各2个平行面分别相同的最小平行六面体
1、下列各项是晶体结构中具有代表性的最小重复单元的排列方式,图中:○—X,●—Y,?—Z。其中对应的化学式不正确的是( )
课堂达标
B
2、某晶胞的结构如图所示,这种晶体中A、B、C三种粒子数之比是( )
A. 3:9:4 B. 1:4:2 C. 2:9:4 D. 3:8:4
B
3.话筒是声电转换的换能器,在话筒中有一种材料的结构如图所示,它的主要成分是钛酸钡,根据晶胞的结构示意图,可知它的化学式是( )
A.BaTi8O12 B.BaTi4O6
C.BaTi2O4 D.BaTiO3
D
4、2011年,以色列化学家谢赫特曼因发现准晶体获诺贝尔化学奖。由于准晶体原子排列不具有周期性,因此准晶体材料硬度很高,同时具有一定弹性,不易损伤,使用寿命长。这种材料的应用有较大发展空间。下列说法不正确的是 ( )
A.液晶不是准晶体
B.准晶体是一种介于晶体和非晶体之间的固体
C.自然界的固态物质分为晶体和非晶体
D.构成晶体的微粒在空间呈现有规则的重复排列
C
5、石墨晶体的层状结构,层内为平面正六边形结构(如图),图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个。碳原子数目与碳碳化学键数目之比为_____。
2 : 3
3
2
6、下图是超导化合物一钙钛矿晶体中晶胞的结构。请回答:
(1)该化合物的化学式为____________。
(2)在该化合物晶体中,与某个钛离子距离最近
且相等的其他钛离子共有____个。
(3)该晶体结构单元中,氧、钛、钙离子的个数比
是 ____________ 。
CaTiO3
6
Ca O Ti
3∶1∶1
7、(2018年全国Ⅲ卷)金属Zn晶体中的原子堆积方式如图,六棱柱底边边长为a cm,高为c cm,阿伏伽德罗常数的值为NA,Zn的密度为_______g·cm-3(列出计算式)。
ρ =
N · M
abc · NA
6×65
6× ×a2c×NA
3
4
√
=
