9.3 溶液的浓度-第一课时 2023-2024学年九年级化学下册同步讲透教材优选课件(人教版)(共29张PPT)
文档属性
| 名称 | 9.3 溶液的浓度-第一课时 2023-2024学年九年级化学下册同步讲透教材优选课件(人教版)(共29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 43.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-23 00:00:00 | ||
图片预览







文档简介
(共29张PPT)
课题3 溶液的浓度
第九单元 溶 液
人教版九年级化学下册
半勺糖
两勺糖
两杯糖水的甜度是否相同?你觉得哪杯糖水较浓、哪杯较稀?
在两杯等量的水中分别加入1勺糖和2勺糖,搅拌后完全溶解。
思考
试管、滴管
实验
9 - 7
实验药品
水20mL、硫酸铜
实验仪器
实验目的
探究硫酸铜溶液浓度的表示
实验方案
在相同体积的溶剂中溶解不同质量的硫酸铜固体,观察现象。
在三支试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。比较三种溶液的颜色。
淡蓝 蓝色 深蓝
实验
9 - 7
实验步骤
实验现象
实验结论
硫酸铜固体都溶解,浓度越大颜色越深。
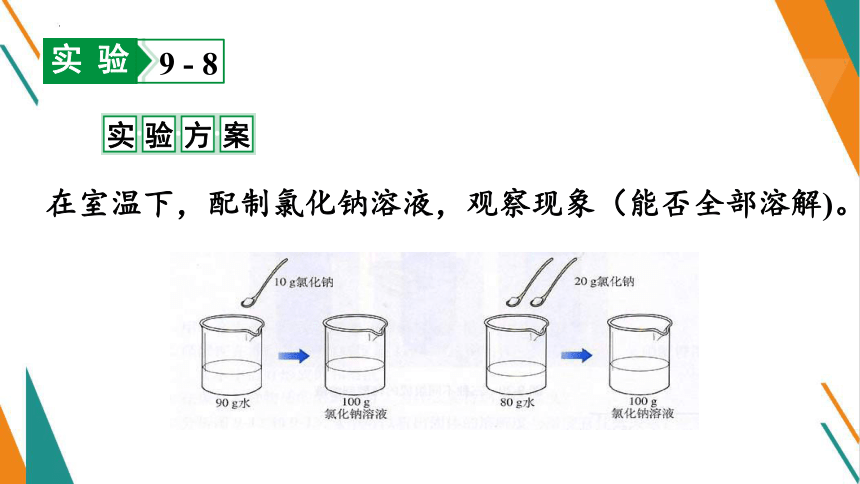
在室温下,配制氯化钠溶液,观察现象(能否全部溶解)。
实验
9 - 8
实验方案
两杯溶液都是无色透明。
实验现象
实验
9 - 8
怎样比较溶液的稀浓?
思考
分析实验结论
1
2
对于有色溶液,我们可以根据颜色深浅来判断溶液是浓还是稀;但是这种分法比较粗略,不能准确地表明一定量溶液里究竟含有多少溶质。
在实际应用中,常常要准确知道一定量溶液里含有多少溶质,即溶液的浓度(浓稀程度)。
100克水
100克水
A
B
稀
浓
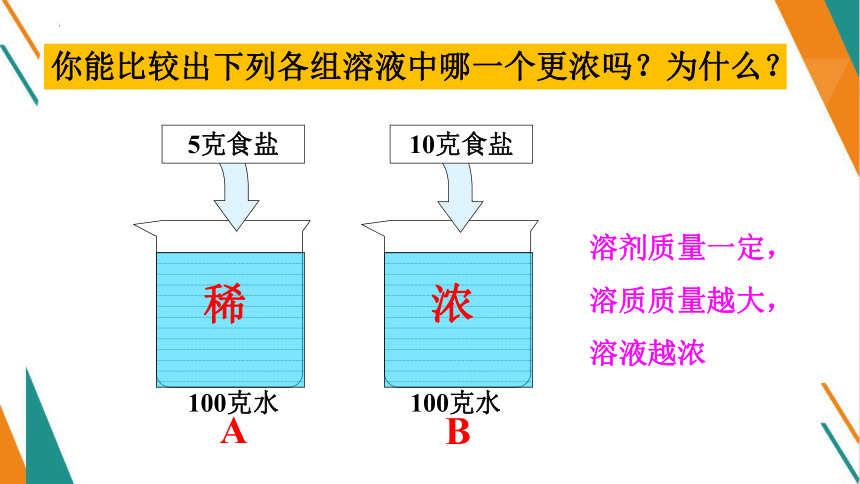
溶剂质量一定,
溶质质量越大,
溶液越浓
你能比较出下列各组溶液中哪一个更浓吗?为什么?
5克食盐
10克食盐
10克食盐
10克食盐
100克水
50克水
A
B
稀
浓
溶质质量一定,
溶剂质量越小,
溶液越浓
95克水
90克水
A
B
稀
浓
溶液质量一定,
溶质质量越大,
溶液越浓
5g+95g=100g
10g+90g=100g
10克食盐
5克食盐
81克水
40克水
A
B
稀
浓
溶质质量与溶液质量 之比越大 溶液越浓
19g+81g=100g
10g+40g=50g
10克食盐
19克食盐
“浓溶液”和“稀溶液”是由溶质和溶剂共同决定的,表示溶液里相对溶质的含量多少。
浓溶液
稀溶液
饱和溶液
不饱和溶液
一、溶液的浓度
溶质的质量分数
溶质的体积分数
一定量的溶液里所含溶质的量
1
定 义
2
表示方法
二、溶质的质量分数
溶质的质量与溶液的质量之比
1
定 义
2
公 式
×100%
=
溶液质量(g)
溶质质量(g)
溶质的质量分数
单位要统一
①溶质的质量分数一般用百分数表示。
②溶质的质量和溶液的质量单位必须统一。
③溶质的质量是指已经溶解了的溶物质质量,没有溶解的不算在内。
注意
%
×100
+
=
溶剂质量(g)
溶质质量(g)
溶质质量(g)
溶质质量=溶液质量×溶质的质量分数
溶液的质量=溶质的质量 + 溶剂的质量
=溶液的体积×溶液的密度
公式变形
试管 编号 溶液颜 色比较 溶 剂 质量/g 溶 质 质量/g 溶 液 质量/g 溶质质
量分数
1
2
3
浅
较深
深
20g
20g
20g
0.1g
0.5g
2g
20.1g
20.5g
22g
0.5%
2.4%
9.1%
在实验9-7中,三种硫酸铜溶液中溶质的质量分数各是多少?把计算结果填写在下表中。
动笔算算
10%
20%
溶质质量 溶剂质量 现 象 溶液中溶质质量分数
10g 90g
20g 80g
全部溶解
全部溶解
动笔算算
实验
9 - 8
某氯化钠溶液中溶质的质量分数为10%,其含义是什么?
表示100份质量的氯化钠溶液中含有10份质量的氯化钠,90份质量的水。
溶质质量 :溶剂质量 =
1:9
3
溶质质量分数的含义
讨
论
已知溶质和溶剂的量,求溶质的质量分数;
溶质质量分数计算
4
题型
1
在20℃时,将40g硝酸钾固体加入 100g水中,充分搅拌后,仍有8.4g硝酸钾固体 未溶解。请填写下列空白:
① 所得溶液是20℃时硝酸钾的 溶液;
(填“饱和”或“不饱”)
② 20℃时硝酸钾的溶解度为 ;
③ 所得溶液中硝酸钾的质量分数为 。
24%
31.6g
饱和
要配制一定量的溶质的质量分数一定的溶液,计算所需溶质和溶剂的量;
溶质质量
溶液质量
× 100%
溶质质量分数=
溶液质量 = 溶质质量 + 溶剂质量
计算依据 :
溶质质量分数计算
4
题型
2
在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
【解】
溶质的质量分数
溶质质量
溶液质量
100%
溶质质量
溶液质量
×溶质的质量分数
答: 配制150kg质量分数为16%的氯化钠溶液需24 kg氯化钠和126 kg水。
溶剂质量
溶液质量
溶质质量
—
150kg
16%
24kg
150kg
24kg
126kg
例题讲解
例题
1
练习1、20g10%的盐水中加入2g水,求所得溶液的溶质质量分数。若加入2g食盐呢?
练习2、 20g10%的盐水倒出一半,则剩余溶液的溶质质量分数为多少?
答案: 9.1% 18.2%
答案: 10%
20℃时,氯化钠的溶解度为36g,
(1)若将32g氯化钠溶于100g水里,所得溶液是 溶液,溶质质量分数为 。
(2)若将36g氯化钠溶于100g水里,所得溶液是 溶液,溶质质量分数为 。
(3)若将38g氯化钠溶于100g水里,所得溶液是 溶液,溶质质量分数为 。
思考: 从上面讨论中你能得出一定温度下饱和溶液中溶质质量分数吗?
饱和溶液的溶质质量分数=
溶解度
100g+溶解度
小 组 讨 论
100C时,NaCl的溶解度是36克。现有20克NaCl放入50克水,求:所得溶液的溶质质量分数
分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度 36 /(100+36)。
解:
x = 18g < 20g
则:溶质在溶液中的质量分数为:
100g
36g
=
50g
x
×100% ≈ 26.5%
18g
50g+18g
例题
2
一、溶质的质量分数
1、概念:溶质质量与溶液质量之比。
2、计算公式:
溶质质量
溶质质量+溶剂质量
溶质质量
溶液质量
溶质的质量分数
饱和溶液的溶质质量分数=
溶解度
100g+溶解度
小结
1、已知,20℃时,氯化钠的溶解度为36g。现分别取10g水,在20℃时按下表所示加入一定量的氯化钠进行实验,试填写下表:
编号 水的质量g 氯化钠的质量g 溶液的质量g 是否饱和 溶质的质量分数
1 10 2
2 10 3
3 10 4
4 10 5
2、下列几种硝酸钾溶液中溶质的质量分数最大的是( )
A.150g水溶解30g硝酸钾;
B.15g硝酸钾溶解在85g水中;
C.85g硝酸钾溶液中含有15g硝酸钾;
D.一定量的硝酸钾溶于80g水中制成100g硝酸钾溶液。
D
3、 50℃时,氯化铵的溶解度是50克,则50℃时,下列溶质质量分数的氯化铵溶液无法配制的是( )
A. 35% B. 30% C. 25% D. 20%
A
4、配制500mL质量分数为10%的氢氧化钠溶液(密度1.1g/cm3),需要氢氧化钠和水各多少克?
解:
需要NaOH的质量为:
550g× 10% =55g
需要水的质量为:
答:需要氢氧化钠和水的质量分别是55g和495g。
NaOH溶液的质量为:100mL×1.1g/cm3=550g
550g﹣55g=495g
课题3 溶液的浓度
第九单元 溶 液
人教版九年级化学下册
半勺糖
两勺糖
两杯糖水的甜度是否相同?你觉得哪杯糖水较浓、哪杯较稀?
在两杯等量的水中分别加入1勺糖和2勺糖,搅拌后完全溶解。
思考
试管、滴管
实验
9 - 7
实验药品
水20mL、硫酸铜
实验仪器
实验目的
探究硫酸铜溶液浓度的表示
实验方案
在相同体积的溶剂中溶解不同质量的硫酸铜固体,观察现象。
在三支试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。比较三种溶液的颜色。
淡蓝 蓝色 深蓝
实验
9 - 7
实验步骤
实验现象
实验结论
硫酸铜固体都溶解,浓度越大颜色越深。
在室温下,配制氯化钠溶液,观察现象(能否全部溶解)。
实验
9 - 8
实验方案
两杯溶液都是无色透明。
实验现象
实验
9 - 8
怎样比较溶液的稀浓?
思考
分析实验结论
1
2
对于有色溶液,我们可以根据颜色深浅来判断溶液是浓还是稀;但是这种分法比较粗略,不能准确地表明一定量溶液里究竟含有多少溶质。
在实际应用中,常常要准确知道一定量溶液里含有多少溶质,即溶液的浓度(浓稀程度)。
100克水
100克水
A
B
稀
浓
溶剂质量一定,
溶质质量越大,
溶液越浓
你能比较出下列各组溶液中哪一个更浓吗?为什么?
5克食盐
10克食盐
10克食盐
10克食盐
100克水
50克水
A
B
稀
浓
溶质质量一定,
溶剂质量越小,
溶液越浓
95克水
90克水
A
B
稀
浓
溶液质量一定,
溶质质量越大,
溶液越浓
5g+95g=100g
10g+90g=100g
10克食盐
5克食盐
81克水
40克水
A
B
稀
浓
溶质质量与溶液质量 之比越大 溶液越浓
19g+81g=100g
10g+40g=50g
10克食盐
19克食盐
“浓溶液”和“稀溶液”是由溶质和溶剂共同决定的,表示溶液里相对溶质的含量多少。
浓溶液
稀溶液
饱和溶液
不饱和溶液
一、溶液的浓度
溶质的质量分数
溶质的体积分数
一定量的溶液里所含溶质的量
1
定 义
2
表示方法
二、溶质的质量分数
溶质的质量与溶液的质量之比
1
定 义
2
公 式
×100%
=
溶液质量(g)
溶质质量(g)
溶质的质量分数
单位要统一
①溶质的质量分数一般用百分数表示。
②溶质的质量和溶液的质量单位必须统一。
③溶质的质量是指已经溶解了的溶物质质量,没有溶解的不算在内。
注意
%
×100
+
=
溶剂质量(g)
溶质质量(g)
溶质质量(g)
溶质质量=溶液质量×溶质的质量分数
溶液的质量=溶质的质量 + 溶剂的质量
=溶液的体积×溶液的密度
公式变形
试管 编号 溶液颜 色比较 溶 剂 质量/g 溶 质 质量/g 溶 液 质量/g 溶质质
量分数
1
2
3
浅
较深
深
20g
20g
20g
0.1g
0.5g
2g
20.1g
20.5g
22g
0.5%
2.4%
9.1%
在实验9-7中,三种硫酸铜溶液中溶质的质量分数各是多少?把计算结果填写在下表中。
动笔算算
10%
20%
溶质质量 溶剂质量 现 象 溶液中溶质质量分数
10g 90g
20g 80g
全部溶解
全部溶解
动笔算算
实验
9 - 8
某氯化钠溶液中溶质的质量分数为10%,其含义是什么?
表示100份质量的氯化钠溶液中含有10份质量的氯化钠,90份质量的水。
溶质质量 :溶剂质量 =
1:9
3
溶质质量分数的含义
讨
论
已知溶质和溶剂的量,求溶质的质量分数;
溶质质量分数计算
4
题型
1
在20℃时,将40g硝酸钾固体加入 100g水中,充分搅拌后,仍有8.4g硝酸钾固体 未溶解。请填写下列空白:
① 所得溶液是20℃时硝酸钾的 溶液;
(填“饱和”或“不饱”)
② 20℃时硝酸钾的溶解度为 ;
③ 所得溶液中硝酸钾的质量分数为 。
24%
31.6g
饱和
要配制一定量的溶质的质量分数一定的溶液,计算所需溶质和溶剂的量;
溶质质量
溶液质量
× 100%
溶质质量分数=
溶液质量 = 溶质质量 + 溶剂质量
计算依据 :
溶质质量分数计算
4
题型
2
在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
【解】
溶质的质量分数
溶质质量
溶液质量
100%
溶质质量
溶液质量
×溶质的质量分数
答: 配制150kg质量分数为16%的氯化钠溶液需24 kg氯化钠和126 kg水。
溶剂质量
溶液质量
溶质质量
—
150kg
16%
24kg
150kg
24kg
126kg
例题讲解
例题
1
练习1、20g10%的盐水中加入2g水,求所得溶液的溶质质量分数。若加入2g食盐呢?
练习2、 20g10%的盐水倒出一半,则剩余溶液的溶质质量分数为多少?
答案: 9.1% 18.2%
答案: 10%
20℃时,氯化钠的溶解度为36g,
(1)若将32g氯化钠溶于100g水里,所得溶液是 溶液,溶质质量分数为 。
(2)若将36g氯化钠溶于100g水里,所得溶液是 溶液,溶质质量分数为 。
(3)若将38g氯化钠溶于100g水里,所得溶液是 溶液,溶质质量分数为 。
思考: 从上面讨论中你能得出一定温度下饱和溶液中溶质质量分数吗?
饱和溶液的溶质质量分数=
溶解度
100g+溶解度
小 组 讨 论
100C时,NaCl的溶解度是36克。现有20克NaCl放入50克水,求:所得溶液的溶质质量分数
分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度 36 /(100+36)。
解:
x = 18g < 20g
则:溶质在溶液中的质量分数为:
100g
36g
=
50g
x
×100% ≈ 26.5%
18g
50g+18g
例题
2
一、溶质的质量分数
1、概念:溶质质量与溶液质量之比。
2、计算公式:
溶质质量
溶质质量+溶剂质量
溶质质量
溶液质量
溶质的质量分数
饱和溶液的溶质质量分数=
溶解度
100g+溶解度
小结
1、已知,20℃时,氯化钠的溶解度为36g。现分别取10g水,在20℃时按下表所示加入一定量的氯化钠进行实验,试填写下表:
编号 水的质量g 氯化钠的质量g 溶液的质量g 是否饱和 溶质的质量分数
1 10 2
2 10 3
3 10 4
4 10 5
2、下列几种硝酸钾溶液中溶质的质量分数最大的是( )
A.150g水溶解30g硝酸钾;
B.15g硝酸钾溶解在85g水中;
C.85g硝酸钾溶液中含有15g硝酸钾;
D.一定量的硝酸钾溶于80g水中制成100g硝酸钾溶液。
D
3、 50℃时,氯化铵的溶解度是50克,则50℃时,下列溶质质量分数的氯化铵溶液无法配制的是( )
A. 35% B. 30% C. 25% D. 20%
A
4、配制500mL质量分数为10%的氢氧化钠溶液(密度1.1g/cm3),需要氢氧化钠和水各多少克?
解:
需要NaOH的质量为:
550g× 10% =55g
需要水的质量为:
答:需要氢氧化钠和水的质量分别是55g和495g。
NaOH溶液的质量为:100mL×1.1g/cm3=550g
550g﹣55g=495g
同课章节目录
