11.1.1 生活中常见的盐(第1课时)-【教学新思维】2023-2024学年九年级化学下册同步讲透教材优选课件(人教版)
文档属性
| 名称 | 11.1.1 生活中常见的盐(第1课时)-【教学新思维】2023-2024学年九年级化学下册同步讲透教材优选课件(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-24 22:01:01 | ||
图片预览





文档简介
(共28张PPT)
课题1 生活中常见的盐
人教版九年级化学下册
第十一单元 盐 化肥
第1课时
知道氯化钠、碳酸钠、碳酸氢钠、碳酸钙的性质及主要用途;
学会鉴定碳酸根离子或碳酸氢根离子的方法;
掌握盐的化学性质,以及物质分类的方法。
1
2
3
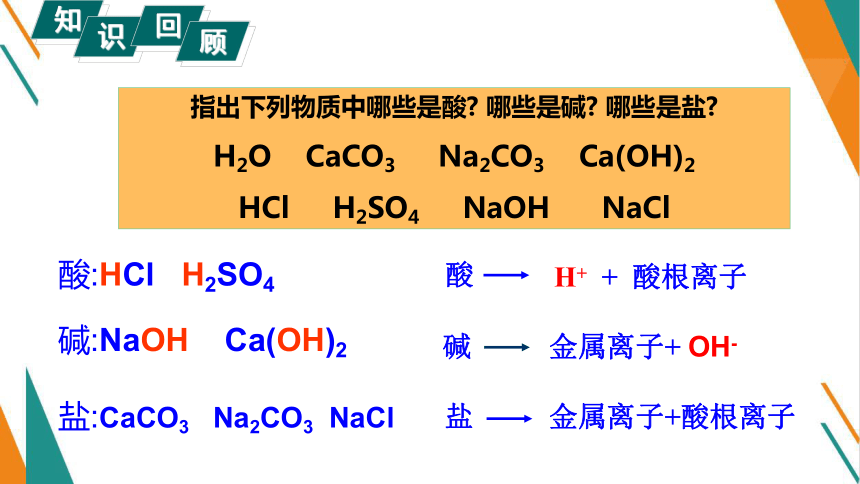
指出下列物质中哪些是酸 哪些是碱 哪些是盐
H2O CaCO3 Na2CO3 Ca(OH)2
HCl H2SO4 NaOH NaCl
酸:HCl H2SO4
碱:NaOH Ca(OH)2
盐:CaCO3 Na2CO3 NaCl
酸
H+ + 酸根离子
碱
金属离子+ OH-
盐
金属离子+酸根离子
知
识
回
顾
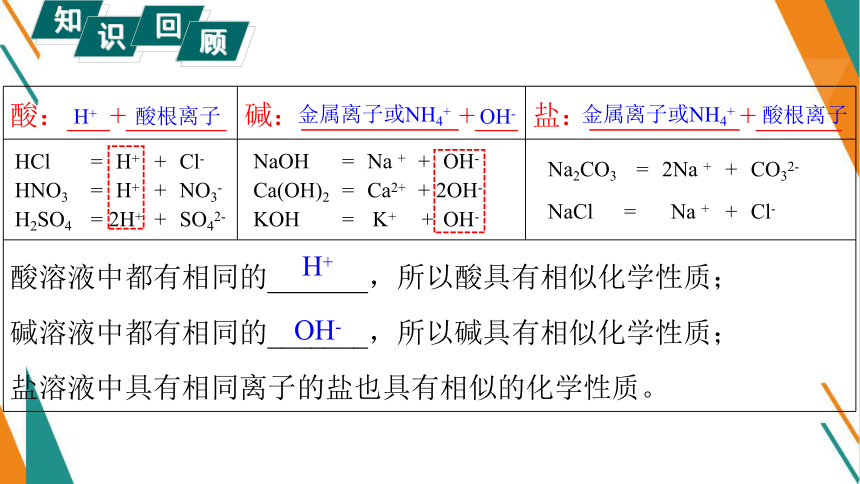
酸:___+_______ 碱: +___ 盐: +______
酸溶液中都有相同的_______,所以酸具有相似化学性质; 碱溶液中都有相同的_______,所以碱具有相似化学性质; 盐溶液中具有相同离子的盐也具有相似的化学性质。 OH-
金属离子或NH4+
酸根离子
H+
H+
OH-
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
KOH = K+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
NaOH = Na + + OH-
金属离子或NH4+
酸根离子
Na2CO3 = 2Na + + CO32-
NaCl = Na + + Cl-
知
识
回
顾
,
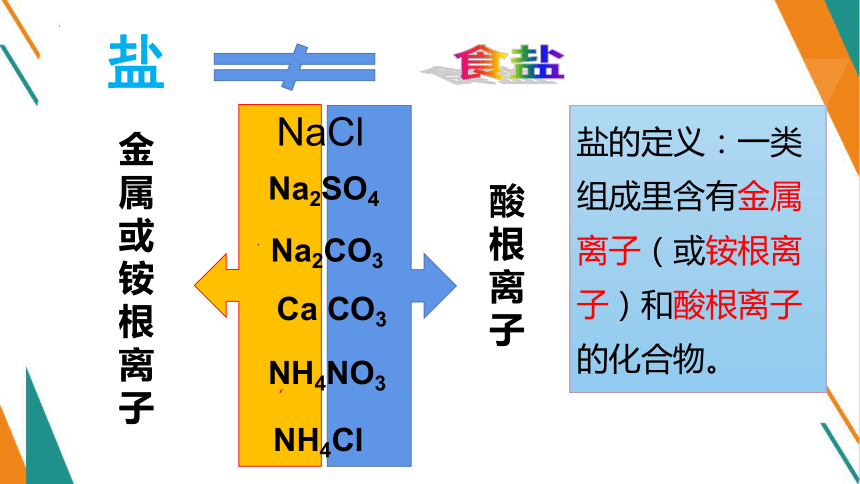
盐
Ca CO3
NaCl
NH4Cl
NH4NO3
Na2CO3
Na2SO4
金属或铵根离子
酸根离子
盐的定义:一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
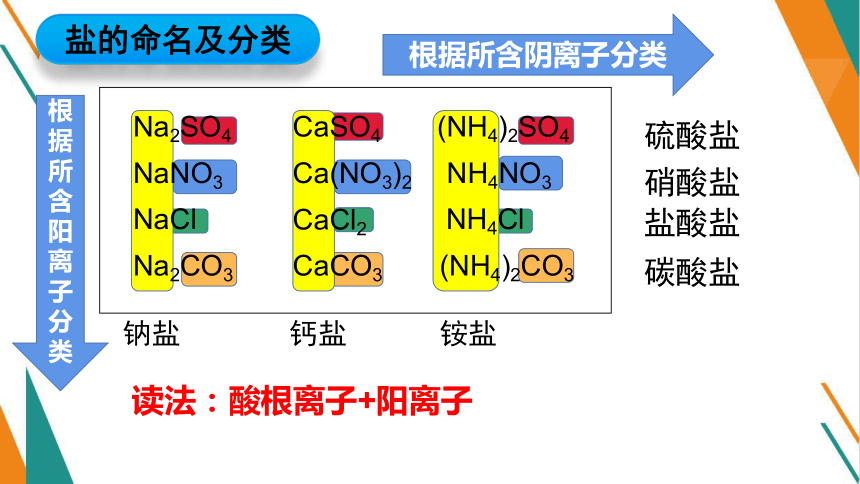
Na2SO4
NaNO3
NaCl
Na2CO3
CaSO4
Ca(NO3)2
CaCl2
CaCO3
(NH4)2SO4
NH4NO3
NH4Cl
(NH4)2CO3
钠盐
钙盐
铵盐
硫酸盐
硝酸盐
碳酸盐
盐酸盐
根据所含阴离子分类
根据所含阳离子分类
读法:酸根离子+阳离子
盐的命名及分类
请根据生活经验,描述食盐的组成和物理性质。
2. 物理性质:白色颗粒,微有咸味,易潮解,易溶于水
1. 组成:主要成分是NaCl
一、氯化钠
2. 物理性质:白色结晶,微有咸味,易潮解,易溶于水
1. 组成:由Na+、Cl-构成
3. 用途:调味品,配制生理盐水,农业选种,工业原料,腌食品,消积雪
4. 来源:
请根据给出的信息,分析为什么亚硝酸钠会被误作食盐用于
烹调而引起中毒事件。
亚硝酸钠,化学式NaNO2,白色结晶性粉末,有咸味,易潮解,易溶于水(其水溶液呈碱性,其pH约为9),微溶于乙醇,食用0.2~0.5g引起食物中毒,3g可致死。
怎样鉴别食盐和亚硝酸钠?
1.酸碱指示剂
2.测pH
粗盐制取
海水
盐井水
盐湖水
粗盐
初步提纯的精盐
溶解
沉淀
过滤
蒸发
结晶
煮沸
粗盐提纯
晾晒
1.含泥沙等不溶性杂质
2.含MgCl2、CaCl2等可溶性杂质
粗盐提纯
粗盐的初步提纯:粗盐中难溶性杂质的去除
实验药品
1
仪器:烧杯、玻璃棒、铁架台(带铁圈)、漏斗、滤纸、蒸发皿、酒精灯、药匙、量筒、托盘天平(带砝码)、坩埚钳、火柴。
药品:蒸馏水、粗盐。
(1)称量
(2)溶解:加水溶解,并用玻璃棒_____,作用是________。粗盐一次不宜
加得太多, 以免不能完全溶解。
(3)过滤(除去难溶性杂质):玻璃棒用于_____,若滤液浑浊应__________。
(4)蒸发
①加热过程中,用玻璃棒______,目的是____________________________
②当蒸发皿中出现__________时停止加热,利用余热把滤液蒸干。
(5)计算产率:用________把蒸发皿中的晶体转移到称量纸上称量。
搅拌
加速溶解
引流
重新过滤
搅拌
防止因局部温度过高,造成液滴飞溅
较多固体
玻璃棒
2
实验步骤
“一贴二低三靠”
二、碳酸钠、碳酸氢钠、碳酸钙
仿照氯化钠的说明书,请制作碳酸钠、碳酸氢钠、碳酸钙的说明书。
提示:通过阅读课本,完成相应的物理性质(化学式、俗称、颜色、状态、溶解性)及用途
物质 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3) 碳酸钙(CaCO3)
俗称 /
物理性质
用途
二、碳酸钠、碳酸氢钠和碳酸钙
纯碱、苏打
小苏打
白色粉末状固体,易溶于水
白色晶体,能溶于水
白色固体,难溶于水
重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产等
焙制糕点所用的发酵粉的主要成分之一,医疗上用于治疗胃酸过多症
用作补钙剂、建筑材料,用于实验室制取二氧化碳
侯德榜制碱法
物理性质
1
碳酸钠和碳酸氢钠显碱性
总结:盐在水溶液中大部分成中性,但碳酸钠和碳酸氢钠溶于水后显碱性。
思考
既然碳酸钠是盐,为什么叫纯碱呢?
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥工业所做的贡献。
我国制碱工业的先驱——侯德榜
请书写出实验室制取CO2的方程式。
CaCO3 + 2 HCl CaCl2 + CO2↑+H2O
讨论
比较碳酸钠与碳酸氢钠的组成,推断碳酸钠与碳酸氢钠是否也能发生上述类似的反应。
知
识
回
顾
(1)、碳酸钠和碳酸氢钠与酸的反应
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现 象 分 析 你能写出上述有关反应的化学方程式吗?
白色固体溶解,有大量气泡产生,澄清石灰水变浑浊
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
实验
11 - 1
2
化学性质
H2O + CO2 ↑
① Na2CO3 + 2HCl = 2NaCl +
请同学们写出上述反应的化学方程式:
② NaHCO3 + HCl = NaCl +
H2O + CO2 ↑
综上所述:含有碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)的盐都能与盐酸反应,产生CO2 气体。
③ CaCO3+ 2HCl = CaCl2 + CO2 ↑ + H2O
实验室制取二氧化碳:
碳酸根或碳酸氢根离子检验方法:
某物质
+稀盐酸
产生气体
变浑浊
CO2
CaCO3
(含碳酸根或碳酸氢根离子)
+澄清石灰水
归纳
碳酸根离子和碳酸氢根离子的检验方法
(1)检验试剂:稀盐酸和澄清石灰水
(2)检验方法:取盐的样品少量于试管中,滴加稀盐酸,若有气泡产生,将生成的气体通入澄清的石灰水,若石灰水变浑浊,则证明原盐的样品中含有CO32- (或 H CO3- )。
碳酸氢钠受热分解:
澄清石灰水变浑浊
不稳定性
如何鉴别碳酸钠或碳酸氢钠:
方法:加热固体,将产生的气体通入澄清石灰水。
向盛有少量Na2CO3溶液的试管滴入澄清的石灰水,观察现象。
现象
化学方程式
溶液产生白色沉淀
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
(2)、碳酸钠与碱的反应
实验
11 - 2
1、盛夏跑步后,很多同学穿的衣服变干了后会出现一些细小的白色粉末,主要成分是( B)
A.石灰石 B.氯化钠
C.油脂 D.烧碱
B
2、氯化钠是一种重要的化工原料。下列说法不.正.确.的是( C)
A.氯化钠俗称食盐
B.氯化钠中钠元素的化合价为+1
C.氯化钠可以治疗胃酸过多症
D.生理盐水是0.9%的氯化钠溶液
C
3.食盐(NaCl)是我们生活中的必需品。下列关于氯化钠的说法错.误.的是( C )
A.海水晒盐:采用盐田法从海水中提取食盐的基本原理是蒸发结晶
B.粗盐提纯:可用溶解、过滤、蒸发结晶的方法,除去粗盐中的泥沙
C.配制溶液:氯化钠易溶于水,其水溶液中存在水分子和氯化钠分子
D.餐桌饮食:氯化钠常用于调味、腌渍食品,可以延长食物保质期
C
4、发明联合制碱法,为纯碱工业发展作出杰出贡献的是( )
A.张青莲 B.侯德榜
C.拉瓦锡 D.道尔顿
5、蒸馒头、炸油条时常用到一种白色物质,它既能中和面粉发酵过程产生的酸,也能起发泡作用,这种白色物质是( )
A.NaOH B.Ca(OH)2
C.NaHCO3 D.NaCl
B
C
6、下列说法正确的是( )
A.用NaOH溶液除去餐具、衣物上的油污
B.用Na2CO3溶液除去热水瓶、烧水壶内壁的水垢
C.用NaHCO3治疗胃酸过多症
D.用CaCO3既可做食品防腐剂,也可用作建筑材料
C
课题1 生活中常见的盐
人教版九年级化学下册
第十一单元 盐 化肥
第1课时
知道氯化钠、碳酸钠、碳酸氢钠、碳酸钙的性质及主要用途;
学会鉴定碳酸根离子或碳酸氢根离子的方法;
掌握盐的化学性质,以及物质分类的方法。
1
2
3
指出下列物质中哪些是酸 哪些是碱 哪些是盐
H2O CaCO3 Na2CO3 Ca(OH)2
HCl H2SO4 NaOH NaCl
酸:HCl H2SO4
碱:NaOH Ca(OH)2
盐:CaCO3 Na2CO3 NaCl
酸
H+ + 酸根离子
碱
金属离子+ OH-
盐
金属离子+酸根离子
知
识
回
顾
酸:___+_______ 碱: +___ 盐: +______
酸溶液中都有相同的_______,所以酸具有相似化学性质; 碱溶液中都有相同的_______,所以碱具有相似化学性质; 盐溶液中具有相同离子的盐也具有相似的化学性质。 OH-
金属离子或NH4+
酸根离子
H+
H+
OH-
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
KOH = K+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
NaOH = Na + + OH-
金属离子或NH4+
酸根离子
Na2CO3 = 2Na + + CO32-
NaCl = Na + + Cl-
知
识
回
顾
,
盐
Ca CO3
NaCl
NH4Cl
NH4NO3
Na2CO3
Na2SO4
金属或铵根离子
酸根离子
盐的定义:一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
Na2SO4
NaNO3
NaCl
Na2CO3
CaSO4
Ca(NO3)2
CaCl2
CaCO3
(NH4)2SO4
NH4NO3
NH4Cl
(NH4)2CO3
钠盐
钙盐
铵盐
硫酸盐
硝酸盐
碳酸盐
盐酸盐
根据所含阴离子分类
根据所含阳离子分类
读法:酸根离子+阳离子
盐的命名及分类
请根据生活经验,描述食盐的组成和物理性质。
2. 物理性质:白色颗粒,微有咸味,易潮解,易溶于水
1. 组成:主要成分是NaCl
一、氯化钠
2. 物理性质:白色结晶,微有咸味,易潮解,易溶于水
1. 组成:由Na+、Cl-构成
3. 用途:调味品,配制生理盐水,农业选种,工业原料,腌食品,消积雪
4. 来源:
请根据给出的信息,分析为什么亚硝酸钠会被误作食盐用于
烹调而引起中毒事件。
亚硝酸钠,化学式NaNO2,白色结晶性粉末,有咸味,易潮解,易溶于水(其水溶液呈碱性,其pH约为9),微溶于乙醇,食用0.2~0.5g引起食物中毒,3g可致死。
怎样鉴别食盐和亚硝酸钠?
1.酸碱指示剂
2.测pH
粗盐制取
海水
盐井水
盐湖水
粗盐
初步提纯的精盐
溶解
沉淀
过滤
蒸发
结晶
煮沸
粗盐提纯
晾晒
1.含泥沙等不溶性杂质
2.含MgCl2、CaCl2等可溶性杂质
粗盐提纯
粗盐的初步提纯:粗盐中难溶性杂质的去除
实验药品
1
仪器:烧杯、玻璃棒、铁架台(带铁圈)、漏斗、滤纸、蒸发皿、酒精灯、药匙、量筒、托盘天平(带砝码)、坩埚钳、火柴。
药品:蒸馏水、粗盐。
(1)称量
(2)溶解:加水溶解,并用玻璃棒_____,作用是________。粗盐一次不宜
加得太多, 以免不能完全溶解。
(3)过滤(除去难溶性杂质):玻璃棒用于_____,若滤液浑浊应__________。
(4)蒸发
①加热过程中,用玻璃棒______,目的是____________________________
②当蒸发皿中出现__________时停止加热,利用余热把滤液蒸干。
(5)计算产率:用________把蒸发皿中的晶体转移到称量纸上称量。
搅拌
加速溶解
引流
重新过滤
搅拌
防止因局部温度过高,造成液滴飞溅
较多固体
玻璃棒
2
实验步骤
“一贴二低三靠”
二、碳酸钠、碳酸氢钠、碳酸钙
仿照氯化钠的说明书,请制作碳酸钠、碳酸氢钠、碳酸钙的说明书。
提示:通过阅读课本,完成相应的物理性质(化学式、俗称、颜色、状态、溶解性)及用途
物质 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3) 碳酸钙(CaCO3)
俗称 /
物理性质
用途
二、碳酸钠、碳酸氢钠和碳酸钙
纯碱、苏打
小苏打
白色粉末状固体,易溶于水
白色晶体,能溶于水
白色固体,难溶于水
重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产等
焙制糕点所用的发酵粉的主要成分之一,医疗上用于治疗胃酸过多症
用作补钙剂、建筑材料,用于实验室制取二氧化碳
侯德榜制碱法
物理性质
1
碳酸钠和碳酸氢钠显碱性
总结:盐在水溶液中大部分成中性,但碳酸钠和碳酸氢钠溶于水后显碱性。
思考
既然碳酸钠是盐,为什么叫纯碱呢?
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥工业所做的贡献。
我国制碱工业的先驱——侯德榜
请书写出实验室制取CO2的方程式。
CaCO3 + 2 HCl CaCl2 + CO2↑+H2O
讨论
比较碳酸钠与碳酸氢钠的组成,推断碳酸钠与碳酸氢钠是否也能发生上述类似的反应。
知
识
回
顾
(1)、碳酸钠和碳酸氢钠与酸的反应
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现 象 分 析 你能写出上述有关反应的化学方程式吗?
白色固体溶解,有大量气泡产生,澄清石灰水变浑浊
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
实验
11 - 1
2
化学性质
H2O + CO2 ↑
① Na2CO3 + 2HCl = 2NaCl +
请同学们写出上述反应的化学方程式:
② NaHCO3 + HCl = NaCl +
H2O + CO2 ↑
综上所述:含有碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)的盐都能与盐酸反应,产生CO2 气体。
③ CaCO3+ 2HCl = CaCl2 + CO2 ↑ + H2O
实验室制取二氧化碳:
碳酸根或碳酸氢根离子检验方法:
某物质
+稀盐酸
产生气体
变浑浊
CO2
CaCO3
(含碳酸根或碳酸氢根离子)
+澄清石灰水
归纳
碳酸根离子和碳酸氢根离子的检验方法
(1)检验试剂:稀盐酸和澄清石灰水
(2)检验方法:取盐的样品少量于试管中,滴加稀盐酸,若有气泡产生,将生成的气体通入澄清的石灰水,若石灰水变浑浊,则证明原盐的样品中含有CO32- (或 H CO3- )。
碳酸氢钠受热分解:
澄清石灰水变浑浊
不稳定性
如何鉴别碳酸钠或碳酸氢钠:
方法:加热固体,将产生的气体通入澄清石灰水。
向盛有少量Na2CO3溶液的试管滴入澄清的石灰水,观察现象。
现象
化学方程式
溶液产生白色沉淀
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
(2)、碳酸钠与碱的反应
实验
11 - 2
1、盛夏跑步后,很多同学穿的衣服变干了后会出现一些细小的白色粉末,主要成分是( B)
A.石灰石 B.氯化钠
C.油脂 D.烧碱
B
2、氯化钠是一种重要的化工原料。下列说法不.正.确.的是( C)
A.氯化钠俗称食盐
B.氯化钠中钠元素的化合价为+1
C.氯化钠可以治疗胃酸过多症
D.生理盐水是0.9%的氯化钠溶液
C
3.食盐(NaCl)是我们生活中的必需品。下列关于氯化钠的说法错.误.的是( C )
A.海水晒盐:采用盐田法从海水中提取食盐的基本原理是蒸发结晶
B.粗盐提纯:可用溶解、过滤、蒸发结晶的方法,除去粗盐中的泥沙
C.配制溶液:氯化钠易溶于水,其水溶液中存在水分子和氯化钠分子
D.餐桌饮食:氯化钠常用于调味、腌渍食品,可以延长食物保质期
C
4、发明联合制碱法,为纯碱工业发展作出杰出贡献的是( )
A.张青莲 B.侯德榜
C.拉瓦锡 D.道尔顿
5、蒸馒头、炸油条时常用到一种白色物质,它既能中和面粉发酵过程产生的酸,也能起发泡作用,这种白色物质是( )
A.NaOH B.Ca(OH)2
C.NaHCO3 D.NaCl
B
C
6、下列说法正确的是( )
A.用NaOH溶液除去餐具、衣物上的油污
B.用Na2CO3溶液除去热水瓶、烧水壶内壁的水垢
C.用NaHCO3治疗胃酸过多症
D.用CaCO3既可做食品防腐剂,也可用作建筑材料
C
同课章节目录
