第八单元课题2 金属的化学性质课件(共24张PPT内嵌视频)-2023-2024学年九年级化学人教版下册
文档属性
| 名称 | 第八单元课题2 金属的化学性质课件(共24张PPT内嵌视频)-2023-2024学年九年级化学人教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 17.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-26 21:29:02 | ||
图片预览








文档简介
(共24张PPT)
第八单元 金属和金属材料
课题二 金属的化学性质
黄金饰品中的假货常常鱼目混珠,社会上有些不法分子时常以黄铜冒充黄金进行诈骗活动.因为黄铜(铜、锌合金)单纯从颜色、外形上看,与黄金极为相似,所以很难区分,我们可以通过哪些方法来鉴别真假黄金呢?
回忆一下,哪些金属能和氧气反应?
1.镁常温与氧气反应:银白色镁表面会逐渐变暗,生成白色固体
2.铝常温与氧气反应:银白色铝表面会逐渐变暗,生成一层致密的薄膜
3.铁在氧气中点燃时才能与氧气反应:剧烈燃烧,火星四射,放出热量,生成黑色固体
4.铜在加热时能与氧气反应:紫红色的铜表面逐渐变成黑色
5.金高温也不与氧气反应(真金不怕火炼)
综合上述信息可知:
1.大多数金属都能与氧气反应,生成金属氧化物。
注意:反应的难易程度作为判断金属活动性依据之一。
2.金属的活泼性:说明Mg、Al较活泼,Fe、Cu次之,Au很不活泼。
1)铝比铁更容易与氧气反应,但我们很少见生活中的铝制品生锈,这是怎么回事呢?
铝性质活泼,常温下能与氧气反应,形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。
2)为何不宜用钢刷来擦洗铝制餐具呢?
若用钢刷擦洗铝制品,容易把氧化薄膜除掉,从而起不到保护作用。
回忆实验室制H2 反应的方程式:
以上是否说明:金属都能与酸反应呢?
金属与酸的反应探究:
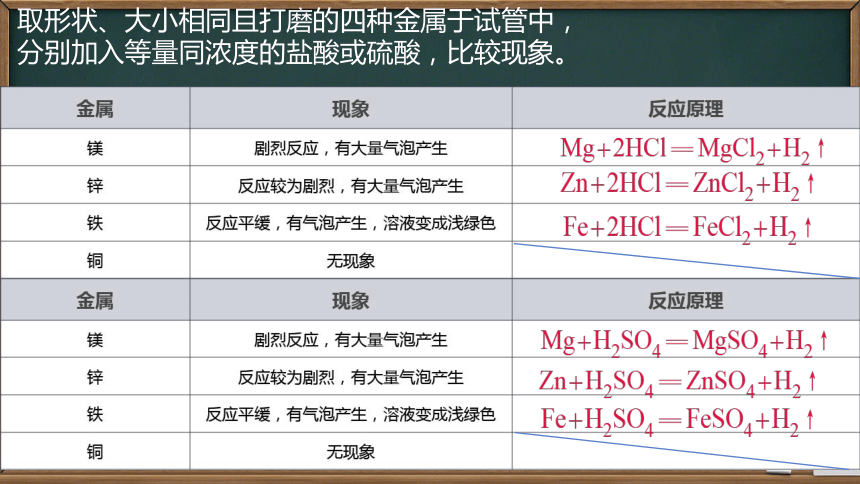
取形状、大小相同且打磨的四种金属于试管中,
分别加入等量同浓度的盐酸或硫酸,比较现象。
我得意的笑,又得意的笑…
无所谓, 我无所谓…
为什么受伤的总是我!
Help!
help!
1、能与盐酸,稀硫酸反应的金属是 ;
2、不能与盐酸,稀硫酸反应的金属是 ;
3、根据金属与酸反应的剧烈程度,推断镁、锌、铁、铜四种金属的活动性顺序是 > > > .
Mg、Zn、Fe
Cu
Mg Zn Fe Cu
结论:
1、金属与稀盐酸、稀硫酸反应
2、金属与酸反应的剧烈程度作为判断金属活动性依据之二;
金属与化合物的反应
铝丝表面覆盖一层红色的固体,溶液由蓝色变为无色
铜丝表面覆盖一层银白色的固体,溶液由无色变为蓝色
无明显现象
1、金属能与盐(金属化合物)溶液反应:
2、金属能否与盐(金属化合物)溶液反应,作为判断金属活动性依据之三;
湿法炼铜
曾青得铁而为铜
金属活动性依次减弱
1、金属的位置越靠前,它的活动性就越强
2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢
3、位于前面的金属能把位于后面的金属从它们盐(化合物)溶液里置换出来(K、Ca、Na除外)
金属的化学性质:
条件:金属活动性排在H之前
条件:
1、金属活动性强于盐中所含金属活动性;
2、该盐应可溶;
分析与思考:
从物质分类的角度观察并分析上面几个反应的共同特征是什么?
单质
化合物
化合物
单质
置换反应
置换反应的特点及规律:
1、特点:A+BC==AC+B
2、类型:氢前金属+酸
金属+盐溶液
H2/C还原反应
练习
1、镁与稀硫酸
2、铝与稀盐酸
3、实验室制氢气
4、铁与稀盐酸
5、镁与硝酸铜溶液
6、铝与硫酸铜溶液
7、湿法炼铜
8、铜与硝酸银溶液
9、银与硫酸亚铁溶液
1、“两金夹一液 ” 2、“两液夹一金”
滤液滤渣分析
1、一种金属放在多种金属盐溶液的混合溶液中
2、多种金属放在同一种金属盐溶液中
距离越远越先反应
3、滤渣中有红色固体则有Cu,滤渣能被磁铁吸引则有Fe,滤渣滴加盐酸冒气泡则有氢前金属
4、滤液为蓝色则有Cu2+、为浅绿色则有Fe2+
1.将一定量的锌粉加入到含有Cu(NO3)2溶液中,充分反应后过滤,则滤渣 滤液
2.将一定量的锌粉加入到含有Cu(NO3)2溶液中,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生。则滤渣中一定有,滤液中一定有?
3.将一定量的铁粉加入到含有Cu(NO3)2和AgNO3的废液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。下列判断正确的是( )
A.滤渣中一定含有Ag和Cu,滤液中一定含有Fe(NO3)2
B.滤渣中一定不含Fe,滤液中一定含有Fe(NO3)2和Cu(NO3)2
C.滤渣中一定含有Ag,滤液中可能含有Cu(NO3)2和AgNO3
D.滤渣中一定含有Ag和Cu,滤液中可能含有Cu(NO3)2和AgNO3
金属质量*金属化合价
——————————
金属相对原子质量
金属与酸反应
1、氢前金属与酸反应后溶液质量增加
2、
氢气质量=
第八单元 金属和金属材料
课题二 金属的化学性质
黄金饰品中的假货常常鱼目混珠,社会上有些不法分子时常以黄铜冒充黄金进行诈骗活动.因为黄铜(铜、锌合金)单纯从颜色、外形上看,与黄金极为相似,所以很难区分,我们可以通过哪些方法来鉴别真假黄金呢?
回忆一下,哪些金属能和氧气反应?
1.镁常温与氧气反应:银白色镁表面会逐渐变暗,生成白色固体
2.铝常温与氧气反应:银白色铝表面会逐渐变暗,生成一层致密的薄膜
3.铁在氧气中点燃时才能与氧气反应:剧烈燃烧,火星四射,放出热量,生成黑色固体
4.铜在加热时能与氧气反应:紫红色的铜表面逐渐变成黑色
5.金高温也不与氧气反应(真金不怕火炼)
综合上述信息可知:
1.大多数金属都能与氧气反应,生成金属氧化物。
注意:反应的难易程度作为判断金属活动性依据之一。
2.金属的活泼性:说明Mg、Al较活泼,Fe、Cu次之,Au很不活泼。
1)铝比铁更容易与氧气反应,但我们很少见生活中的铝制品生锈,这是怎么回事呢?
铝性质活泼,常温下能与氧气反应,形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。
2)为何不宜用钢刷来擦洗铝制餐具呢?
若用钢刷擦洗铝制品,容易把氧化薄膜除掉,从而起不到保护作用。
回忆实验室制H2 反应的方程式:
以上是否说明:金属都能与酸反应呢?
金属与酸的反应探究:
取形状、大小相同且打磨的四种金属于试管中,
分别加入等量同浓度的盐酸或硫酸,比较现象。
我得意的笑,又得意的笑…
无所谓, 我无所谓…
为什么受伤的总是我!
Help!
help!
1、能与盐酸,稀硫酸反应的金属是 ;
2、不能与盐酸,稀硫酸反应的金属是 ;
3、根据金属与酸反应的剧烈程度,推断镁、锌、铁、铜四种金属的活动性顺序是 > > > .
Mg、Zn、Fe
Cu
Mg Zn Fe Cu
结论:
1、金属与稀盐酸、稀硫酸反应
2、金属与酸反应的剧烈程度作为判断金属活动性依据之二;
金属与化合物的反应
铝丝表面覆盖一层红色的固体,溶液由蓝色变为无色
铜丝表面覆盖一层银白色的固体,溶液由无色变为蓝色
无明显现象
1、金属能与盐(金属化合物)溶液反应:
2、金属能否与盐(金属化合物)溶液反应,作为判断金属活动性依据之三;
湿法炼铜
曾青得铁而为铜
金属活动性依次减弱
1、金属的位置越靠前,它的活动性就越强
2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢
3、位于前面的金属能把位于后面的金属从它们盐(化合物)溶液里置换出来(K、Ca、Na除外)
金属的化学性质:
条件:金属活动性排在H之前
条件:
1、金属活动性强于盐中所含金属活动性;
2、该盐应可溶;
分析与思考:
从物质分类的角度观察并分析上面几个反应的共同特征是什么?
单质
化合物
化合物
单质
置换反应
置换反应的特点及规律:
1、特点:A+BC==AC+B
2、类型:氢前金属+酸
金属+盐溶液
H2/C还原反应
练习
1、镁与稀硫酸
2、铝与稀盐酸
3、实验室制氢气
4、铁与稀盐酸
5、镁与硝酸铜溶液
6、铝与硫酸铜溶液
7、湿法炼铜
8、铜与硝酸银溶液
9、银与硫酸亚铁溶液
1、“两金夹一液 ” 2、“两液夹一金”
滤液滤渣分析
1、一种金属放在多种金属盐溶液的混合溶液中
2、多种金属放在同一种金属盐溶液中
距离越远越先反应
3、滤渣中有红色固体则有Cu,滤渣能被磁铁吸引则有Fe,滤渣滴加盐酸冒气泡则有氢前金属
4、滤液为蓝色则有Cu2+、为浅绿色则有Fe2+
1.将一定量的锌粉加入到含有Cu(NO3)2溶液中,充分反应后过滤,则滤渣 滤液
2.将一定量的锌粉加入到含有Cu(NO3)2溶液中,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生。则滤渣中一定有,滤液中一定有?
3.将一定量的铁粉加入到含有Cu(NO3)2和AgNO3的废液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。下列判断正确的是( )
A.滤渣中一定含有Ag和Cu,滤液中一定含有Fe(NO3)2
B.滤渣中一定不含Fe,滤液中一定含有Fe(NO3)2和Cu(NO3)2
C.滤渣中一定含有Ag,滤液中可能含有Cu(NO3)2和AgNO3
D.滤渣中一定含有Ag和Cu,滤液中可能含有Cu(NO3)2和AgNO3
金属质量*金属化合价
——————————
金属相对原子质量
金属与酸反应
1、氢前金属与酸反应后溶液质量增加
2、
氢气质量=
同课章节目录
