第十一单元+盐化肥拓展课物质的分类与性质课件-2023—2024学年九年级化学人教版下册
文档属性
| 名称 | 第十一单元+盐化肥拓展课物质的分类与性质课件-2023—2024学年九年级化学人教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-26 00:00:00 | ||
图片预览








文档简介
(共29张PPT)
拓展课 物质的分类和性质
学习目标
能从组成上区分混合物、纯净物;单质、化合物;酸、碱、盐、氧化物。
了解金属单质、非金属单质、金属氧化物、非金属氧化物的常见化学性质,理解酸、碱、盐的组成与其化学性质之间的关系。
学习用分类的方法整理物质的组成与性质之间的关系,认识物质类别之间的反应规律,初步学会应用物质的反应规律预测物质的性质及制备。
请将以上试剂放回试剂柜。
硫酸盐
碱
碳酸盐
碳酸钙
CaCO3
硫酸钾
K2SO4
氢氧化钠
NaOH
物质
纯净物
混合物
Fe Cu
空气、合金、溶液等
单质
化合物
CaCO3 CuSO4
金属单质
非金属单质
稀有气体单质
O2 C
He
氧化物
金属氧化物
非金属氧化物
CuO CaO
H2O CO2
酸
碱
盐
H2SO4
NaOH
物质的分类
碳酸盐、硫酸盐等
钠盐、钾盐等
NaCl K2SO4
小结:各类物质的组成特点
元素组成特点 粒子构成特点 类别名称 代表物
1种,金属元素 原子 金属单质 Fe、Cu
1种,非金属元素 分子/原子 非金属单质 O2、C
2种 金属元素+氧元素 多数是离子 金属氧化物 CuO、CaO
2种 非金属元素+氧元素 分子 非金属氧化物 H2O、CO2
2种或以上 氢元素+酸根 水溶液中解离出 H+和酸根离子 酸 HCl、H2SO4
3种或以上 金属元素+氢氧根 水溶液中解离出 金属离子和OH- 碱 NaOH、Ca(OH)2
2种或以上 金属元素+酸根 水溶液中解离出 金属离子和酸根离子 盐 NaCl、CaCO3
现提供4种溶液,请选择一种代替硫酸钠溶液制备硫酸钡固体。
氯化钡溶液
BaCl2
硫酸钠溶液
Na2SO4
(用完)
碳酸钠溶液
Na2CO3
氢氧化钠溶液
NaOH
稀盐酸
HCl
硫酸钾溶液
K2SO4
BaCl2 + Na2SO4 = 2NaCl + BaSO4↓
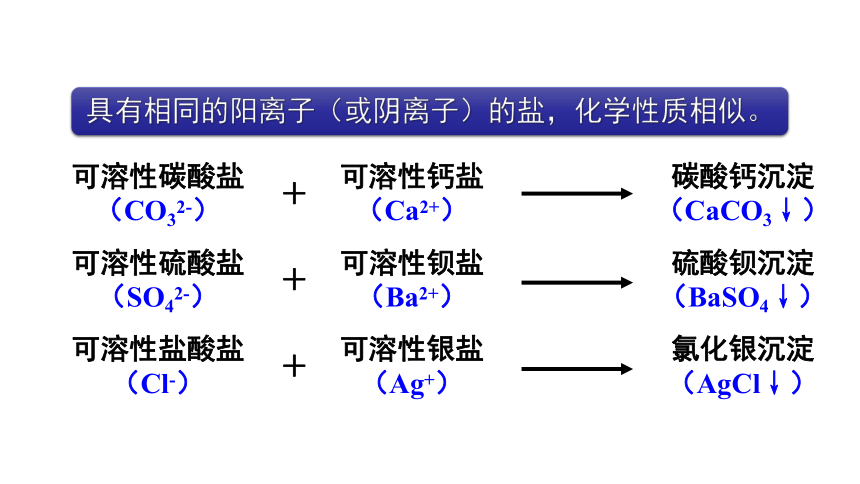
具有相同的阳离子(或阴离子)的盐,化学性质相似。
可溶性碳酸盐
(CO32-)
可溶性硫酸盐
(SO42-)
可溶性盐酸盐
(Cl-)
可溶性钙盐
(Ca2+)
可溶性钡盐
(Ba2+)
可溶性银盐
(Ag+)
+
+
+
碳酸钙沉淀
(CaCO3↓)
硫酸钡沉淀
(BaSO4↓)
氯化银沉淀
(AgCl↓)
金属单质
金属氧化物
非金属氧化物
碱
酸
盐
盐
盐和氢气
盐和水
碱和盐
酸和盐
盐和盐
盐和金属
各类物质的化学性质及转化关系
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3↑
红磷
铁
硫
木炭
镁
铜
金属+氧气 → 金属氧化物
非金属+氧气 → 非金属氧化物
金属氧化物+水 → 碱
非金属氧化物+水 → 酸
CO2+H2O=H2CO3
CaO+H2O=Ca(OH)2
金属单质
非金属单质
金属氧化物
非金属氧化物
碱
酸
盐
盐
盐和氢气
+O2
+O2
盐和水
碱和盐
酸和盐
盐和盐
+H2O
+H2O
盐和金属
各类物质的化学性质及转化关系
元素组成特点 粒子构成特点 类别名称 代表物 类别反应规律
1种,金属元素 原子 金属单质 Fe、Cu
1种,非金属元素 分子/原子 非金属单质 O2、C 2种 金属元素+氧元素 多数是离子 金属氧化物 CuO、CaO 2种 非金属元素+氧元素 分子 非金属氧化物 H2O、CO2 2种或以上 氢元素+酸根 水溶液中解离出 H+和酸根离子 酸 HCl、H2SO4 3种或以上 金属元素+氢氧根 水溶液中解离出 金属离子和OH- 碱 NaOH、Ca(OH)2 2种或以上 金属元素+酸根 水溶液中解离出 金属离子和酸根离子 盐 NaCl、CaCO3 (注意限定条件和特例)
物质分类和性质的应用
1.在某化学药品柜中发现一瓶标签模糊不清的溶液,这瓶溶液一定不是
A.H2SO4溶液
B.CuSO4溶液
C.Na2SO4溶液
D.FeSO4溶液
硫酸钾
硫酸铝
硫酸铵
硫酸盐
硫酸镁
硫酸镁
硫酸镁
硫酸铜
硫酸锌
酸
A
物质分类和性质的应用
2.下图为“领取奖杯游戏”的物质阶梯。当阶梯上相邻的物质之间能发生反应,方可向上攀登。例如,攀登阶梯甲能领取奖杯。
(1) 搭建阶梯乙
请你从O2、Fe、Fe2O3、HCl、NaOH中选择4种物质,排在图中相应的台阶上,能领取奖杯。从高到低的顺序________________________________。
NaOH
HCl
Fe
Fe2O3
Fe2O3
×
Fe
NaOH、HCl、Fe、O2
Fe/O2
O2
物质分类和性质的应用
2.下图为“领取奖杯游戏”的物质阶梯。当阶梯上相邻的物质之间能发生反应,方可向上攀登。例如,攀登阶梯甲能领取奖杯。
(2)共享物质、重塑阶梯
阶梯乙搭建完成后,若在阶梯甲和阶梯乙中各选择一种物质进行互换,也均能领取奖杯,则这两种物质是 或 。
思路:
同类物质具有
相似化学性质
NaOH
HCl
Fe
O2
Fe
Mg
HCl
H2SO4
NaOH
×
Mg和Fe
H2SO4和HCl
物质分类和性质的应用
3.以下物质的分类对于预测其化学性质没有帮助的是
A.二氧化硫属于非金属氧化物
B.锌属于“氢前金属”
C.氢氧化锰属于白色固体
D.硫酸亚铁属于硫酸盐
属于物理性质的描述,没有描述组成,无法预测化学性质
属于物质化学性质的描述
属于物质组成的描述
属于物质组成的描述
C
物质分类和性质的应用
4.碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域,是一种微溶于水的白色固体。
结合所学知识预测,Li2CO3能与 (填物质类别)反应,验证预测的实验操作与预期现象是:取Li2CO3固体于试管中, 。
碳酸盐 + 酸 = 盐 + 水 + 二氧化碳
酸
加入少量稀盐酸,产生气泡
Li+、CO32-
(碳酸盐)
物质分类和性质的应用
5.依据各类物质之间的反应规律,设计两种制备Li2CO3的方案(要求依据两种不同的反应规律)。完成下表(已知Li2CO3微溶于水)。
方案 原料1 原料2 预期反应的化学方程式 依据的反应规律
① Li2SO4溶液 两种盐反应生成两种新盐,生成物中有沉淀。
②
提供Li+
提供CO32-
Na2CO3
溶液
Li2SO4 + Na2CO3
= Li2CO3↓ + Na2SO4
物质分类和性质的应用
5.依据各类物质之间的反应规律,设计两种制备Li2CO3的方案(要求依据两种不同的反应规律)。完成下表(已知Li2CO3微溶于水)。
方案 原料1 原料2 预期反应的化学方程式 依据的反应规律
① Li2SO4溶液 两种盐反应生成两种新盐,生成物中有沉淀。
②
1.金属+酸:
2.金属+盐溶液:
3.金属氧化物+酸:
4.非金属氧化物+碱:
5.酸+碱:
6.碱和盐:
7.酸和盐:
Li + H2CO3
Li + Na2CO3
Li2O + H2CO3
LiOH + CO2
LiOH + H2CO3
LiOH + Na2CO3
没有合适的反应物
方案 原料1 原料2 预期反应的化学方程式 依据的反应规律
②1 Li H2CO3溶液 2Li+H2CO3=Li2CO3+H2↑ 两种盐反应生成两种新盐,
生成物中有沉淀。
②2 Li Na2CO3溶液 2Li+Na2CO3=Li2CO3+2Na 金属与盐溶液反应生成
新金属和新盐。
②3 Li2O H2CO3溶液 Li2O+H2CO3=Li2CO3+H2O 金属氧化物与酸反应生成
盐和水。
②4 LiOH溶液 CO2 2LiOH+CO2=Li2CO3↓+H2O 可溶性碱与非金属氧化物
反应生成盐和水。
②5 LiOH溶液 H2CO3溶液 2LiOH+H2CO3=Li2CO3↓+2H2O 酸与碱反应生成盐和水。
②6 LiOH溶液 Na2CO3溶液 2LiOH+Na2CO3=Li2CO3↓+2NaOH 可溶性碱与盐反应生成新的
碱和盐,生成物中有沉淀。
参考答案
学完本节课你应该知道
组成
化学性质
应用
陌生物质的化学性质预测
(反应物)
陌生物质的制备原理预测
(生成物)
元素组成特点 粒子构成特点 类别名称 代表物 类别反应规律 预测陌生物质的性质 推断陌生物质的制备
1种 金属元素 原子 金属单质 Fe、Cu 1种 非金属元素 分子/原子 非金属单质 O2、C 2种 金属元素+氧元素 多数是离子 金属氧化物 CuO、CaO 2种 非金属元素+氧元素 分子 非金属氧化物 H2O、CO2 2种或以上 氢元素+酸根 水溶液中解离出 H+和酸根离子 酸 HCl、H2SO4 3种或以上 金属元素+氢氧根 水溶液中解离出 金属离子和OH- 碱 NaOH、Ca(OH)2 2种或以上 金属元素+酸根 水溶液中解离出 金属离子和酸根离子 盐 NaCl、CaCO3 (反应物)
(生成物)
谢 谢 观 看
拓展课 物质的分类和性质(答疑)
初三—人教版—化学—第十一单元
1.按酸、碱、盐、氧化物的分类,下列各组物质属于同一类别的是
A.氯化钠和碳酸钙
B.烧碱和纯碱
C.硫酸镁和硫酸
D.氧化钙和氢氧化钙
NaCl CaCO3
NaOH Na2CO3
MgSO4 H2SO4
CaO Ca(OH)2
盐
盐
碱
盐
盐
酸
氧化物
碱
A
2.中国丝绸有几千年的历史传承。古代染坊常用某种“碱剂”来处理丝绸,该“碱剂”可使丝绸颜色洁白、质感柔软,其主要成分是一种盐,这种“碱剂”可能是
A.食醋 B.烧碱
C.草木灰 D.生石灰
CH3COOH(酸)
H2O(氧化物)
NaOH(碱)
K2CO3(盐)
CaO(氧化物)
C
3.甲、乙、丙、丁四瓶溶液分别是K2CO3、Ba(NO3)2、H2SO4、K2SO4中的一种,其中甲分别能与乙、丙、丁发生反应,甲是
A.K2SO4 B.H2SO4 C.Ba(NO3)2 D.K2CO3
K2SO4
H2SO4
Ba(NO3)2
K2CO3
C
4.镉是一种“氢前金属”,金属活动性介于铁和铜之间。根据金属化学性质的一般规律,下列预测合理的是
A.镉能与氢氧化钠溶液反应
B.镉不能与盐酸或稀硫酸反应
C.H2或CO能将镉的氧化物转化为金属镉
D.硫酸镉溶液中的硫酸锌可加入镉粉除去
C
5.三氧化二碳(C2O3)是金星大气的成分之一,通常情况下是一种无色无味的气体,可溶于水,与水反应生成的草酸可与氢氧化钙反应产生难溶于水的草酸钙,其他的化学性质与一氧化碳相似。下列有关C2O3的说法中,不正确的是
A.C2O3在一定条件下可还原CuO
B.C2O3可使澄清石灰水变浑浊
C.C2O3可与氢氧化钠溶液反应可生成盐
D.C2O3能用来灭火
D
拓展课 物质的分类和性质
学习目标
能从组成上区分混合物、纯净物;单质、化合物;酸、碱、盐、氧化物。
了解金属单质、非金属单质、金属氧化物、非金属氧化物的常见化学性质,理解酸、碱、盐的组成与其化学性质之间的关系。
学习用分类的方法整理物质的组成与性质之间的关系,认识物质类别之间的反应规律,初步学会应用物质的反应规律预测物质的性质及制备。
请将以上试剂放回试剂柜。
硫酸盐
碱
碳酸盐
碳酸钙
CaCO3
硫酸钾
K2SO4
氢氧化钠
NaOH
物质
纯净物
混合物
Fe Cu
空气、合金、溶液等
单质
化合物
CaCO3 CuSO4
金属单质
非金属单质
稀有气体单质
O2 C
He
氧化物
金属氧化物
非金属氧化物
CuO CaO
H2O CO2
酸
碱
盐
H2SO4
NaOH
物质的分类
碳酸盐、硫酸盐等
钠盐、钾盐等
NaCl K2SO4
小结:各类物质的组成特点
元素组成特点 粒子构成特点 类别名称 代表物
1种,金属元素 原子 金属单质 Fe、Cu
1种,非金属元素 分子/原子 非金属单质 O2、C
2种 金属元素+氧元素 多数是离子 金属氧化物 CuO、CaO
2种 非金属元素+氧元素 分子 非金属氧化物 H2O、CO2
2种或以上 氢元素+酸根 水溶液中解离出 H+和酸根离子 酸 HCl、H2SO4
3种或以上 金属元素+氢氧根 水溶液中解离出 金属离子和OH- 碱 NaOH、Ca(OH)2
2种或以上 金属元素+酸根 水溶液中解离出 金属离子和酸根离子 盐 NaCl、CaCO3
现提供4种溶液,请选择一种代替硫酸钠溶液制备硫酸钡固体。
氯化钡溶液
BaCl2
硫酸钠溶液
Na2SO4
(用完)
碳酸钠溶液
Na2CO3
氢氧化钠溶液
NaOH
稀盐酸
HCl
硫酸钾溶液
K2SO4
BaCl2 + Na2SO4 = 2NaCl + BaSO4↓
具有相同的阳离子(或阴离子)的盐,化学性质相似。
可溶性碳酸盐
(CO32-)
可溶性硫酸盐
(SO42-)
可溶性盐酸盐
(Cl-)
可溶性钙盐
(Ca2+)
可溶性钡盐
(Ba2+)
可溶性银盐
(Ag+)
+
+
+
碳酸钙沉淀
(CaCO3↓)
硫酸钡沉淀
(BaSO4↓)
氯化银沉淀
(AgCl↓)
金属单质
金属氧化物
非金属氧化物
碱
酸
盐
盐
盐和氢气
盐和水
碱和盐
酸和盐
盐和盐
盐和金属
各类物质的化学性质及转化关系
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3↑
红磷
铁
硫
木炭
镁
铜
金属+氧气 → 金属氧化物
非金属+氧气 → 非金属氧化物
金属氧化物+水 → 碱
非金属氧化物+水 → 酸
CO2+H2O=H2CO3
CaO+H2O=Ca(OH)2
金属单质
非金属单质
金属氧化物
非金属氧化物
碱
酸
盐
盐
盐和氢气
+O2
+O2
盐和水
碱和盐
酸和盐
盐和盐
+H2O
+H2O
盐和金属
各类物质的化学性质及转化关系
元素组成特点 粒子构成特点 类别名称 代表物 类别反应规律
1种,金属元素 原子 金属单质 Fe、Cu
1种,非金属元素 分子/原子 非金属单质 O2、C 2种 金属元素+氧元素 多数是离子 金属氧化物 CuO、CaO 2种 非金属元素+氧元素 分子 非金属氧化物 H2O、CO2 2种或以上 氢元素+酸根 水溶液中解离出 H+和酸根离子 酸 HCl、H2SO4 3种或以上 金属元素+氢氧根 水溶液中解离出 金属离子和OH- 碱 NaOH、Ca(OH)2 2种或以上 金属元素+酸根 水溶液中解离出 金属离子和酸根离子 盐 NaCl、CaCO3 (注意限定条件和特例)
物质分类和性质的应用
1.在某化学药品柜中发现一瓶标签模糊不清的溶液,这瓶溶液一定不是
A.H2SO4溶液
B.CuSO4溶液
C.Na2SO4溶液
D.FeSO4溶液
硫酸钾
硫酸铝
硫酸铵
硫酸盐
硫酸镁
硫酸镁
硫酸镁
硫酸铜
硫酸锌
酸
A
物质分类和性质的应用
2.下图为“领取奖杯游戏”的物质阶梯。当阶梯上相邻的物质之间能发生反应,方可向上攀登。例如,攀登阶梯甲能领取奖杯。
(1) 搭建阶梯乙
请你从O2、Fe、Fe2O3、HCl、NaOH中选择4种物质,排在图中相应的台阶上,能领取奖杯。从高到低的顺序________________________________。
NaOH
HCl
Fe
Fe2O3
Fe2O3
×
Fe
NaOH、HCl、Fe、O2
Fe/O2
O2
物质分类和性质的应用
2.下图为“领取奖杯游戏”的物质阶梯。当阶梯上相邻的物质之间能发生反应,方可向上攀登。例如,攀登阶梯甲能领取奖杯。
(2)共享物质、重塑阶梯
阶梯乙搭建完成后,若在阶梯甲和阶梯乙中各选择一种物质进行互换,也均能领取奖杯,则这两种物质是 或 。
思路:
同类物质具有
相似化学性质
NaOH
HCl
Fe
O2
Fe
Mg
HCl
H2SO4
NaOH
×
Mg和Fe
H2SO4和HCl
物质分类和性质的应用
3.以下物质的分类对于预测其化学性质没有帮助的是
A.二氧化硫属于非金属氧化物
B.锌属于“氢前金属”
C.氢氧化锰属于白色固体
D.硫酸亚铁属于硫酸盐
属于物理性质的描述,没有描述组成,无法预测化学性质
属于物质化学性质的描述
属于物质组成的描述
属于物质组成的描述
C
物质分类和性质的应用
4.碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域,是一种微溶于水的白色固体。
结合所学知识预测,Li2CO3能与 (填物质类别)反应,验证预测的实验操作与预期现象是:取Li2CO3固体于试管中, 。
碳酸盐 + 酸 = 盐 + 水 + 二氧化碳
酸
加入少量稀盐酸,产生气泡
Li+、CO32-
(碳酸盐)
物质分类和性质的应用
5.依据各类物质之间的反应规律,设计两种制备Li2CO3的方案(要求依据两种不同的反应规律)。完成下表(已知Li2CO3微溶于水)。
方案 原料1 原料2 预期反应的化学方程式 依据的反应规律
① Li2SO4溶液 两种盐反应生成两种新盐,生成物中有沉淀。
②
提供Li+
提供CO32-
Na2CO3
溶液
Li2SO4 + Na2CO3
= Li2CO3↓ + Na2SO4
物质分类和性质的应用
5.依据各类物质之间的反应规律,设计两种制备Li2CO3的方案(要求依据两种不同的反应规律)。完成下表(已知Li2CO3微溶于水)。
方案 原料1 原料2 预期反应的化学方程式 依据的反应规律
① Li2SO4溶液 两种盐反应生成两种新盐,生成物中有沉淀。
②
1.金属+酸:
2.金属+盐溶液:
3.金属氧化物+酸:
4.非金属氧化物+碱:
5.酸+碱:
6.碱和盐:
7.酸和盐:
Li + H2CO3
Li + Na2CO3
Li2O + H2CO3
LiOH + CO2
LiOH + H2CO3
LiOH + Na2CO3
没有合适的反应物
方案 原料1 原料2 预期反应的化学方程式 依据的反应规律
②1 Li H2CO3溶液 2Li+H2CO3=Li2CO3+H2↑ 两种盐反应生成两种新盐,
生成物中有沉淀。
②2 Li Na2CO3溶液 2Li+Na2CO3=Li2CO3+2Na 金属与盐溶液反应生成
新金属和新盐。
②3 Li2O H2CO3溶液 Li2O+H2CO3=Li2CO3+H2O 金属氧化物与酸反应生成
盐和水。
②4 LiOH溶液 CO2 2LiOH+CO2=Li2CO3↓+H2O 可溶性碱与非金属氧化物
反应生成盐和水。
②5 LiOH溶液 H2CO3溶液 2LiOH+H2CO3=Li2CO3↓+2H2O 酸与碱反应生成盐和水。
②6 LiOH溶液 Na2CO3溶液 2LiOH+Na2CO3=Li2CO3↓+2NaOH 可溶性碱与盐反应生成新的
碱和盐,生成物中有沉淀。
参考答案
学完本节课你应该知道
组成
化学性质
应用
陌生物质的化学性质预测
(反应物)
陌生物质的制备原理预测
(生成物)
元素组成特点 粒子构成特点 类别名称 代表物 类别反应规律 预测陌生物质的性质 推断陌生物质的制备
1种 金属元素 原子 金属单质 Fe、Cu 1种 非金属元素 分子/原子 非金属单质 O2、C 2种 金属元素+氧元素 多数是离子 金属氧化物 CuO、CaO 2种 非金属元素+氧元素 分子 非金属氧化物 H2O、CO2 2种或以上 氢元素+酸根 水溶液中解离出 H+和酸根离子 酸 HCl、H2SO4 3种或以上 金属元素+氢氧根 水溶液中解离出 金属离子和OH- 碱 NaOH、Ca(OH)2 2种或以上 金属元素+酸根 水溶液中解离出 金属离子和酸根离子 盐 NaCl、CaCO3 (反应物)
(生成物)
谢 谢 观 看
拓展课 物质的分类和性质(答疑)
初三—人教版—化学—第十一单元
1.按酸、碱、盐、氧化物的分类,下列各组物质属于同一类别的是
A.氯化钠和碳酸钙
B.烧碱和纯碱
C.硫酸镁和硫酸
D.氧化钙和氢氧化钙
NaCl CaCO3
NaOH Na2CO3
MgSO4 H2SO4
CaO Ca(OH)2
盐
盐
碱
盐
盐
酸
氧化物
碱
A
2.中国丝绸有几千年的历史传承。古代染坊常用某种“碱剂”来处理丝绸,该“碱剂”可使丝绸颜色洁白、质感柔软,其主要成分是一种盐,这种“碱剂”可能是
A.食醋 B.烧碱
C.草木灰 D.生石灰
CH3COOH(酸)
H2O(氧化物)
NaOH(碱)
K2CO3(盐)
CaO(氧化物)
C
3.甲、乙、丙、丁四瓶溶液分别是K2CO3、Ba(NO3)2、H2SO4、K2SO4中的一种,其中甲分别能与乙、丙、丁发生反应,甲是
A.K2SO4 B.H2SO4 C.Ba(NO3)2 D.K2CO3
K2SO4
H2SO4
Ba(NO3)2
K2CO3
C
4.镉是一种“氢前金属”,金属活动性介于铁和铜之间。根据金属化学性质的一般规律,下列预测合理的是
A.镉能与氢氧化钠溶液反应
B.镉不能与盐酸或稀硫酸反应
C.H2或CO能将镉的氧化物转化为金属镉
D.硫酸镉溶液中的硫酸锌可加入镉粉除去
C
5.三氧化二碳(C2O3)是金星大气的成分之一,通常情况下是一种无色无味的气体,可溶于水,与水反应生成的草酸可与氢氧化钙反应产生难溶于水的草酸钙,其他的化学性质与一氧化碳相似。下列有关C2O3的说法中,不正确的是
A.C2O3在一定条件下可还原CuO
B.C2O3可使澄清石灰水变浑浊
C.C2O3可与氢氧化钠溶液反应可生成盐
D.C2O3能用来灭火
D
同课章节目录
