第八单元课题2 金属的化学性质第2课时课件(共30张PPT内嵌视频)-2023-2024学年九年级化学人教版下册
文档属性
| 名称 | 第八单元课题2 金属的化学性质第2课时课件(共30张PPT内嵌视频)-2023-2024学年九年级化学人教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 58.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-26 21:59:09 | ||
图片预览











文档简介
(共30张PPT)
第2课时
金属的化学性质
课题2
复习引入
1、金属的化学性质
2、金属活动性
Cu
Mg
Fe
Zn
Au
金属+氧气→金属氧化物
金属+酸→盐+H2↑
一次葛洪的妻子用铁勺盛曾青,几天后,葛洪拿起铁勺,奇妙的现象出现了:铁勺变成了“铜勺”,金光闪闪。葛洪的徒弟高兴得跳了起来:“点石成金了!”
晋-葛洪《抱朴子内篇·黄白》中有“以曾青涂铁,铁赤色如铜”的记载。
东晋道教学者、著名炼丹家、医药学家
2000多年前西汉刘安所著的《淮南万毕
术》中有“曾青得铁则化为铜”的记载。
我国的劳动人民早就知道了铁能置换出
硫酸铜溶液中的铜,从而发明了湿法冶金,
成为了人类冶金史上一个重要的里程碑。
现象
铁钉表面有红色物质析出
溶液由蓝色变成浅绿色
反应原理
铁跟硫酸铜溶液的反应
实验探究
金属和金属的化合物(盐)溶液之间反应
实验探究
金属和金属的化合物(盐)溶液之间反应
1、把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中
2、把一根洁净的铜丝浸入硝酸银溶液中
3、把另一根洁净的铜丝浸入硫酸铝溶液中
金属表面的变化情况
溶液颜色的变化情况
演示实验
观察现象
现象
铝丝表面有红色物质析出
溶液由蓝色变成无色
反应原理
铝跟硫酸铜溶液的反应
金属和金属的化合物(盐)溶液之间反应
实验探究
现象
铜丝表面有银白色物质析出
溶液由无色变成蓝色
反应原理
铜跟硝酸银溶液的反应
金属和金属的化合物(盐)溶液之间反应
实验探究
现象
无明显现象
结论
铜+硫酸铝溶液
铜和硫酸铝溶液不反应
金属和金属的化合物(盐)溶液之间反应
实验探究
参加反应的金属比化合物中的金属活动性要强。
为什么铝和硫酸铜、铁和硫酸铜、铜和硝酸银溶液能发生反应,而铜和硫酸铝溶液却不能发生反应呢?
讨论交流
Cu
Fe
Al
Ag
Cu
Cu
微观探究
铁与硫酸铜溶液反应的实质
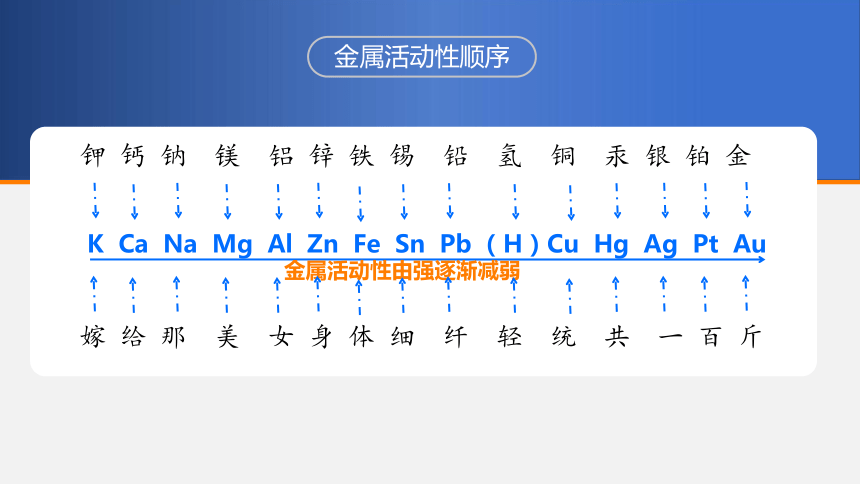
金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金
嫁 给 那 美 女 身 体 细 纤 轻 统 共 一 百 斤
金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
化学也可以很浪漫
课时小结
金属的化学性质
条件:1、金属要排在盐中所含金属的前面(除去K、Ca、Na);2、该盐必须可溶
条件:1、金属排在H前;2、酸专指盐酸和稀硫酸
学以致用
黄铜(铜锌合金)与黄金外观很相似,我们可以用什么方法来鉴别它们呢?
讨论交流
·如何设计实验验证金属的活动性顺序?
1.设计原理
讨论交流
·如何设计实验验证金属的活动性顺序?
2.设计方法
⑴验证两种金属的活动性顺序时,可以将一种金属放入另
一种金属的化合物溶液中,观察能否将另一种金属置换出来
或根据金属能否与酸反应及反应的剧烈程度来判断。
讨论交流
·如何设计实验验证金属的活动性顺序?
2.设计方法
⑵验证三种金属的活动性顺序的实验设计。
①方法一:两头金属中间盐。即选用三种金属活动性最强和最弱的两种金属的单质及活动性居中的金属的化合物溶液作为试剂,根据两种金属单质分别与金属化合物溶液反应的情况进行判断。
讨论交流
·如何设计实验验证金属的活动性顺序?
2.设计方法
⑵验证三种金属的活动性顺序的实验设计。
②方法二:中间金属两头盐。即选用三种金属活动性居中的金属
单质及活动性最强和最弱的金属的化合物溶液作为试剂,根
据金属单质分别与两种金属化合物溶液反应的情况进行判断。
1.X、Y、Z三种金属中,只有Z能和稀硫酸反应,将Y放入X的盐溶液中,Y表面有X析出。则X、Y、Z三种金属的活动性顺序为( )
A.X>Z>Y B.Y>X>Z C.Y>Z>X D.Z>Y>X
D
课堂练习
2.若金属锰在金属活动性顺序中位于铝和锌之间,则下列反应不能发生的是(提示:MnSO4溶于水)( )
A.Mn+2HCl=MnCl2+H2↑
B.Fe+MnSO4=FeSO4+Mn
C.2Al+3MnSO4=Al2(SO4)3+3Mn D.Mg+MnSO4=MgSO4+Mn
B
课堂练习
课堂练习
3.仅用下列各组试剂无法完成验证Zn,Cu,Ag三种金属活
动性顺序的是( )
A.Zn、Ag、CuSO4溶液
B.Cu、ZnSO4溶液、AgNO3溶液
C.Zn、Ag、稀硫酸、ZnSO4溶液
D.Zn、Cu、稀硫酸、AgNO3溶液
C
课堂练习
4.如图所示,烧杯中盛有等质量、等浓度的足量的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左偏
65 2
m x1
56 2
m x2
24 2
m x3
54 6
m x4
金属与酸反应的规律
等质量的不同种金属与
足量的酸反应,相对原
子质量小的产生的氢气
反而多。(铝最多)
等量金属足量酸
等质量、等浓度的同种酸与足量的不同种金属反应:产生的氢气一样多。
那...等质量、等浓度的同种酸与足量的不同金属反应,产生氢气质量又该如何计算呢?
小结
课堂练习
4.如图所示,烧杯中盛有等质量、等浓度的足量的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左偏
D
课堂练习
5.向AgNO3、Zn(NO3)2的混合溶液中,加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生,下列说法正确的是( )
A、滤液中一定有Fe(NO3)2,一定没有AgNO3和Zn(NO3)2
B、滤液中一定有Zn(NO3)2,一定没有AgNO3和Fe(NO3)2
C、滤渣中一定有Ag和Fe,一定没有Zn
D、反应后的滤液的质量大于反应前溶液的质量
c
化学反应优先原则:
1、金属与酸反应,较活泼的金属优先反应。
2、金属与金属化合物溶液反应,金属中最活泼的优先置换出最不活泼的金属。
(强先溶,弱先析)
课堂练习
6.向AgNO3、Cu(NO3)2、Mg(NO3)2的混合溶液中,加入一定量的锌粉,充分反应后过滤,下列情况可能发生的是( )
A、滤渣中有Cu,滤液中有AgNO3、Cu(NO3)2、Zn(NO3)2和Mg(NO3)2
B、滤渣中有Cu、Ag,滤液中有AgNO3、Zn(NO3)2和Mg(NO3)2
C、滤渣中有Cu、Ag、Zn,滤液中有Zn(NO3)2和Mg(NO3)2
D、滤渣中有Cu、Ag、Zn、Mg,滤液中有Zn(NO3)2
C
(强先溶,弱先析)
D
课堂练习
(强先溶,弱先析)
课堂练习
将适量的铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,则关于滤出的固体和无色滤液的下列判断正确的是( )
A.滤出的固体中一定含有银和铜,一定不含镁
B.滤出的固体中一定含有银,可能含有铜和镁
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
D
(强先溶,弱先析)
第2课时
金属的化学性质
课题2
复习引入
1、金属的化学性质
2、金属活动性
Cu
Mg
Fe
Zn
Au
金属+氧气→金属氧化物
金属+酸→盐+H2↑
一次葛洪的妻子用铁勺盛曾青,几天后,葛洪拿起铁勺,奇妙的现象出现了:铁勺变成了“铜勺”,金光闪闪。葛洪的徒弟高兴得跳了起来:“点石成金了!”
晋-葛洪《抱朴子内篇·黄白》中有“以曾青涂铁,铁赤色如铜”的记载。
东晋道教学者、著名炼丹家、医药学家
2000多年前西汉刘安所著的《淮南万毕
术》中有“曾青得铁则化为铜”的记载。
我国的劳动人民早就知道了铁能置换出
硫酸铜溶液中的铜,从而发明了湿法冶金,
成为了人类冶金史上一个重要的里程碑。
现象
铁钉表面有红色物质析出
溶液由蓝色变成浅绿色
反应原理
铁跟硫酸铜溶液的反应
实验探究
金属和金属的化合物(盐)溶液之间反应
实验探究
金属和金属的化合物(盐)溶液之间反应
1、把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中
2、把一根洁净的铜丝浸入硝酸银溶液中
3、把另一根洁净的铜丝浸入硫酸铝溶液中
金属表面的变化情况
溶液颜色的变化情况
演示实验
观察现象
现象
铝丝表面有红色物质析出
溶液由蓝色变成无色
反应原理
铝跟硫酸铜溶液的反应
金属和金属的化合物(盐)溶液之间反应
实验探究
现象
铜丝表面有银白色物质析出
溶液由无色变成蓝色
反应原理
铜跟硝酸银溶液的反应
金属和金属的化合物(盐)溶液之间反应
实验探究
现象
无明显现象
结论
铜+硫酸铝溶液
铜和硫酸铝溶液不反应
金属和金属的化合物(盐)溶液之间反应
实验探究
参加反应的金属比化合物中的金属活动性要强。
为什么铝和硫酸铜、铁和硫酸铜、铜和硝酸银溶液能发生反应,而铜和硫酸铝溶液却不能发生反应呢?
讨论交流
Cu
Fe
Al
Ag
Cu
Cu
微观探究
铁与硫酸铜溶液反应的实质
金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金
嫁 给 那 美 女 身 体 细 纤 轻 统 共 一 百 斤
金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
化学也可以很浪漫
课时小结
金属的化学性质
条件:1、金属要排在盐中所含金属的前面(除去K、Ca、Na);2、该盐必须可溶
条件:1、金属排在H前;2、酸专指盐酸和稀硫酸
学以致用
黄铜(铜锌合金)与黄金外观很相似,我们可以用什么方法来鉴别它们呢?
讨论交流
·如何设计实验验证金属的活动性顺序?
1.设计原理
讨论交流
·如何设计实验验证金属的活动性顺序?
2.设计方法
⑴验证两种金属的活动性顺序时,可以将一种金属放入另
一种金属的化合物溶液中,观察能否将另一种金属置换出来
或根据金属能否与酸反应及反应的剧烈程度来判断。
讨论交流
·如何设计实验验证金属的活动性顺序?
2.设计方法
⑵验证三种金属的活动性顺序的实验设计。
①方法一:两头金属中间盐。即选用三种金属活动性最强和最弱的两种金属的单质及活动性居中的金属的化合物溶液作为试剂,根据两种金属单质分别与金属化合物溶液反应的情况进行判断。
讨论交流
·如何设计实验验证金属的活动性顺序?
2.设计方法
⑵验证三种金属的活动性顺序的实验设计。
②方法二:中间金属两头盐。即选用三种金属活动性居中的金属
单质及活动性最强和最弱的金属的化合物溶液作为试剂,根
据金属单质分别与两种金属化合物溶液反应的情况进行判断。
1.X、Y、Z三种金属中,只有Z能和稀硫酸反应,将Y放入X的盐溶液中,Y表面有X析出。则X、Y、Z三种金属的活动性顺序为( )
A.X>Z>Y B.Y>X>Z C.Y>Z>X D.Z>Y>X
D
课堂练习
2.若金属锰在金属活动性顺序中位于铝和锌之间,则下列反应不能发生的是(提示:MnSO4溶于水)( )
A.Mn+2HCl=MnCl2+H2↑
B.Fe+MnSO4=FeSO4+Mn
C.2Al+3MnSO4=Al2(SO4)3+3Mn D.Mg+MnSO4=MgSO4+Mn
B
课堂练习
课堂练习
3.仅用下列各组试剂无法完成验证Zn,Cu,Ag三种金属活
动性顺序的是( )
A.Zn、Ag、CuSO4溶液
B.Cu、ZnSO4溶液、AgNO3溶液
C.Zn、Ag、稀硫酸、ZnSO4溶液
D.Zn、Cu、稀硫酸、AgNO3溶液
C
课堂练习
4.如图所示,烧杯中盛有等质量、等浓度的足量的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左偏
65 2
m x1
56 2
m x2
24 2
m x3
54 6
m x4
金属与酸反应的规律
等质量的不同种金属与
足量的酸反应,相对原
子质量小的产生的氢气
反而多。(铝最多)
等量金属足量酸
等质量、等浓度的同种酸与足量的不同种金属反应:产生的氢气一样多。
那...等质量、等浓度的同种酸与足量的不同金属反应,产生氢气质量又该如何计算呢?
小结
课堂练习
4.如图所示,烧杯中盛有等质量、等浓度的足量的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左偏
D
课堂练习
5.向AgNO3、Zn(NO3)2的混合溶液中,加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生,下列说法正确的是( )
A、滤液中一定有Fe(NO3)2,一定没有AgNO3和Zn(NO3)2
B、滤液中一定有Zn(NO3)2,一定没有AgNO3和Fe(NO3)2
C、滤渣中一定有Ag和Fe,一定没有Zn
D、反应后的滤液的质量大于反应前溶液的质量
c
化学反应优先原则:
1、金属与酸反应,较活泼的金属优先反应。
2、金属与金属化合物溶液反应,金属中最活泼的优先置换出最不活泼的金属。
(强先溶,弱先析)
课堂练习
6.向AgNO3、Cu(NO3)2、Mg(NO3)2的混合溶液中,加入一定量的锌粉,充分反应后过滤,下列情况可能发生的是( )
A、滤渣中有Cu,滤液中有AgNO3、Cu(NO3)2、Zn(NO3)2和Mg(NO3)2
B、滤渣中有Cu、Ag,滤液中有AgNO3、Zn(NO3)2和Mg(NO3)2
C、滤渣中有Cu、Ag、Zn,滤液中有Zn(NO3)2和Mg(NO3)2
D、滤渣中有Cu、Ag、Zn、Mg,滤液中有Zn(NO3)2
C
(强先溶,弱先析)
D
课堂练习
(强先溶,弱先析)
课堂练习
将适量的铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,则关于滤出的固体和无色滤液的下列判断正确的是( )
A.滤出的固体中一定含有银和铜,一定不含镁
B.滤出的固体中一定含有银,可能含有铜和镁
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
D
(强先溶,弱先析)
同课章节目录
