吉林省长春市重点学校2023-2024学年高二上学期期末化学试题(含解析)
文档属性
| 名称 | 吉林省长春市重点学校2023-2024学年高二上学期期末化学试题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 962.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-21 09:55:27 | ||
图片预览


文档简介
2023—2024学年上学期高二年级
期末考试化学学科试卷
考试时间:75分钟 试卷满分:100分
可能用到的相对原子质量:H-1 Li-7 C-12 O-16 Mg-24 P-31 Ni-59
第Ⅰ卷(选择题,共45分)
一、选择题(每小题只有一个正确选项,每小题3分,共45分)
1.化学与生活、生产息息相关。下列说法错误的是
A.将水闸和惰性电极分别连接电源的正极和负极,是外加电流法防腐
B.钛合金不仅具有优异的抗腐蚀性,还具有良好的生物兼容性
C.锅炉的内壁、船舶的外壳等常安装若干镁合金达到被保护的目的
D.在潮湿的空气中,白铁(镀锌铁)比马口铁(镀锡铁)镀层破损后腐蚀更慢一些
2.下列化学用语表述错误的是
A.乙烯的球棍模型 B.甲基的电子式:
C.基态O原子的价层电子排布式: D.p-pπ键的电子云轮廓图
3.下列说法正确的是
A.原子的核外电子排布式是:
B.、、轨道能量不相同
C.原子核外电子填充3p、3d、4s能级的顺序为
D.最外层电子排布式为的基态原子所对应元素一定是金属元素
4.下列关于电子云和原子轨道的说法正确的是
A.通常用小黑点来表示电子的多少,黑点密度大,电子数目多
B.s能级的原子轨道呈球形,处在该轨道上的电子在球壳上运动
C.所有原子的任一能层的s电子云轮廓图都是一个球形,并且球的半径大小相同
D.基态氯原子核外电子占有9个原子轨道
5.咔唑()是一种新型有机液体储氢介质。下列说法错误的是
A.碳、氮、氢三种元素电负性:N>C>H
B.同周期元素中第一电离能高于N的有3种
C.咔唑的沸点比的沸点高
D.基态氮原子的外围电子轨道表示式不能写为,因为违背了洪特规则
6.某种离子液体的结构如图所示,X、Y、Z、M、Q为原子序数依次增大的五种短周期非金属元素,Z的原子序数等于X、Y原子序数之和,Q为非金属性最强的元素。
下列说法正确的是
A.的键角大于的键角 B.的VSEPR模型为正四面体形
C.是极性分子,是非极性分子 D.M2的键能小于Q2的键能
7.DNA中四种碱基间的配对方式如图。以下说法不正确的是
A.配对碱基间的作用力属于共价键
B.碱基中元素第一电离能大小关系为N>O>C
C.鸟嘌呤与胞嘧啶之间的相互作用比腺嘌呤与胸腺嘧啶之间的更强
D.若图中①②分别代表不同化学键,则键能:②<①
8.短周期主族元素W、X、Y、W的原子序数依次增加,K、L、M、N均是由这些元素组成的二元化合物,甲是元素X的单质,是常见的固体,L和N组成元素相同,K是无色气体,是主要的大气污染物之一,0.05 mol L乙溶液的pH为1,上述物质的转化关系如图所示。
下列说法错误的是
A.简单氢化物的沸点:Z>Y
B.最高价氧化物对应的水化物的酸性Z>X
C.M、L中中心原子杂化方式分别为sp、杂化
D.反应①和反应②均为氧化还原反应
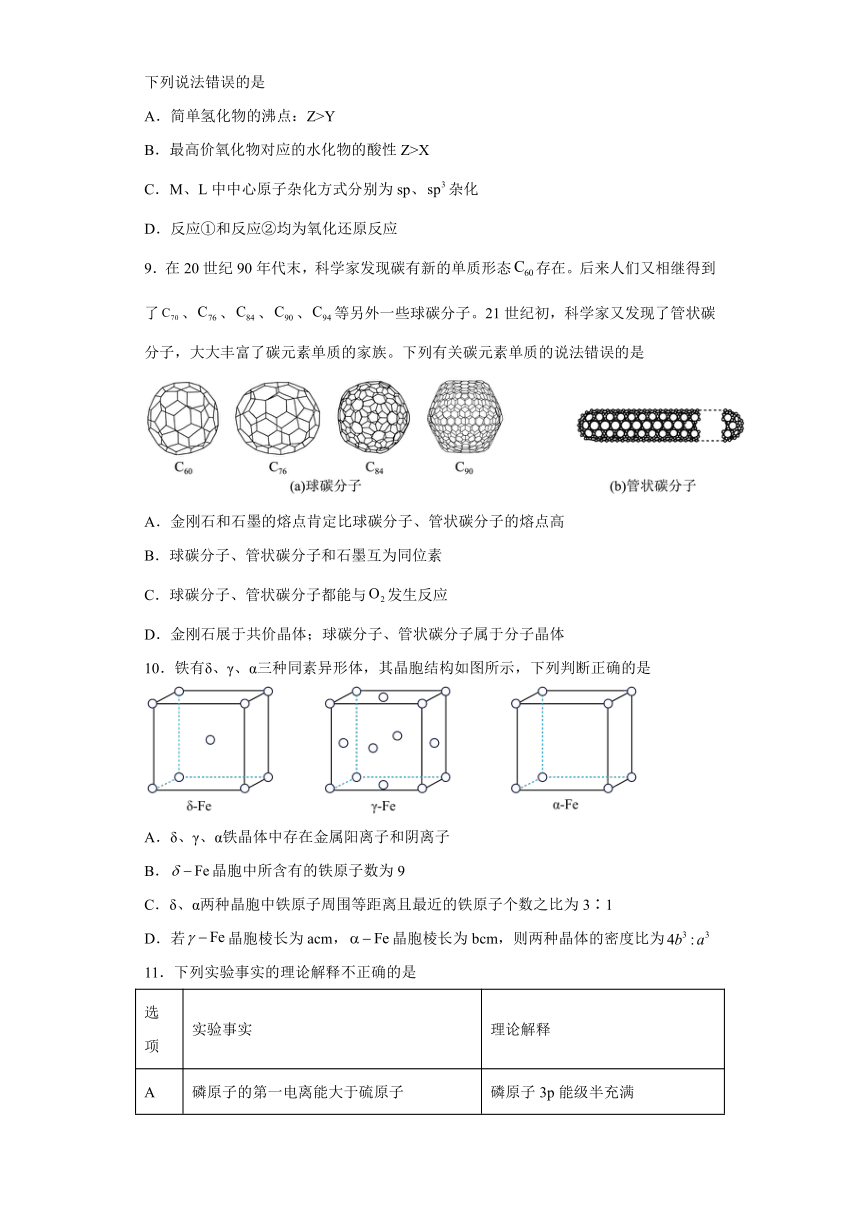
9.在20世纪90年代末,科学家发现碳有新的单质形态存在。后来人们又相继得到了、、、、等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是
A.金刚石和石墨的熔点肯定比球碳分子、管状碳分子的熔点高
B.球碳分子、管状碳分子和石墨互为同位素
C.球碳分子、管状碳分子都能与发生反应
D.金刚石展于共价晶体;球碳分子、管状碳分子属于分子晶体
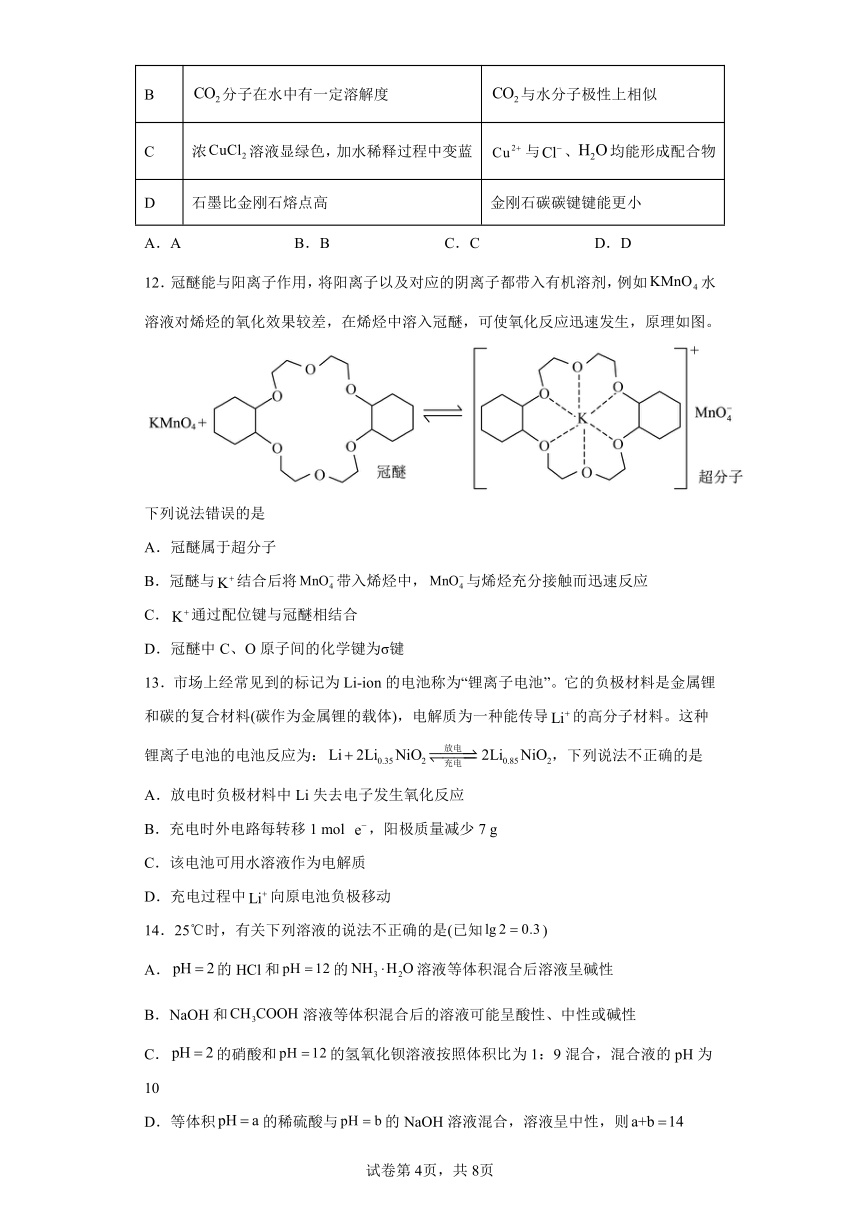
10.铁有δ、γ、α三种同素异形体,其晶胞结构如图所示,下列判断正确的是
A.δ、γ、α铁晶体中存在金属阳离子和阴离子
B.晶胞中所含有的铁原子数为9
C.δ、α两种晶胞中铁原子周围等距离且最近的铁原子个数之比为3∶1
D.若晶胞棱长为acm,晶胞棱长为bcm,则两种晶体的密度比为
11.下列实验事实的理论解释不正确的是
选项 实验事实 理论解释
A 磷原子的第一电离能大于硫原子 磷原子3p能级半充满
B 分子在水中有一定溶解度 与水分子极性上相似
C 浓溶液显绿色,加水稀释过程中变蓝 与、均能形成配合物
D 石墨比金刚石熔点高 金刚石碳碳键键能更小
A.A B.B C.C D.D
12.冠醚能与阳离子作用,将阳离子以及对应的阴离子都带入有机溶剂,例如水溶液对烯烃的氧化效果较差,在烯烃中溶入冠醚,可使氧化反应迅速发生,原理如图。
下列说法错误的是
A.冠醚属于超分子
B.冠醚与结合后将带入烯烃中,与烯烃充分接触而迅速反应
C.通过配位键与冠醚相结合
D.冠醚中C、O原子间的化学键为σ键
13.市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导的高分子材料。这种锂离子电池的电池反应为:,下列说法不正确的是
A.放电时负极材料中Li失去电子发生氧化反应
B.充电时外电路每转移1 mol ,阳极质量减少7 g
C.该电池可用水溶液作为电解质
D.充电过程中向原电池负极移动
14.25℃时,有关下列溶液的说法不正确的是(已知)
A.的HCl和的溶液等体积混合后溶液呈碱性
B.NaOH和溶液等体积混合后的溶液可能呈酸性、中性或碱性
C.的硝酸和的氢氧化钡溶液按照体积比为1:9混合,混合液的pH为10
D.等体积的稀硫酸与的NaOH溶液混合,溶液呈中性,则
15.溶洞水体中的与空气中的保持平衡,其水体中(X为、、或)与pH的关系如图所示。已知,下列说法错误的是
A.线Ⅰ代表与pH的关系曲线
B.
C.b点溶液中, mol L
D.
第Ⅱ卷(非选择题,共55分)
二、非选择题(本题包括4个小题,共55分)
16.下表是元素周期表的一部分,表中所列字母分别代表一种元素。回答下列问题:
(1)依据元素周期表的分区,元素c属于 区;
(2)基态离子的核外电子排布式是 :
(3)元素f的基态原子核外有 种不同运动状态的电子;
(4)b、c、d、e四种元素按电负性由大到小顺序排列为 (用元素符号表示,下同),按第一电离能由大到小的顺序排列为 ;
(5)表中某主族元素的电离能情况如下图所示,则该元素在周期表中的位置 ;
(6)h和i可按原子个数比为1∶3形成化合物E,E的空间构型为 ,中心原子的杂化轨道类型为 。
17.材料是生物医疗、国防军事以及航空航天等领域发展提供支撑。
(1)磷酸亚铁锂()常用作锂离子电池正极材料,周期表中与Li的化学性质最相似的邻族元素是 (填元素符号),该元素基态原子核外M层电子自旋状态 (填“相同”或“相反”);
(2)苯胺()常作为合成原料,与甲苯()相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是 ;
(3)反应的产物分子中采取杂化的原子是 (填元素名称):
(4)是制备氟磺酸类化合物的常用原料,分子结构如图所示:
已知键角α为124°,β为96°,则的原因主要是 ;
(5)第三代硅太阳能电池以铜钢镓硒CiGs(CIS中掺入Ga)等化合物为主要材料。Cu晶体的晶胞如图,其配位数为 ;
往溶液中加入过量氨水,可生成,下列说法正确的是 ;
A.中所含的化学键有离子键、极性键和配位键
B.在中给出孤电子对,提供空轨道
C.组成元素中第一电离能最大的是氧元素
D.与互为等电子体,空间构型均为正四面体形
(6)和属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
这类磷酸根离子的化学式可用通式表示为 (用n代表P原子数)。
18.向某草酸溶液中滴加KOH溶液,溶液中、、的物质的量浓度分数δ(X)[]与pH的关系如图所示:
请回答下列问题:
(1)室温下,草酸的一级电离常数为 ;
(2)①向草酸溶液中滴加KOH溶液至的过程中主要反应的离子方程式为 。
②0.1 moL 溶液中, (填“>”、“<”或“=”);
(3)室温下,通过下列实验探究0.0100 mol L 溶液的性质:
实验1:实验测得0.0100 mol L 溶液的pH为8.6。
实验2:向溶液中滴加等体积、0.0100 mol L HCl溶液。pH由8.6降为4.8。
实验3:向溶液中加入等体积0.0200 mol L 溶液,出现白色沉淀。
实验4:向稀硫酸酸化的,溶液中滴加溶液至溶液褪色。
已知室温下,下列说法错误的是_______;
A.0.0100 mol L 溶液中满足:
B.实验2滴加盐酸过程中不可能存在:
C.实验3所得上层清液中: mol L
D.实验4发生反应的离子方程式为
(4)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:。
①制备时需添加氨水以提高的产率,从化学平衡移动角度解释原因 :
②测定草酸亚铁晶体()的x值,实验如下:
称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用酸性溶液漓定。到达滴定终点时,消耗0.1000 mol·L的酸性溶液18.00 mL。
则中 (的摩尔质量是144 g mol)。
试卷第8页,共8页
1.A
【详解】A.应将水中的钢闸门连接电源的负极,钢闸门不参与反应,起到了保护作用,该方法是外加电流的阴极保护法,A错误;
B.钛合金性能优良,不仅具有优异的抗腐蚀性,还具有良好的生物兼容性,B正确;
C.镁比铁活泼,可以做原电池的负极而保护钢铁,C正确;
D.镀层破损后,马口铁(镀锡铁)中铁做负极被腐蚀,白铁皮(镀锌铁)中锌做负极、铁做正极被保护,故马口铁(镀锡铁)不如白铁皮(镀锌铁)耐腐蚀,D正确;
故选A。
2.B
【详解】A.乙烯分子中含碳碳双键,球棍模型中黑球代表碳原子,白球代表氢原子,棍代表共价键,,A正确;
B.甲基中含有1个未成对电子,电子式:,B错误;
C.O为8号元素,基态O原子的价层电子排布式:,C正确;
D.p-pπ键的电子云为镜面对称,D正确;
故选B。
3.C
【详解】A.铜元素的原子序数为29,基态原子的核外电子排布式为1s22s22p63s23p63d104s1,故A错误;
B.、、为简并轨道,轨道能量相同,但轨道的伸展方向不同,故B错误;
C.由能量最低原理可知,原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d,故C正确;
D.最外层电子排布式为ns2的基态原子所对应元素不一定是金属元素,如基态原子的最外层电子排布式为1s2的氦元素为非金属元素,故D错误;
故选C。
4.D
【详解】A.小黑点表示电子在核外空间某处出现的机会,不表示电子数目,A错误;
B.s能级的原子轨道呈球形,处在该轨道上的电子不只在球壳内运动,还在球壳外运动,只是在球壳外运动概率较小,B错误;
C.所有原子的任一能层的s电子云轮廓图都是一个球形,但是能层不同球的半径大小不同,C错误;
D.基态氯原子核外电子排布为1s22s22p63s23p5,核外电子占有9个原子轨道,D正确;
故选D。
5.B
【详解】A.同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;电负性:N>C>H,A正确;
B.同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,在第二周期元素中第一电离能小于N的有:锂、铍、硼、碳、氧共5种,高于N的有2种,B错误;
C.咔唑中能形成分子间氢键,所以咔唑的沸点比的沸点高,C正确;
D.洪特规则是指在相同能量的轨道上,电子总是尽可能分占不同的轨道且自旋方向相同;如果基态氮原子的外围电子轨道表示式不能写为,因为违背了洪特规则,D正确;
故选B。
6.B
【分析】X、Y、Z、M、Q为原子序数依次增大的五种短周期非金属元素,Q为非金属性最强的元素,则Q为F元素;由阴阳离子的结构可知,离子中X、Y、Z、M形成的共价键数目分别为1、4、4、4,Z的原子序数等于X、Y原子序数之和,则X为H元素、Y为B元素、Z为C元素、M为N元素。
【详解】A.氨分子中氮原子的孤对电子对数为1,甲烷分子中碳原子的孤对电子对数为0,孤对电子对数越多,对成键电子对的斥力越大,分子的键角越小,所以甲烷分子的键角大于氨分子,故A错误;
B.四氟合硼离子中硼原子的价层电子对数为4,孤对电子对数为0,离子的VSEPR模型为正四面体形,故B正确;
C.三氟化氨分子中氮原子的价层电子对数为4、孤对电子对数为1,分子的空间构型为结构不对称的三角锥形,属于极性分子,故C错误;
D.氮气分子中氮氮三键的键能大于氟气分子中氟氟单键的键能,故D错误;
故选B。
7.A
【详解】A.配对碱基间的作用力属于属于分子间作用力,而不是共价键,A错误;
B.同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,第一电离能大小关系为N>O>C,B正确;
C.鸟嘌呤与胞嘧啶之间形成3个氢键,腺嘌呤与胸腺嘧啶之间形成2个氢键,故鸟嘌呤与胞嘧啶之间的相互作用比腺嘌呤与胸腺嘧啶之间的更强,C正确;
D.①②分别为碳氮单键和碳氮双键,单键键长长,键能小,所以键能:①<②,D正确;
故选A。
8.A
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,K、L、M均是由这些元素组成的二元化合物,0.05mol/L乙溶液pH为l,说明乙为二元强酸,甲是元素X的单质,是常见的固体,K是无色气体,是主要的大气污染物之一,则甲为碳、乙为硫酸、K为二氧化硫;由转化关系可知,乙的浓溶液与碳共热反应生成二氧化硫、二氧化碳和水,L和N组成元素相同,N能与二氧化硫反应生成硫酸,则L为水、M为二氧化碳、N为过氧化氢,所以W为H元素、X为C元素、Y为O元素、Z为S元素。
【详解】A.水分子能形成分子间氢键,硫化氢不能形成分子间氢键,则水分子的分子间作用力大于硫化氢,沸点高于硫化氢,故A错误;
B.元素的非金属性越强,最高价氧化物对应的水化物的酸性越强,硫元素的非金属性强于碳元素,则硫酸的酸性强于碳酸,故B正确;
C.二氧化碳分子中碳原子的价层电子对数为2,碳原子的杂化方式为sp杂化,水分子中氧原子的价层电子对数为4,氧原子的杂化方式为sp3杂化,故C正确;
D.由分析可知,反应①为碳元素与浓硫酸反应共热反应生成二氧化硫、二氧化碳和水,反应②为二氧化硫与过氧化氢溶液反应生成硫酸,反应中均有元素发生化合价变化,均属于氧化还原反应,故D正确;
故选A。
9.B
【详解】A.金刚石属于共价晶体,石墨属于混合晶体,球碳分子、管状碳分子属于分子晶体,因此金刚石和石墨的熔点肯定要比球碳分子、管状碳分子高,A正确;
B.球碳分子、管状碳分子和石墨都是碳元素形成的不同单质,所以均为碳的同素异形体,B错误;
C.球碳分子、管状碳分子都是碳元素形成的不同单质,都能和氧气发生氧化反应,C正确;
D.金刚石属于共价晶体,球碳分子、管状碳分子都是分子晶体,D正确;
故选B。
10.D
【详解】A.金属晶体中存在金属阳离子和自由电子,不存在阴离子,A错误;
B.根据“均摊法”,晶胞中含个Fe,B错误;
C.由图可知,δ-Fe晶胞中Fe原子的配位数为8,α-Fe晶胞中铁原子的配位数为6,故二者晶胞中铁原子周围等距离且最近的铁原子个数之比为8∶6=4∶3,C错误;
D.根据“均摊法”, 晶胞中含个Fe,晶胞中含个Fe,则晶体密度比为,D正确;
故选D。
11.B
【详解】A.同一周期随着原子序数变大,第一电离能变大,P的3p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,A正确;
B.CO2为非极性分子,水分子为极性分子,CO2与水分子在极性上不相似,B错误;
C.浓CuCl2溶液显绿色,加水稀释过程中变蓝,氯化铜稀释过过程中发生反应,所以与、均能形成配合物,C正确;
D.金刚石和石墨晶体中碳原子成键方式和排列方式不同,金刚石的熔点低于石墨是由于金刚石中的C-C的键长比石墨中的C-C键键长大,键能小,D正确;
故选B。
12.A
【详解】A.超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,组成复杂的、有组织的聚集体,并保持一定的完整性使其具有明确的微观结构和宏观特性;冠醚是单独的一个分子结构,不是超分子,A错误;
B.已知冠醚能与阳离子作用,将阳离子以及对应的阴离子都带入有机溶剂,则冠醚与K+结合后将带入烯烃中,与烯烃充分接触而迅速反应,B正确;
C.冠醚提供孤对电子,K+提供空轨道,两者通过配位键形成超分子,C正确;
D.冠醚中碳原子杂化类型为sp3杂化,C、O原子间形成σ键,D正确;
故选A。
13.C
【详解】A.由总反应可知,放电时,负极锂失去电子发生氧化反应:,A正确;
B.充电时,阳极失去电子发生氧化反应:,外电路每转移1 mol ,阳极释放出1mol锂离子,质量减少1mol×7 g/mol=7g,B正确;
C.Li很活泼,会与水反应,不能用水溶液,C错误;
D.充电过程为电解池,则向阴极也就是原电池负极移动,D正确;
故选C。
14.C
【详解】A.盐酸是强酸,pH为2的盐酸溶液浓度为0.01mol/L,一水合氨是弱碱,pH为12的一水合氨溶液的浓度大于0.01mol/L,则pH为2的盐酸和pH为12的一水合氨溶液等体积混合后一水合氨溶液过量,溶液呈碱性,故A正确;
B.氢氧化钠溶液与醋酸溶液反应生成醋酸钠和水,氢氧化钠溶液与醋酸溶液等体积混合时,若氢氧化钠溶液的浓度大于或等于醋酸溶液的浓度,溶液呈碱性,若醋酸溶液的浓度大于氢氧化钠溶液,溶液可能呈酸性或中性,故B正确;
C.pH为2的硝酸溶液与pH为12的氢氧化钡溶液按照体积比为1:9混合时,溶液中的氢氧根离子浓度为mol/L=8×10—3 mol/L,溶液pH为11+lg8,故C错误;
D.设溶液的体积为VL,等体积pH为a的稀硫酸与pH为b的氢氧化钠溶液混合后溶液呈中性说明酸溶液中的氢离子物质的量与碱溶液中的氢氧根离子物质的量相等,则10—amol/L×VL=10—14+bmol/L×VL,解得a+b=14,故D正确;
故选C。
15.D
【分析】随着溶液pH值增大,碳酸氢根离子、碳酸根离子浓度变大,pH值较大时,溶液中碳酸根离子为主要离子,钙离子浓度随着碳酸根离子浓度增大而减小,故曲线Ⅰ、Ⅱ、Ⅲ分别为碳酸氢根离子、碳酸根离子、钙离子关系曲线;由Ⅰ中a点(6.3,-5)可知,,Ⅱ中c点(10.3,-1.1)可知,;
【详解】A.由分析可知,线Ⅰ代表与pH的关系曲线,A正确;
B.由分析可知,,B正确;
C.由图可知,b点溶液中,此时=,,C正确;
D.b点溶液中,,则,,故,D错误;
故选D。
16.(1)p
(2)1s22s22p63s23p63d6
(3)11
(4) F>O>N>C F>N>O>C
(5)第三周期第ⅢA族
(6) 三角锥形 sp3杂化
【分析】由图可知,a-i及p分别为氢、碳、氮、氧、氟、钠、铝、磷、氯、铁;
【详解】(1)c为氮,属于p区元素;
(2)基态离子为亚铁离子,是铁原子失去2个电子形成的,核外电子排布式是1s22s22p63s23p63d6;
(3)在同一原子轨道下最多可以有两个自旋方向不同的电子,自旋方向不同,运动状态也就不相同,即运动状态个数等于电子数;元素f为钠,基态原子核外有11种不同运动状态的电子;
(4)同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强,b、c、d、e四种元素按电负性由大到小顺序排列为F>O>N>C;同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,故第一电离能由大到小的顺序排列为F>N>O>C;
(5)由图可知,其第四电离能出现突变,则最外层有3个电子,是g元素,也就是铝元素,位于第三周期第ⅢA族;
(6)h和i可按原子个数比为1∶3形成化合物E为NCl3,分子中N原子的价层电子对数为3+=4,孤电子对数为1,所以为三角锥形结构,N原子采用sp3杂化。
17.(1) Mg 相反
(2)苯胺中有—NH2,分子间可形成氢键,而甲苯分子间不能形成氢键,分子间氢键可明显地提高分子晶体的熔、沸点
(3)N、B
(4)双键成键电子对之间的排斥作用大于单键成键电子对之间的排斥作用
(5) 12 A
(6)
【详解】(1)由元素周期表中的“对角线规则”可知,与Li的化学性质最相似的邻族元素是Mg;Mg为12号元素,M层只有2个电子,排布在3s轨道上,故M层的2个电子自旋状态相反;
(2)苯胺为有机物,结合题给信息中苯胺的熔、沸点可知苯胺为分子晶体,苯胺中有—NH2,分子间可形成氢键,而甲苯分子间不能形成氢键,分子间氢键可明显地提高分子晶体的熔、沸点;
(3)产物分子中N提供孤电子对、B提供空轨道,两者形成配位键,故N、B均形成4个共价键,均采取杂化;
(4)硫氧形成双键、硫氟形成单键,的原因主要是双键成键电子对之间的排斥作用大于单键成键电子对之间的排斥作用;
(5)以底面面心的铜原子为例,与其最近且相邻的铜原子,同层、上下层各存在4个,故其配位数为12;
A.为硫酸根离子和四氨合铜离子形成的,铜氮之间形成配位键、氮氢之间存在极性键,故所含的化学键有离子键、极性键和配位键,正确;
B.在中的N给出孤电子对,提供空轨道,形成配位键,错误;
C.同一主族随原子序数变大,原子半径变大,第一电离能变小;同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,组成元素中第一电离能最大的是N元素,错误;
D.等电子体是指价电子数和原子数相同的分子、离子或原子团,与不是互为等电子体,错误;
故选A;
(6))由三磷酸根离子的结构可知,中间P原子连接的4个O原子中,2个O原子完全属于该P原子,另外2个O原子分别属于2个P原子,故属于该P原子的O原子数为,属于左、右两边的2个P原子的O原子数为,故若这类磷酸根离子中含n个P原子,则O原子个数为3n+1,又O元素的化合价为-2,P元素的化合价为+5,故该离子所带电荷为-2×(3n+1)+5n=-n-2,这类磷酸根离子的化学式可用通式表示为。
18.(1)
(2) <
(3)B
(4) 氨水为碱性,和氢离子反应,使得氢离子浓度减小,平衡正向移动,使得的产率得到提高 2
【分析】向某草酸溶液中滴加KOH溶液,溶液中的量一直减小、的量先增加后减小、的量一直减小,故曲线1、2、3分别为、、的物质的量浓度分数δ(X)与pH的关系曲线;
【详解】(1)由点(1.2,0.5)可知,则室温下,草酸的一级电离常数;
(2)①由图可知,c点pH为(1.2+4.2)÷2=2.7,则向草酸溶液中滴加KOH溶液至<2.7的过程中主要反应为草酸和氢氧化钾生成草酸氢钾和水:;
②由点(4.2,0.5)可知,则室温下,草酸的电离常数;0.1 moL 溶液中的水解常数为,则其电离大于水解,溶液显酸性,,由电荷守恒可知,,则;
(3)A.0.0100 mol L 溶液中根据物料守恒可知,则,正确;
B.实验2滴加盐酸过程中pH由8.6降为4.8,则当pH=7时,由电荷守恒可知 :,错误;
C.实验3加入等体积0.0200 mol L 溶液,反应后钙离子过量,所得上层清液中,则,正确;
D.高锰酸根离子具有强氧化性,氧化草酸根离子生成二氧化碳,发生反应的离子方程式为,正确;
故选B。
(4)①制备时需添加氨水,氨水为碱性,和氢离子反应,使得氢离子浓度减小,平衡正向移动,使得的产率得到提高;
②亚铁离子和草酸根离子均会被高锰酸根离子氧化,铁化合价由+2变为+3、碳化合价由+3变为+4、锰化合价由+7变为+2,根据电子守恒可知,,则为,则,2。
答案第10页,共10页
答案第9页,共10页
期末考试化学学科试卷
考试时间:75分钟 试卷满分:100分
可能用到的相对原子质量:H-1 Li-7 C-12 O-16 Mg-24 P-31 Ni-59
第Ⅰ卷(选择题,共45分)
一、选择题(每小题只有一个正确选项,每小题3分,共45分)
1.化学与生活、生产息息相关。下列说法错误的是
A.将水闸和惰性电极分别连接电源的正极和负极,是外加电流法防腐
B.钛合金不仅具有优异的抗腐蚀性,还具有良好的生物兼容性
C.锅炉的内壁、船舶的外壳等常安装若干镁合金达到被保护的目的
D.在潮湿的空气中,白铁(镀锌铁)比马口铁(镀锡铁)镀层破损后腐蚀更慢一些
2.下列化学用语表述错误的是
A.乙烯的球棍模型 B.甲基的电子式:
C.基态O原子的价层电子排布式: D.p-pπ键的电子云轮廓图
3.下列说法正确的是
A.原子的核外电子排布式是:
B.、、轨道能量不相同
C.原子核外电子填充3p、3d、4s能级的顺序为
D.最外层电子排布式为的基态原子所对应元素一定是金属元素
4.下列关于电子云和原子轨道的说法正确的是
A.通常用小黑点来表示电子的多少,黑点密度大,电子数目多
B.s能级的原子轨道呈球形,处在该轨道上的电子在球壳上运动
C.所有原子的任一能层的s电子云轮廓图都是一个球形,并且球的半径大小相同
D.基态氯原子核外电子占有9个原子轨道
5.咔唑()是一种新型有机液体储氢介质。下列说法错误的是
A.碳、氮、氢三种元素电负性:N>C>H
B.同周期元素中第一电离能高于N的有3种
C.咔唑的沸点比的沸点高
D.基态氮原子的外围电子轨道表示式不能写为,因为违背了洪特规则
6.某种离子液体的结构如图所示,X、Y、Z、M、Q为原子序数依次增大的五种短周期非金属元素,Z的原子序数等于X、Y原子序数之和,Q为非金属性最强的元素。
下列说法正确的是
A.的键角大于的键角 B.的VSEPR模型为正四面体形
C.是极性分子,是非极性分子 D.M2的键能小于Q2的键能
7.DNA中四种碱基间的配对方式如图。以下说法不正确的是
A.配对碱基间的作用力属于共价键
B.碱基中元素第一电离能大小关系为N>O>C
C.鸟嘌呤与胞嘧啶之间的相互作用比腺嘌呤与胸腺嘧啶之间的更强
D.若图中①②分别代表不同化学键,则键能:②<①
8.短周期主族元素W、X、Y、W的原子序数依次增加,K、L、M、N均是由这些元素组成的二元化合物,甲是元素X的单质,是常见的固体,L和N组成元素相同,K是无色气体,是主要的大气污染物之一,0.05 mol L乙溶液的pH为1,上述物质的转化关系如图所示。
下列说法错误的是
A.简单氢化物的沸点:Z>Y
B.最高价氧化物对应的水化物的酸性Z>X
C.M、L中中心原子杂化方式分别为sp、杂化
D.反应①和反应②均为氧化还原反应
9.在20世纪90年代末,科学家发现碳有新的单质形态存在。后来人们又相继得到了、、、、等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是
A.金刚石和石墨的熔点肯定比球碳分子、管状碳分子的熔点高
B.球碳分子、管状碳分子和石墨互为同位素
C.球碳分子、管状碳分子都能与发生反应
D.金刚石展于共价晶体;球碳分子、管状碳分子属于分子晶体
10.铁有δ、γ、α三种同素异形体,其晶胞结构如图所示,下列判断正确的是
A.δ、γ、α铁晶体中存在金属阳离子和阴离子
B.晶胞中所含有的铁原子数为9
C.δ、α两种晶胞中铁原子周围等距离且最近的铁原子个数之比为3∶1
D.若晶胞棱长为acm,晶胞棱长为bcm,则两种晶体的密度比为
11.下列实验事实的理论解释不正确的是
选项 实验事实 理论解释
A 磷原子的第一电离能大于硫原子 磷原子3p能级半充满
B 分子在水中有一定溶解度 与水分子极性上相似
C 浓溶液显绿色,加水稀释过程中变蓝 与、均能形成配合物
D 石墨比金刚石熔点高 金刚石碳碳键键能更小
A.A B.B C.C D.D
12.冠醚能与阳离子作用,将阳离子以及对应的阴离子都带入有机溶剂,例如水溶液对烯烃的氧化效果较差,在烯烃中溶入冠醚,可使氧化反应迅速发生,原理如图。
下列说法错误的是
A.冠醚属于超分子
B.冠醚与结合后将带入烯烃中,与烯烃充分接触而迅速反应
C.通过配位键与冠醚相结合
D.冠醚中C、O原子间的化学键为σ键
13.市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导的高分子材料。这种锂离子电池的电池反应为:,下列说法不正确的是
A.放电时负极材料中Li失去电子发生氧化反应
B.充电时外电路每转移1 mol ,阳极质量减少7 g
C.该电池可用水溶液作为电解质
D.充电过程中向原电池负极移动
14.25℃时,有关下列溶液的说法不正确的是(已知)
A.的HCl和的溶液等体积混合后溶液呈碱性
B.NaOH和溶液等体积混合后的溶液可能呈酸性、中性或碱性
C.的硝酸和的氢氧化钡溶液按照体积比为1:9混合,混合液的pH为10
D.等体积的稀硫酸与的NaOH溶液混合,溶液呈中性,则
15.溶洞水体中的与空气中的保持平衡,其水体中(X为、、或)与pH的关系如图所示。已知,下列说法错误的是
A.线Ⅰ代表与pH的关系曲线
B.
C.b点溶液中, mol L
D.
第Ⅱ卷(非选择题,共55分)
二、非选择题(本题包括4个小题,共55分)
16.下表是元素周期表的一部分,表中所列字母分别代表一种元素。回答下列问题:
(1)依据元素周期表的分区,元素c属于 区;
(2)基态离子的核外电子排布式是 :
(3)元素f的基态原子核外有 种不同运动状态的电子;
(4)b、c、d、e四种元素按电负性由大到小顺序排列为 (用元素符号表示,下同),按第一电离能由大到小的顺序排列为 ;
(5)表中某主族元素的电离能情况如下图所示,则该元素在周期表中的位置 ;
(6)h和i可按原子个数比为1∶3形成化合物E,E的空间构型为 ,中心原子的杂化轨道类型为 。
17.材料是生物医疗、国防军事以及航空航天等领域发展提供支撑。
(1)磷酸亚铁锂()常用作锂离子电池正极材料,周期表中与Li的化学性质最相似的邻族元素是 (填元素符号),该元素基态原子核外M层电子自旋状态 (填“相同”或“相反”);
(2)苯胺()常作为合成原料,与甲苯()相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是 ;
(3)反应的产物分子中采取杂化的原子是 (填元素名称):
(4)是制备氟磺酸类化合物的常用原料,分子结构如图所示:
已知键角α为124°,β为96°,则的原因主要是 ;
(5)第三代硅太阳能电池以铜钢镓硒CiGs(CIS中掺入Ga)等化合物为主要材料。Cu晶体的晶胞如图,其配位数为 ;
往溶液中加入过量氨水,可生成,下列说法正确的是 ;
A.中所含的化学键有离子键、极性键和配位键
B.在中给出孤电子对,提供空轨道
C.组成元素中第一电离能最大的是氧元素
D.与互为等电子体,空间构型均为正四面体形
(6)和属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
这类磷酸根离子的化学式可用通式表示为 (用n代表P原子数)。
18.向某草酸溶液中滴加KOH溶液,溶液中、、的物质的量浓度分数δ(X)[]与pH的关系如图所示:
请回答下列问题:
(1)室温下,草酸的一级电离常数为 ;
(2)①向草酸溶液中滴加KOH溶液至的过程中主要反应的离子方程式为 。
②0.1 moL 溶液中, (填“>”、“<”或“=”);
(3)室温下,通过下列实验探究0.0100 mol L 溶液的性质:
实验1:实验测得0.0100 mol L 溶液的pH为8.6。
实验2:向溶液中滴加等体积、0.0100 mol L HCl溶液。pH由8.6降为4.8。
实验3:向溶液中加入等体积0.0200 mol L 溶液,出现白色沉淀。
实验4:向稀硫酸酸化的,溶液中滴加溶液至溶液褪色。
已知室温下,下列说法错误的是_______;
A.0.0100 mol L 溶液中满足:
B.实验2滴加盐酸过程中不可能存在:
C.实验3所得上层清液中: mol L
D.实验4发生反应的离子方程式为
(4)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:。
①制备时需添加氨水以提高的产率,从化学平衡移动角度解释原因 :
②测定草酸亚铁晶体()的x值,实验如下:
称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用酸性溶液漓定。到达滴定终点时,消耗0.1000 mol·L的酸性溶液18.00 mL。
则中 (的摩尔质量是144 g mol)。
试卷第8页,共8页
1.A
【详解】A.应将水中的钢闸门连接电源的负极,钢闸门不参与反应,起到了保护作用,该方法是外加电流的阴极保护法,A错误;
B.钛合金性能优良,不仅具有优异的抗腐蚀性,还具有良好的生物兼容性,B正确;
C.镁比铁活泼,可以做原电池的负极而保护钢铁,C正确;
D.镀层破损后,马口铁(镀锡铁)中铁做负极被腐蚀,白铁皮(镀锌铁)中锌做负极、铁做正极被保护,故马口铁(镀锡铁)不如白铁皮(镀锌铁)耐腐蚀,D正确;
故选A。
2.B
【详解】A.乙烯分子中含碳碳双键,球棍模型中黑球代表碳原子,白球代表氢原子,棍代表共价键,,A正确;
B.甲基中含有1个未成对电子,电子式:,B错误;
C.O为8号元素,基态O原子的价层电子排布式:,C正确;
D.p-pπ键的电子云为镜面对称,D正确;
故选B。
3.C
【详解】A.铜元素的原子序数为29,基态原子的核外电子排布式为1s22s22p63s23p63d104s1,故A错误;
B.、、为简并轨道,轨道能量相同,但轨道的伸展方向不同,故B错误;
C.由能量最低原理可知,原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d,故C正确;
D.最外层电子排布式为ns2的基态原子所对应元素不一定是金属元素,如基态原子的最外层电子排布式为1s2的氦元素为非金属元素,故D错误;
故选C。
4.D
【详解】A.小黑点表示电子在核外空间某处出现的机会,不表示电子数目,A错误;
B.s能级的原子轨道呈球形,处在该轨道上的电子不只在球壳内运动,还在球壳外运动,只是在球壳外运动概率较小,B错误;
C.所有原子的任一能层的s电子云轮廓图都是一个球形,但是能层不同球的半径大小不同,C错误;
D.基态氯原子核外电子排布为1s22s22p63s23p5,核外电子占有9个原子轨道,D正确;
故选D。
5.B
【详解】A.同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;电负性:N>C>H,A正确;
B.同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,在第二周期元素中第一电离能小于N的有:锂、铍、硼、碳、氧共5种,高于N的有2种,B错误;
C.咔唑中能形成分子间氢键,所以咔唑的沸点比的沸点高,C正确;
D.洪特规则是指在相同能量的轨道上,电子总是尽可能分占不同的轨道且自旋方向相同;如果基态氮原子的外围电子轨道表示式不能写为,因为违背了洪特规则,D正确;
故选B。
6.B
【分析】X、Y、Z、M、Q为原子序数依次增大的五种短周期非金属元素,Q为非金属性最强的元素,则Q为F元素;由阴阳离子的结构可知,离子中X、Y、Z、M形成的共价键数目分别为1、4、4、4,Z的原子序数等于X、Y原子序数之和,则X为H元素、Y为B元素、Z为C元素、M为N元素。
【详解】A.氨分子中氮原子的孤对电子对数为1,甲烷分子中碳原子的孤对电子对数为0,孤对电子对数越多,对成键电子对的斥力越大,分子的键角越小,所以甲烷分子的键角大于氨分子,故A错误;
B.四氟合硼离子中硼原子的价层电子对数为4,孤对电子对数为0,离子的VSEPR模型为正四面体形,故B正确;
C.三氟化氨分子中氮原子的价层电子对数为4、孤对电子对数为1,分子的空间构型为结构不对称的三角锥形,属于极性分子,故C错误;
D.氮气分子中氮氮三键的键能大于氟气分子中氟氟单键的键能,故D错误;
故选B。
7.A
【详解】A.配对碱基间的作用力属于属于分子间作用力,而不是共价键,A错误;
B.同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,第一电离能大小关系为N>O>C,B正确;
C.鸟嘌呤与胞嘧啶之间形成3个氢键,腺嘌呤与胸腺嘧啶之间形成2个氢键,故鸟嘌呤与胞嘧啶之间的相互作用比腺嘌呤与胸腺嘧啶之间的更强,C正确;
D.①②分别为碳氮单键和碳氮双键,单键键长长,键能小,所以键能:①<②,D正确;
故选A。
8.A
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,K、L、M均是由这些元素组成的二元化合物,0.05mol/L乙溶液pH为l,说明乙为二元强酸,甲是元素X的单质,是常见的固体,K是无色气体,是主要的大气污染物之一,则甲为碳、乙为硫酸、K为二氧化硫;由转化关系可知,乙的浓溶液与碳共热反应生成二氧化硫、二氧化碳和水,L和N组成元素相同,N能与二氧化硫反应生成硫酸,则L为水、M为二氧化碳、N为过氧化氢,所以W为H元素、X为C元素、Y为O元素、Z为S元素。
【详解】A.水分子能形成分子间氢键,硫化氢不能形成分子间氢键,则水分子的分子间作用力大于硫化氢,沸点高于硫化氢,故A错误;
B.元素的非金属性越强,最高价氧化物对应的水化物的酸性越强,硫元素的非金属性强于碳元素,则硫酸的酸性强于碳酸,故B正确;
C.二氧化碳分子中碳原子的价层电子对数为2,碳原子的杂化方式为sp杂化,水分子中氧原子的价层电子对数为4,氧原子的杂化方式为sp3杂化,故C正确;
D.由分析可知,反应①为碳元素与浓硫酸反应共热反应生成二氧化硫、二氧化碳和水,反应②为二氧化硫与过氧化氢溶液反应生成硫酸,反应中均有元素发生化合价变化,均属于氧化还原反应,故D正确;
故选A。
9.B
【详解】A.金刚石属于共价晶体,石墨属于混合晶体,球碳分子、管状碳分子属于分子晶体,因此金刚石和石墨的熔点肯定要比球碳分子、管状碳分子高,A正确;
B.球碳分子、管状碳分子和石墨都是碳元素形成的不同单质,所以均为碳的同素异形体,B错误;
C.球碳分子、管状碳分子都是碳元素形成的不同单质,都能和氧气发生氧化反应,C正确;
D.金刚石属于共价晶体,球碳分子、管状碳分子都是分子晶体,D正确;
故选B。
10.D
【详解】A.金属晶体中存在金属阳离子和自由电子,不存在阴离子,A错误;
B.根据“均摊法”,晶胞中含个Fe,B错误;
C.由图可知,δ-Fe晶胞中Fe原子的配位数为8,α-Fe晶胞中铁原子的配位数为6,故二者晶胞中铁原子周围等距离且最近的铁原子个数之比为8∶6=4∶3,C错误;
D.根据“均摊法”, 晶胞中含个Fe,晶胞中含个Fe,则晶体密度比为,D正确;
故选D。
11.B
【详解】A.同一周期随着原子序数变大,第一电离能变大,P的3p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,A正确;
B.CO2为非极性分子,水分子为极性分子,CO2与水分子在极性上不相似,B错误;
C.浓CuCl2溶液显绿色,加水稀释过程中变蓝,氯化铜稀释过过程中发生反应,所以与、均能形成配合物,C正确;
D.金刚石和石墨晶体中碳原子成键方式和排列方式不同,金刚石的熔点低于石墨是由于金刚石中的C-C的键长比石墨中的C-C键键长大,键能小,D正确;
故选B。
12.A
【详解】A.超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,组成复杂的、有组织的聚集体,并保持一定的完整性使其具有明确的微观结构和宏观特性;冠醚是单独的一个分子结构,不是超分子,A错误;
B.已知冠醚能与阳离子作用,将阳离子以及对应的阴离子都带入有机溶剂,则冠醚与K+结合后将带入烯烃中,与烯烃充分接触而迅速反应,B正确;
C.冠醚提供孤对电子,K+提供空轨道,两者通过配位键形成超分子,C正确;
D.冠醚中碳原子杂化类型为sp3杂化,C、O原子间形成σ键,D正确;
故选A。
13.C
【详解】A.由总反应可知,放电时,负极锂失去电子发生氧化反应:,A正确;
B.充电时,阳极失去电子发生氧化反应:,外电路每转移1 mol ,阳极释放出1mol锂离子,质量减少1mol×7 g/mol=7g,B正确;
C.Li很活泼,会与水反应,不能用水溶液,C错误;
D.充电过程为电解池,则向阴极也就是原电池负极移动,D正确;
故选C。
14.C
【详解】A.盐酸是强酸,pH为2的盐酸溶液浓度为0.01mol/L,一水合氨是弱碱,pH为12的一水合氨溶液的浓度大于0.01mol/L,则pH为2的盐酸和pH为12的一水合氨溶液等体积混合后一水合氨溶液过量,溶液呈碱性,故A正确;
B.氢氧化钠溶液与醋酸溶液反应生成醋酸钠和水,氢氧化钠溶液与醋酸溶液等体积混合时,若氢氧化钠溶液的浓度大于或等于醋酸溶液的浓度,溶液呈碱性,若醋酸溶液的浓度大于氢氧化钠溶液,溶液可能呈酸性或中性,故B正确;
C.pH为2的硝酸溶液与pH为12的氢氧化钡溶液按照体积比为1:9混合时,溶液中的氢氧根离子浓度为mol/L=8×10—3 mol/L,溶液pH为11+lg8,故C错误;
D.设溶液的体积为VL,等体积pH为a的稀硫酸与pH为b的氢氧化钠溶液混合后溶液呈中性说明酸溶液中的氢离子物质的量与碱溶液中的氢氧根离子物质的量相等,则10—amol/L×VL=10—14+bmol/L×VL,解得a+b=14,故D正确;
故选C。
15.D
【分析】随着溶液pH值增大,碳酸氢根离子、碳酸根离子浓度变大,pH值较大时,溶液中碳酸根离子为主要离子,钙离子浓度随着碳酸根离子浓度增大而减小,故曲线Ⅰ、Ⅱ、Ⅲ分别为碳酸氢根离子、碳酸根离子、钙离子关系曲线;由Ⅰ中a点(6.3,-5)可知,,Ⅱ中c点(10.3,-1.1)可知,;
【详解】A.由分析可知,线Ⅰ代表与pH的关系曲线,A正确;
B.由分析可知,,B正确;
C.由图可知,b点溶液中,此时=,,C正确;
D.b点溶液中,,则,,故,D错误;
故选D。
16.(1)p
(2)1s22s22p63s23p63d6
(3)11
(4) F>O>N>C F>N>O>C
(5)第三周期第ⅢA族
(6) 三角锥形 sp3杂化
【分析】由图可知,a-i及p分别为氢、碳、氮、氧、氟、钠、铝、磷、氯、铁;
【详解】(1)c为氮,属于p区元素;
(2)基态离子为亚铁离子,是铁原子失去2个电子形成的,核外电子排布式是1s22s22p63s23p63d6;
(3)在同一原子轨道下最多可以有两个自旋方向不同的电子,自旋方向不同,运动状态也就不相同,即运动状态个数等于电子数;元素f为钠,基态原子核外有11种不同运动状态的电子;
(4)同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强,b、c、d、e四种元素按电负性由大到小顺序排列为F>O>N>C;同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,故第一电离能由大到小的顺序排列为F>N>O>C;
(5)由图可知,其第四电离能出现突变,则最外层有3个电子,是g元素,也就是铝元素,位于第三周期第ⅢA族;
(6)h和i可按原子个数比为1∶3形成化合物E为NCl3,分子中N原子的价层电子对数为3+=4,孤电子对数为1,所以为三角锥形结构,N原子采用sp3杂化。
17.(1) Mg 相反
(2)苯胺中有—NH2,分子间可形成氢键,而甲苯分子间不能形成氢键,分子间氢键可明显地提高分子晶体的熔、沸点
(3)N、B
(4)双键成键电子对之间的排斥作用大于单键成键电子对之间的排斥作用
(5) 12 A
(6)
【详解】(1)由元素周期表中的“对角线规则”可知,与Li的化学性质最相似的邻族元素是Mg;Mg为12号元素,M层只有2个电子,排布在3s轨道上,故M层的2个电子自旋状态相反;
(2)苯胺为有机物,结合题给信息中苯胺的熔、沸点可知苯胺为分子晶体,苯胺中有—NH2,分子间可形成氢键,而甲苯分子间不能形成氢键,分子间氢键可明显地提高分子晶体的熔、沸点;
(3)产物分子中N提供孤电子对、B提供空轨道,两者形成配位键,故N、B均形成4个共价键,均采取杂化;
(4)硫氧形成双键、硫氟形成单键,的原因主要是双键成键电子对之间的排斥作用大于单键成键电子对之间的排斥作用;
(5)以底面面心的铜原子为例,与其最近且相邻的铜原子,同层、上下层各存在4个,故其配位数为12;
A.为硫酸根离子和四氨合铜离子形成的,铜氮之间形成配位键、氮氢之间存在极性键,故所含的化学键有离子键、极性键和配位键,正确;
B.在中的N给出孤电子对,提供空轨道,形成配位键,错误;
C.同一主族随原子序数变大,原子半径变大,第一电离能变小;同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,组成元素中第一电离能最大的是N元素,错误;
D.等电子体是指价电子数和原子数相同的分子、离子或原子团,与不是互为等电子体,错误;
故选A;
(6))由三磷酸根离子的结构可知,中间P原子连接的4个O原子中,2个O原子完全属于该P原子,另外2个O原子分别属于2个P原子,故属于该P原子的O原子数为,属于左、右两边的2个P原子的O原子数为,故若这类磷酸根离子中含n个P原子,则O原子个数为3n+1,又O元素的化合价为-2,P元素的化合价为+5,故该离子所带电荷为-2×(3n+1)+5n=-n-2,这类磷酸根离子的化学式可用通式表示为。
18.(1)
(2) <
(3)B
(4) 氨水为碱性,和氢离子反应,使得氢离子浓度减小,平衡正向移动,使得的产率得到提高 2
【分析】向某草酸溶液中滴加KOH溶液,溶液中的量一直减小、的量先增加后减小、的量一直减小,故曲线1、2、3分别为、、的物质的量浓度分数δ(X)与pH的关系曲线;
【详解】(1)由点(1.2,0.5)可知,则室温下,草酸的一级电离常数;
(2)①由图可知,c点pH为(1.2+4.2)÷2=2.7,则向草酸溶液中滴加KOH溶液至<2.7的过程中主要反应为草酸和氢氧化钾生成草酸氢钾和水:;
②由点(4.2,0.5)可知,则室温下,草酸的电离常数;0.1 moL 溶液中的水解常数为,则其电离大于水解,溶液显酸性,,由电荷守恒可知,,则;
(3)A.0.0100 mol L 溶液中根据物料守恒可知,则,正确;
B.实验2滴加盐酸过程中pH由8.6降为4.8,则当pH=7时,由电荷守恒可知 :,错误;
C.实验3加入等体积0.0200 mol L 溶液,反应后钙离子过量,所得上层清液中,则,正确;
D.高锰酸根离子具有强氧化性,氧化草酸根离子生成二氧化碳,发生反应的离子方程式为,正确;
故选B。
(4)①制备时需添加氨水,氨水为碱性,和氢离子反应,使得氢离子浓度减小,平衡正向移动,使得的产率得到提高;
②亚铁离子和草酸根离子均会被高锰酸根离子氧化,铁化合价由+2变为+3、碳化合价由+3变为+4、锰化合价由+7变为+2,根据电子守恒可知,,则为,则,2。
答案第10页,共10页
答案第9页,共10页
同课章节目录
