2023-2024学年高中化学人教版选择性必修2易错点达标练习(含答案)
文档属性
| 名称 | 2023-2024学年高中化学人教版选择性必修2易错点达标练习(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 716.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-22 07:40:45 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2023-2024学年高中化学人教版选择性必修2易错点达标练习
一、选择题
1.含有未成对电子的物质具有顺磁性。下列物质具有顺磁性的是( )
A. B. C.NO D.Be
2.可用作白色颜料和阻燃剂,在实验室中可利用的水解反应制取,总反应可表示为。下列化学用语表示正确的是( )
A.的电子式:
B.基态原子价层电子排布图:
C.和互为同位素
D.的VSEPR模型:
3.苯甲酰胺是常见的酰胺类物质,可用于合成农药和医药,其结构简式如图所示。下列说法正确的是( )
A.分子式为
B.分子中含有1个手性碳原子
C.分子中碳原子的杂化轨道类型是
D.在碱性条件下加热水解,可生成苯甲酸盐和氨
4.某离子液体结构如下图所示。W、X、Y、Z原子序数依次增大,W、X和Y的原子序数之和为14,X和Y基态原子的核外未成对电子数之和为5,Z是第四周期元素。下列说法错误的是( )
A.X、Z的简单氢化物均可溶于水
B.电负性:
C.第一电离能:
D.W、Y、Z可形成既含离子键又含共价键的化合物
5.下列关于物质的结构与性质描述错误的是( )
A.石英的熔点、硬度比金刚石的小
B.分子中存在非极性共价键
C.既含有离子键又含有共价键
D.的熔点比的高,因为氨分子间存在氢键
6.高分子的循环利用过程如下图所示。下列说法错误的是(不考虑立体异构)( )
A.b生成a的反应属于加聚反应
B.a中碳原子杂化方式为和
C.a的链节与b分子中氢元素的质量分数不同
D.b与发生加成反应最多可生成4种二溴代物
7.关于反应,下列说法正确的是( )
A.分子中没有极性键
B.的模型和空间结构一致
C.的电子式为
D.分子之间的范德华力强于氢键
8.亚氨基锂是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为。下列有关说法错误的是( )
A.中的化合价是
B.参与反应,还原产物比氧化产物多
C.该反应中既是氧化剂又是还原剂
D.和都属于离子化合物
9.已知前四周期元素X、Y、Z、R的原子序数依次增大。X是最轻的元素,Y的p轨道比s轨道少2个电子,Z与Y同周期,Z的最简氢化物水溶液呈碱性,R元素常被称为“21世纪金属”,广泛用作航空材料。元素Y和R组成的某气态团簇分子结构如图所示。下列说法正确的是( )。
A.最简氢化物熔沸点比较:Y<Z
B.元素X分别与Y、Z组成的常见化合物均为极性分子
C.基态Y、Z原子核外电子均有5种空间运动状态
D.该气态团簇分子的分子式为RY
二、非选择题
10.锡在材料、医药、化工等方面有广泛的应用,锡精矿中主要有、S、、、等杂质元素。下图为锡的冶炼工艺流程。
已知:性质稳定,难溶于酸。
回答下列问题:
(1)锡的原子序数为50,其价层电子排布式为 ,在元素周期表中位于 区。
(2)烟尘中的主要杂质元素是 (填元素符号)。
(3)酸浸时,生成,该反应的离子方程式为 ,为了提高铅的浸出率,最宜添加 (填标号)。
A. B. C. D.
(4)还原时需加入过量的焦炭,写出该反应的化学方程式 。
(5)电解精炼时,以和少量作为电解液,电源的负极与 (填“粗锡”或“精锡”)相连;的作用是 、 。
(6)酸浸滤液中的可用沉淀,并通过与强碱反应获得,写出与熔融反应的化学方程式 。
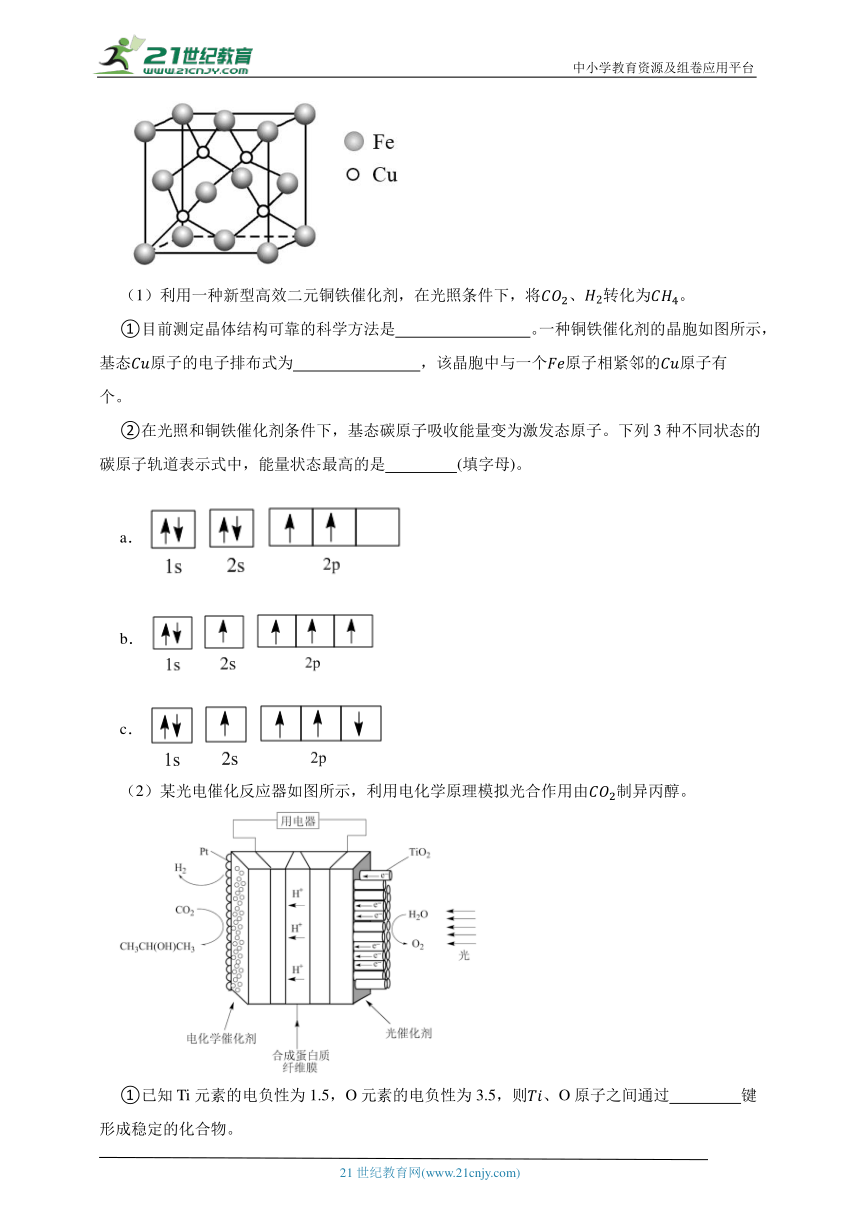
11.科学家模拟光合作用,利用太阳能制备甲烷和异丙醇等燃料。
(1)利用一种新型高效二元铜铁催化剂,在光照条件下,将、转化为。
①目前测定晶体结构可靠的科学方法是 。一种铜铁催化剂的晶胞如图所示,基态原子的电子排布式为 ,该晶胞中与一个原子相紧邻的原子有 个。
②在光照和铜铁催化剂条件下,基态碳原子吸收能量变为激发态原子。下列3种不同状态的碳原子轨道表示式中,能量状态最高的是 (填字母)。
a.
b.
c.
(2)某光电催化反应器如图所示,利用电化学原理模拟光合作用由制异丙醇。
①已知Ti元素的电负性为1.5,O元素的电负性为3.5,则、O原子之间通过 键形成稳定的化合物。
②电极表面生成异丙醇的电极反应式为 ,此电极反应需选用高活性和高选择性的电化学催化剂,其目的是 。
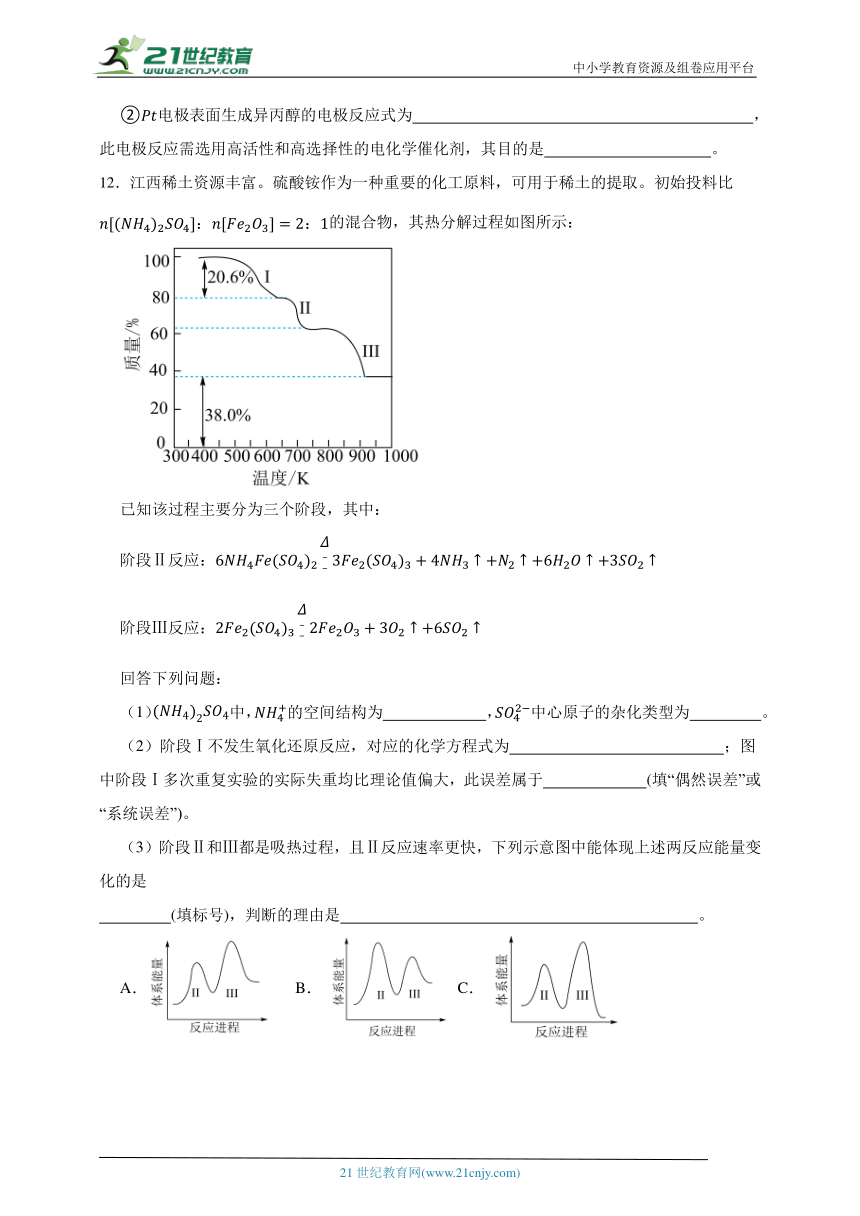
12.江西稀土资源丰富。硫酸铵作为一种重要的化工原料,可用于稀土的提取。初始投料比的混合物,其热分解过程如图所示:
已知该过程主要分为三个阶段,其中:
阶段Ⅱ反应:
阶段Ⅲ反应:
回答下列问题:
(1)中,的空间结构为 ,中心原子的杂化类型为 。
(2)阶段Ⅰ不发生氧化还原反应,对应的化学方程式为 ;图中阶段Ⅰ多次重复实验的实际失重均比理论值偏大,此误差属于 (填“偶然误差”或“系统误差”)。
(3)阶段Ⅱ和Ⅲ都是吸热过程,且Ⅱ反应速率更快,下列示意图中能体现上述两反应能量变化的是
(填标号),判断的理由是 。
A. B. C. D.
(4)该热分解过程中,的作用为 。
(5)一定温度下,在真空刚性容器中,的分解过程会发生下列反应:
主反应
副反应
两个反应的平衡常数比值随反应温度升高而 (填“增大”,“减小”或“不变”);若平衡时总压为的体积分数为0.4,主反应的平衡常数 。
(6)在高温下可以自发分解,原因是 。
13.是一种易溶于热水,难溶于乙醇的紫红色晶体。可通过如下实验步骤制备。
Ⅰ.将适量氯化铵溶于浓氨水中,搅拌下,分批次加入研细的,得到沉淀。
Ⅱ.边搅拌边慢慢滴入足量溶液,得到溶液。
Ⅲ.慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤。
Ⅳ.依次用不同试剂洗涤晶体,烘干,得到产品。
回答下列问题:
(1)本实验涉及钴配合物的配体有 (填化学式)。
(2)本实验应在通风橱中进行,原因是 。
(3)步骤Ⅰ中分批次加入研细的,原因是 。
(4)步骤Ⅱ发生反应的离子方程式是 。
(5)步骤Ⅳ中使用的洗涤试剂有:①冷水 ②乙醇 ③冷的盐酸 ④丙酮。试剂使用的先后顺序是:① ④(填序号)。
(6)已知:;。则在水溶液中的稳定性: (填“大于”或“小于”)。
(7)本实验的产率最接近于____(填标号)。
A. B. C. D.
答案解析部分
1.【答案】C
2.【答案】C
3.【答案】D
4.【答案】A
5.【答案】B
6.【答案】D
7.【答案】B
8.【答案】B
9.【答案】A
10.【答案】(1)5s25p2;p
(2)S、、
(3);D
(4)
(5)精锡;增强溶液的导电性;防止Sn2+的水解
(6)
11.【答案】(1)X 射线衍射法;[Ar]3d104s1;4;c
(2)离子;3CO2+18e-+18H+=CH3CH(OH)CH3+5H2O;有效抑制析氢反应
12.【答案】(1)正四面体;sp3
(2);系统误差
(3)A;阶段Ⅱ和Ⅲ都是吸热过程,产物能量大于反应物,且Ⅱ反应速率更快,活化能越低,反应速率就越快
(4)催化剂
(5)减小;
(6)分解为吸热反应,同时还是气体体积分数增大的反应,高温下
13.【答案】(1)NH3,Cl-、H2O
(2)需要使用浓氨水、浓盐酸这种有毒易挥发的物质
(3)控制化学反应进行的速率,避免其反应过快
(4)
(5)③②
(6)小于
(7)A
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2023-2024学年高中化学人教版选择性必修2易错点达标练习
一、选择题
1.含有未成对电子的物质具有顺磁性。下列物质具有顺磁性的是( )
A. B. C.NO D.Be
2.可用作白色颜料和阻燃剂,在实验室中可利用的水解反应制取,总反应可表示为。下列化学用语表示正确的是( )
A.的电子式:
B.基态原子价层电子排布图:
C.和互为同位素
D.的VSEPR模型:
3.苯甲酰胺是常见的酰胺类物质,可用于合成农药和医药,其结构简式如图所示。下列说法正确的是( )
A.分子式为
B.分子中含有1个手性碳原子
C.分子中碳原子的杂化轨道类型是
D.在碱性条件下加热水解,可生成苯甲酸盐和氨
4.某离子液体结构如下图所示。W、X、Y、Z原子序数依次增大,W、X和Y的原子序数之和为14,X和Y基态原子的核外未成对电子数之和为5,Z是第四周期元素。下列说法错误的是( )
A.X、Z的简单氢化物均可溶于水
B.电负性:
C.第一电离能:
D.W、Y、Z可形成既含离子键又含共价键的化合物
5.下列关于物质的结构与性质描述错误的是( )
A.石英的熔点、硬度比金刚石的小
B.分子中存在非极性共价键
C.既含有离子键又含有共价键
D.的熔点比的高,因为氨分子间存在氢键
6.高分子的循环利用过程如下图所示。下列说法错误的是(不考虑立体异构)( )
A.b生成a的反应属于加聚反应
B.a中碳原子杂化方式为和
C.a的链节与b分子中氢元素的质量分数不同
D.b与发生加成反应最多可生成4种二溴代物
7.关于反应,下列说法正确的是( )
A.分子中没有极性键
B.的模型和空间结构一致
C.的电子式为
D.分子之间的范德华力强于氢键
8.亚氨基锂是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为。下列有关说法错误的是( )
A.中的化合价是
B.参与反应,还原产物比氧化产物多
C.该反应中既是氧化剂又是还原剂
D.和都属于离子化合物
9.已知前四周期元素X、Y、Z、R的原子序数依次增大。X是最轻的元素,Y的p轨道比s轨道少2个电子,Z与Y同周期,Z的最简氢化物水溶液呈碱性,R元素常被称为“21世纪金属”,广泛用作航空材料。元素Y和R组成的某气态团簇分子结构如图所示。下列说法正确的是( )。
A.最简氢化物熔沸点比较:Y<Z
B.元素X分别与Y、Z组成的常见化合物均为极性分子
C.基态Y、Z原子核外电子均有5种空间运动状态
D.该气态团簇分子的分子式为RY
二、非选择题
10.锡在材料、医药、化工等方面有广泛的应用,锡精矿中主要有、S、、、等杂质元素。下图为锡的冶炼工艺流程。
已知:性质稳定,难溶于酸。
回答下列问题:
(1)锡的原子序数为50,其价层电子排布式为 ,在元素周期表中位于 区。
(2)烟尘中的主要杂质元素是 (填元素符号)。
(3)酸浸时,生成,该反应的离子方程式为 ,为了提高铅的浸出率,最宜添加 (填标号)。
A. B. C. D.
(4)还原时需加入过量的焦炭,写出该反应的化学方程式 。
(5)电解精炼时,以和少量作为电解液,电源的负极与 (填“粗锡”或“精锡”)相连;的作用是 、 。
(6)酸浸滤液中的可用沉淀,并通过与强碱反应获得,写出与熔融反应的化学方程式 。
11.科学家模拟光合作用,利用太阳能制备甲烷和异丙醇等燃料。
(1)利用一种新型高效二元铜铁催化剂,在光照条件下,将、转化为。
①目前测定晶体结构可靠的科学方法是 。一种铜铁催化剂的晶胞如图所示,基态原子的电子排布式为 ,该晶胞中与一个原子相紧邻的原子有 个。
②在光照和铜铁催化剂条件下,基态碳原子吸收能量变为激发态原子。下列3种不同状态的碳原子轨道表示式中,能量状态最高的是 (填字母)。
a.
b.
c.
(2)某光电催化反应器如图所示,利用电化学原理模拟光合作用由制异丙醇。
①已知Ti元素的电负性为1.5,O元素的电负性为3.5,则、O原子之间通过 键形成稳定的化合物。
②电极表面生成异丙醇的电极反应式为 ,此电极反应需选用高活性和高选择性的电化学催化剂,其目的是 。
12.江西稀土资源丰富。硫酸铵作为一种重要的化工原料,可用于稀土的提取。初始投料比的混合物,其热分解过程如图所示:
已知该过程主要分为三个阶段,其中:
阶段Ⅱ反应:
阶段Ⅲ反应:
回答下列问题:
(1)中,的空间结构为 ,中心原子的杂化类型为 。
(2)阶段Ⅰ不发生氧化还原反应,对应的化学方程式为 ;图中阶段Ⅰ多次重复实验的实际失重均比理论值偏大,此误差属于 (填“偶然误差”或“系统误差”)。
(3)阶段Ⅱ和Ⅲ都是吸热过程,且Ⅱ反应速率更快,下列示意图中能体现上述两反应能量变化的是
(填标号),判断的理由是 。
A. B. C. D.
(4)该热分解过程中,的作用为 。
(5)一定温度下,在真空刚性容器中,的分解过程会发生下列反应:
主反应
副反应
两个反应的平衡常数比值随反应温度升高而 (填“增大”,“减小”或“不变”);若平衡时总压为的体积分数为0.4,主反应的平衡常数 。
(6)在高温下可以自发分解,原因是 。
13.是一种易溶于热水,难溶于乙醇的紫红色晶体。可通过如下实验步骤制备。
Ⅰ.将适量氯化铵溶于浓氨水中,搅拌下,分批次加入研细的,得到沉淀。
Ⅱ.边搅拌边慢慢滴入足量溶液,得到溶液。
Ⅲ.慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤。
Ⅳ.依次用不同试剂洗涤晶体,烘干,得到产品。
回答下列问题:
(1)本实验涉及钴配合物的配体有 (填化学式)。
(2)本实验应在通风橱中进行,原因是 。
(3)步骤Ⅰ中分批次加入研细的,原因是 。
(4)步骤Ⅱ发生反应的离子方程式是 。
(5)步骤Ⅳ中使用的洗涤试剂有:①冷水 ②乙醇 ③冷的盐酸 ④丙酮。试剂使用的先后顺序是:① ④(填序号)。
(6)已知:;。则在水溶液中的稳定性: (填“大于”或“小于”)。
(7)本实验的产率最接近于____(填标号)。
A. B. C. D.
答案解析部分
1.【答案】C
2.【答案】C
3.【答案】D
4.【答案】A
5.【答案】B
6.【答案】D
7.【答案】B
8.【答案】B
9.【答案】A
10.【答案】(1)5s25p2;p
(2)S、、
(3);D
(4)
(5)精锡;增强溶液的导电性;防止Sn2+的水解
(6)
11.【答案】(1)X 射线衍射法;[Ar]3d104s1;4;c
(2)离子;3CO2+18e-+18H+=CH3CH(OH)CH3+5H2O;有效抑制析氢反应
12.【答案】(1)正四面体;sp3
(2);系统误差
(3)A;阶段Ⅱ和Ⅲ都是吸热过程,产物能量大于反应物,且Ⅱ反应速率更快,活化能越低,反应速率就越快
(4)催化剂
(5)减小;
(6)分解为吸热反应,同时还是气体体积分数增大的反应,高温下
13.【答案】(1)NH3,Cl-、H2O
(2)需要使用浓氨水、浓盐酸这种有毒易挥发的物质
(3)控制化学反应进行的速率,避免其反应过快
(4)
(5)③②
(6)小于
(7)A
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
