广西壮族自治区百色市2023-2024学年高一上学期期末教学质量调研化学试题(含解析)
文档属性
| 名称 | 广西壮族自治区百色市2023-2024学年高一上学期期末教学质量调研化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-21 21:36:11 | ||
图片预览



文档简介
百色市2023-2024学年高一上学期期末教学质量调研
化学
(试卷总分100分;考试时长75分钟)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.答题前,考生务必将自己的班级、姓名、准考证号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案标号,写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上.写在本试卷上无效.
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 K-39
Fe-56 Cu-64
第Ⅰ卷
一、选择题:本题共14题,每题3分,共42分,每小题只有1个选项符合题意。
1.化学与生产、生活密切相关。下列有关说法不正确的是( )
A.硬铝(铝合金)密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料.
B.储氢合金是一类能够大量吸收,并与结合成金属氢化物的材料,可用于以为燃料的汽车.
C.用盐酸除铁锈,是因为溶于水后,其溶液显碱性.
D.不锈钢是常见的一种合金钢,有些地铁列车的车体材质也是不锈钢.
2.中国空间站“天宫课堂”第二次太空授课:“太空教师”往蓝色水球里塞入半片泡腾片,做成蓝色太空欢乐球。水球中产生的大量小气泡并没有离开水球,而是一直附着在泡腾片放入蓝色水球做成的太空欢乐球容器内部。下列关于叙述正确的是( )
A.和互为同素异形体 B.楁于水能导电,所以它是电解质
C.属于离子化合物 D.属于酸性氧化物
3.在下列物质中,只含有极性共价键的共价化合物是( )
A: B. C. D.
4.下列各组中的离子,能在水滓湤中大量共存的是( )
A.、、、 B.、、、
C.、、、 D.、、、
5.向下列溶液中分别逐滴加入和两种溶液,出现不同现象的是( )
A.溶液 B.溶液 C.溶液 D.溶液
6.为阿伏加德罗常数的值。下列叙述正确的是( )
A.含有的分子数目
B.标准状况下,中电子的数目为
C.常温常压下,原子数目为
D.的溶液中含有的数目为
7.下列转化中,需要加入氧化剂才能实现的是( )
A. B. C. D.
8.下列反应的离子方程式书写正确的是( )
A.用溶液腐蚀铜线路板:
B.碳酸钡和盐酸反应:
C.氢氧化钠与醋酸反应:
D.向溶液中滴加溶液:
9.自来水厂水质检验员在自来水出厂前需对水中的氯离子等进行检测。实验室检验氯离子的试剂是( )
A.稀硝酸和溶液 B.溶液
C.稀硝酸和溶液 D.稀硫酸
10.明胶是水溶性蛋白质混合物,溶于水形成胶体。下列关于明胶在水中形成的分散系和溶液的说法不正确的是( )
A.都是混合物
B.可利用丁达尔效应区分
C.明胶在水中形成的分散系不能透过滤纸
D.分散质粒子的直径大小不同,前者为
11.短周期主族元素X、Y、Z、W的原子序数依次增大,在短周期中原子半径最大,是地壳中含量最高的金属元素,和同主族,的最高正化合价与最低负化合价的代数和为4。下列说法不正确的是( )
A.简单气态氢化物的稳定性:
B.离子半径由小到大的顺序:
C.的最高价氧化物的水化物能与强碱反应
D.与形成的化合物中可能既含有离子键,又含有共价键
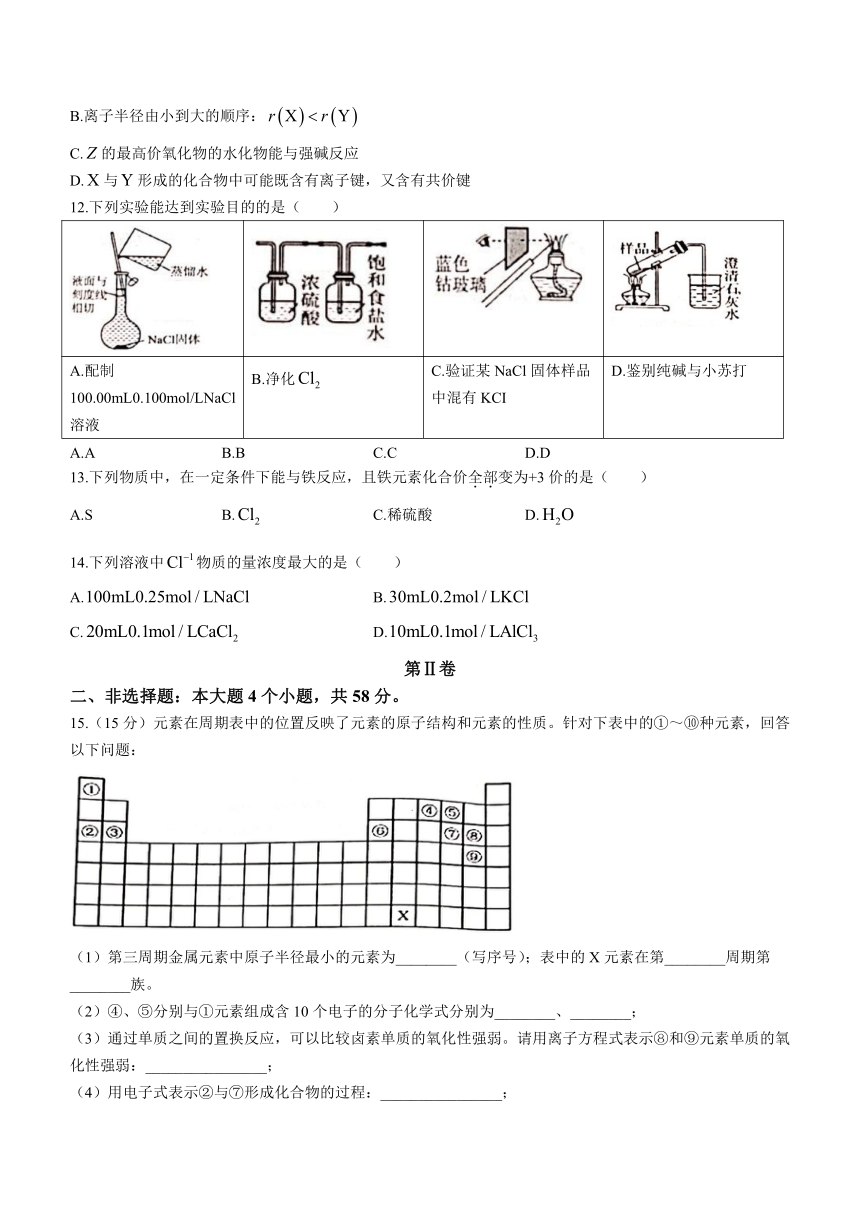
12.下列实验能达到实验目的的是( )
A.配制100.00mL0.100mol/LNaCl溶液 B.净化 C.验证某NaCl固体样品中混有KCI D.鉴别纯碱与小苏打
A.A B.B C.C D.D
13.下列物质中,在一定条件下能与铁反应,且铁元素化合价全部变为+3价的是( )
A.S B. C.稀硫酸 D.
14.下列溶液中物质的量浓度最大的是( )
A. B.
C. D.
第Ⅱ卷
二、非选择题:本大题4个小题,共58分。
15.(15分)元素在周期表中的位置反映了元素的原子结构和元素的性质。针对下表中的①~⑩种元素,回答以下问题:
(1)第三周期金属元素中原子半径最小的元素为________(写序号);表中的X元素在第________周期第________族。
(2)④、⑤分别与①元素组成含10个电子的分子化学式分别为________、________;
(3)通过单质之间的置换反应,可以比较卤素单质的氧化性强弱。请用离子方程式表示⑧和⑨元素单质的氧化性强弱:________________;
(4)用电子式表示②与⑦形成化合物的过程:________________;
(5)由①②⑤元素组成的化合物的化学键类型为________、________;
(6)写出能证明②的金属性强于③的化学事实________(任写一条)。
16.(15分)已知为一种常见的金属单质,B、C、D、E是含元素的常见化合物,它们的焰色均为黄色。根据下图的转化关系,回答下列问题。
(1)写出下列物质的化学式:B________;C________;
(2)物质B的颜色为________;
(3)写出下列转化的化学方程式:
①:________;
②:________;
(4)写出的离子方程式:________;
(5)加热和的固体混合物,使完全分解,固体混合物的质量减少了,则混合物中的质量为________。
17.(14分)回答下列问题
Ⅰ、(1)水中含有________个水分子:标准状况下,11.2LCO物质的量为________。
(2)溶液中的物质的量浓度为________。
(3)标准状况下,和含有相同氢原子数的的体积为________。
Ⅱ、实验室配制的溶液,请填写下列空白:
(4)本实验所需固体质量为________;
(5)本实验用到的基本仪器已有烧杯、天平(带砝码)、镊子、玻璃棒、量筒、胶头滴管,还缺少的仪器是________。
(6)下列情况会使所配溶液浓度偏高的是________(填序号)。
a.加蒸馏水时,不慎超过了刻度线
b.容量瓶使用前内壁沾有水珠
c.定容操作时,俯视刻度线
d.砝码上沾有杂质
18.(14分)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置制备和,探究其氧化还原性质。
已知:
回答下列问题:
(1)盛装浓盐酸的仪器名称为________。的作用________。
(2)b中试管内发生反应的还原剂和氧化剂的物质的量之比为________。中反应的离子方程式是________。
(3)用双线桥表示该实验制备氯气的化学方程式,并标注电子转移的方向和数目________。
(4)将氯气持续通入紫色石蕊试液中,溶液颜色呈如图变化:
根据溶液变色情况,写出相应微粒的化学式,Ⅰ为________、Ⅱ为________、Ⅲ为________。
(5)某游泳池常用来抑制藻类生长,工作人员一次错用消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了和,写出相应的离子方程式________。
百色市2023-2024学年高一上学期期末教学质量调研
化学参考答案
一、选择题:本题共14题,每题3分,共42分,每小题只有1个选项符合题意。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 C D B C D A C B A C B C B D
1.【答案】C用盐酸除铁锈,是因为盐酸反应生成易溶于水的氯化铁,故错误;
2.【答案】D【详解】
A.同素异形体为由同一种元素组成的的不同单质,和不是单质,不互为同素异形体,A错误;
B.溶于水能导电的原因是:与水反应生成是电解质,为非电解质.
C.为共价化合物,C错误;
D.酸性氧化物是指:与碱反应只生成一种盐和水的化合物。是酸性氧化物,D正确。
3.【答案】B【详解】
A.为共价化合物,含极性键键、非极性键键,A错误;
B.HCl为共价化合物,只含极性键H-Cl键,B正确;
C.为离子化合物,C错误;
D.为离子化合物,D错误。故选B。
4.【答案】C【详解】
A.和反应生成沉淀,不能大量共存,A错误;
B.和反应生成沉淀,不能大量共存,B错误;
C.C中四种离子不反应,可以大量共存,C正确;
D.和会反应生成,不能大量共存,D错误。故选C。
5.答案D详解:A、C不反应,B与反应,但没有明显现象;D与反应产生白色沉淀,与不反应。
6.答案A详解:A.为,的微粒数为;B.标准状况下,不是气体,不能确定物质的量,所以无法计算电子数;C.原子数目为.D.没有体积,无法计算物质的量。
7.【答案】C【详解】
A.Mn元素化合价降低,被还原,应加入还原剂,A错误;
B.I元素化合价降低,被还原,应加入还原剂,B错误;
C.Fe元素化合价升高,被氧化,应加入氧化剂,C正确;
D.S元素无化合价变化,不需加氧化剂或还原剂,D错误。
8.【答案】B
【详解】A.溶液腐蚀铜线路板,离子方程式为:,错误;B.正确;C.氢氧化钠与醋酸反应的离子方程式为,错误。D.向溶液中滴加溶液:.
9.【答案】A【详解】氯离子检测:先加入稀硝酸排除、、的干扰,再加入硝酸银溶液,产生不溶于水的白色沉淀。答案为:A。
10.【答案】C【详解】
A.明胶的水溶液属于胶体,溶液均为混合物,A正确;
B.只有明胶的水溶液有丁达尔效应,B正确;
C.胶体能透过滤纸,C错误;
D.分散质粒子的直径大小不同,前者为,D正确;选C。
11.【答案】B【分析】短周期主族元素X、Y、Z、W的原子序数依次增大,Y在短周期中原子半径最大,则Y为元素;Z是地壳中含量最高的金属元素,则Z为元素;X和W同主族,W的最高正化合价与最低负化合价的代数和为4,二者处于VIA族,故为0元素、W为S元素。由分析可知,X为O元素、Y为Na元素、Z为AI元素、W为S元素;
A.元素非金属性:,故氢化物稳定性:,故A正确;
B.离子半径:,故B错误;
C.氢氧化铝具有两性,可以与强碱反应,C正确;
D.X与Y形成的化合物有、,过氧化钠既含有离子键,又含有共价键。
12.【答案】C
【详解】A.液面接近刻度线时,改用胶头滴管逐滴滴加蒸馏水定容,故A错误;
B.净化氯气,应该先将氯气通过饱和食盐水除去,再通过浓硫酸除去水蒸气.B错误;
C.观察元素的焰色试验时,需要透过蓝色的钴玻璃观察,C正确;
D.加热纯碱或小苏打,试管口应向下倾斜,故D错误;故选C。
13.【答案】B【详解】A.S氧化性弱,与反应生成,A不符合题意;
B.与氯气反应生成,D符合题意;C.与稀硫酸反应生成,C不符合题意;
D.与水蒸气反应生成,其中铁元素既有+2价,又有+3价,B不符合题意;
14.【答案】D
【详解】A.溶液中的物质的量浓度为;
B.溶液中的物质的量浓度为;
C.溶液中的物质的量浓度为;
D.溶液中的物质的量浓度为;故选D。
二、非选择题:本大题4个小题,共58分。
15题:
(1)⑥(1分);七(1分);IVA(1分);
(2)(2分);(2分)。
(3)
(4)(2分)
(5)离子键(1分);共价键(或极性共价键)(1分);
(6)分别将②与③加入水(或酸)中,②反应比③更剧烈。(2分)(其它符合题意的答案均给分)
详解:由元素在周期表中的位置可知,①-⑨号元素分别为:、、、、、、、、。
(1)第三周期金属元素有、、。同一周期,从左到右原子半径越来越小,所以金属元素中原子半径最小的元素为AI,⑥号元素;元素位于周期表第7行,介于与之间的主族元素,则在周期表中位置是第七周期第IVA族。
(2)在原子结构中,电子数等于原子序数,、电子数分别为、,则与原子结合组成含10个电子的分子化学式分别为、。
(3)⑧和⑨元素组成的单质分别为和,由于的氧化性比强,故置换反应的离子方程式为。
(4)②与⑦元素分别为和,它们之间形成离子化合物,则用电子式表示形成过程为:
(5)由①②⑤元素组成的化合物为,和形成离子键,O和形成共价键。
(6)②和③分别是、元素,只要是用化学事实描述的金属性比强均得分。
16题:(15分)(1)(2分)(2分)(2)淡黄色(2分)
(3)①(2分,不配平、配平错误扣1分,化学式错误得0分)
②(2分,不配平、配平错误扣1分,化学式错误得0分)
(4)(2分,不配平、配平错误扣1分,化学式错误得0分)
(5)(3分,不写单位扣1分)
【详解】
根据题意,已知为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,则是,根据转化关系知,是、是、是、是。
(1)由以上分析可知为、是;
(2)物质B为过氧化钠,颜色为淡黄色,故答案为淡黄色;
(3)为过氧化钠与二氧化碳反应碳酸钠和氧气,反应的化学方程式为;
为碳酸氢钠与氢氧化钠反应碳酸钠和水,反应的化学方程式为;
(4)为与水反应生成和,反应的离子方程式;
(5)较稳定,加热不易分解,只有受热分解,设混合物中的质量为,则
解,,,故答案为。
17题:(14分)
(1)(2分,不写单位扣1分)(2分,不写单位扣1分)
(2)(2分,不写单位扣1分)
(3)(2分,不写单位扣1分)
(4)(2分,不写单位扣1分)
(5)容量瓶(2分,不写规格、写错仪器名称扣1分)(6)cd(2分)
【详解】(1)水中含有水分子数为;标准状况下,物质的量为。
(2)溶液中的物质的量浓度与溶液体积无关,是浓度的2倍,故的物质的量浓度为。
(3)的氢原子为,故的物质的量为,标准状况下的体积为。
(4)本实验所需容量瓶规格为,物质的量为,故质量为;
(5)配制一定物质的量浓度溶液使用的仪器有一定规格的容量瓶、烧杯、玻璃棒、托盘天平、量筒、胶头滴管,故缺少容量瓶。
(6)根据进行判断。a.增大,故使c偏低;b.无影响c.俯视使减小,故使c偏高;d.增大,故使c偏高。故选cd。
18题:(14分)
(1)分液漏斗(1分),除去中的,抑制溶解(2分,答对一点得1分)
(2)1:5(2分)(2分,不配平、配平错误扣1分,化学式错误得0分)
(3)
(2分,不配平、配平错误、不标注双线、转移数目错误扣1分,化学式错误得0分)
(4)(1分)、HClO(1分)、Cl2(1分)
(5)(2分,不配平、配平错误扣1分,化学式错误得0分)
【详解】(1)盛装浓盐酸的仪器名称为分液漏斗,a中试剂为饱和食盐水,作用为除去中的,抑制溶解。
(2)浓盐酸与加热条件下反应化学方程式为中。C1元素化合价由-1升高为O、元素化合价由+4降低为+2,电子转移的方向和数目为
(3)中反应为,该反应中一个失电子转化为,5个得电子转化为,还原剂与氧化剂的物质的量之比为1:5。c中反应的化学方程式为,故离子方程式为
(4)氯气与水反应生成、,具有酸性,具有漂白性,则将氯气持续通入紫色石荵试液中先变红后褪色,最后形成饱和氯水溶液显浅黄绿色为溶解的氯气分子,氯水中使紫色石荵试液变红色,具有漂白性,能将红色变无色,溶解在水中的使溶液呈浅黄绿色,微粒Ⅰ、Ⅱ、Ⅲ分别为、、,故选:微粒Ⅰ、Ⅱ、Ⅲ分别为、、。
(5)根据题意,和用反应生成和,该反应的化学方程式为,故该反应的离子方程式为。
化学
(试卷总分100分;考试时长75分钟)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.答题前,考生务必将自己的班级、姓名、准考证号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案标号,写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上.写在本试卷上无效.
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 K-39
Fe-56 Cu-64
第Ⅰ卷
一、选择题:本题共14题,每题3分,共42分,每小题只有1个选项符合题意。
1.化学与生产、生活密切相关。下列有关说法不正确的是( )
A.硬铝(铝合金)密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料.
B.储氢合金是一类能够大量吸收,并与结合成金属氢化物的材料,可用于以为燃料的汽车.
C.用盐酸除铁锈,是因为溶于水后,其溶液显碱性.
D.不锈钢是常见的一种合金钢,有些地铁列车的车体材质也是不锈钢.
2.中国空间站“天宫课堂”第二次太空授课:“太空教师”往蓝色水球里塞入半片泡腾片,做成蓝色太空欢乐球。水球中产生的大量小气泡并没有离开水球,而是一直附着在泡腾片放入蓝色水球做成的太空欢乐球容器内部。下列关于叙述正确的是( )
A.和互为同素异形体 B.楁于水能导电,所以它是电解质
C.属于离子化合物 D.属于酸性氧化物
3.在下列物质中,只含有极性共价键的共价化合物是( )
A: B. C. D.
4.下列各组中的离子,能在水滓湤中大量共存的是( )
A.、、、 B.、、、
C.、、、 D.、、、
5.向下列溶液中分别逐滴加入和两种溶液,出现不同现象的是( )
A.溶液 B.溶液 C.溶液 D.溶液
6.为阿伏加德罗常数的值。下列叙述正确的是( )
A.含有的分子数目
B.标准状况下,中电子的数目为
C.常温常压下,原子数目为
D.的溶液中含有的数目为
7.下列转化中,需要加入氧化剂才能实现的是( )
A. B. C. D.
8.下列反应的离子方程式书写正确的是( )
A.用溶液腐蚀铜线路板:
B.碳酸钡和盐酸反应:
C.氢氧化钠与醋酸反应:
D.向溶液中滴加溶液:
9.自来水厂水质检验员在自来水出厂前需对水中的氯离子等进行检测。实验室检验氯离子的试剂是( )
A.稀硝酸和溶液 B.溶液
C.稀硝酸和溶液 D.稀硫酸
10.明胶是水溶性蛋白质混合物,溶于水形成胶体。下列关于明胶在水中形成的分散系和溶液的说法不正确的是( )
A.都是混合物
B.可利用丁达尔效应区分
C.明胶在水中形成的分散系不能透过滤纸
D.分散质粒子的直径大小不同,前者为
11.短周期主族元素X、Y、Z、W的原子序数依次增大,在短周期中原子半径最大,是地壳中含量最高的金属元素,和同主族,的最高正化合价与最低负化合价的代数和为4。下列说法不正确的是( )
A.简单气态氢化物的稳定性:
B.离子半径由小到大的顺序:
C.的最高价氧化物的水化物能与强碱反应
D.与形成的化合物中可能既含有离子键,又含有共价键
12.下列实验能达到实验目的的是( )
A.配制100.00mL0.100mol/LNaCl溶液 B.净化 C.验证某NaCl固体样品中混有KCI D.鉴别纯碱与小苏打
A.A B.B C.C D.D
13.下列物质中,在一定条件下能与铁反应,且铁元素化合价全部变为+3价的是( )
A.S B. C.稀硫酸 D.
14.下列溶液中物质的量浓度最大的是( )
A. B.
C. D.
第Ⅱ卷
二、非选择题:本大题4个小题,共58分。
15.(15分)元素在周期表中的位置反映了元素的原子结构和元素的性质。针对下表中的①~⑩种元素,回答以下问题:
(1)第三周期金属元素中原子半径最小的元素为________(写序号);表中的X元素在第________周期第________族。
(2)④、⑤分别与①元素组成含10个电子的分子化学式分别为________、________;
(3)通过单质之间的置换反应,可以比较卤素单质的氧化性强弱。请用离子方程式表示⑧和⑨元素单质的氧化性强弱:________________;
(4)用电子式表示②与⑦形成化合物的过程:________________;
(5)由①②⑤元素组成的化合物的化学键类型为________、________;
(6)写出能证明②的金属性强于③的化学事实________(任写一条)。
16.(15分)已知为一种常见的金属单质,B、C、D、E是含元素的常见化合物,它们的焰色均为黄色。根据下图的转化关系,回答下列问题。
(1)写出下列物质的化学式:B________;C________;
(2)物质B的颜色为________;
(3)写出下列转化的化学方程式:
①:________;
②:________;
(4)写出的离子方程式:________;
(5)加热和的固体混合物,使完全分解,固体混合物的质量减少了,则混合物中的质量为________。
17.(14分)回答下列问题
Ⅰ、(1)水中含有________个水分子:标准状况下,11.2LCO物质的量为________。
(2)溶液中的物质的量浓度为________。
(3)标准状况下,和含有相同氢原子数的的体积为________。
Ⅱ、实验室配制的溶液,请填写下列空白:
(4)本实验所需固体质量为________;
(5)本实验用到的基本仪器已有烧杯、天平(带砝码)、镊子、玻璃棒、量筒、胶头滴管,还缺少的仪器是________。
(6)下列情况会使所配溶液浓度偏高的是________(填序号)。
a.加蒸馏水时,不慎超过了刻度线
b.容量瓶使用前内壁沾有水珠
c.定容操作时,俯视刻度线
d.砝码上沾有杂质
18.(14分)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置制备和,探究其氧化还原性质。
已知:
回答下列问题:
(1)盛装浓盐酸的仪器名称为________。的作用________。
(2)b中试管内发生反应的还原剂和氧化剂的物质的量之比为________。中反应的离子方程式是________。
(3)用双线桥表示该实验制备氯气的化学方程式,并标注电子转移的方向和数目________。
(4)将氯气持续通入紫色石蕊试液中,溶液颜色呈如图变化:
根据溶液变色情况,写出相应微粒的化学式,Ⅰ为________、Ⅱ为________、Ⅲ为________。
(5)某游泳池常用来抑制藻类生长,工作人员一次错用消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了和,写出相应的离子方程式________。
百色市2023-2024学年高一上学期期末教学质量调研
化学参考答案
一、选择题:本题共14题,每题3分,共42分,每小题只有1个选项符合题意。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 C D B C D A C B A C B C B D
1.【答案】C用盐酸除铁锈,是因为盐酸反应生成易溶于水的氯化铁,故错误;
2.【答案】D【详解】
A.同素异形体为由同一种元素组成的的不同单质,和不是单质,不互为同素异形体,A错误;
B.溶于水能导电的原因是:与水反应生成是电解质,为非电解质.
C.为共价化合物,C错误;
D.酸性氧化物是指:与碱反应只生成一种盐和水的化合物。是酸性氧化物,D正确。
3.【答案】B【详解】
A.为共价化合物,含极性键键、非极性键键,A错误;
B.HCl为共价化合物,只含极性键H-Cl键,B正确;
C.为离子化合物,C错误;
D.为离子化合物,D错误。故选B。
4.【答案】C【详解】
A.和反应生成沉淀,不能大量共存,A错误;
B.和反应生成沉淀,不能大量共存,B错误;
C.C中四种离子不反应,可以大量共存,C正确;
D.和会反应生成,不能大量共存,D错误。故选C。
5.答案D详解:A、C不反应,B与反应,但没有明显现象;D与反应产生白色沉淀,与不反应。
6.答案A详解:A.为,的微粒数为;B.标准状况下,不是气体,不能确定物质的量,所以无法计算电子数;C.原子数目为.D.没有体积,无法计算物质的量。
7.【答案】C【详解】
A.Mn元素化合价降低,被还原,应加入还原剂,A错误;
B.I元素化合价降低,被还原,应加入还原剂,B错误;
C.Fe元素化合价升高,被氧化,应加入氧化剂,C正确;
D.S元素无化合价变化,不需加氧化剂或还原剂,D错误。
8.【答案】B
【详解】A.溶液腐蚀铜线路板,离子方程式为:,错误;B.正确;C.氢氧化钠与醋酸反应的离子方程式为,错误。D.向溶液中滴加溶液:.
9.【答案】A【详解】氯离子检测:先加入稀硝酸排除、、的干扰,再加入硝酸银溶液,产生不溶于水的白色沉淀。答案为:A。
10.【答案】C【详解】
A.明胶的水溶液属于胶体,溶液均为混合物,A正确;
B.只有明胶的水溶液有丁达尔效应,B正确;
C.胶体能透过滤纸,C错误;
D.分散质粒子的直径大小不同,前者为,D正确;选C。
11.【答案】B【分析】短周期主族元素X、Y、Z、W的原子序数依次增大,Y在短周期中原子半径最大,则Y为元素;Z是地壳中含量最高的金属元素,则Z为元素;X和W同主族,W的最高正化合价与最低负化合价的代数和为4,二者处于VIA族,故为0元素、W为S元素。由分析可知,X为O元素、Y为Na元素、Z为AI元素、W为S元素;
A.元素非金属性:,故氢化物稳定性:,故A正确;
B.离子半径:,故B错误;
C.氢氧化铝具有两性,可以与强碱反应,C正确;
D.X与Y形成的化合物有、,过氧化钠既含有离子键,又含有共价键。
12.【答案】C
【详解】A.液面接近刻度线时,改用胶头滴管逐滴滴加蒸馏水定容,故A错误;
B.净化氯气,应该先将氯气通过饱和食盐水除去,再通过浓硫酸除去水蒸气.B错误;
C.观察元素的焰色试验时,需要透过蓝色的钴玻璃观察,C正确;
D.加热纯碱或小苏打,试管口应向下倾斜,故D错误;故选C。
13.【答案】B【详解】A.S氧化性弱,与反应生成,A不符合题意;
B.与氯气反应生成,D符合题意;C.与稀硫酸反应生成,C不符合题意;
D.与水蒸气反应生成,其中铁元素既有+2价,又有+3价,B不符合题意;
14.【答案】D
【详解】A.溶液中的物质的量浓度为;
B.溶液中的物质的量浓度为;
C.溶液中的物质的量浓度为;
D.溶液中的物质的量浓度为;故选D。
二、非选择题:本大题4个小题,共58分。
15题:
(1)⑥(1分);七(1分);IVA(1分);
(2)(2分);(2分)。
(3)
(4)(2分)
(5)离子键(1分);共价键(或极性共价键)(1分);
(6)分别将②与③加入水(或酸)中,②反应比③更剧烈。(2分)(其它符合题意的答案均给分)
详解:由元素在周期表中的位置可知,①-⑨号元素分别为:、、、、、、、、。
(1)第三周期金属元素有、、。同一周期,从左到右原子半径越来越小,所以金属元素中原子半径最小的元素为AI,⑥号元素;元素位于周期表第7行,介于与之间的主族元素,则在周期表中位置是第七周期第IVA族。
(2)在原子结构中,电子数等于原子序数,、电子数分别为、,则与原子结合组成含10个电子的分子化学式分别为、。
(3)⑧和⑨元素组成的单质分别为和,由于的氧化性比强,故置换反应的离子方程式为。
(4)②与⑦元素分别为和,它们之间形成离子化合物,则用电子式表示形成过程为:
(5)由①②⑤元素组成的化合物为,和形成离子键,O和形成共价键。
(6)②和③分别是、元素,只要是用化学事实描述的金属性比强均得分。
16题:(15分)(1)(2分)(2分)(2)淡黄色(2分)
(3)①(2分,不配平、配平错误扣1分,化学式错误得0分)
②(2分,不配平、配平错误扣1分,化学式错误得0分)
(4)(2分,不配平、配平错误扣1分,化学式错误得0分)
(5)(3分,不写单位扣1分)
【详解】
根据题意,已知为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,则是,根据转化关系知,是、是、是、是。
(1)由以上分析可知为、是;
(2)物质B为过氧化钠,颜色为淡黄色,故答案为淡黄色;
(3)为过氧化钠与二氧化碳反应碳酸钠和氧气,反应的化学方程式为;
为碳酸氢钠与氢氧化钠反应碳酸钠和水,反应的化学方程式为;
(4)为与水反应生成和,反应的离子方程式;
(5)较稳定,加热不易分解,只有受热分解,设混合物中的质量为,则
解,,,故答案为。
17题:(14分)
(1)(2分,不写单位扣1分)(2分,不写单位扣1分)
(2)(2分,不写单位扣1分)
(3)(2分,不写单位扣1分)
(4)(2分,不写单位扣1分)
(5)容量瓶(2分,不写规格、写错仪器名称扣1分)(6)cd(2分)
【详解】(1)水中含有水分子数为;标准状况下,物质的量为。
(2)溶液中的物质的量浓度与溶液体积无关,是浓度的2倍,故的物质的量浓度为。
(3)的氢原子为,故的物质的量为,标准状况下的体积为。
(4)本实验所需容量瓶规格为,物质的量为,故质量为;
(5)配制一定物质的量浓度溶液使用的仪器有一定规格的容量瓶、烧杯、玻璃棒、托盘天平、量筒、胶头滴管,故缺少容量瓶。
(6)根据进行判断。a.增大,故使c偏低;b.无影响c.俯视使减小,故使c偏高;d.增大,故使c偏高。故选cd。
18题:(14分)
(1)分液漏斗(1分),除去中的,抑制溶解(2分,答对一点得1分)
(2)1:5(2分)(2分,不配平、配平错误扣1分,化学式错误得0分)
(3)
(2分,不配平、配平错误、不标注双线、转移数目错误扣1分,化学式错误得0分)
(4)(1分)、HClO(1分)、Cl2(1分)
(5)(2分,不配平、配平错误扣1分,化学式错误得0分)
【详解】(1)盛装浓盐酸的仪器名称为分液漏斗,a中试剂为饱和食盐水,作用为除去中的,抑制溶解。
(2)浓盐酸与加热条件下反应化学方程式为中。C1元素化合价由-1升高为O、元素化合价由+4降低为+2,电子转移的方向和数目为
(3)中反应为,该反应中一个失电子转化为,5个得电子转化为,还原剂与氧化剂的物质的量之比为1:5。c中反应的化学方程式为,故离子方程式为
(4)氯气与水反应生成、,具有酸性,具有漂白性,则将氯气持续通入紫色石荵试液中先变红后褪色,最后形成饱和氯水溶液显浅黄绿色为溶解的氯气分子,氯水中使紫色石荵试液变红色,具有漂白性,能将红色变无色,溶解在水中的使溶液呈浅黄绿色,微粒Ⅰ、Ⅱ、Ⅲ分别为、、,故选:微粒Ⅰ、Ⅱ、Ⅲ分别为、、。
(5)根据题意,和用反应生成和,该反应的化学方程式为,故该反应的离子方程式为。
同课章节目录
