安徽省皖中联盟2023-2024学年高二上学期期末联考化学试题(含答案)
文档属性
| 名称 | 安徽省皖中联盟2023-2024学年高二上学期期末联考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-21 22:53:54 | ||
图片预览




文档简介
安徽省皖中联盟2023-2024学年高二上学期期末联考化学
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:人教版必修第一册、第二册,选择性必修1,选择性必修2第一章。
5.可能用到的相对原子质量:H 1 Li 7 C 12 Zn 65
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.以下表示钠原子结构的化学用语中,对电子运动状态描述最详尽的是( )
A. B.
C.Na* D.
2.在基态多电子原子中,下列叙述不正确的是( )
A.2s和3s轨道形状均为球形 B.3d、4d、5d能级的轨道数相等
C.4p、4p、4p轨道相互垂直,且能量相等 D.p能级能量一定比s能级的能量高
3.化学与生产、生活、能量等密切相关。下列说法正确的是( )
A.化石燃料燃烧使化学能全部转化为热能 B.陶瓷、水泥、石灰石的主要成分都是硅酸盐
C.三星堆出土的黄金面具材料属于合金 D.塑料、纤维、橡胶均属于有机合成材料
4.某反应过程中体系的能量变化如图所示,下列说法不正确的是( )
A.催化剂能改变该反应的焓变 B.该反应的逆反应为吸热反应
C.该反应的 D.若改变某条件时化学反应速率加快,则E1不一定减小
5.常温常压下,下列热化学方程式(的绝对值均正确)或有关结论正确的是( )
选项 已知条件 热化学方程式或结论
A 同温同压下,分别在光照和点燃条件下发生反应 不同
B 与反应生成时,放出热量
C 增大压强平衡正向移动,放出的热量增大,Q增大
D
6.电负性用来描述不同元素的原子对键合电子吸引力的大小,是元素的一种基本性质。下表为一些元素的电负性(已知两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键):
元素 Li Be B C N F Na Mg Al Si Cl Ca
电负性 1.0 1.5 2.0 2.5 3.0 4.0 0.9 a 1.5 1.8 3.0 1.0
下列说法不正确的是( )
A.根据电负性变化规律,确定a的最小范围为1.0B.NF3中N-F键的极性比NCl3中N-Cl键的极性强
C.AlCl3是一种可溶性盐,属于离子化合物
D.可以通过测定化合物在熔融状态下是否导电鉴别Li3N与SiC
7.我国科学家最近发明了一种Zn-PbO2二次电池,电解质为K2SO4、H2SO4和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域。如图是其放电过程工作示意图,下列说法不正确的是( )
A.放电时,PbO2为原电池的正极
B.每消耗6.5gZn就有0.2molK+通过交换膜a进入B区域
C.电池反应的离子方程式为
D.b为阳离子交换膜
8.下表是某些元素的各级电离能数据(单位:kJ·mol-1),下列说法不正确的是( )
电离能 元素代号 I1 I2 I3 I4
X 500 4600 6900 9500
Y 740 1500 7700 10500
Z 580 1800 2700 11600
A.X元素最有可能为Li B.基态Y原子的价层电子数可能为2
C.元素Y不一定是主族元素 D.Z的氯化物的化学式可能为ZCl3
9.下列除杂试剂和分离方法都正确的是( )
选项 物质(括号内为杂质) 除杂试剂 分离方法
A FeCl3(FeCl2) 铁粉 过滤
B O2(C2H4) 酸性KMnO4溶液 洗气
C CH3COOCH2CH3(CH3CH2OH) 饱和Na2CO3溶液 分液
D Cl2(HCl) 饱和NaHCO3溶液 洗气
10.下列叙述正确的是( )
A.50℃时,的纯碱溶液中,
B.相同条件下,浓度均为的盐酸与溶液,水的电离程度相同
C.将水加热到,测得其,则液体呈酸性
D.常温时,的溶液与的溶液等体积混合后
11.已知X、Y是短周期的两种元素,下表中由条件得出的结论一定正确的是( )
选项 条件 结论
A 若原子半径:X>Y 原子序数:X
B 若常见化合物XmYn中Y显负价 元素的电负性:X
C 若元素原子的价层电子数:X>Y 元素的最高正价:X>Y
D 若X、Y原子最外层电子数分别为1、7 元素的第一电离能:X>Y
12.已知甲、乙、丙、丁是原子序数依次增大的短周期元素。甲是宇宙中含量最多的元素。基态时:乙原子最高能级的不同轨道内都有电子,且自旋方向都相同;丙原子中有两种形状的电子云,最高能层只有一种自旋方向的电子,丁原子的价电子排布式为nsn-1npn+1。下列说法不正确的是( )
A.电负性:甲>丙 B.第一电离能:乙>丁
C.原子半径:丙>丁 D.简单离子的半径:丙阳离子>乙阴离子
13.下列实验操作的现象不能达到预期实验目的或不能得出相应结论的是( )
选项 实验操作和现象 预期实验目的或结论
A 向溶液中滴入2滴溶液,有白色沉淀生成,再滴入4滴溶液,白色沉淀转变为黄色沉淀
B 将溶液与溶液充分混合;再继续加入固体,溶液颜色加深 证明溶液中存在平衡:
C pH计分别测定的溶液和的溶液的,其均为7 同温下,不同浓度的溶液中水的电离程度相同
D Zn和稀反应的试管中滴加几滴溶液,气泡生成速率加快 形成原电池能加快反应速率
14.某小组同学用0.1mol·L-1的NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1盐酸和醋酸溶液得到如图所示的滴定曲线。下列说法正确的是( )
A.图中和大小:
B.水的电离程度:点点
C.P点
D.点离子浓度大小:
二、非选择题(本题共4小题,共58分)
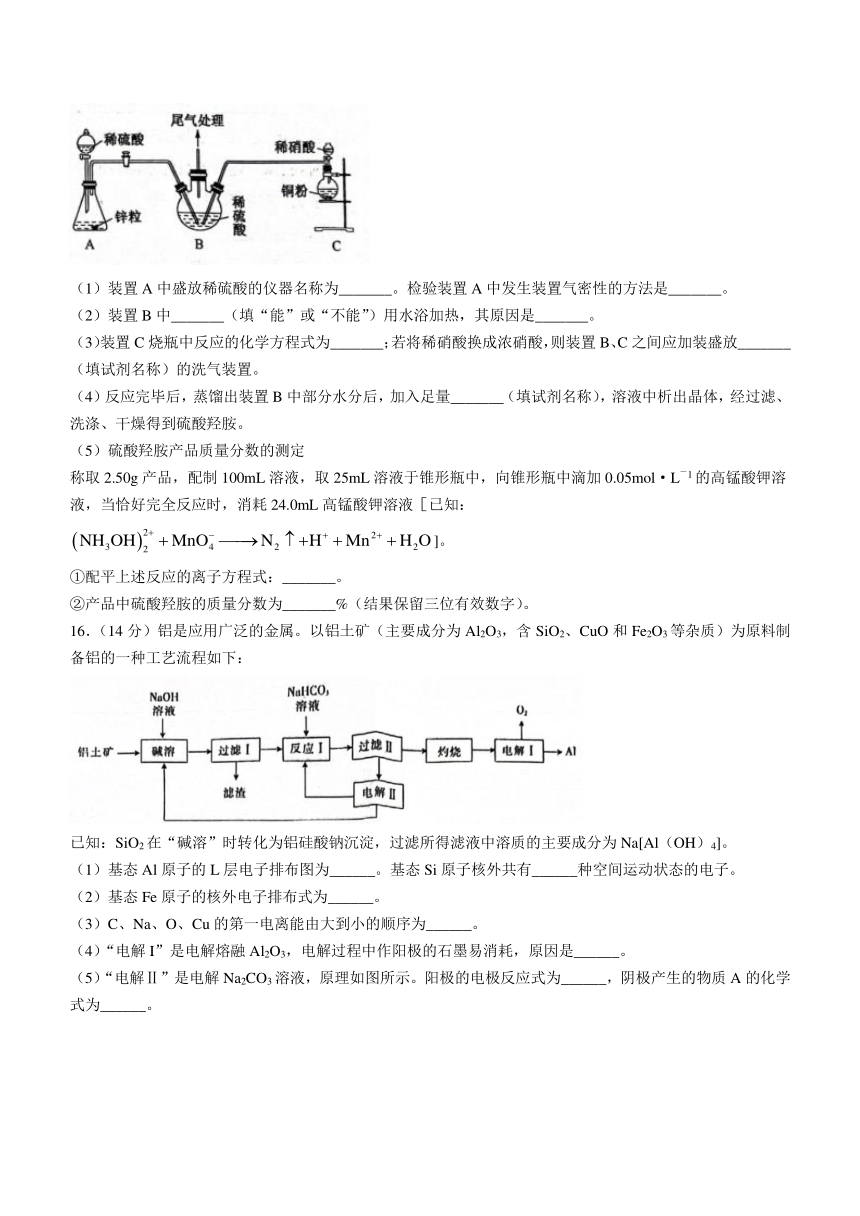
15.(14分)硫酸羟胺[或,易溶于水,不溶于乙醇]常用作还原剂、显影剂和橡胶硫化剂。某同学设计如下实验装置(部分加热装置和夹持装置已省略)制备少量硫酸羟胺,反应原理为。回答下列问题:
(1)装置A中盛放稀硫酸的仪器名称为_______。检验装置A中发生装置气密性的方法是_______。
(2)装置B中_______(填“能”或“不能”)用水浴加热,其原因是_______。
(3)装置C烧瓶中反应的化学方程式为_______;若将稀硝酸换成浓硝酸,则装置B、C之间应加装盛放_______(填试剂名称)的洗气装置。
(4)反应完毕后,蒸馏出装置B中部分水分后,加入足量_______(填试剂名称),溶液中析出晶体,经过滤、洗涤、干燥得到硫酸羟胺。
(5)硫酸羟胺产品质量分数的测定
称取2.50g产品,配制100mL溶液,取25mL溶液于锥形瓶中,向锥形瓶中滴加0.05mol·L-1的高锰酸钾溶液,当恰好完全反应时,消耗24.0mL高锰酸钾溶液[已知:]。
①配平上述反应的离子方程式:_______。
②产品中硫酸羟胺的质量分数为_______%(结果保留三位有效数字)。
16.(14分)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2、CuO和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
已知:SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤所得滤液中溶质的主要成分为Na[Al(OH)4]。
(1)基态Al原子的L层电子排布图为______。基态Si原子核外共有______种空间运动状态的电子。
(2)基态Fe原子的核外电子排布式为______。
(3)C、Na、O、Cu的第一电离能由大到小的顺序为______。
(4)“电解I”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是______。
(5)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为______,阴极产生的物质A的化学式为______。
17.(15分)平衡移动原理在实验、生活、生产中应用广泛。回答下列问题:
(1)实验室配制溶液时需将粉末加浓盐酸进行溶解,请用平衡移动原理解释原因:_______[已知:水解生成]。
(2)泡沫灭火器里的药品是溶液和溶液,其工作原理为_______(用离子方程式表示)。泡沫灭火器有内筒(塑料材质)和外筒(钢质)两部分组成,外筒放入的药品是_______(填化学式)。
(3)只用一种试剂就可以鉴别下列溶液:溶液、溶液、溶液。该试剂为_______。
(4)相同物质的量浓度的下列溶液:①、②、③、④,由大到小的顺序是_______(用序号表示)。
(5)向少量悬浊液中加入适量的饱和溶液,结果固体完全溶解,固体溶解的原因可能是:
猜想甲:①
②
③
结论:由于③反应的发生,使反应①平衡正向移动,溶解。
猜想乙:①
②______
结论:由于②反应的发生,_______。
(6)设计一个简单的实验方案证明纯碱溶液中存在水解平衡:向盛有碳酸钠溶液的试管中滴入几滴酚酞溶液,振荡,溶液变红,_______,证明纯碱溶液中存在水解平衡。已知25℃时,Na2CO3溶液的第一步水解常数KM=2×10-4,则当溶液pH=10时______。
18.(15分)的资源化利用成为研究热点。一定条件下,催化加氢发生的反应为。一定条件下,向容积为的恒容密闭容器中充入和,分别在温度为条件下反应,测得反应体系中的物质的量分数随时间的变化关系如图所示。回答下列问题:
(1)在T1K温度下,CO2的平衡转化率=_____%。压缩平衡体系体积,平衡______(“正向移动”“不移动”或“逆向移动”)。若想进一步提高CO2的平衡转化率,除改变温度外还可以采取的措施是______
(2)在T2K温度下,经t1min后反应达到平衡。
①0~t1min内,用CO2表示的反应速率v(CO2)=_______mol·L-1·min-1。
②在温度下,该反应的平衡常数______(用分数表示)。
(3)下图中能正确表示反应的化学平衡常数与温度关系的是______(填字母)。
(4)若反应在恒容容器中发生,下列情况下反应一定达到平衡状态的是_______(填字母)。
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内
D.单位时间内,断开键的数目和断开键的数目相同
(5)已知反应的。为速率常数,x(B)为组分B的物质的量分数。a、b点的正反应速率之比va:vb_______(填“>”“<”或“=”)1;c点的=_______。
安徽省皖中联盟2023-2024学年高二上学期期末联考
化学
参考答案、提示及评分细则
一、选择题:本大题共14小题,每题3分,总共42分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
选项 D D C A B C D A C B B D C D
1.D【解析】图示只能表示原子核外2p能级电子云轮廓图,A项不符合题意;原子结构示意图只表示核外的电子分层排布情况,B项不符合题意;电子式只能表示最外层电子数,C项不符合题意;电子排布图包含了能层、能级、轨道以及轨道内电子的自旋状态,对电子运动状态描述最详尽,D项符合题意。
2.D【解析】2s和3s轨道形状均为球形,A项正确;无论是哪个能层上的能级,d能级都有5个轨道,B项正确;同一能层,p轨道上原子轨道能量相等并且互相垂直,C项正确;当s和p能级不在同一能层时,p能级能量不一定比s能级的能量高,D项错误。
3.C【解析】化石燃料的燃烧是化学能转化为热能与光能,A项错误;石灰石的主要成分是碳酸盐,B项错误;三星堆出土的黄金面具材料属于合金,C项正确;纤维0有天然纤维和合成纤维,橡胶有天然橡胶和合成橡胶,D项错误。
4.A【解析】催化剂能加快化学反应速率,但不能改变反应的焓变,A项错误;题图中正反应的焓变,所以其逆反应为吸热反应,B项正确;从图中可以看出,该反应的,C项正确;E1为正反应的活化能;增大反应物浓度或升高温度都可以加快化学反应速率,但不能降低反应的活化能,D项正确。
5.B【解析】同温同压下,同一反应的相同,与引发条件无关,A项错误;与反应生成时,放出热量,则热化学方程式为,B项正确:增大压强,反应平衡正向移动,放出的热量增大,但反应热不变,不变,项错误;为弱酸、为弱碱,均存在电离平衡,电离过程吸热,所以产生时放出的热量小于,D项错误。
6.C【解析】根据电负性的递变规律:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小可知,在同周期中电负性:NaMg>Ca,即1.07.D【解析】锌是活泼金属,PbO2具有强氧化性,则放电时Zn电极为原电池的负极,PbO2为原电池的正极,A项正确;A区域是溶液,结合变为,为了维持溶液呈电中性,应通过交换膜进入区域,每消耗就有通过交换膜a进入B区域,B项正确;负极电极反应式为,正极电极反应式为,总反应离子方程式为,C项正确;由C项分析可知A区域电解质为区域电解质为,则在B区域电解质为,交换膜为阳离子交换膜,交换膜为阴离子交换膜,D项错误。
8.A【解析】X出现了I4,而锂原子核外只有3个电子,R元素不可能为Li元素,A项错误;Y最高价为+2价,则基态Y原子的价层电子数可能为2,B项正确;最外层有2个电子的元素可能是主族元素,也可能是副族元素,C项正确;当时,元素的最高化合价为+n价,故X最高价为+1,Y最高价为+2,Z最高价为+3.Z的氯化物的化学式可能为ZCl3,D项正确。
9.C【解析】加入铁粉会与FeCl3反应,A项错误;酸性高锰酸钾溶液将C2H4氧化,生成CO2,引入新杂质,
B项错误;CH3CH2OH易溶于水,而乙酸乙酯难溶于饱和碳酸钠溶液,故可以除去杂质CH3CH2OH,C项正确;通过饱和NaHCO3溶液洗气会引入新杂质CO2,D项错误。
10.B【解析】该溶液的温度是,故,所以,A项错误;的盐酸中,由水电离出的的溶液中,由水电离出的,则水的电离程度相同,B项正确;将水加热到,但所得液体仍呈中性,C项错误;两种溶液反应后过量,则溶液,D项错误。
11.B【解析】原子半径:Na>O,原子序数Na>O,A项错误;电负性大的元素吸引电子的能力强,化合物中电负性大的元素显负价,B项正确;F原子的价层电子数大于N的,但F没有正价,C项错误;若X、Y原子的最外层电子数分别为1、7,则X可能为H、Li、Na,Y可能为F、Cl,第一电离能:Li12.D【解析】分析可知,甲、乙、丙、丁分别为H、N、Na、P。电负性:H>Na,A项正确;第一电离能:N>P,B项正确;原子半径:Na>P,C项正确;简单离子半径:Na+13.C【解析】NaCl过量,AgNO3被完全沉淀,通过观察固体颜色是否变化可以判断AgCl沉淀是否转变为
AgI沉淀,从而比较Ksp(AgCl)和Ksp(AgI)大小,A项正确;KSCN和FeCl3按照物质的量之比4:1发生反应,达到平衡后继续加入KSCN固体,增大c(KSCN),平衡正向移动,使Fe(SCN)3物质的量浓度增大,溶液颜色加深,能够证明溶液中存在平衡:,B项正确;溶液为中性,水解促进水的电离,浓度不同,对水的电离促进作用不同,则水的电离程度不同,C项错误;生成的附着在上,形成原电池,加快反应速率,D项正确。
14.D【解析】由图中未加NaOH溶液时的pH可知,图I中酸的pH大于1,图Ⅱ中酸的pH=1,说明Ⅱ为滴定0.1mol·1的盐酸溶液的曲线,醋酸和氢氧化钠恰好完全反应时,得到的醋酸钠溶液显碱性,要使溶液显中性,需要NaOH的体积小于完全反应时的体积,盐酸和氢氧化钠恰好完全反应时,得到的氯化钠溶液显中性,所以V1二、非选择题:本题共4小题,共58分。
15.【答案】(除标注外,每空2分,共14分)
(1)分液漏斗(1分)关闭装置A、B之间和装置A中分液漏斗的活塞,向装置A中的分液漏斗内注入适量水,打开分液漏斗的活塞,分液漏斗中的水不滴落,则装置气密性良好(或其他合理答案)
(2)不能(1分) 水浴加热最多能加热到100℃,而本实验所需温度为150℃(1分)
(3) 水
(4)乙醇(1分)
(5)①
②78.7
16.【答案】(每空2分,共14分)
(1)8
(2)(或)
(3)
(4)石墨电极被阳极上产生的氧化
(5)
17.【答案】(除标注外,每空2分,共15分)
(1)溶液中存在水解平衡:,加入浓盐酸,增大,使该平衡逆向移动,抑制水解
(2)(1分)
(3)紫色石蕊溶液(或其他合理答案,1分)
(4)①>②>③>④
(5) 使反应①平衡正向移动,Mg(OH)2溶解(1分)
(6)加热,溶液红色加深或者向溶液中再加入过量的BaCl2固体,产生白色沉淀,且红色褪去(或其他合理答案) 2:1
18.【答案】(除标注外,每空2分,共15分)
(1)40不移动(1分) 将水蒸气液化后分离出来(或其他合理答案,1分)
(2)① ②
(3)d (4)D (5)>(1分) 2.25或
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:人教版必修第一册、第二册,选择性必修1,选择性必修2第一章。
5.可能用到的相对原子质量:H 1 Li 7 C 12 Zn 65
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.以下表示钠原子结构的化学用语中,对电子运动状态描述最详尽的是( )
A. B.
C.Na* D.
2.在基态多电子原子中,下列叙述不正确的是( )
A.2s和3s轨道形状均为球形 B.3d、4d、5d能级的轨道数相等
C.4p、4p、4p轨道相互垂直,且能量相等 D.p能级能量一定比s能级的能量高
3.化学与生产、生活、能量等密切相关。下列说法正确的是( )
A.化石燃料燃烧使化学能全部转化为热能 B.陶瓷、水泥、石灰石的主要成分都是硅酸盐
C.三星堆出土的黄金面具材料属于合金 D.塑料、纤维、橡胶均属于有机合成材料
4.某反应过程中体系的能量变化如图所示,下列说法不正确的是( )
A.催化剂能改变该反应的焓变 B.该反应的逆反应为吸热反应
C.该反应的 D.若改变某条件时化学反应速率加快,则E1不一定减小
5.常温常压下,下列热化学方程式(的绝对值均正确)或有关结论正确的是( )
选项 已知条件 热化学方程式或结论
A 同温同压下,分别在光照和点燃条件下发生反应 不同
B 与反应生成时,放出热量
C 增大压强平衡正向移动,放出的热量增大,Q增大
D
6.电负性用来描述不同元素的原子对键合电子吸引力的大小,是元素的一种基本性质。下表为一些元素的电负性(已知两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键):
元素 Li Be B C N F Na Mg Al Si Cl Ca
电负性 1.0 1.5 2.0 2.5 3.0 4.0 0.9 a 1.5 1.8 3.0 1.0
下列说法不正确的是( )
A.根据电负性变化规律,确定a的最小范围为1.0
C.AlCl3是一种可溶性盐,属于离子化合物
D.可以通过测定化合物在熔融状态下是否导电鉴别Li3N与SiC
7.我国科学家最近发明了一种Zn-PbO2二次电池,电解质为K2SO4、H2SO4和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域。如图是其放电过程工作示意图,下列说法不正确的是( )
A.放电时,PbO2为原电池的正极
B.每消耗6.5gZn就有0.2molK+通过交换膜a进入B区域
C.电池反应的离子方程式为
D.b为阳离子交换膜
8.下表是某些元素的各级电离能数据(单位:kJ·mol-1),下列说法不正确的是( )
电离能 元素代号 I1 I2 I3 I4
X 500 4600 6900 9500
Y 740 1500 7700 10500
Z 580 1800 2700 11600
A.X元素最有可能为Li B.基态Y原子的价层电子数可能为2
C.元素Y不一定是主族元素 D.Z的氯化物的化学式可能为ZCl3
9.下列除杂试剂和分离方法都正确的是( )
选项 物质(括号内为杂质) 除杂试剂 分离方法
A FeCl3(FeCl2) 铁粉 过滤
B O2(C2H4) 酸性KMnO4溶液 洗气
C CH3COOCH2CH3(CH3CH2OH) 饱和Na2CO3溶液 分液
D Cl2(HCl) 饱和NaHCO3溶液 洗气
10.下列叙述正确的是( )
A.50℃时,的纯碱溶液中,
B.相同条件下,浓度均为的盐酸与溶液,水的电离程度相同
C.将水加热到,测得其,则液体呈酸性
D.常温时,的溶液与的溶液等体积混合后
11.已知X、Y是短周期的两种元素,下表中由条件得出的结论一定正确的是( )
选项 条件 结论
A 若原子半径:X>Y 原子序数:X
B 若常见化合物XmYn中Y显负价 元素的电负性:X
C 若元素原子的价层电子数:X>Y 元素的最高正价:X>Y
D 若X、Y原子最外层电子数分别为1、7 元素的第一电离能:X>Y
12.已知甲、乙、丙、丁是原子序数依次增大的短周期元素。甲是宇宙中含量最多的元素。基态时:乙原子最高能级的不同轨道内都有电子,且自旋方向都相同;丙原子中有两种形状的电子云,最高能层只有一种自旋方向的电子,丁原子的价电子排布式为nsn-1npn+1。下列说法不正确的是( )
A.电负性:甲>丙 B.第一电离能:乙>丁
C.原子半径:丙>丁 D.简单离子的半径:丙阳离子>乙阴离子
13.下列实验操作的现象不能达到预期实验目的或不能得出相应结论的是( )
选项 实验操作和现象 预期实验目的或结论
A 向溶液中滴入2滴溶液,有白色沉淀生成,再滴入4滴溶液,白色沉淀转变为黄色沉淀
B 将溶液与溶液充分混合;再继续加入固体,溶液颜色加深 证明溶液中存在平衡:
C pH计分别测定的溶液和的溶液的,其均为7 同温下,不同浓度的溶液中水的电离程度相同
D Zn和稀反应的试管中滴加几滴溶液,气泡生成速率加快 形成原电池能加快反应速率
14.某小组同学用0.1mol·L-1的NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1盐酸和醋酸溶液得到如图所示的滴定曲线。下列说法正确的是( )
A.图中和大小:
B.水的电离程度:点点
C.P点
D.点离子浓度大小:
二、非选择题(本题共4小题,共58分)
15.(14分)硫酸羟胺[或,易溶于水,不溶于乙醇]常用作还原剂、显影剂和橡胶硫化剂。某同学设计如下实验装置(部分加热装置和夹持装置已省略)制备少量硫酸羟胺,反应原理为。回答下列问题:
(1)装置A中盛放稀硫酸的仪器名称为_______。检验装置A中发生装置气密性的方法是_______。
(2)装置B中_______(填“能”或“不能”)用水浴加热,其原因是_______。
(3)装置C烧瓶中反应的化学方程式为_______;若将稀硝酸换成浓硝酸,则装置B、C之间应加装盛放_______(填试剂名称)的洗气装置。
(4)反应完毕后,蒸馏出装置B中部分水分后,加入足量_______(填试剂名称),溶液中析出晶体,经过滤、洗涤、干燥得到硫酸羟胺。
(5)硫酸羟胺产品质量分数的测定
称取2.50g产品,配制100mL溶液,取25mL溶液于锥形瓶中,向锥形瓶中滴加0.05mol·L-1的高锰酸钾溶液,当恰好完全反应时,消耗24.0mL高锰酸钾溶液[已知:]。
①配平上述反应的离子方程式:_______。
②产品中硫酸羟胺的质量分数为_______%(结果保留三位有效数字)。
16.(14分)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2、CuO和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
已知:SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤所得滤液中溶质的主要成分为Na[Al(OH)4]。
(1)基态Al原子的L层电子排布图为______。基态Si原子核外共有______种空间运动状态的电子。
(2)基态Fe原子的核外电子排布式为______。
(3)C、Na、O、Cu的第一电离能由大到小的顺序为______。
(4)“电解I”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是______。
(5)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为______,阴极产生的物质A的化学式为______。
17.(15分)平衡移动原理在实验、生活、生产中应用广泛。回答下列问题:
(1)实验室配制溶液时需将粉末加浓盐酸进行溶解,请用平衡移动原理解释原因:_______[已知:水解生成]。
(2)泡沫灭火器里的药品是溶液和溶液,其工作原理为_______(用离子方程式表示)。泡沫灭火器有内筒(塑料材质)和外筒(钢质)两部分组成,外筒放入的药品是_______(填化学式)。
(3)只用一种试剂就可以鉴别下列溶液:溶液、溶液、溶液。该试剂为_______。
(4)相同物质的量浓度的下列溶液:①、②、③、④,由大到小的顺序是_______(用序号表示)。
(5)向少量悬浊液中加入适量的饱和溶液,结果固体完全溶解,固体溶解的原因可能是:
猜想甲:①
②
③
结论:由于③反应的发生,使反应①平衡正向移动,溶解。
猜想乙:①
②______
结论:由于②反应的发生,_______。
(6)设计一个简单的实验方案证明纯碱溶液中存在水解平衡:向盛有碳酸钠溶液的试管中滴入几滴酚酞溶液,振荡,溶液变红,_______,证明纯碱溶液中存在水解平衡。已知25℃时,Na2CO3溶液的第一步水解常数KM=2×10-4,则当溶液pH=10时______。
18.(15分)的资源化利用成为研究热点。一定条件下,催化加氢发生的反应为。一定条件下,向容积为的恒容密闭容器中充入和,分别在温度为条件下反应,测得反应体系中的物质的量分数随时间的变化关系如图所示。回答下列问题:
(1)在T1K温度下,CO2的平衡转化率=_____%。压缩平衡体系体积,平衡______(“正向移动”“不移动”或“逆向移动”)。若想进一步提高CO2的平衡转化率,除改变温度外还可以采取的措施是______
(2)在T2K温度下,经t1min后反应达到平衡。
①0~t1min内,用CO2表示的反应速率v(CO2)=_______mol·L-1·min-1。
②在温度下,该反应的平衡常数______(用分数表示)。
(3)下图中能正确表示反应的化学平衡常数与温度关系的是______(填字母)。
(4)若反应在恒容容器中发生,下列情况下反应一定达到平衡状态的是_______(填字母)。
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内
D.单位时间内,断开键的数目和断开键的数目相同
(5)已知反应的。为速率常数,x(B)为组分B的物质的量分数。a、b点的正反应速率之比va:vb_______(填“>”“<”或“=”)1;c点的=_______。
安徽省皖中联盟2023-2024学年高二上学期期末联考
化学
参考答案、提示及评分细则
一、选择题:本大题共14小题,每题3分,总共42分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
选项 D D C A B C D A C B B D C D
1.D【解析】图示只能表示原子核外2p能级电子云轮廓图,A项不符合题意;原子结构示意图只表示核外的电子分层排布情况,B项不符合题意;电子式只能表示最外层电子数,C项不符合题意;电子排布图包含了能层、能级、轨道以及轨道内电子的自旋状态,对电子运动状态描述最详尽,D项符合题意。
2.D【解析】2s和3s轨道形状均为球形,A项正确;无论是哪个能层上的能级,d能级都有5个轨道,B项正确;同一能层,p轨道上原子轨道能量相等并且互相垂直,C项正确;当s和p能级不在同一能层时,p能级能量不一定比s能级的能量高,D项错误。
3.C【解析】化石燃料的燃烧是化学能转化为热能与光能,A项错误;石灰石的主要成分是碳酸盐,B项错误;三星堆出土的黄金面具材料属于合金,C项正确;纤维0有天然纤维和合成纤维,橡胶有天然橡胶和合成橡胶,D项错误。
4.A【解析】催化剂能加快化学反应速率,但不能改变反应的焓变,A项错误;题图中正反应的焓变,所以其逆反应为吸热反应,B项正确;从图中可以看出,该反应的,C项正确;E1为正反应的活化能;增大反应物浓度或升高温度都可以加快化学反应速率,但不能降低反应的活化能,D项正确。
5.B【解析】同温同压下,同一反应的相同,与引发条件无关,A项错误;与反应生成时,放出热量,则热化学方程式为,B项正确:增大压强,反应平衡正向移动,放出的热量增大,但反应热不变,不变,项错误;为弱酸、为弱碱,均存在电离平衡,电离过程吸热,所以产生时放出的热量小于,D项错误。
6.C【解析】根据电负性的递变规律:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小可知,在同周期中电负性:Na
8.A【解析】X出现了I4,而锂原子核外只有3个电子,R元素不可能为Li元素,A项错误;Y最高价为+2价,则基态Y原子的价层电子数可能为2,B项正确;最外层有2个电子的元素可能是主族元素,也可能是副族元素,C项正确;当时,元素的最高化合价为+n价,故X最高价为+1,Y最高价为+2,Z最高价为+3.Z的氯化物的化学式可能为ZCl3,D项正确。
9.C【解析】加入铁粉会与FeCl3反应,A项错误;酸性高锰酸钾溶液将C2H4氧化,生成CO2,引入新杂质,
B项错误;CH3CH2OH易溶于水,而乙酸乙酯难溶于饱和碳酸钠溶液,故可以除去杂质CH3CH2OH,C项正确;通过饱和NaHCO3溶液洗气会引入新杂质CO2,D项错误。
10.B【解析】该溶液的温度是,故,所以,A项错误;的盐酸中,由水电离出的的溶液中,由水电离出的,则水的电离程度相同,B项正确;将水加热到,但所得液体仍呈中性,C项错误;两种溶液反应后过量,则溶液,D项错误。
11.B【解析】原子半径:Na>O,原子序数Na>O,A项错误;电负性大的元素吸引电子的能力强,化合物中电负性大的元素显负价,B项正确;F原子的价层电子数大于N的,但F没有正价,C项错误;若X、Y原子的最外层电子数分别为1、7,则X可能为H、Li、Na,Y可能为F、Cl,第一电离能:Li
AgI沉淀,从而比较Ksp(AgCl)和Ksp(AgI)大小,A项正确;KSCN和FeCl3按照物质的量之比4:1发生反应,达到平衡后继续加入KSCN固体,增大c(KSCN),平衡正向移动,使Fe(SCN)3物质的量浓度增大,溶液颜色加深,能够证明溶液中存在平衡:,B项正确;溶液为中性,水解促进水的电离,浓度不同,对水的电离促进作用不同,则水的电离程度不同,C项错误;生成的附着在上,形成原电池,加快反应速率,D项正确。
14.D【解析】由图中未加NaOH溶液时的pH可知,图I中酸的pH大于1,图Ⅱ中酸的pH=1,说明Ⅱ为滴定0.1mol·1的盐酸溶液的曲线,醋酸和氢氧化钠恰好完全反应时,得到的醋酸钠溶液显碱性,要使溶液显中性,需要NaOH的体积小于完全反应时的体积,盐酸和氢氧化钠恰好完全反应时,得到的氯化钠溶液显中性,所以V1
15.【答案】(除标注外,每空2分,共14分)
(1)分液漏斗(1分)关闭装置A、B之间和装置A中分液漏斗的活塞,向装置A中的分液漏斗内注入适量水,打开分液漏斗的活塞,分液漏斗中的水不滴落,则装置气密性良好(或其他合理答案)
(2)不能(1分) 水浴加热最多能加热到100℃,而本实验所需温度为150℃(1分)
(3) 水
(4)乙醇(1分)
(5)①
②78.7
16.【答案】(每空2分,共14分)
(1)8
(2)(或)
(3)
(4)石墨电极被阳极上产生的氧化
(5)
17.【答案】(除标注外,每空2分,共15分)
(1)溶液中存在水解平衡:,加入浓盐酸,增大,使该平衡逆向移动,抑制水解
(2)(1分)
(3)紫色石蕊溶液(或其他合理答案,1分)
(4)①>②>③>④
(5) 使反应①平衡正向移动,Mg(OH)2溶解(1分)
(6)加热,溶液红色加深或者向溶液中再加入过量的BaCl2固体,产生白色沉淀,且红色褪去(或其他合理答案) 2:1
18.【答案】(除标注外,每空2分,共15分)
(1)40不移动(1分) 将水蒸气液化后分离出来(或其他合理答案,1分)
(2)① ②
(3)d (4)D (5)>(1分) 2.25或
同课章节目录
