化学人教版(2019)必修第二册6.1.2化学反应与电能(共36张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.1.2化学反应与电能(共36张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-22 00:00:00 | ||
图片预览








文档简介
(共36张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
第二课时
学习目标
1.借助原电池装置和原理的学习,体会化学能到电能的直接转化,提高模型认知能力,学习科学探究方法。
2.能够辨识简单原电池的构成要素,能正确判断原电池的正、负极,能够用电极反应式对简单原电池的宏观实验现象进行符号表征。
3.了解各类电池在生产、生活实际中的应用,能够举例说明化学电源对提高生活质量的重要意义。
新课导入
能源是人类社会赖以生存和发展的物质基础,能源是城市的血液,现代化程度越高对能源的依赖越强。
能源
二级
能源
一级
能源
在自然界现成存在的能源,
如化石燃料、水能等。
由一级能源转换而成的能源,
如电能、煤气、汽油等。
生活中的电池
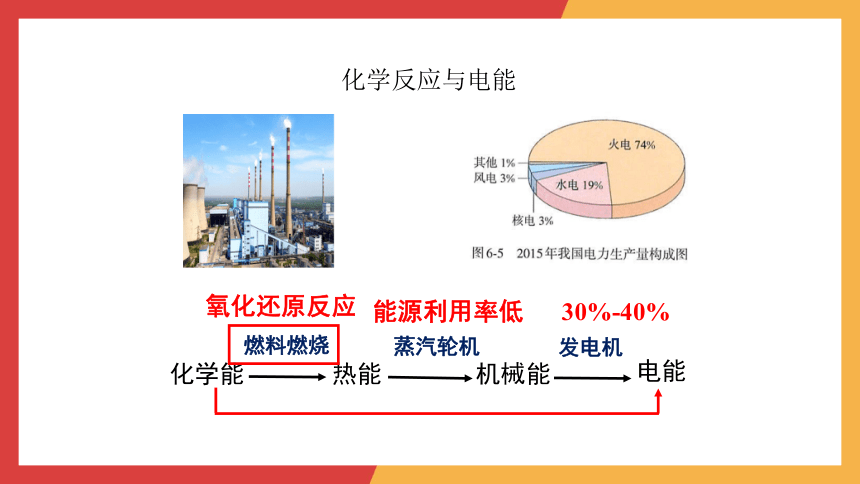
化学反应与电能
化学能
热能
机械能
电能
燃料燃烧
蒸汽轮机
发电机
能源利用率低 30%-40%
氧化还原反应
化学反应与电能
实验探究6-3
(1) 将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
(2) 用导线连接锌片和铜片,观察、比较导线连接前后的现象。
(3) 如图6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
请输入标题内容
化学反应与电能
实验分析
实验现象:① 刚开始,锌片上有气泡产生,铜片上无气泡产生;
② 当用导线相连后,铜片上有气泡产生;
③ 串联电流表后,电流表指针发生偏转,
实验结论:① 锌与稀硫酸反应,铜不与稀硫酸反应;
② 导线中有电流通过。
2e-
Zn + 2H+ = Zn2+ + H2
Zn + H2SO4 = ZnSO4 + H2
实验原理:
化学反应与电能
思考
①既然铜片不与稀硫酸反应,为什么铜上会有氢气生成?
②电流表的指针为何偏转?
③只将锌插入H2SO4溶液中,根据现象知:锌也失电子变成锌离子,氢离子也得电子变成氢气。为什么不产生电流呢?
④负极失电子呈正电性趋势,正极呈负电性趋势,溶液中的离子是怎样移动的?
化学反应与电能
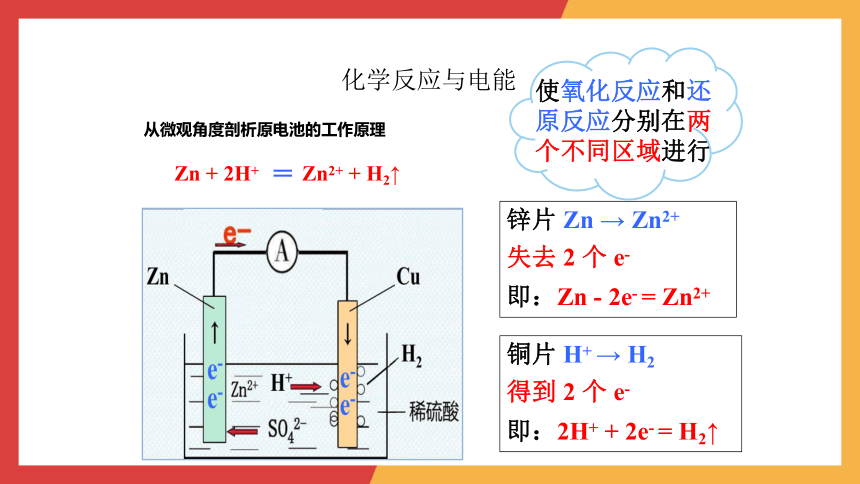
从微观角度剖析原电池的工作原理
Zn + 2H+ Zn2+ + H2↑
锌片 Zn → Zn2+
失去 2 个 e-
即:Zn - 2e- = Zn2+
铜片 H+ → H2
得到 2 个 e-
即:2H+ + 2e- = H2↑
使氧化反应和还原反应分别在两个不同区域进行
化学反应与电能
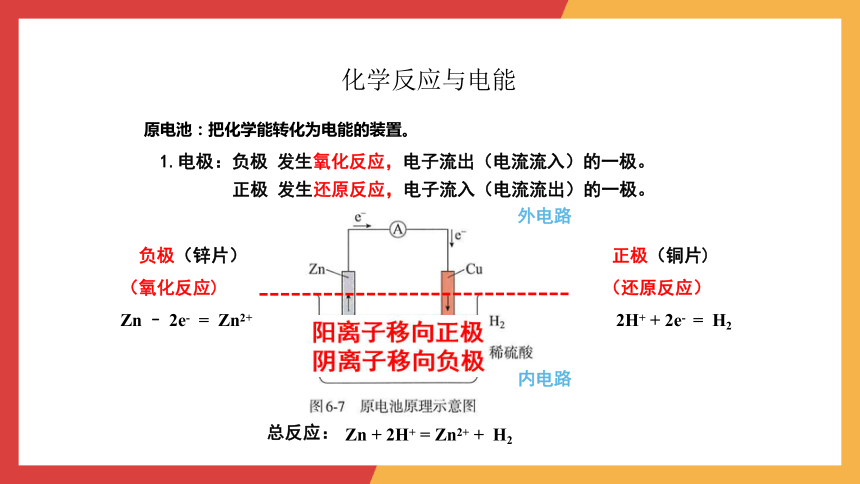
原电池:把化学能转化为电能的装置。
1.电极:负极 发生氧化反应,电子流出(电流流入)的一极。
正极 发生还原反应,电子流入(电流流出)的一极。
负极(锌片)
(氧化反应)
Zn – 2e- = Zn2+
总反应:
Zn + 2H+ = Zn2+ + H2
正极(铜片)
(还原反应)
2H+ + 2e- = H2
内电路
外电路
化学反应与电能
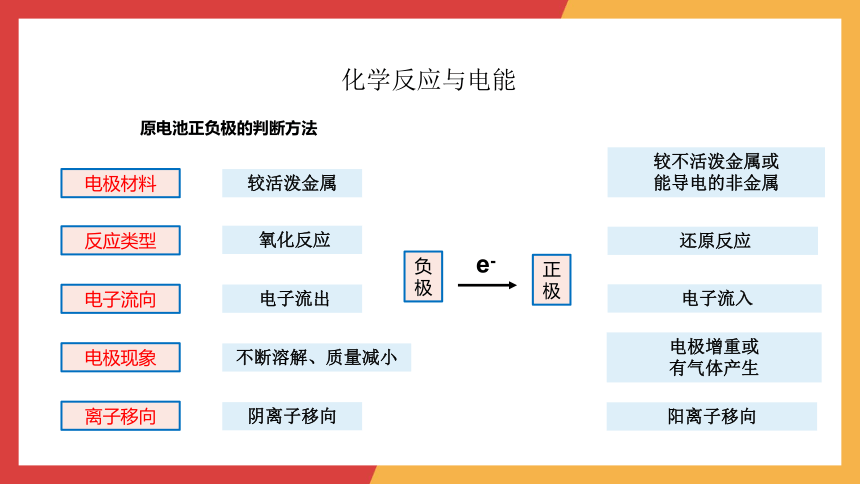
原电池正负极的判断方法
电极材料
反应类型
电子流向
电极现象
离子移向
负极
正极
较活泼金属
较不活泼金属或
能导电的非金属
氧化反应
还原反应
电子流出
电子流入
e-
不断溶解、质量减小
电极增重或
有气体产生
阴离子移向
阳离子移向
化学反应与电能
原电池的构成条件:
1.能自发进行的放热的氧化还原反应、一般是负极与电解质溶液发生反应
2.活动性不同的两极(一般是较活泼金属作负极)
注意:可以是金属与金属,也可以是金属与导电非金属(石墨)
3.有电解质溶液
4.两极形成闭合回路(相连或接触)
下列哪些装置能构成原电池?
稀硫酸
Ag
Cu
A
稀硫酸
Zn
Cu
稀硫酸
Zn
Fe
Zn
H2SO4溶液
G
√
√
√
√
化学反应与电能
原电池的应用
1.比较金属活动性强弱。
2.加快化学反应速率
构成原电池的反应的速率比直接接触的反应的速率快。如实验室制H2时,粗锌比纯锌与稀硫酸反应的速率快,或向溶液中滴入几滴 CuSO4溶液,反应加快。
3.设计化学电池
例如:以2FeCl3+Cu =2FeCl2+CuCl2为依据,设计一个原电池。
化学反应与电能
(1)将氧化还原反应拆成氧化反应和还原反应两个半反应,分别作原电池的负极和正极的电极反应式。
负极:Cu-2e- =Cu2+,正极:2Fe3++2e- = 2Fe2+。
(2)确定电极材料
若发生氧化反应的物质为金属单质,可用该金属直接作负极;若发生氧化反应的物质为气体(如H2)或溶液中的还原性离子,可用惰性电极(如Pt、碳棒)作负极。
正极发生还原反应,其电极材料一般不如负极材料活泼。
本例中可用铜棒作负极,用铂丝或碳棒作正极。
(3)确定电解质溶液
一般选用反应物中的电解质溶液即可,如本例中可用FeCl3溶液作电解质溶液。
(4)构成闭合回路
将电极用导线连接,使之构成闭合回路。
设计化学电源
还原剂 + 氧化剂=氧化产物+还原产物
氧化还原反应
还原反应
形成
闭合回路
(失电子)
(得电子)
原电池
负极反应物
负极材料
正极反应物
正极材料
?
设计化学电源
原理:理论上任何自发的氧化还原反应都可以设计成原电池
设计思路
(1)定反应:确定一个能够自发进行的氧化还原反应。
(2)拆两半:将氧化还原反应拆分为氧化反应和还原反应两个半反应,
分别作为负极和正极的电极反应
还原剂-ne-===氧化产物(负极电极反应);
氧化剂+ne-===还原产物(正极电极反应)。
(3)找材料:电极材料必须导电,负极材料一般选择较活泼的金属材料,
或者在该氧化还原反应中,本身失去电子的材料;
电解质溶液一般能与负极反应。
(4)画装置:连接电路形成闭合回路,画出原电池示意图。
设计化学电源
设计原电池,以Fe+CuSO4==FeSO4+Cu进行设计,画出原电池示意图,标出正负极和电子移动方向,并写出该电池的正负极电极反应式。
探究
电解质溶液
序号 电极(大小相同) 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
电极材料的选择对电池效果的影响?
序号 电极(大小相同) 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
对比实验①②③或⑤⑥,得出结论:
在其他条件相同时,电极材料活泼性差别越大,电池效果越好。
自发进行的氧化还原反应
电极材料(金属、石墨棒)
形成闭合回路(导线、电解质溶液等)
2. 原电池的构成要素
化学电池
1.一次电池:放电之后不能充电的电池。
(内部氧化还原反应无法逆向进行)
负极(锌筒):Zn – 2e- = Zn2+ 氧化反应
正极(石墨棒):MnO2 得电子 还原反应
锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。
化学电池
2.二次电池
铅酸蓄电池
镍氢电池
锂离子电池
化学能
电能
放电
充电
充电电池
纽扣电池
干电池
笔记本电脑电池
手机锂电池
铅蓄电池
新能源汽车电池
发展中的燃料电池
燃料电池是一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置,具有清洁、安全、高效等特点。当以氢气为燃料时,产物为水;以甲烷为燃料时,产物为水和二氧化碳。与常规发电厂相比,其二氧化碳排放量明显降低。燃料电池与干电池或蓄电池的主要差别在与反应物不是储存在电池内部,而是从外部提供,这时电池起着类似试管、烧杯等反应器的作用。
燃料电池的供电量易于调节,能适应用电器负载的变化,而且不需要很长的充电时间,在航天,军事和交通等领域有广阔的应用前景。
化学电池
一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。
特点:
清洁、安全、高效;
能量转化率可以达到80%以上;
反应物不是储存在电池内部,而是从外部提供,供电量易于调节。
发展中的燃料电池
负极(氧化反应)
正极(还原反应)
2H2 + O2 = 2H2O
归纳总结
负极锌片失去的电子通过导线定向移动到正极铜片,从而形成电流
随堂训练
C
C
随堂训练
还原反应
由Fe片流出经导线和LED灯流向Cu片
Fe
Fe-2e-===Fe2+
Zn
Zn-2e-===Zn2+
随堂训练
B
D
随堂训练
A
随堂训练
D
随堂训练
B
随堂训练
A
不可以,该反应不是氧化还原反应,无电子转移
Zn
H2SO4(或H+)
Cu
稀硫酸
锌电极失去电子,电子通过导线流向铜电极上,溶液中的氢离子在铜电极得到电子。同时,电解质溶液中的离子定向移动,构成闭合回路,形成电流
第六章 化学反应与能量
第一节 化学反应与能量变化
第二课时
学习目标
1.借助原电池装置和原理的学习,体会化学能到电能的直接转化,提高模型认知能力,学习科学探究方法。
2.能够辨识简单原电池的构成要素,能正确判断原电池的正、负极,能够用电极反应式对简单原电池的宏观实验现象进行符号表征。
3.了解各类电池在生产、生活实际中的应用,能够举例说明化学电源对提高生活质量的重要意义。
新课导入
能源是人类社会赖以生存和发展的物质基础,能源是城市的血液,现代化程度越高对能源的依赖越强。
能源
二级
能源
一级
能源
在自然界现成存在的能源,
如化石燃料、水能等。
由一级能源转换而成的能源,
如电能、煤气、汽油等。
生活中的电池
化学反应与电能
化学能
热能
机械能
电能
燃料燃烧
蒸汽轮机
发电机
能源利用率低 30%-40%
氧化还原反应
化学反应与电能
实验探究6-3
(1) 将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
(2) 用导线连接锌片和铜片,观察、比较导线连接前后的现象。
(3) 如图6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
请输入标题内容
化学反应与电能
实验分析
实验现象:① 刚开始,锌片上有气泡产生,铜片上无气泡产生;
② 当用导线相连后,铜片上有气泡产生;
③ 串联电流表后,电流表指针发生偏转,
实验结论:① 锌与稀硫酸反应,铜不与稀硫酸反应;
② 导线中有电流通过。
2e-
Zn + 2H+ = Zn2+ + H2
Zn + H2SO4 = ZnSO4 + H2
实验原理:
化学反应与电能
思考
①既然铜片不与稀硫酸反应,为什么铜上会有氢气生成?
②电流表的指针为何偏转?
③只将锌插入H2SO4溶液中,根据现象知:锌也失电子变成锌离子,氢离子也得电子变成氢气。为什么不产生电流呢?
④负极失电子呈正电性趋势,正极呈负电性趋势,溶液中的离子是怎样移动的?
化学反应与电能
从微观角度剖析原电池的工作原理
Zn + 2H+ Zn2+ + H2↑
锌片 Zn → Zn2+
失去 2 个 e-
即:Zn - 2e- = Zn2+
铜片 H+ → H2
得到 2 个 e-
即:2H+ + 2e- = H2↑
使氧化反应和还原反应分别在两个不同区域进行
化学反应与电能
原电池:把化学能转化为电能的装置。
1.电极:负极 发生氧化反应,电子流出(电流流入)的一极。
正极 发生还原反应,电子流入(电流流出)的一极。
负极(锌片)
(氧化反应)
Zn – 2e- = Zn2+
总反应:
Zn + 2H+ = Zn2+ + H2
正极(铜片)
(还原反应)
2H+ + 2e- = H2
内电路
外电路
化学反应与电能
原电池正负极的判断方法
电极材料
反应类型
电子流向
电极现象
离子移向
负极
正极
较活泼金属
较不活泼金属或
能导电的非金属
氧化反应
还原反应
电子流出
电子流入
e-
不断溶解、质量减小
电极增重或
有气体产生
阴离子移向
阳离子移向
化学反应与电能
原电池的构成条件:
1.能自发进行的放热的氧化还原反应、一般是负极与电解质溶液发生反应
2.活动性不同的两极(一般是较活泼金属作负极)
注意:可以是金属与金属,也可以是金属与导电非金属(石墨)
3.有电解质溶液
4.两极形成闭合回路(相连或接触)
下列哪些装置能构成原电池?
稀硫酸
Ag
Cu
A
稀硫酸
Zn
Cu
稀硫酸
Zn
Fe
Zn
H2SO4溶液
G
√
√
√
√
化学反应与电能
原电池的应用
1.比较金属活动性强弱。
2.加快化学反应速率
构成原电池的反应的速率比直接接触的反应的速率快。如实验室制H2时,粗锌比纯锌与稀硫酸反应的速率快,或向溶液中滴入几滴 CuSO4溶液,反应加快。
3.设计化学电池
例如:以2FeCl3+Cu =2FeCl2+CuCl2为依据,设计一个原电池。
化学反应与电能
(1)将氧化还原反应拆成氧化反应和还原反应两个半反应,分别作原电池的负极和正极的电极反应式。
负极:Cu-2e- =Cu2+,正极:2Fe3++2e- = 2Fe2+。
(2)确定电极材料
若发生氧化反应的物质为金属单质,可用该金属直接作负极;若发生氧化反应的物质为气体(如H2)或溶液中的还原性离子,可用惰性电极(如Pt、碳棒)作负极。
正极发生还原反应,其电极材料一般不如负极材料活泼。
本例中可用铜棒作负极,用铂丝或碳棒作正极。
(3)确定电解质溶液
一般选用反应物中的电解质溶液即可,如本例中可用FeCl3溶液作电解质溶液。
(4)构成闭合回路
将电极用导线连接,使之构成闭合回路。
设计化学电源
还原剂 + 氧化剂=氧化产物+还原产物
氧化还原反应
还原反应
形成
闭合回路
(失电子)
(得电子)
原电池
负极反应物
负极材料
正极反应物
正极材料
?
设计化学电源
原理:理论上任何自发的氧化还原反应都可以设计成原电池
设计思路
(1)定反应:确定一个能够自发进行的氧化还原反应。
(2)拆两半:将氧化还原反应拆分为氧化反应和还原反应两个半反应,
分别作为负极和正极的电极反应
还原剂-ne-===氧化产物(负极电极反应);
氧化剂+ne-===还原产物(正极电极反应)。
(3)找材料:电极材料必须导电,负极材料一般选择较活泼的金属材料,
或者在该氧化还原反应中,本身失去电子的材料;
电解质溶液一般能与负极反应。
(4)画装置:连接电路形成闭合回路,画出原电池示意图。
设计化学电源
设计原电池,以Fe+CuSO4==FeSO4+Cu进行设计,画出原电池示意图,标出正负极和电子移动方向,并写出该电池的正负极电极反应式。
探究
电解质溶液
序号 电极(大小相同) 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
电极材料的选择对电池效果的影响?
序号 电极(大小相同) 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
对比实验①②③或⑤⑥,得出结论:
在其他条件相同时,电极材料活泼性差别越大,电池效果越好。
自发进行的氧化还原反应
电极材料(金属、石墨棒)
形成闭合回路(导线、电解质溶液等)
2. 原电池的构成要素
化学电池
1.一次电池:放电之后不能充电的电池。
(内部氧化还原反应无法逆向进行)
负极(锌筒):Zn – 2e- = Zn2+ 氧化反应
正极(石墨棒):MnO2 得电子 还原反应
锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。
化学电池
2.二次电池
铅酸蓄电池
镍氢电池
锂离子电池
化学能
电能
放电
充电
充电电池
纽扣电池
干电池
笔记本电脑电池
手机锂电池
铅蓄电池
新能源汽车电池
发展中的燃料电池
燃料电池是一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置,具有清洁、安全、高效等特点。当以氢气为燃料时,产物为水;以甲烷为燃料时,产物为水和二氧化碳。与常规发电厂相比,其二氧化碳排放量明显降低。燃料电池与干电池或蓄电池的主要差别在与反应物不是储存在电池内部,而是从外部提供,这时电池起着类似试管、烧杯等反应器的作用。
燃料电池的供电量易于调节,能适应用电器负载的变化,而且不需要很长的充电时间,在航天,军事和交通等领域有广阔的应用前景。
化学电池
一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。
特点:
清洁、安全、高效;
能量转化率可以达到80%以上;
反应物不是储存在电池内部,而是从外部提供,供电量易于调节。
发展中的燃料电池
负极(氧化反应)
正极(还原反应)
2H2 + O2 = 2H2O
归纳总结
负极锌片失去的电子通过导线定向移动到正极铜片,从而形成电流
随堂训练
C
C
随堂训练
还原反应
由Fe片流出经导线和LED灯流向Cu片
Fe
Fe-2e-===Fe2+
Zn
Zn-2e-===Zn2+
随堂训练
B
D
随堂训练
A
随堂训练
D
随堂训练
B
随堂训练
A
不可以,该反应不是氧化还原反应,无电子转移
Zn
H2SO4(或H+)
Cu
稀硫酸
锌电极失去电子,电子通过导线流向铜电极上,溶液中的氢离子在铜电极得到电子。同时,电解质溶液中的离子定向移动,构成闭合回路,形成电流
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
