6.1.3 化学电池 课件(共20张PPT含视频) 高中化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.3 化学电池 课件(共20张PPT含视频) 高中化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 33.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-22 10:39:19 | ||
图片预览




文档简介
(共20张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
课时3 化学电池
课堂导入
课堂学习
生活中常见的电池
根据原电池的工作原理,人们研制出很多结构和性能各异的化学电池,以满足不同的用电需要。
生活中常见的电池类型有锌锰干电池、铅酸蓄电池、锂离子电池和燃料电池等,根据其充放电次数的不同,又可以将电池分为一次电池和二次电池(充电电池)。
课堂学习
一次电池
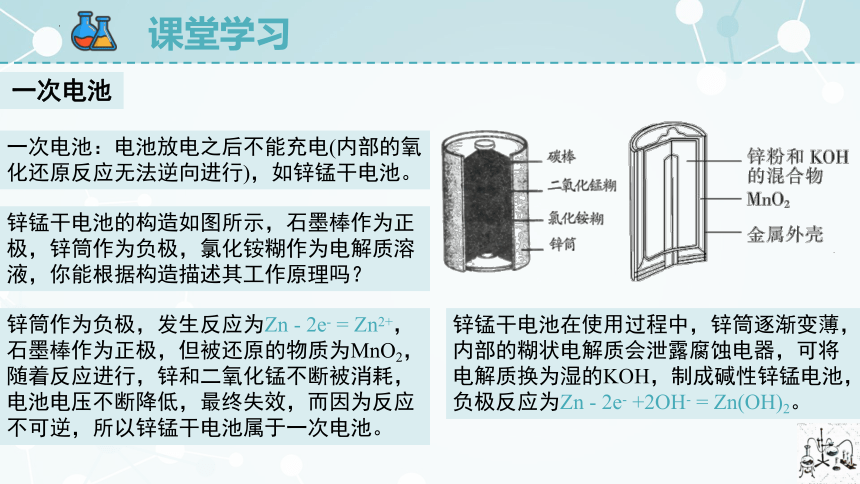
锌锰干电池的构造如图所示,石墨棒作为正极,锌筒作为负极,氯化铵糊作为电解质溶液,你能根据构造描述其工作原理吗?
一次电池:电池放电之后不能充电(内部的氧化还原反应无法逆向进行),如锌锰干电池。
锌筒作为负极,发生反应为Zn - 2e- = Zn2+,石墨棒作为正极,但被还原的物质为MnO2,随着反应进行,锌和二氧化锰不断被消耗,电池电压不断降低,最终失效,而因为反应不可逆,所以锌锰干电池属于一次电池。
锌锰干电池在使用过程中,锌筒逐渐变薄,内部的糊状电解质会泄露腐蚀电器,可将电解质换为湿的KOH,制成碱性锌锰电池,负极反应为Zn - 2e- +2OH- = Zn(OH)2。
课堂学习
二次电池
二次电池:放电时所进行的氧化还原反应在充电时可以逆向进行,使电池恢复到放电前的状态,从而实现放电与充电的循环,又称为充电电池。
能量转化:
化学能
电能
放电
充电
常见例子:铅酸蓄电池、镍氢电池、锂离子电池等。
课堂学习
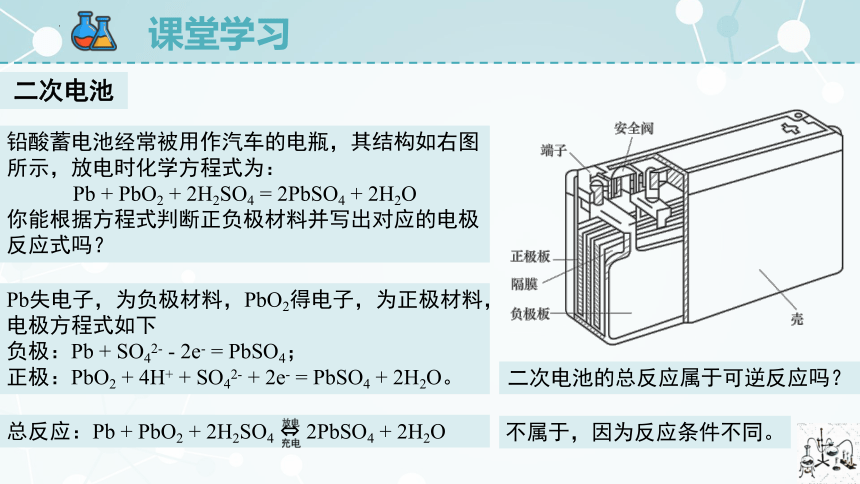
二次电池
铅酸蓄电池经常被用作汽车的电瓶,其结构如右图所示,放电时化学方程式为:
Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
你能根据方程式判断正负极材料并写出对应的电极反应式吗?
Pb失电子,为负极材料,PbO2得电子,为正极材料,电极方程式如下
负极:Pb + SO42- - 2e- = PbSO4;
正极:PbO2 + 4H+ + SO42- + 2e- = PbSO4 + 2H2O。
总反应:Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
二次电池的总反应属于可逆反应吗?
不属于,因为反应条件不同。
课堂学习
燃料电池
燃料电池:将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。
燃料电池的优点:
具有清洁、安全、高效等特点;
燃料电池的能量转化率可以达到80%以上;
反应物不储存在电池内部,而是由外设设备提供,供电量易于调节。
应用:在航天、军事、交通等领域均有广阔的应用前景。
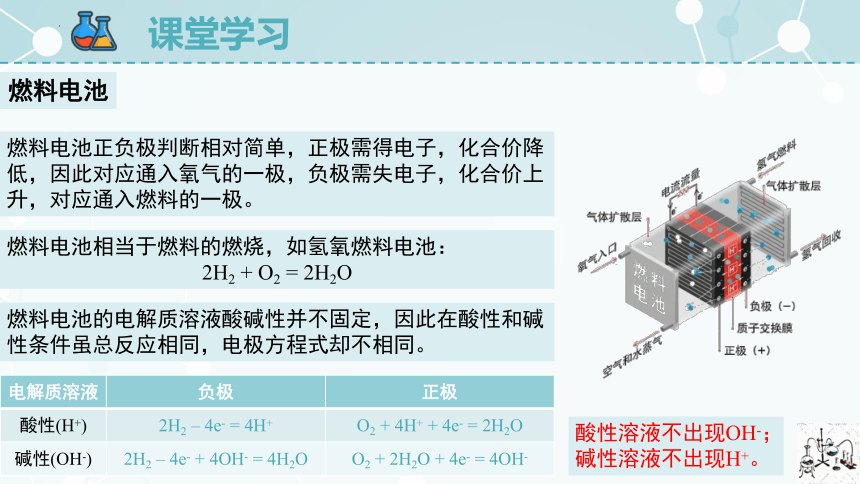
如图是氢氧燃料电池的工作原理图,你能判断出电池的正负极,写出总反应方程式和电极反应式吗?
电解质溶液 负极 正极
酸性(H+)
碱性(OH-)
课堂学习
燃料电池
燃料电池正负极判断相对简单,正极需得电子,化合价降低,因此对应通入氧气的一极,负极需失电子,化合价上升,对应通入燃料的一极。
燃料电池相当于燃料的燃烧,如氢氧燃料电池:
2H2 + O2 = 2H2O
燃料电池的电解质溶液酸碱性并不固定,因此在酸性和碱性条件虽总反应相同,电极方程式却不相同。
电解质溶液 负极 正极
酸性(H+) 2H2 – 4e- = 4H+ O2 + 4H+ + 4e- = 2H2O
碱性(OH-) 2H2 – 4e- + 4OH- = 4H2O O2 + 2H2O + 4e- = 4OH-
酸性溶液不出现OH-;
碱性溶液不出现H+。
课堂学习
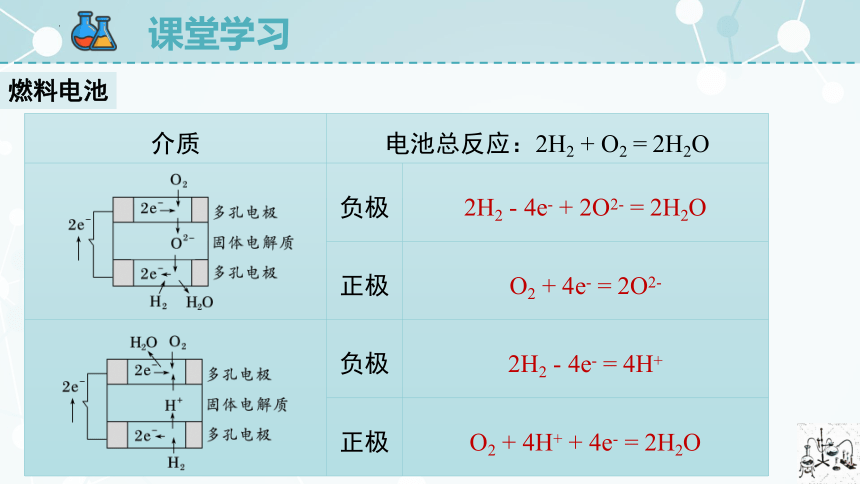
燃料电池
介质 电池总反应:2H2 + O2 = 2H2O 负极 2H2 - 4e- + 2O2- = 2H2O
正极 O2 + 4e- = 2O2-
负极 2H2 - 4e- = 4H+
正极 O2 + 4H+ + 4e- = 2H2O
课堂学习
原电池电极反应式书写常见错误
1.不能正确判断原电池正负极
混淆正负极:负极上电极材料本身或电极反应物发生氧化反应,对应元素化合价升高,正极上电极反应物发生还原反应,对应元素化合价降低。
易混淆电子流向与电流方向而错判,电子流出的方向与电流方向相反,电子流出的电极是负极。
错误地认为排在金属活动性顺序前面的金属一定是负极,忽视反应本质。
2.电极反应式配平错误
不能根据化合价变化正确计算电子转移的数目。
不满足守恒定律:电极反应式和氧化还原方程式一样,要满足得失电子守恒、电荷守恒和质量守恒。
课堂学习
原电池电极反应式书写常见错误
将甲烷燃料电池设计为右图所示装置后发现OH-定向移向A电极,则两极电极反应式应如何书写?
3.电极产物书写错误
忽视变价金属被氧化的价态,如铁片与碳棒用导线连接插入硫酸铜溶液中,错误书写可能为负极:Fe - 3e- = Fe3+,实际上,铁在硫酸铜溶液中只能被铜离子氧化为Fe2+。
对于活泼金属电极,想当然地认为电极产物为金属离子,忽视金属离子与电解质溶液的某种成分可继续反应,最终的氧化产物要根据题中信息确定。
忽略介质信息,错判电极产物。
特别注意:酸性介质中不能出现OH-,碱性介质中不能出现H+。
A极为负极,通入甲烷:CH4 + 10OH- - 8e- = CO32- + 7H2O;
B极为正极,通入氧气:2O2 + 4H2O + 8e- = 8OH-。
课堂学习
汽车发展史
(1)喷气式汽车
1680年,英国著名科学家牛顿设想了喷气式汽车的方案,利用喷管喷射蒸汽来推动汽车,但未能制成实物。
(2)蒸汽动力汽车
1769年,法国人N·J·居纽制造了用煤气燃烧产生蒸汽驱动的三轮汽车。
1829年,英国的詹姆斯发明了时速25千米的蒸汽车,该车可以作为大轿车使用。
(3)汽油汽车
1885年是汽车发明取得决定性突破的一年。
德国工程师本茨和戴姆勒、英国的巴特勒分别发明了装有汽油发动机的汽车。
俄国的普奇洛夫和伏洛波夫两人发明了装有内燃机的汽车。
课堂学习
(4)电力汽车
第一辆实际制造出来的电动车是由美国人安德森在1832年到1839年之间发明的。
1898年,德国人波尔舍开发了名为“Lohner-Porsche”的电动车,该车采用铅酸蓄电池作为动力源。
(5)现代汽车
1885年德国工程师卡尔·本茨在曼海姆制造了第一辆装有汽油机的三轮车。这一辆装有内燃动力机的汽车才被认为是世界上真正的第一辆汽车,因为它是真正以汽油为动力源的第一辆汽车,而不是蒸汽机。
(6)新能源汽车
①混合动力汽车:内燃机可持续工作,电池又可以不断得到充电,故其行程和普通汽车一样;②纯电动汽车:以蓄电池提供电能以作为动力;③燃料电池汽车:以燃料电池提供电能作为动力。
汽车发展史
课堂学习
车用能源
(1)常规汽车燃料
汽油和柴油是目前汽车最常用的燃料。通过石油炼制获得的汽油和柴油能量密度高、价格低、不易变质、便于运输,因此非常适用于点燃式发动机和压燃式发动机。
(2)代用燃料
发动机代用燃料指使用代用燃料来替代汽油或柴油。目前国内开发使用的发动机代用燃料包括天然气、液化石油气、甲醇、乙醇、生物质燃料、氢气以及二甲醚等。
课堂学习
车用能源
(3)燃料电池
燃料电池电动汽车替代内燃机动力汽车将是发展趋势。燃料电池是一种直接将燃料的化学能转化为电能的装置。从理论上来讲,只要连续供给燃料,燃料电池便能连续发电,能量转化效率高,且能量高、无噪音、无污染,正在成为理想的能源利用方式。
(4)锂电池等新型电池
①车用锂电池是混合动力汽车及电动汽车的动力电池,具有能量密度高、容量大、无记忆性等优点。
②石墨烯电池是利用锂离子在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出的一种新能源电池。
课堂巩固
正误判断
1. 燃料电池利用燃料的燃烧发电。
4. 原电池中,电极材料不一定参与氧化还原反应。
2. 燃料电池可以将热能转化为电能。
3. 氢氧燃料电池负极反应为2H2 – 4e- = 4H+。
×
×
×
√
课堂巩固
某同学用铝片、铜片和西红柿组成水果电池,下列说法不正确的是 ( )
A.该水果电池中,水果的作用是提供电解质溶液
B.该电池放电时,电子由铝片经电解质溶液流向铜片
C.该水果电池中,铝片做负极发生氧化反应
D.可以通过调节电极材料、水果的种类来调节电池效果
B
课堂巩固
国家电投氢能公司全自主研发的“氢腾”燃料电池系统广泛应用于氢能大巴。某种氢燃料电池的内部结构如图,下列说法正确的是 ( )
A. 电池工作时,电解质溶液中的H+向b极移动
B. a极发生的电极反应为H2 + 2e- + 2OH- = 2H2O
C. b极为正极,发生氧化反应
D. 当外电路有1mol电子转移时,b极消耗5.6L O2
A
课堂小结
氢氧燃料电池 酸性溶液不出现OH-,碱性溶液不出现H+ 电解质溶液 负极 正极
酸性(H+) 2H2 – 4e- = 4H+ O2 + 4H+ + 4e- = 2H2O
碱性(OH-) 2H2 – 4e- + 4OH- = 4H2O O2 + 2H2O + 4e- = 4OH-
电极书写常见错误:
不能正确判断正负极;
电极反应式配平错误;
电极产物书写错误。
谢谢观看
THANKS
第六章 化学反应与能量
第一节 化学反应与能量变化
课时3 化学电池
课堂导入
课堂学习
生活中常见的电池
根据原电池的工作原理,人们研制出很多结构和性能各异的化学电池,以满足不同的用电需要。
生活中常见的电池类型有锌锰干电池、铅酸蓄电池、锂离子电池和燃料电池等,根据其充放电次数的不同,又可以将电池分为一次电池和二次电池(充电电池)。
课堂学习
一次电池
锌锰干电池的构造如图所示,石墨棒作为正极,锌筒作为负极,氯化铵糊作为电解质溶液,你能根据构造描述其工作原理吗?
一次电池:电池放电之后不能充电(内部的氧化还原反应无法逆向进行),如锌锰干电池。
锌筒作为负极,发生反应为Zn - 2e- = Zn2+,石墨棒作为正极,但被还原的物质为MnO2,随着反应进行,锌和二氧化锰不断被消耗,电池电压不断降低,最终失效,而因为反应不可逆,所以锌锰干电池属于一次电池。
锌锰干电池在使用过程中,锌筒逐渐变薄,内部的糊状电解质会泄露腐蚀电器,可将电解质换为湿的KOH,制成碱性锌锰电池,负极反应为Zn - 2e- +2OH- = Zn(OH)2。
课堂学习
二次电池
二次电池:放电时所进行的氧化还原反应在充电时可以逆向进行,使电池恢复到放电前的状态,从而实现放电与充电的循环,又称为充电电池。
能量转化:
化学能
电能
放电
充电
常见例子:铅酸蓄电池、镍氢电池、锂离子电池等。
课堂学习
二次电池
铅酸蓄电池经常被用作汽车的电瓶,其结构如右图所示,放电时化学方程式为:
Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
你能根据方程式判断正负极材料并写出对应的电极反应式吗?
Pb失电子,为负极材料,PbO2得电子,为正极材料,电极方程式如下
负极:Pb + SO42- - 2e- = PbSO4;
正极:PbO2 + 4H+ + SO42- + 2e- = PbSO4 + 2H2O。
总反应:Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
二次电池的总反应属于可逆反应吗?
不属于,因为反应条件不同。
课堂学习
燃料电池
燃料电池:将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。
燃料电池的优点:
具有清洁、安全、高效等特点;
燃料电池的能量转化率可以达到80%以上;
反应物不储存在电池内部,而是由外设设备提供,供电量易于调节。
应用:在航天、军事、交通等领域均有广阔的应用前景。
如图是氢氧燃料电池的工作原理图,你能判断出电池的正负极,写出总反应方程式和电极反应式吗?
电解质溶液 负极 正极
酸性(H+)
碱性(OH-)
课堂学习
燃料电池
燃料电池正负极判断相对简单,正极需得电子,化合价降低,因此对应通入氧气的一极,负极需失电子,化合价上升,对应通入燃料的一极。
燃料电池相当于燃料的燃烧,如氢氧燃料电池:
2H2 + O2 = 2H2O
燃料电池的电解质溶液酸碱性并不固定,因此在酸性和碱性条件虽总反应相同,电极方程式却不相同。
电解质溶液 负极 正极
酸性(H+) 2H2 – 4e- = 4H+ O2 + 4H+ + 4e- = 2H2O
碱性(OH-) 2H2 – 4e- + 4OH- = 4H2O O2 + 2H2O + 4e- = 4OH-
酸性溶液不出现OH-;
碱性溶液不出现H+。
课堂学习
燃料电池
介质 电池总反应:2H2 + O2 = 2H2O 负极 2H2 - 4e- + 2O2- = 2H2O
正极 O2 + 4e- = 2O2-
负极 2H2 - 4e- = 4H+
正极 O2 + 4H+ + 4e- = 2H2O
课堂学习
原电池电极反应式书写常见错误
1.不能正确判断原电池正负极
混淆正负极:负极上电极材料本身或电极反应物发生氧化反应,对应元素化合价升高,正极上电极反应物发生还原反应,对应元素化合价降低。
易混淆电子流向与电流方向而错判,电子流出的方向与电流方向相反,电子流出的电极是负极。
错误地认为排在金属活动性顺序前面的金属一定是负极,忽视反应本质。
2.电极反应式配平错误
不能根据化合价变化正确计算电子转移的数目。
不满足守恒定律:电极反应式和氧化还原方程式一样,要满足得失电子守恒、电荷守恒和质量守恒。
课堂学习
原电池电极反应式书写常见错误
将甲烷燃料电池设计为右图所示装置后发现OH-定向移向A电极,则两极电极反应式应如何书写?
3.电极产物书写错误
忽视变价金属被氧化的价态,如铁片与碳棒用导线连接插入硫酸铜溶液中,错误书写可能为负极:Fe - 3e- = Fe3+,实际上,铁在硫酸铜溶液中只能被铜离子氧化为Fe2+。
对于活泼金属电极,想当然地认为电极产物为金属离子,忽视金属离子与电解质溶液的某种成分可继续反应,最终的氧化产物要根据题中信息确定。
忽略介质信息,错判电极产物。
特别注意:酸性介质中不能出现OH-,碱性介质中不能出现H+。
A极为负极,通入甲烷:CH4 + 10OH- - 8e- = CO32- + 7H2O;
B极为正极,通入氧气:2O2 + 4H2O + 8e- = 8OH-。
课堂学习
汽车发展史
(1)喷气式汽车
1680年,英国著名科学家牛顿设想了喷气式汽车的方案,利用喷管喷射蒸汽来推动汽车,但未能制成实物。
(2)蒸汽动力汽车
1769年,法国人N·J·居纽制造了用煤气燃烧产生蒸汽驱动的三轮汽车。
1829年,英国的詹姆斯发明了时速25千米的蒸汽车,该车可以作为大轿车使用。
(3)汽油汽车
1885年是汽车发明取得决定性突破的一年。
德国工程师本茨和戴姆勒、英国的巴特勒分别发明了装有汽油发动机的汽车。
俄国的普奇洛夫和伏洛波夫两人发明了装有内燃机的汽车。
课堂学习
(4)电力汽车
第一辆实际制造出来的电动车是由美国人安德森在1832年到1839年之间发明的。
1898年,德国人波尔舍开发了名为“Lohner-Porsche”的电动车,该车采用铅酸蓄电池作为动力源。
(5)现代汽车
1885年德国工程师卡尔·本茨在曼海姆制造了第一辆装有汽油机的三轮车。这一辆装有内燃动力机的汽车才被认为是世界上真正的第一辆汽车,因为它是真正以汽油为动力源的第一辆汽车,而不是蒸汽机。
(6)新能源汽车
①混合动力汽车:内燃机可持续工作,电池又可以不断得到充电,故其行程和普通汽车一样;②纯电动汽车:以蓄电池提供电能以作为动力;③燃料电池汽车:以燃料电池提供电能作为动力。
汽车发展史
课堂学习
车用能源
(1)常规汽车燃料
汽油和柴油是目前汽车最常用的燃料。通过石油炼制获得的汽油和柴油能量密度高、价格低、不易变质、便于运输,因此非常适用于点燃式发动机和压燃式发动机。
(2)代用燃料
发动机代用燃料指使用代用燃料来替代汽油或柴油。目前国内开发使用的发动机代用燃料包括天然气、液化石油气、甲醇、乙醇、生物质燃料、氢气以及二甲醚等。
课堂学习
车用能源
(3)燃料电池
燃料电池电动汽车替代内燃机动力汽车将是发展趋势。燃料电池是一种直接将燃料的化学能转化为电能的装置。从理论上来讲,只要连续供给燃料,燃料电池便能连续发电,能量转化效率高,且能量高、无噪音、无污染,正在成为理想的能源利用方式。
(4)锂电池等新型电池
①车用锂电池是混合动力汽车及电动汽车的动力电池,具有能量密度高、容量大、无记忆性等优点。
②石墨烯电池是利用锂离子在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出的一种新能源电池。
课堂巩固
正误判断
1. 燃料电池利用燃料的燃烧发电。
4. 原电池中,电极材料不一定参与氧化还原反应。
2. 燃料电池可以将热能转化为电能。
3. 氢氧燃料电池负极反应为2H2 – 4e- = 4H+。
×
×
×
√
课堂巩固
某同学用铝片、铜片和西红柿组成水果电池,下列说法不正确的是 ( )
A.该水果电池中,水果的作用是提供电解质溶液
B.该电池放电时,电子由铝片经电解质溶液流向铜片
C.该水果电池中,铝片做负极发生氧化反应
D.可以通过调节电极材料、水果的种类来调节电池效果
B
课堂巩固
国家电投氢能公司全自主研发的“氢腾”燃料电池系统广泛应用于氢能大巴。某种氢燃料电池的内部结构如图,下列说法正确的是 ( )
A. 电池工作时,电解质溶液中的H+向b极移动
B. a极发生的电极反应为H2 + 2e- + 2OH- = 2H2O
C. b极为正极,发生氧化反应
D. 当外电路有1mol电子转移时,b极消耗5.6L O2
A
课堂小结
氢氧燃料电池 酸性溶液不出现OH-,碱性溶液不出现H+ 电解质溶液 负极 正极
酸性(H+) 2H2 – 4e- = 4H+ O2 + 4H+ + 4e- = 2H2O
碱性(OH-) 2H2 – 4e- + 4OH- = 4H2O O2 + 2H2O + 4e- = 4OH-
电极书写常见错误:
不能正确判断正负极;
电极反应式配平错误;
电极产物书写错误。
谢谢观看
THANKS
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
