化学人教版(2019)必修第二册6.2.1化学反应的速率与影响因素(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.2.1化学反应的速率与影响因素(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 44.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-22 10:49:41 | ||
图片预览








文档简介
(共26张PPT)
第六章 化学反应与能量
第二节 化学反应的速率与限度
第一课时
学习目标
1.通过生活常识、数据分析和实验现象的观察,初步形成化学反应速率的概念及其定量表示的一般方法、知道影响化学反应速率的常见因素。
2.通过影响化学反应速率实验方案的设计,学会“控制变量”的科学方法,增强证据推理的意识。
3.能从微观角度理解浓度和压强对速率的影响,发展宏观辨识与微观探析的化学学科核心素养。
新课导入
在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现所期待的物质转化或能量转化,还要关注化学反应进行的快慢和程度,以提高生产效率。
爆炸
牛奶变质
钢铁生锈
溶洞形成
哪个反应更快?
新课导入
不同的化学反应进行的快慢千差万别,快与慢是相对而言的,是一种定性的比较
定性描述:
①冒气泡快慢
②颜色变化快慢
③固体物质的减少快慢
④出现浑浊的快慢
⑤温度变化快慢
如何定量判断化学反应的快慢呢?
化学反应速率
化学反应速率是用来衡量化学反应过程进行的快慢的物理量。通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
Δc(B)表示某物质(B)浓度的变化量,常用单位:mol/L或mol·L-1;
Δt 表示发生浓度变化所用时间,常用单位:s,min,h等;
v(B)表示用物质B表示的化学反应速率,
常用单位:mol·L-1·s-1或mol/(L·s),mol·L-1·min-1或mol/(L·min)等。
数学表达式:
v(B) =
Δc(B)
Δt
化学反应速率
注意事项:
1.速率的单位也可表示为mol/(L·s)或mol/(L·min),但是必须要加括号,
2.化学反应速率是物质在一段时间内的平均速率,而不是在某一时刻的瞬时速率,且均取正值
3.在反应中,用浓度变化表示化学反应速率只适用于气体和溶液中的溶质,纯液体和纯固体的浓度是恒定不变的,因此对有纯液体或纯固体参加的化学反应,一般不用其浓度来表示化学反应速率
错误的写法:mol/L·s
4.同一化学反应中,选用不同物质表示化学反应速率,其数值可能相同也可能不相同,但表示的意义相同且化学反应速率之比=化学计量数之比。因此,表示化学反应速率时,必须指明用哪种物质作标准,在v的后面将该物质的化学式用括号括起来
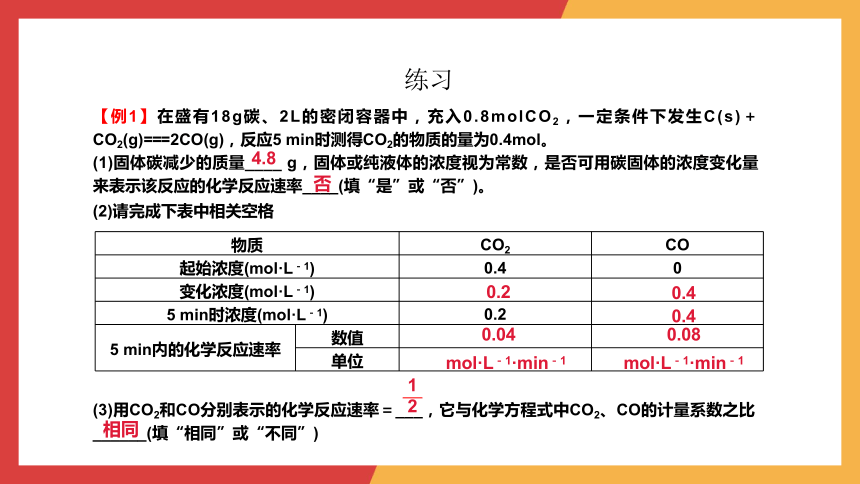
练习
物质 CO2 CO
起始浓度(mol·L-1) 0.4 0
变化浓度(mol·L-1)
5 min时浓度(mol·L-1) 0.2
5 min内的化学反应速率 数值
单位
【例1】在盛有18g碳、2L的密闭容器中,充入0.8molCO2,一定条件下发生C(s)+CO2(g)===2CO(g),反应5 min时测得CO2的物质的量为0.4mol。
(1)固体碳减少的质量____ g,固体或纯液体的浓度视为常数,是否可用碳固体的浓度变化量来表示该反应的化学反应速率____(填“是”或“否”)。
(2)请完成下表中相关空格
(3)用CO2和CO分别表示的化学反应速率=___,它与化学方程式中CO2、CO的计量系数之比______(填“相同”或“不同”)
4.8
否
0.2
0.4
0.4
0.04
0.08
mol·L-1·min-1
mol·L-1·min-1
相同
1
2
比较化学反应速率与化学计量数的比值,如aA(g)+bB(g) cC(g)+dD(g),
则说明用A表示的化学反应速率大于用B表示的化学反应速率
化学反应速率
化学反应速率大小的比较方法
归一法
比值法
若单位不统一,则要换算成相同的单位;若为不同物质表示的反应速率,则要换算成同一物质来表示反应速率;再比较数值的大小。
v(A)
a
v(B)
b
>
影响化学反应速率的因素
爆炸
牛奶变质
钢铁生锈
溶洞形成
如何减慢牛奶变质的速率?
对于有些化学反应,我们希望其越慢越好,如食物的变质、橡胶和塑料的老化、金属的锈蚀;有些则希望其快一些,如氨、硫酸等化工产品的生产。调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
影响化学反应速率的因素
在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/L 盐酸反应时,速率最快的是:A 镁 B 铝 C 钠 D 铁
1.内因:反应物本身的性质(决定因素)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
√
2.外因:
浓度?
温度?
压强?
催化剂?
物质的形状?
影响化学反应速率的因素
影响化学反应速率的因素
操作 现象 ①产生气泡速率最慢 ②产生气泡速率较快 ③产生气泡速率最快
结论 对于反应2H2O2 2H2O+O2↑来说,温度升高,H2O2的分解速率_____ 加快
(1)温度对化学反应速率影响的探究
当其它条件不变时,升高温度,化学反应速率增大。降低温度,化学反应速率减小。
影响化学反应速率的因素
影响化学反应速率的因素
实验操作
实验现象 加_________盐酸的试管中产生气泡的速率更快
实验结论 浓度______,化学反应速率越快
1 mol/L
越大
(3)浓度对化学反应速率影响的探究
其它条件不变时,增大反应物的浓度,化学反应速率增大。减小反应物的浓度,化学反应速率减慢。改变固体或纯液体的量不影响反应速率。
影响化学反应速率的因素
影响化学反应速率的因素
操作 现象 ①产生少量气泡 ②产生大量气泡 ③产生大量气泡
结论 MnO2、FeCl3可以_____H2O2分解的速率 (1)催化剂对化学反应速率影响的探究
加快
2H2O2 = 2H2O +O2↑
催化剂能改变化学反应的速率。正催化剂快化学反应速率;负催化剂减慢化学反应速率
影响化学反应速率的因素
压强对化学反应速率的影响
有气体参加的反应,改变压强对反应速率的影响实质是改变体系体积,使反应物的浓度改变。
增大压强(减小容器体积,增大反应物浓度),能加快化学反应速率。
减小压强(增大容器体积,减小反应物浓度),能减慢化学反应速率。
影响化学反应速率的因素
压强对化学反应速率的影响
活化分子
容器的容积不变
充入非反应气体
在其它条件不变时,充入非反应气体→压强增大,但各物质浓度不变→反应速率不变
总结归纳
条件 改变 对化学反应速率的影响
浓度 增大反应物的浓度
减小反应物的浓度
温度 升高温度
降低温度
催化剂 多数情况下,使用催化剂能够 化学反应速率 压强(对有气体参加的化学反应) 增大压强
减小压强
接触面积 块状固体变为粉末状
加快
加快
加快
加快
减慢
减慢
减慢
加快
随堂训练
D
随堂训练
C
B
随堂训练
B
B
随堂训练
C
D
随堂训练
C
随堂训练
B
随堂训练
对照实验,证明实验Ⅱ和Ⅲ中反应速率加快与过氧化氢溶液浓度变化无关
不同催化剂的催化效率(效果)不同
0.05
第六章 化学反应与能量
第二节 化学反应的速率与限度
第一课时
学习目标
1.通过生活常识、数据分析和实验现象的观察,初步形成化学反应速率的概念及其定量表示的一般方法、知道影响化学反应速率的常见因素。
2.通过影响化学反应速率实验方案的设计,学会“控制变量”的科学方法,增强证据推理的意识。
3.能从微观角度理解浓度和压强对速率的影响,发展宏观辨识与微观探析的化学学科核心素养。
新课导入
在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现所期待的物质转化或能量转化,还要关注化学反应进行的快慢和程度,以提高生产效率。
爆炸
牛奶变质
钢铁生锈
溶洞形成
哪个反应更快?
新课导入
不同的化学反应进行的快慢千差万别,快与慢是相对而言的,是一种定性的比较
定性描述:
①冒气泡快慢
②颜色变化快慢
③固体物质的减少快慢
④出现浑浊的快慢
⑤温度变化快慢
如何定量判断化学反应的快慢呢?
化学反应速率
化学反应速率是用来衡量化学反应过程进行的快慢的物理量。通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
Δc(B)表示某物质(B)浓度的变化量,常用单位:mol/L或mol·L-1;
Δt 表示发生浓度变化所用时间,常用单位:s,min,h等;
v(B)表示用物质B表示的化学反应速率,
常用单位:mol·L-1·s-1或mol/(L·s),mol·L-1·min-1或mol/(L·min)等。
数学表达式:
v(B) =
Δc(B)
Δt
化学反应速率
注意事项:
1.速率的单位也可表示为mol/(L·s)或mol/(L·min),但是必须要加括号,
2.化学反应速率是物质在一段时间内的平均速率,而不是在某一时刻的瞬时速率,且均取正值
3.在反应中,用浓度变化表示化学反应速率只适用于气体和溶液中的溶质,纯液体和纯固体的浓度是恒定不变的,因此对有纯液体或纯固体参加的化学反应,一般不用其浓度来表示化学反应速率
错误的写法:mol/L·s
4.同一化学反应中,选用不同物质表示化学反应速率,其数值可能相同也可能不相同,但表示的意义相同且化学反应速率之比=化学计量数之比。因此,表示化学反应速率时,必须指明用哪种物质作标准,在v的后面将该物质的化学式用括号括起来
练习
物质 CO2 CO
起始浓度(mol·L-1) 0.4 0
变化浓度(mol·L-1)
5 min时浓度(mol·L-1) 0.2
5 min内的化学反应速率 数值
单位
【例1】在盛有18g碳、2L的密闭容器中,充入0.8molCO2,一定条件下发生C(s)+CO2(g)===2CO(g),反应5 min时测得CO2的物质的量为0.4mol。
(1)固体碳减少的质量____ g,固体或纯液体的浓度视为常数,是否可用碳固体的浓度变化量来表示该反应的化学反应速率____(填“是”或“否”)。
(2)请完成下表中相关空格
(3)用CO2和CO分别表示的化学反应速率=___,它与化学方程式中CO2、CO的计量系数之比______(填“相同”或“不同”)
4.8
否
0.2
0.4
0.4
0.04
0.08
mol·L-1·min-1
mol·L-1·min-1
相同
1
2
比较化学反应速率与化学计量数的比值,如aA(g)+bB(g) cC(g)+dD(g),
则说明用A表示的化学反应速率大于用B表示的化学反应速率
化学反应速率
化学反应速率大小的比较方法
归一法
比值法
若单位不统一,则要换算成相同的单位;若为不同物质表示的反应速率,则要换算成同一物质来表示反应速率;再比较数值的大小。
v(A)
a
v(B)
b
>
影响化学反应速率的因素
爆炸
牛奶变质
钢铁生锈
溶洞形成
如何减慢牛奶变质的速率?
对于有些化学反应,我们希望其越慢越好,如食物的变质、橡胶和塑料的老化、金属的锈蚀;有些则希望其快一些,如氨、硫酸等化工产品的生产。调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
影响化学反应速率的因素
在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/L 盐酸反应时,速率最快的是:A 镁 B 铝 C 钠 D 铁
1.内因:反应物本身的性质(决定因素)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
√
2.外因:
浓度?
温度?
压强?
催化剂?
物质的形状?
影响化学反应速率的因素
影响化学反应速率的因素
操作 现象 ①产生气泡速率最慢 ②产生气泡速率较快 ③产生气泡速率最快
结论 对于反应2H2O2 2H2O+O2↑来说,温度升高,H2O2的分解速率_____ 加快
(1)温度对化学反应速率影响的探究
当其它条件不变时,升高温度,化学反应速率增大。降低温度,化学反应速率减小。
影响化学反应速率的因素
影响化学反应速率的因素
实验操作
实验现象 加_________盐酸的试管中产生气泡的速率更快
实验结论 浓度______,化学反应速率越快
1 mol/L
越大
(3)浓度对化学反应速率影响的探究
其它条件不变时,增大反应物的浓度,化学反应速率增大。减小反应物的浓度,化学反应速率减慢。改变固体或纯液体的量不影响反应速率。
影响化学反应速率的因素
影响化学反应速率的因素
操作 现象 ①产生少量气泡 ②产生大量气泡 ③产生大量气泡
结论 MnO2、FeCl3可以_____H2O2分解的速率 (1)催化剂对化学反应速率影响的探究
加快
2H2O2 = 2H2O +O2↑
催化剂能改变化学反应的速率。正催化剂快化学反应速率;负催化剂减慢化学反应速率
影响化学反应速率的因素
压强对化学反应速率的影响
有气体参加的反应,改变压强对反应速率的影响实质是改变体系体积,使反应物的浓度改变。
增大压强(减小容器体积,增大反应物浓度),能加快化学反应速率。
减小压强(增大容器体积,减小反应物浓度),能减慢化学反应速率。
影响化学反应速率的因素
压强对化学反应速率的影响
活化分子
容器的容积不变
充入非反应气体
在其它条件不变时,充入非反应气体→压强增大,但各物质浓度不变→反应速率不变
总结归纳
条件 改变 对化学反应速率的影响
浓度 增大反应物的浓度
减小反应物的浓度
温度 升高温度
降低温度
催化剂 多数情况下,使用催化剂能够 化学反应速率 压强(对有气体参加的化学反应) 增大压强
减小压强
接触面积 块状固体变为粉末状
加快
加快
加快
加快
减慢
减慢
减慢
加快
随堂训练
D
随堂训练
C
B
随堂训练
B
B
随堂训练
C
D
随堂训练
C
随堂训练
B
随堂训练
对照实验,证明实验Ⅱ和Ⅲ中反应速率加快与过氧化氢溶液浓度变化无关
不同催化剂的催化效率(效果)不同
0.05
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
