河南省开封市五校2023-2024学年高二上学期期末联考化学试题(含答案)
文档属性
| 名称 | 河南省开封市五校2023-2024学年高二上学期期末联考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-22 15:25:32 | ||
图片预览



文档简介
开封五校2023~2024学年上学期期末联考
高二化学
考生注意:
1.本试卷分选择题和非选择题两部分.满分100分,考试时间75分钟.
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚.
3.考生作答时,请将答案答在答题卡上.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效.
4.本卷命题范围:人教版选择性必修1、2.
5.可能用到的相对原子质量:H 1 C 12 O 16 Na 23
一、选择题(本大题共15小题,每小题3分,共计45分.在每小题列出的四个选项中,只有一项是符合题目要求的)
1.我国研发一款拥有自主知识产权的超薄铷原子钟,每3000万年误差仅1秒.Rb是第五周期第ⅠA族元素,下列有关说法中正确的是( )
A.第一电离能: B.铷原子核外电子运动状态有37种
C.单质沸点: D.最高能级电子排布式为
2.盐类水解在生产和生活中有着较广泛的应用,下列有关说法正确的是( )
A.加入浓溶液可以使紫色石蕊试液变红
B.明矾净水的反应:
C.由于硫酸铜溶液呈酸性所以能使蛋白质变性
D.“84”的漂白原理是水解生成具有漂白性的
3.下列变化需克服相同类型作用力的是( )
A.碘和干冰的升华 B.硅和的熔化
C.氯化氢和氯化钠的溶解 D.溴和汞的汽化
4.下列有关超分子的说法错误的是( )
A.超分子具有“分子识别”和“自组装”的特性
B.分子以共价键聚合形成超分子
C.超分子是由两种或多种分子形成的聚集体
D.分子形成超分子的作用可能是分子间作用力
5.下列对一些实验事实的解释错误的是( )
选项 实验事实 解释
A 水加热到较高温度难以分解 水分子中共价键键能较大
B 石墨棒作为原电池的电极材料 石墨品体能导电
C 的沸点高于 H-N键的键长比H-P键的键长短
D 用X射线实验区分玻璃和水晶 水晶的衍射图上有明锐的衍射峰
6.某配合物W的化学式为,下列说法正确的是( )
A.中心离子提供空轨道 B.的W溶液中
C.基态钛原子的价层电子数为2 D.配体中氢原子提供孤电子对
7.丙烯酸是非常重要的化工原料之一,由甘油催化转化生成丙烯酸的过程为:甘油丙烯醛丙烯酸.
已知:反应Ⅰ:(活化能)
反应Ⅱ:(活化能)
甘油在常压下沸点为290℃,工业生产选择反应温度为300℃常压下进行.下列说法错误的是( )
A.当的体积分数保持不变,说明反应达到平衡状态
B.丙烯醛有毒,为了工业生产安全可选择能大幅降低且对几乎无影响的催化剂
C.固体催化剂一定时,增大其表面积可提高化学反应速率,增大甘油的平衡转化率
D.若改变条件增大反应Ⅱ的平衡常数,反应Ⅱ一定向正反应方向移动
8.X、Y、Z、W、R五种元素,原子序数依次增大,元素X有一种同位素无中子,Y的简单气态氢化物溶于水呈碱性,Z的2p轨道有两个未成对电子,W的简单离子是同周期离子半径最小的,R为第四周期基态原子未成对电子数最多的元素,下列说法错误的是( )
A.性质较稳定是由于含有氢键的缘故
B.X、Y、Z组成的化合物可能是离子化合物
C.工业上常用电解熔融的来制备单质W
D.R位于周期表的d区
9.极易发生水解,水解机理如图所示,下列说法正确的是( )
A.分子的空间结构是平面三角形 B.中3个原子被取代的机会不均等
C.水解产物是一种三元酸 D.可与某些金属离子形成配位化合物
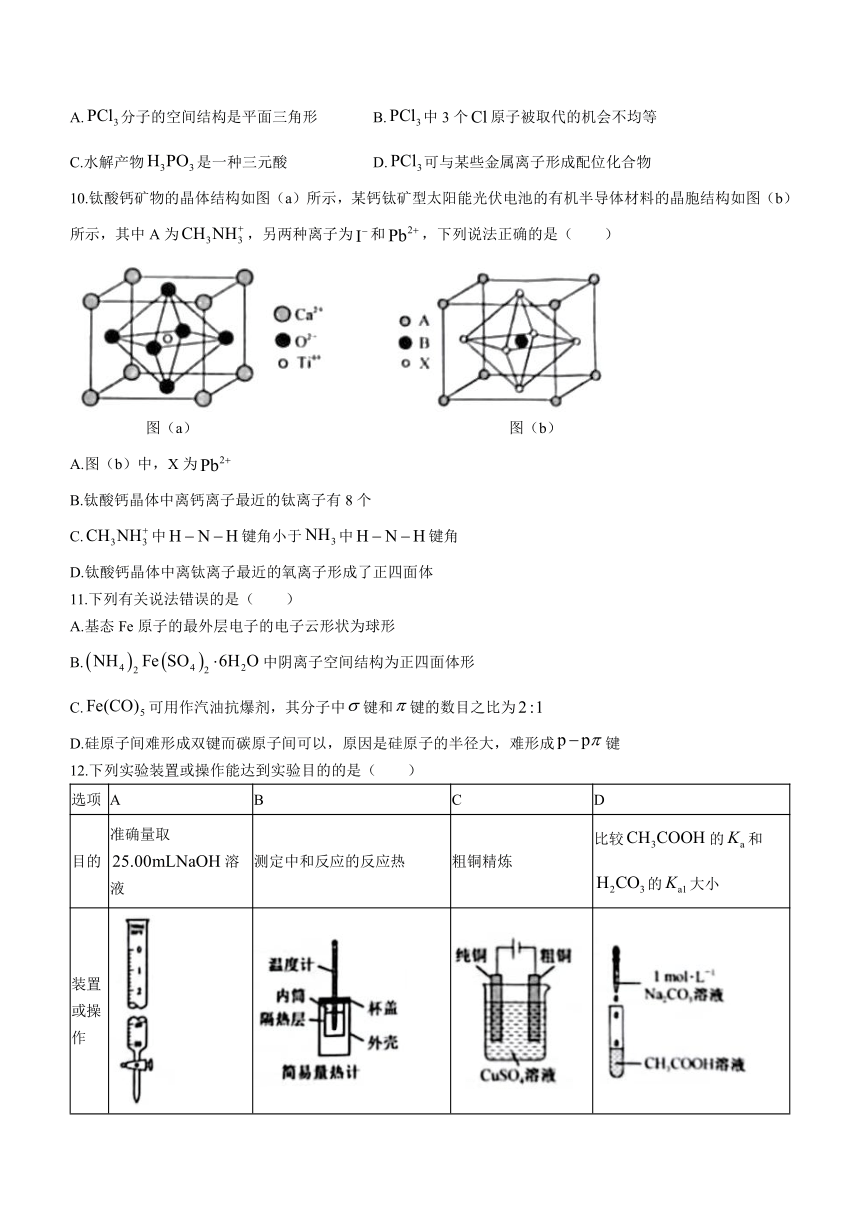
10.钛酸钙矿物的晶体结构如图(a)所示,某钙钛矿型太阳能光伏电池的有机半导体材料的晶胞结构如图(b)所示,其中A为,另两种离子为和,下列说法正确的是( )
图(a) 图(b)
A.图(b)中,X为
B.钛酸钙晶体中离钙离子最近的钛离子有8个
C.中键角小于中键角
D.钛酸钙晶体中离钛离子最近的氧离子形成了正四面体
11.下列有关说法错误的是( )
A.基态Fe原子的最外层电子的电子云形状为球形
B.中阴离子空间结构为正四面体形
C.可用作汽油抗爆剂,其分子中键和键的数目之比为
D.硅原子间难形成双键而碳原子间可以,原因是硅原子的半径大,难形成键
12.下列实验装置或操作能达到实验目的的是( )
选项 A B C D
目的 准确量取溶液 测定中和反应的反应热 粗铜精炼 比较的和的大小
装置或操作
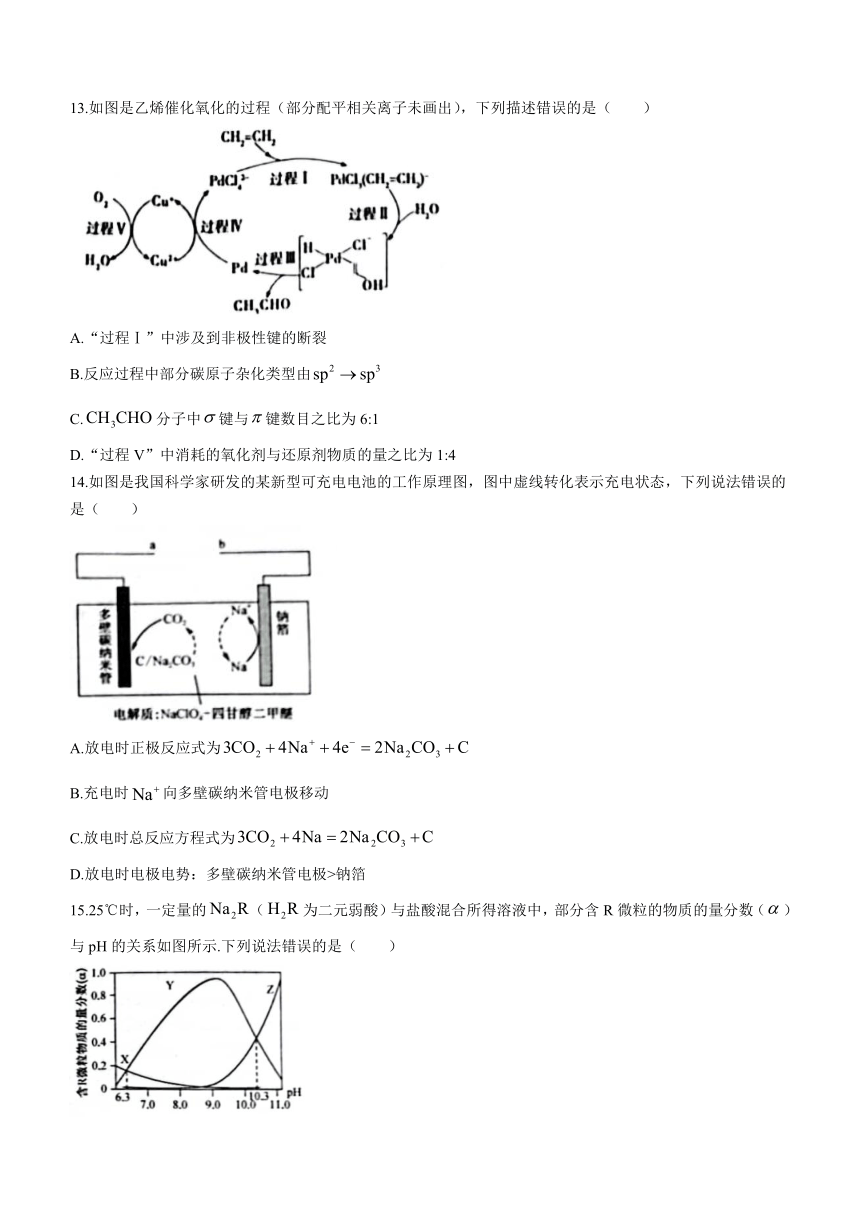
13.如图是乙烯催化氧化的过程(部分配平相关离子未画出),下列描述错误的是( )
A.“过程Ⅰ”中涉及到非极性键的断裂
B.反应过程中部分碳原子杂化类型由
C.分子中键与键数目之比为6:1
D.“过程V”中消耗的氧化剂与还原剂物质的量之比为1:4
14.如图是我国科学家研发的某新型可充电电池的工作原理图,图中虚线转化表示充电状态,下列说法错误的是( )
A.放电时正极反应式为
B.充电时向多壁碳纳米管电极移动
C.放电时总反应方程式为
D.放电时电极电势:多壁碳纳米管电极>钠箔
15.25℃时,一定量的(为二元弱酸)与盐酸混合所得溶液中,部分含R微粒的物质的量分数()与pH的关系如图所示.下列说法错误的是( )
A.曲线Z表示微粒
B.
C.时,
D.时,
二、非选择题(本题共4小题,共55分)
16.(14分)、的合理利用或处理是化学家们研究的重要课题.回答下列问题:
(1)科学家找到了使转化为的途径:.又知有关化学键键能如下表所示:
化学键
键能 728 436 464
则_________.又知,则,____________.
(2)工业上可用反应处理含氮废气,在某容积为2L的密闭容器内充入和,在一定条件下发生上述反应,5min时测得的质量为18g.
①该段时间内用表示的平均反应速率为___________;若5min时反应达到平衡,此时容器内气体密度与反应开始时气体密度之比为______________.
②下列事实能说明该反应已达平衡状态的是__________(填字母).
A.消耗12gC同时消耗 B.容器内压强不再变化
C.容器内气体密度不再变化 D.键生成速率与键断裂速率相等
(3)向某密闭容器中通入、,控制适当条件使其发生反应,测得不同温度、压强下的平衡转化率如图所示.
①X表示___________(填“温度”或“压强”),__________(填“>”或“<”).
②与A点对应的反应中,容器容积为2L,则A点温度下,该反应的平衡常数__________.
17.(14分)A、B、C、D、E是原子序数依次增大的前四周期元素.已知A元素基态原子的核外电子分占四个原子轨道;B元素与C元素同周期,B元素基态原子的成对电子数是未成对电子数的6倍;C元素基态原子只有一个未成对电子;D元素基态原子的L层与M层的电子数相等,且与s能级的电子总数相同;基态的3d轨道中有5个电子.
回答下列问题:
(1)基态C原子电子占据最高能级的电子云轮廓图为____________;基态E原子核外未成对电子数为____________.
(2)一般情况下,B元素的最高价氧化物的晶体类型为_________;A、B元素最高价氧化物以及C元素与氧形成的化合物,三种物质中心原子杂化类型相同的是___________(用化学式填空).
(3)A、B、C、D四种元素的电负性按由大到小排序为_____________(用元素符号填空).
(4)配离子中,中心离子的配位数为_____________;在结构示意图的相应位置补填缺少的配体.
18.(14分)过渡金属铬、铅、镍、铁及其化合物在工业上有重要用途,回答下列问题:
(1)基态Cr原子的价层电子的轨道表示式为__________.
(2)氮化铬在超级电容器领域具有良好的应用前景,可由与尿素反应先得到配合物,然后在通有和混合气体的反应炉内热分解制得.
①尿素中C、N、O三种元素的第一电离能由大到小的顺序为_____________.
②中存在的化学键有____________(填字母).
A.极性共价键 B.非极性共价键 C.氢键 D.配位键
(3)四卤化硅的沸点和二卤化铅的熔点如图所示.
①的沸点依F、Cl、Br、I次序升高的原因是_______________________.
②结合的沸点和的熔点的变化规律,可推断:依F、Cl、Br、I次序,中的化学键中离子键成分的百分数____________(填“增大”“减小”或“不变”).
(4)丁二酮肟常与形成图A所示的配合物,图B是图A中硫代氧后的结构简式:
A的熔、沸点高于B的原因是_____________________________.
(5)某的晶胞如图1所示.Cu可以完全替代该晶胞中a位置Fe或者b位置Fe,形成Cu替代型产物.转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为_____________.
图1 晶胞结构示意图 图2 转化过程的能量变化
19.(13分)磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
(1)已知与足量的溶液反应得到,试推测的结构式为____________,和属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等.焦磷酸根离子、三磷酸根离子如图所示.这类磷酸根离子的化学式可用通式表示为____________(用代表P原子数).
(2)中存在离子,离子的空间结构为___________,中心原子的杂化类型为____________.
(3)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电.已知砷化镓的熔点为1238℃,GaAs的品胞结构如图所示.该晶体的类型为_____________,则1号镓原子的分数坐标为____________,晶胞密度为,GaAs的摩尔质量为,阿伏加德罗常数的值用表示,则晶胞中最近的As和Ga原子核间距为___________nm(列式表示).
开封五校2023~2024学年上学期期末联考·高二化学
参考答案、提示及评分细则
1.B Rb、K同族,钾的第一电离能较大,A项错误;每个电子的运动状态均不相同,B项正确;金属键键能:,沸点Na的较高,C项错误;Rb是第ⅠA族元素,最高能级电子排布式为,D项错误.
2.D 溶液中水解,溶液呈碱性,紫色石蕊试液变蓝,A项错误;明矾净水的原理就是水解生成了氢氧化铝胶体具有吸附性,B项错误;为重金属离子,能使蛋白质变性,C项错误;,具有漂白性,D项正确.
3.A 碘和干冰均属于分子晶体,克服范德华力,A项正确;硅属于共价晶体,破坏的是共价键,属于分子晶体,克服范德华力,B项错误;溶解破坏的是共价键,溶解破坏的是离子键,C项错误;溴、汞的汽化分别克服范德华力、破坏金属键,D项错误.
4.B “分子识别”和“自组装”是超分子形成的两个重要特征,A项正确;超分子内部分子之间通过非共价键相结合,可以通过氢键、静电作用、堆积作用等结合在一起,B项错误;超分子是由两种或多种分子相互“组合”在一起形成具有特定结构和功能的聚集体,C项正确;超分子内部分子之间可以通过氢键、静电作用等作用力结合在一起,D项正确.
5.C 水加热到较高温度难以分解,说明水中存在的化学键较强,键能较大,A项正确;石墨晶体能导电,可作电极材料,B项正确;非金属氢化物的熔沸点与分子间作用力和氢键有关,与键长无关,分子间能形成氢键,分子间不能形成氢键,故的沸点高于,C项错误;晶体的X射线衍射图中有明锐的衍射峰,D项正确.
6.B 由化合价规则知中心离子为,A项错误;W的电离方程式为,B项正确;钛是第ⅣB族元素,价层电子数为4,C项错误;氢原子没有孤电子对但氧原子有,配体水是氧原子提供孤电子对,D项错误.
7.C 恒温恒压下,的体积分数保持不变,则的浓度不再变化,说明反应达到平衡状态,A项正确;活化能越小反应速率越快,丙烯醛有毒,为了安全,应减慢反应Ⅰ的反应速率、加快反应Ⅱ的反应速率,则选择能大幅降低且对几乎无影响的催化剂,B项正确;催化剂不能使平衡移动,甘油的平衡转化率不变,C项错误;反应Ⅱ是吸热反应,若反应Ⅱ的平衡常数增大,则为升高温度,平衡正向移动,反应Ⅱ一定向正反应方向移动,D项正确.
8.A 有一种同位素无中子可推断X为氢元素,气态氢化物溶于水呈碱性可推断Y为氮元素,2p轨道有两个未成对电子,价层电子排布式为或,由原子序数:Z>Y可推断Z为氧元素,W的简单离子是所在周期离子半径最小的,可推断为第三周期的铝元素,第四周期元素中,外围电子排布为,且能级处于半满稳定状态时,含有的未成对电子数最多,即外围电子排布为,R元素为24号铬.性质较稳定是由于分子内共价键较牢固而非氢键的缘故,A项错误;H、N、O形成的是离子化合物,B项正确;为氧化铝,工业上常用电解熔融氧化铝来制备Al,C项正确;24号元素Cr位于第四周期第ⅥB族,属于d区,D项正确.
9.D 分子中存在3个键,且P孤电子对数为1,则价层电子对数为,为杂化,由于存在1对孤对电子,故分子结构为三角锥形,A项错误;中3个原子所处环境相同,完全等效,被取代机会均等,B项错误;观察结构可知,分子中存在2个,中的氢可以电离,另一个氢直接与磷相连不能电离,故为二元酸,C项错误;分子中P原子有孤电子对,当金属离子提供空轨道时可以形成相应配合物,D项正确.
10.B 根据均摊法,由图(b)可知,晶胞中有1个A离子,1个B离子,3个X离子,根据正负化合价代数和为0可知,X为,A项错误;图(a)可知在钛酸钙晶体中离钙离子最近的钛离子有8个,B项正确;中的N原子没有孤电子对,键角较大,氨气中氮原子有1对孤电子对,其对成键电子对的排斥力较大,键角较小,C项错误;由图(a)可知钛酸钙晶体中离钛离子最近的氧离子形成了正八面体,D项错误.
11.C 基态Fe原子的最外层电子在s轨道,其电子云形状为球形,A项正确;中,阴离子为,根据价层电子对互斥理论,的空间结构为正四面体形,B项正确;中键和键的数目分别为10个,之比为,C项错误;硅原子的半径比碳原子的大,不易形成键,D项正确.
12.D 溶液与二氧化硅反应生成具有黏合性的硅酸钠,图中为酸式滴定管,应选碱式滴定管量取溶液,A项错误;图中缺少环形玻璃搅拌器,B项错误;粗铜应与电源正极相连作阳极,C项错误;由强酸制取弱酸的原理,可知醋酸的酸性大于碳酸的酸性,则可比较的和的大小,D项正确.
13.A 由图知,在反应过程Ⅰ中碳碳双键保持不变,A项错误;乙烯中碳原子为杂化,乙醛中碳原子为、杂化,B项正确;分子中有4个“”键、1个“”键,1个碳氧键,1个碳氧键,C项正确;过程Ⅴ反应为,其中氧化剂是、还原剂是,其物质的量之比为,D项正确.
14.B 由图中信息知,放电时正极上转化为、C,A项正确;充电时钠箔电极接电源负极作阴极,移向带负电的钠箔,B项错误;由图知C项正确;放电时是原电池,正极电势高于负极,D项正确.
15.C X为,Y为,Z为,A项正确;由图像可知,,B项正确;时,,由,则,又因为,故,C项错误;时,主要为和,两者物质的量分数均小于0.2,则,D项正确.
16.(1)414;-557(各2分)
(2)①;(或其他合理写法)(各2分)
②AC(全对2分,只选一个且正确得1分)
(3)①压强;(各1分)②0.5(2分)
17.(1)哑铃形或纺锤形;4
(2)共价晶体;、
(3)
(4)6;或(每空2分)
18.(1)
(2)① ②AD
(3)①均为分子晶体,范德华力随相对分子质量增大而增大
②减小
(4)A分子间存在氢键
(5)(每空2分)
19.(1);(各2分)
(2)形;(各2分)
(3)共价晶体(1分);(2分);(2分)
高二化学
考生注意:
1.本试卷分选择题和非选择题两部分.满分100分,考试时间75分钟.
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚.
3.考生作答时,请将答案答在答题卡上.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效.
4.本卷命题范围:人教版选择性必修1、2.
5.可能用到的相对原子质量:H 1 C 12 O 16 Na 23
一、选择题(本大题共15小题,每小题3分,共计45分.在每小题列出的四个选项中,只有一项是符合题目要求的)
1.我国研发一款拥有自主知识产权的超薄铷原子钟,每3000万年误差仅1秒.Rb是第五周期第ⅠA族元素,下列有关说法中正确的是( )
A.第一电离能: B.铷原子核外电子运动状态有37种
C.单质沸点: D.最高能级电子排布式为
2.盐类水解在生产和生活中有着较广泛的应用,下列有关说法正确的是( )
A.加入浓溶液可以使紫色石蕊试液变红
B.明矾净水的反应:
C.由于硫酸铜溶液呈酸性所以能使蛋白质变性
D.“84”的漂白原理是水解生成具有漂白性的
3.下列变化需克服相同类型作用力的是( )
A.碘和干冰的升华 B.硅和的熔化
C.氯化氢和氯化钠的溶解 D.溴和汞的汽化
4.下列有关超分子的说法错误的是( )
A.超分子具有“分子识别”和“自组装”的特性
B.分子以共价键聚合形成超分子
C.超分子是由两种或多种分子形成的聚集体
D.分子形成超分子的作用可能是分子间作用力
5.下列对一些实验事实的解释错误的是( )
选项 实验事实 解释
A 水加热到较高温度难以分解 水分子中共价键键能较大
B 石墨棒作为原电池的电极材料 石墨品体能导电
C 的沸点高于 H-N键的键长比H-P键的键长短
D 用X射线实验区分玻璃和水晶 水晶的衍射图上有明锐的衍射峰
6.某配合物W的化学式为,下列说法正确的是( )
A.中心离子提供空轨道 B.的W溶液中
C.基态钛原子的价层电子数为2 D.配体中氢原子提供孤电子对
7.丙烯酸是非常重要的化工原料之一,由甘油催化转化生成丙烯酸的过程为:甘油丙烯醛丙烯酸.
已知:反应Ⅰ:(活化能)
反应Ⅱ:(活化能)
甘油在常压下沸点为290℃,工业生产选择反应温度为300℃常压下进行.下列说法错误的是( )
A.当的体积分数保持不变,说明反应达到平衡状态
B.丙烯醛有毒,为了工业生产安全可选择能大幅降低且对几乎无影响的催化剂
C.固体催化剂一定时,增大其表面积可提高化学反应速率,增大甘油的平衡转化率
D.若改变条件增大反应Ⅱ的平衡常数,反应Ⅱ一定向正反应方向移动
8.X、Y、Z、W、R五种元素,原子序数依次增大,元素X有一种同位素无中子,Y的简单气态氢化物溶于水呈碱性,Z的2p轨道有两个未成对电子,W的简单离子是同周期离子半径最小的,R为第四周期基态原子未成对电子数最多的元素,下列说法错误的是( )
A.性质较稳定是由于含有氢键的缘故
B.X、Y、Z组成的化合物可能是离子化合物
C.工业上常用电解熔融的来制备单质W
D.R位于周期表的d区
9.极易发生水解,水解机理如图所示,下列说法正确的是( )
A.分子的空间结构是平面三角形 B.中3个原子被取代的机会不均等
C.水解产物是一种三元酸 D.可与某些金属离子形成配位化合物
10.钛酸钙矿物的晶体结构如图(a)所示,某钙钛矿型太阳能光伏电池的有机半导体材料的晶胞结构如图(b)所示,其中A为,另两种离子为和,下列说法正确的是( )
图(a) 图(b)
A.图(b)中,X为
B.钛酸钙晶体中离钙离子最近的钛离子有8个
C.中键角小于中键角
D.钛酸钙晶体中离钛离子最近的氧离子形成了正四面体
11.下列有关说法错误的是( )
A.基态Fe原子的最外层电子的电子云形状为球形
B.中阴离子空间结构为正四面体形
C.可用作汽油抗爆剂,其分子中键和键的数目之比为
D.硅原子间难形成双键而碳原子间可以,原因是硅原子的半径大,难形成键
12.下列实验装置或操作能达到实验目的的是( )
选项 A B C D
目的 准确量取溶液 测定中和反应的反应热 粗铜精炼 比较的和的大小
装置或操作
13.如图是乙烯催化氧化的过程(部分配平相关离子未画出),下列描述错误的是( )
A.“过程Ⅰ”中涉及到非极性键的断裂
B.反应过程中部分碳原子杂化类型由
C.分子中键与键数目之比为6:1
D.“过程V”中消耗的氧化剂与还原剂物质的量之比为1:4
14.如图是我国科学家研发的某新型可充电电池的工作原理图,图中虚线转化表示充电状态,下列说法错误的是( )
A.放电时正极反应式为
B.充电时向多壁碳纳米管电极移动
C.放电时总反应方程式为
D.放电时电极电势:多壁碳纳米管电极>钠箔
15.25℃时,一定量的(为二元弱酸)与盐酸混合所得溶液中,部分含R微粒的物质的量分数()与pH的关系如图所示.下列说法错误的是( )
A.曲线Z表示微粒
B.
C.时,
D.时,
二、非选择题(本题共4小题,共55分)
16.(14分)、的合理利用或处理是化学家们研究的重要课题.回答下列问题:
(1)科学家找到了使转化为的途径:.又知有关化学键键能如下表所示:
化学键
键能 728 436 464
则_________.又知,则,____________.
(2)工业上可用反应处理含氮废气,在某容积为2L的密闭容器内充入和,在一定条件下发生上述反应,5min时测得的质量为18g.
①该段时间内用表示的平均反应速率为___________;若5min时反应达到平衡,此时容器内气体密度与反应开始时气体密度之比为______________.
②下列事实能说明该反应已达平衡状态的是__________(填字母).
A.消耗12gC同时消耗 B.容器内压强不再变化
C.容器内气体密度不再变化 D.键生成速率与键断裂速率相等
(3)向某密闭容器中通入、,控制适当条件使其发生反应,测得不同温度、压强下的平衡转化率如图所示.
①X表示___________(填“温度”或“压强”),__________(填“>”或“<”).
②与A点对应的反应中,容器容积为2L,则A点温度下,该反应的平衡常数__________.
17.(14分)A、B、C、D、E是原子序数依次增大的前四周期元素.已知A元素基态原子的核外电子分占四个原子轨道;B元素与C元素同周期,B元素基态原子的成对电子数是未成对电子数的6倍;C元素基态原子只有一个未成对电子;D元素基态原子的L层与M层的电子数相等,且与s能级的电子总数相同;基态的3d轨道中有5个电子.
回答下列问题:
(1)基态C原子电子占据最高能级的电子云轮廓图为____________;基态E原子核外未成对电子数为____________.
(2)一般情况下,B元素的最高价氧化物的晶体类型为_________;A、B元素最高价氧化物以及C元素与氧形成的化合物,三种物质中心原子杂化类型相同的是___________(用化学式填空).
(3)A、B、C、D四种元素的电负性按由大到小排序为_____________(用元素符号填空).
(4)配离子中,中心离子的配位数为_____________;在结构示意图的相应位置补填缺少的配体.
18.(14分)过渡金属铬、铅、镍、铁及其化合物在工业上有重要用途,回答下列问题:
(1)基态Cr原子的价层电子的轨道表示式为__________.
(2)氮化铬在超级电容器领域具有良好的应用前景,可由与尿素反应先得到配合物,然后在通有和混合气体的反应炉内热分解制得.
①尿素中C、N、O三种元素的第一电离能由大到小的顺序为_____________.
②中存在的化学键有____________(填字母).
A.极性共价键 B.非极性共价键 C.氢键 D.配位键
(3)四卤化硅的沸点和二卤化铅的熔点如图所示.
①的沸点依F、Cl、Br、I次序升高的原因是_______________________.
②结合的沸点和的熔点的变化规律,可推断:依F、Cl、Br、I次序,中的化学键中离子键成分的百分数____________(填“增大”“减小”或“不变”).
(4)丁二酮肟常与形成图A所示的配合物,图B是图A中硫代氧后的结构简式:
A的熔、沸点高于B的原因是_____________________________.
(5)某的晶胞如图1所示.Cu可以完全替代该晶胞中a位置Fe或者b位置Fe,形成Cu替代型产物.转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为_____________.
图1 晶胞结构示意图 图2 转化过程的能量变化
19.(13分)磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
(1)已知与足量的溶液反应得到,试推测的结构式为____________,和属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等.焦磷酸根离子、三磷酸根离子如图所示.这类磷酸根离子的化学式可用通式表示为____________(用代表P原子数).
(2)中存在离子,离子的空间结构为___________,中心原子的杂化类型为____________.
(3)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电.已知砷化镓的熔点为1238℃,GaAs的品胞结构如图所示.该晶体的类型为_____________,则1号镓原子的分数坐标为____________,晶胞密度为,GaAs的摩尔质量为,阿伏加德罗常数的值用表示,则晶胞中最近的As和Ga原子核间距为___________nm(列式表示).
开封五校2023~2024学年上学期期末联考·高二化学
参考答案、提示及评分细则
1.B Rb、K同族,钾的第一电离能较大,A项错误;每个电子的运动状态均不相同,B项正确;金属键键能:,沸点Na的较高,C项错误;Rb是第ⅠA族元素,最高能级电子排布式为,D项错误.
2.D 溶液中水解,溶液呈碱性,紫色石蕊试液变蓝,A项错误;明矾净水的原理就是水解生成了氢氧化铝胶体具有吸附性,B项错误;为重金属离子,能使蛋白质变性,C项错误;,具有漂白性,D项正确.
3.A 碘和干冰均属于分子晶体,克服范德华力,A项正确;硅属于共价晶体,破坏的是共价键,属于分子晶体,克服范德华力,B项错误;溶解破坏的是共价键,溶解破坏的是离子键,C项错误;溴、汞的汽化分别克服范德华力、破坏金属键,D项错误.
4.B “分子识别”和“自组装”是超分子形成的两个重要特征,A项正确;超分子内部分子之间通过非共价键相结合,可以通过氢键、静电作用、堆积作用等结合在一起,B项错误;超分子是由两种或多种分子相互“组合”在一起形成具有特定结构和功能的聚集体,C项正确;超分子内部分子之间可以通过氢键、静电作用等作用力结合在一起,D项正确.
5.C 水加热到较高温度难以分解,说明水中存在的化学键较强,键能较大,A项正确;石墨晶体能导电,可作电极材料,B项正确;非金属氢化物的熔沸点与分子间作用力和氢键有关,与键长无关,分子间能形成氢键,分子间不能形成氢键,故的沸点高于,C项错误;晶体的X射线衍射图中有明锐的衍射峰,D项正确.
6.B 由化合价规则知中心离子为,A项错误;W的电离方程式为,B项正确;钛是第ⅣB族元素,价层电子数为4,C项错误;氢原子没有孤电子对但氧原子有,配体水是氧原子提供孤电子对,D项错误.
7.C 恒温恒压下,的体积分数保持不变,则的浓度不再变化,说明反应达到平衡状态,A项正确;活化能越小反应速率越快,丙烯醛有毒,为了安全,应减慢反应Ⅰ的反应速率、加快反应Ⅱ的反应速率,则选择能大幅降低且对几乎无影响的催化剂,B项正确;催化剂不能使平衡移动,甘油的平衡转化率不变,C项错误;反应Ⅱ是吸热反应,若反应Ⅱ的平衡常数增大,则为升高温度,平衡正向移动,反应Ⅱ一定向正反应方向移动,D项正确.
8.A 有一种同位素无中子可推断X为氢元素,气态氢化物溶于水呈碱性可推断Y为氮元素,2p轨道有两个未成对电子,价层电子排布式为或,由原子序数:Z>Y可推断Z为氧元素,W的简单离子是所在周期离子半径最小的,可推断为第三周期的铝元素,第四周期元素中,外围电子排布为,且能级处于半满稳定状态时,含有的未成对电子数最多,即外围电子排布为,R元素为24号铬.性质较稳定是由于分子内共价键较牢固而非氢键的缘故,A项错误;H、N、O形成的是离子化合物,B项正确;为氧化铝,工业上常用电解熔融氧化铝来制备Al,C项正确;24号元素Cr位于第四周期第ⅥB族,属于d区,D项正确.
9.D 分子中存在3个键,且P孤电子对数为1,则价层电子对数为,为杂化,由于存在1对孤对电子,故分子结构为三角锥形,A项错误;中3个原子所处环境相同,完全等效,被取代机会均等,B项错误;观察结构可知,分子中存在2个,中的氢可以电离,另一个氢直接与磷相连不能电离,故为二元酸,C项错误;分子中P原子有孤电子对,当金属离子提供空轨道时可以形成相应配合物,D项正确.
10.B 根据均摊法,由图(b)可知,晶胞中有1个A离子,1个B离子,3个X离子,根据正负化合价代数和为0可知,X为,A项错误;图(a)可知在钛酸钙晶体中离钙离子最近的钛离子有8个,B项正确;中的N原子没有孤电子对,键角较大,氨气中氮原子有1对孤电子对,其对成键电子对的排斥力较大,键角较小,C项错误;由图(a)可知钛酸钙晶体中离钛离子最近的氧离子形成了正八面体,D项错误.
11.C 基态Fe原子的最外层电子在s轨道,其电子云形状为球形,A项正确;中,阴离子为,根据价层电子对互斥理论,的空间结构为正四面体形,B项正确;中键和键的数目分别为10个,之比为,C项错误;硅原子的半径比碳原子的大,不易形成键,D项正确.
12.D 溶液与二氧化硅反应生成具有黏合性的硅酸钠,图中为酸式滴定管,应选碱式滴定管量取溶液,A项错误;图中缺少环形玻璃搅拌器,B项错误;粗铜应与电源正极相连作阳极,C项错误;由强酸制取弱酸的原理,可知醋酸的酸性大于碳酸的酸性,则可比较的和的大小,D项正确.
13.A 由图知,在反应过程Ⅰ中碳碳双键保持不变,A项错误;乙烯中碳原子为杂化,乙醛中碳原子为、杂化,B项正确;分子中有4个“”键、1个“”键,1个碳氧键,1个碳氧键,C项正确;过程Ⅴ反应为,其中氧化剂是、还原剂是,其物质的量之比为,D项正确.
14.B 由图中信息知,放电时正极上转化为、C,A项正确;充电时钠箔电极接电源负极作阴极,移向带负电的钠箔,B项错误;由图知C项正确;放电时是原电池,正极电势高于负极,D项正确.
15.C X为,Y为,Z为,A项正确;由图像可知,,B项正确;时,,由,则,又因为,故,C项错误;时,主要为和,两者物质的量分数均小于0.2,则,D项正确.
16.(1)414;-557(各2分)
(2)①;(或其他合理写法)(各2分)
②AC(全对2分,只选一个且正确得1分)
(3)①压强;(各1分)②0.5(2分)
17.(1)哑铃形或纺锤形;4
(2)共价晶体;、
(3)
(4)6;或(每空2分)
18.(1)
(2)① ②AD
(3)①均为分子晶体,范德华力随相对分子质量增大而增大
②减小
(4)A分子间存在氢键
(5)(每空2分)
19.(1);(各2分)
(2)形;(各2分)
(3)共价晶体(1分);(2分);(2分)
同课章节目录
