浙江省嘉兴市2023-2024学年高二上学期期末检测化学试题(含答案)
文档属性
| 名称 | 浙江省嘉兴市2023-2024学年高二上学期期末检测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 860.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-22 15:46:57 | ||
图片预览




文档简介
嘉兴市2023-2024学年高二上学期期末检测
化学试题卷 (2024/01 )
1.本试卷分为选择题和非选择题两部分,满分100分,考试时间90分钟。
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Fe 56 Cu 64
选择题部分
一、选择题(每小题只有一个选项符合题意,每小题3分,共48分)
1.化学与生活密切相关,下列说法错误的是( )
A.明矾可用于饮用水的消毒杀菌
B.于谦《石灰吟》中“千锤万凿出深山,烈火焚烧若等闲”涉及的反应是吸热反应
C.化学家戴维利用电解原理制备得到金属钠
D.锂离子电池可用于大型储能电站,以实现对电网供电的灵活调节
2.相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②,分别与等质量的少量锌粉发生反应,下列关于氢气体积(V )随时间(t)变化的示意图正确的是( )
A. B. C. D.
3.下列有关说法中错误的是(盐桥是浸满饱和KCl溶液的琼脂 )( )
A.锌是负极,发生氧化反应 B.铜电极的电极反应式为:
C.电子经盐桥从锌电极流向铜电极 D.盐桥中流向右侧烧杯
4.下列说法正确的是( )
A.F、Cl、Br的电负性依次增大
B.电子排布不同的两种氮原子:① ②,能量
C.太阳光谱中的黑线实质上是太阳中所含元素原子的发射光谱
D.V、Cr、Mn的最外层电子数依次增多
5.某反应过程能量变化如图所示,下列说法正确的是( )
A.反应过程a有催化剂参与
B.该反应为吸热反应,反应热等于
C.加入催化剂,可改变该反应的活化能,但不能改变反应的
D.有催化剂的条件下,反应的活化能等于
6.在恒温条件,体积为V L的密闭容器中,充入一定量混合气体发生反应,,达到平衡时,测得A的浓度为1;将容器的体积扩大到2V L,再次达到平衡时,测得A的浓度为0.6,下列有关判断正确的是( )
A. B.平衡向正反应方向移动
C.B的浓度比第1次平衡时大 D.C的体积分数比第1次平衡时低
7.X、Y、Z、M、Q五种短周期主族元素,原子序数依此增大。X的s轨道上电子全充满,p轨道上无电子,Y与Z相邻,Z是地壳中含量最丰富的元素,M为非金属性最强的元素,Q是纯碱中的一种元素,下列说法不正确的是( )
A.第一电离能:YQ
C.化合物可能为两性氢氧化物 D.Z与Q形成化合物的化合物中可能含有非极性键
8.一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的曲线如图所示。下列描述正确的是( )
A.反应方程式可表示为:
B.Z点时反应达到化学平衡状态
C.反应达到化学平衡状态后:
D.保持温度、体积不变,5min时充入1mol He,正逆反应速率均增大
9.在容积不变的密闭容器中,充入2mol 与1mol 发生反应:。温度分别为和时,的体积分数随时间的变化如图所示。下列说法不正确的是( )
A.保持温度为时,再充入2mol 与lmol ,平衡常数不变
B.
C.向平衡后的体系中充入,达到新平衡后,、、中均含原子
D.平衡后的体系中:
10.某实验小组用50mL 0.50NaOH和50mL 0.55盐酸进行中和反应的反应热测量(装置如图所示 ),下列有关说法正确的是( )
A.因玻璃仪器易碎,可将玻璃搅拌器换成铜丝搅拌器
B.为减小误差,可将盐酸分多次加入到NaOH溶液中
C.将盐酸替换为等浓度的硫酸,会使测量结果偏大
D.此实验应多次测量取平均值,以减小误差
11.下列有关滴定操作的说法正确的是( )
A.酸碱中和滴定实验时,滴定管和锥形瓶水洗后都需要用待装液润洗
B.用标准KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有NaOH杂质,则测定结果偏低
C.可用量筒量取25.00mL NaOH待测液置于锥形瓶中
D.用盐酸标准液滴定NaOH待测液时,选择酚酞指示反应终点,误差比甲基橙的大
12.重整技术是实现“碳中和”的一种理想的利用技术,反应为 。某温度下,向2L密闭容器中充入2mol 气体和4mol 气体,10min后反应达到平衡,测得的含量为2mol,下列说法正确的是( )
A.0~10min,
B.若继续往平衡体系中充入,转化率上升
C.该温度下的平衡转化率为25%
D.升温后,该反应的平衡常数增大
13.化学反应中的能量变化,通常主要表现为热量的变化。下列相关表述正确的是( )
A.一定条件下,将0.5mol 和1.5mol 置于密闭容器中充分反应生成放热a kJ,其热化学方程式为:
B.
C.HCl和NaOH反应的中和热,则0.5mol 和足量反应的
D.在101KPa时,2g 完全燃烧生成液态水,放出285.8kJ热量,表示氢气燃烧热的热化学方程式为:
14.通过如下图所示装置可实现将废旧锂离子电池的正极材料转化为,并回收钴,同时可借助其降解乙酸盐生成。其中电极材料均为石墨,右侧装置为原电池(工作时应保持厌氧环境和pH稳定)。下列说法正确的是( )
A.乙室电极反应式为:
B.装置工作时,乙室pH减小
C.装置工作时,甲室发生还原反应:
D.装置工作一段时间后,应定时将乙室溶液转移至甲室
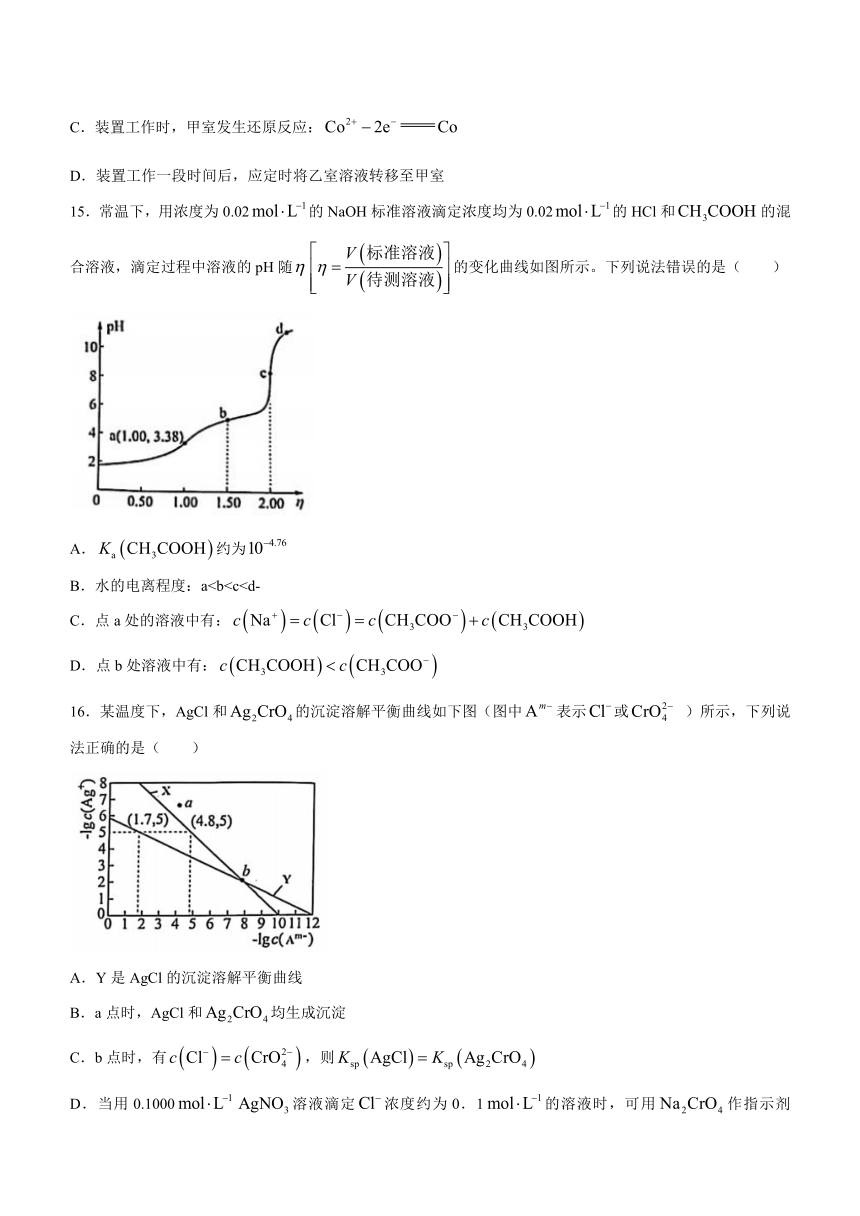
15.常温下,用浓度为0.02的NaOH标准溶液滴定浓度均为0.02的HCl和的混合溶液,滴定过程中溶液的pH随的变化曲线如图所示。下列说法错误的是( )
A.约为
B.水的电离程度:aC.点a处的溶液中有:
D.点b处溶液中有:
16.某温度下,AgCl和的沉淀溶解平衡曲线如下图(图中表示或 )所示,下列说法正确的是( )
A.Y是AgCl的沉淀溶解平衡曲线
B.a点时,AgCl和均生成沉淀
C.b点时,有,则
D.当用0.1000溶液滴定浓度约为0.1的溶液时,可用作指示剂(为红色沉淀 )
非选择题部分
二、填空题(本题有5小题,共52分)
17.(8分)北宋卷轴画《千里江山图》,颜色绚丽,由石绿、雌黄、赭石、砗磲、朱砂等颜料绘制而成,颜料中含有硫、砷、铜、锌、钛、铁等元素。
(1)、、热稳定性由大到小的顺序为______。
(2)Zn属于元素周期表中的______区;基态Ti原子的电子排布式为______;基态硫原子核外电子的空间运动状态有______种:基态的价层电子的轨道表示式为______。
(3)Cu的第二电离能____________Zn的第二电离能(填“>”或“<” ),理由为______。
18.(8分)完成下列问题
(1)已知和反应过程中能量变化如图所示:
写出此反应的热化学方程式______。
(2)已知259℃时,的电离平衡常数为:;.用离子方程式解释溶液呈碱性的原因______,计算25℃时溶液中的水解平衡常数______。
(3)氢气用于工业合成氨 ,一定温度下,在容积恒定的密闭容器中,一定量的和反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
下列说法正确的是______。
A.时刻改变的条件是增加反应物浓度,增加活化分子百分数,加快了反应速率
B.时刻改变的条件是加入催化剂,催化剂可降低活化能,加快了反应速率
C.时刻改变条件可能为降压
D.时刻的转化率最大
19.(10分)我国应对气候变化工作成效显著,北京冬奥会是首个实现“碳中和”的世界级体育盛会,我国承诺2030年前实现“碳达峰”,2060年前实现“碳中和”。如何高效利用是重要的研究课题。
Ⅰ.光合作用[]
(1)植物光合作用中能量的转化形式为______。
(2)“人工树叶”电化学装置如下图1所示(以稀硫酸为电解质溶液 ),该装置能将和转化为糖类(用表示 )和。
①Y为______极,该极上发生的电极反应式为______。
②室温下,该装置工作一段时间后,电解质溶液的pH______(填“升高”“降低”或“不变”)。
Ⅱ.电化学方法可将有效地转化为,装置如,上图2所示
(3)阴极电极反应式为______;电解时,H*通过质子交换膜向______移动(填“左”或“右”)。
20.(12分)生物炼铜技术是一种利用微生物开矿的湿式制铜技术,适用于从含铜量极低的矿石中冶炼出铜,具有环保、高效、低成本的优点。利用生物炼铜方法可以制备金属铜,同时生成副产品,相关转化过程如下图所示:
金属离子沉淀的pH如下表。
开始沉淀时的pH 1.5 4.2 6.3
完全沉淀时的pH 2.8 6.7 8.3
(1)请写出在硫化细菌作用下CuS转化生成的离子方程式______.
(2)请选择合适的试剂X______。
A.新制氯水 B.双氧水 C.稀硝酸 D.酸性高锰酸钾
(3)调节pH的范围在____________之间,试剂是______(写出一种即可 )。
(4)测定的纯度
Ⅰ.用分析天平称取6.000g 晶体,将其溶于硫酸后,加水稀释后用容量瓶配成100mL的待测液:
Ⅱ.取25.00mL的待测液置于锥形瓶中,用0.05000的标准液进行滴定,进行三次平行试验,消耗的标准液的体积如下表所示
实验组 第一次 第二次 第三次
滴定前溶液的体积/mL 0.05 0.20 1.10
滴定后溶液的体积/mL 19.95 20.30 22.10
①标准液盛放在______(填“酸式”或“碱式”)滴定管中。
②滴定终点的现象是______。
③该晶体的纯度是______%(保留2位小数 )。
④现测得该晶体纯度偏低,可能的原因是______。
A.在配制待测液定容时仰视
B.原锥形瓶中有水
C.待测液配制过程中被氧气氧化
D.滴定前盛放标准液的滴定管中滴定前有气泡,滴定后气泡消失
E.滴定终点时仰视读数
21.(14分)天然气经催化重整转化成合成气( )后再合成其他化工产品,既可降解能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下二个反应:
反应Ⅰ
反应Ⅱ
(1)反应Ⅰ可分为如下两步:
裂解:
重整:
则______。反应Ⅰ能够自发进行的条件是______,判断依据是______。
(2)T℃时,向4L容器中通入7mol 、6mol ,发生反应Ⅰ、Ⅱ。min后平衡,体系中,,压强为p。
①此温度下,反应Ⅰ的平衡常数______[对于气相反应,用某组分B的平衡压强代替物质的量浓度也可表示平衡常数,记作,如,p为平衡总压强,为平衡系统中B的物质的量分数]。
②请在图中画出时段,随时间变化曲线并标出CO的平衡浓度。
(3)二甲醚(DME )是重要的有机化工原料,可通过上述原料制备,反应方程式为:
。
①在恒温恒压条件进行此反应,下列能说明反应已达到平衡的是______。
A.、CO、、的反应速率之比为4∶2∶1∶1
B.、CO、、的物质的量之比为4∶2∶1∶1
C.混合气体的平均摩尔质量保持不变
D.容器中气体的密度保持不变
②T℃时,在容积为1L的恒容容器中按体积比2∶1充入总物质的量为3mol 和CO的混合物,发生上述制备反应,平衡时的体积分数对应下图甲中的a点,若调节起始时物质的量之比为3.5∶1,则的平衡体积分数可能对应下图甲中的______(填“b”“c”或“d”)点。
③某温度下,将2.0mol 和4.0mol 充入容积为2L的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中的物质的量分数变化情况如上图乙所示,关于温度和压强的关系判断正确的是______(填序号)。
A., B.,
C., D.,
答案
一、选择题(每小题3分,共48分)
题号 1 2 3 4 5 6 7 8
答案 A A C B C D A C
题号 9 10 11 12 13 14 15 16
答案 B D B C D D B D
二、填空题(5小题,共52分)
17.(8分)
(1)(1分)。
(2)ds(1分),或(1分),9(1分),(1分)。
(3)>(1分),和价层电子排布分别为、;前者属于全充满状态,再失去一个电子更难(2分)。
18.(8分)
(1) (2分,方程式正确得1分,焓变正确得1分)。
(2)( )(2分,第2个反应不写不扣分)。
(2分)。
(3)BD(2分,选对1个得1分,有错不得分)。
19.(10分)
(1)太阳能转化为化学能(2分)。
(2)①阳(1分),(2分)。 ②降低(2分)。
(3)(2分),右(1分)。
20.(12分)
(1)(2分)。
(2)B(1分)。
(3)2.8~4.2(1分)。等合理即可(1分)。
(4)①酸式(1分)。
②当滴入最后半滴标准液时,溶液由无色(浅绿色 )变为浅紫色,且半分钟内不变色(2分,说出半滴得1分,颜色变化得1分)。
③92.67(2分)。
④AC(2分,选对1个得1分,有错不得分)。
21.(14分)
(1)247.1(2分)。高温自发(1分)。该反应是放热反应,且为熵增,所以为高温自发反应(1分)。
(2)①(2分)。 ②(2分,趋势正确得1分,标出2.25得1分)。
(3)①CD(2分)。②d(2分)。③BD(2分)。
化学试题卷 (2024/01 )
1.本试卷分为选择题和非选择题两部分,满分100分,考试时间90分钟。
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Fe 56 Cu 64
选择题部分
一、选择题(每小题只有一个选项符合题意,每小题3分,共48分)
1.化学与生活密切相关,下列说法错误的是( )
A.明矾可用于饮用水的消毒杀菌
B.于谦《石灰吟》中“千锤万凿出深山,烈火焚烧若等闲”涉及的反应是吸热反应
C.化学家戴维利用电解原理制备得到金属钠
D.锂离子电池可用于大型储能电站,以实现对电网供电的灵活调节
2.相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②,分别与等质量的少量锌粉发生反应,下列关于氢气体积(V )随时间(t)变化的示意图正确的是( )
A. B. C. D.
3.下列有关说法中错误的是(盐桥是浸满饱和KCl溶液的琼脂 )( )
A.锌是负极,发生氧化反应 B.铜电极的电极反应式为:
C.电子经盐桥从锌电极流向铜电极 D.盐桥中流向右侧烧杯
4.下列说法正确的是( )
A.F、Cl、Br的电负性依次增大
B.电子排布不同的两种氮原子:① ②,能量
C.太阳光谱中的黑线实质上是太阳中所含元素原子的发射光谱
D.V、Cr、Mn的最外层电子数依次增多
5.某反应过程能量变化如图所示,下列说法正确的是( )
A.反应过程a有催化剂参与
B.该反应为吸热反应,反应热等于
C.加入催化剂,可改变该反应的活化能,但不能改变反应的
D.有催化剂的条件下,反应的活化能等于
6.在恒温条件,体积为V L的密闭容器中,充入一定量混合气体发生反应,,达到平衡时,测得A的浓度为1;将容器的体积扩大到2V L,再次达到平衡时,测得A的浓度为0.6,下列有关判断正确的是( )
A. B.平衡向正反应方向移动
C.B的浓度比第1次平衡时大 D.C的体积分数比第1次平衡时低
7.X、Y、Z、M、Q五种短周期主族元素,原子序数依此增大。X的s轨道上电子全充满,p轨道上无电子,Y与Z相邻,Z是地壳中含量最丰富的元素,M为非金属性最强的元素,Q是纯碱中的一种元素,下列说法不正确的是( )
A.第一电离能:Y
C.化合物可能为两性氢氧化物 D.Z与Q形成化合物的化合物中可能含有非极性键
8.一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的曲线如图所示。下列描述正确的是( )
A.反应方程式可表示为:
B.Z点时反应达到化学平衡状态
C.反应达到化学平衡状态后:
D.保持温度、体积不变,5min时充入1mol He,正逆反应速率均增大
9.在容积不变的密闭容器中,充入2mol 与1mol 发生反应:。温度分别为和时,的体积分数随时间的变化如图所示。下列说法不正确的是( )
A.保持温度为时,再充入2mol 与lmol ,平衡常数不变
B.
C.向平衡后的体系中充入,达到新平衡后,、、中均含原子
D.平衡后的体系中:
10.某实验小组用50mL 0.50NaOH和50mL 0.55盐酸进行中和反应的反应热测量(装置如图所示 ),下列有关说法正确的是( )
A.因玻璃仪器易碎,可将玻璃搅拌器换成铜丝搅拌器
B.为减小误差,可将盐酸分多次加入到NaOH溶液中
C.将盐酸替换为等浓度的硫酸,会使测量结果偏大
D.此实验应多次测量取平均值,以减小误差
11.下列有关滴定操作的说法正确的是( )
A.酸碱中和滴定实验时,滴定管和锥形瓶水洗后都需要用待装液润洗
B.用标准KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有NaOH杂质,则测定结果偏低
C.可用量筒量取25.00mL NaOH待测液置于锥形瓶中
D.用盐酸标准液滴定NaOH待测液时,选择酚酞指示反应终点,误差比甲基橙的大
12.重整技术是实现“碳中和”的一种理想的利用技术,反应为 。某温度下,向2L密闭容器中充入2mol 气体和4mol 气体,10min后反应达到平衡,测得的含量为2mol,下列说法正确的是( )
A.0~10min,
B.若继续往平衡体系中充入,转化率上升
C.该温度下的平衡转化率为25%
D.升温后,该反应的平衡常数增大
13.化学反应中的能量变化,通常主要表现为热量的变化。下列相关表述正确的是( )
A.一定条件下,将0.5mol 和1.5mol 置于密闭容器中充分反应生成放热a kJ,其热化学方程式为:
B.
C.HCl和NaOH反应的中和热,则0.5mol 和足量反应的
D.在101KPa时,2g 完全燃烧生成液态水,放出285.8kJ热量,表示氢气燃烧热的热化学方程式为:
14.通过如下图所示装置可实现将废旧锂离子电池的正极材料转化为,并回收钴,同时可借助其降解乙酸盐生成。其中电极材料均为石墨,右侧装置为原电池(工作时应保持厌氧环境和pH稳定)。下列说法正确的是( )
A.乙室电极反应式为:
B.装置工作时,乙室pH减小
C.装置工作时,甲室发生还原反应:
D.装置工作一段时间后,应定时将乙室溶液转移至甲室
15.常温下,用浓度为0.02的NaOH标准溶液滴定浓度均为0.02的HCl和的混合溶液,滴定过程中溶液的pH随的变化曲线如图所示。下列说法错误的是( )
A.约为
B.水的电离程度:a
D.点b处溶液中有:
16.某温度下,AgCl和的沉淀溶解平衡曲线如下图(图中表示或 )所示,下列说法正确的是( )
A.Y是AgCl的沉淀溶解平衡曲线
B.a点时,AgCl和均生成沉淀
C.b点时,有,则
D.当用0.1000溶液滴定浓度约为0.1的溶液时,可用作指示剂(为红色沉淀 )
非选择题部分
二、填空题(本题有5小题,共52分)
17.(8分)北宋卷轴画《千里江山图》,颜色绚丽,由石绿、雌黄、赭石、砗磲、朱砂等颜料绘制而成,颜料中含有硫、砷、铜、锌、钛、铁等元素。
(1)、、热稳定性由大到小的顺序为______。
(2)Zn属于元素周期表中的______区;基态Ti原子的电子排布式为______;基态硫原子核外电子的空间运动状态有______种:基态的价层电子的轨道表示式为______。
(3)Cu的第二电离能____________Zn的第二电离能(填“>”或“<” ),理由为______。
18.(8分)完成下列问题
(1)已知和反应过程中能量变化如图所示:
写出此反应的热化学方程式______。
(2)已知259℃时,的电离平衡常数为:;.用离子方程式解释溶液呈碱性的原因______,计算25℃时溶液中的水解平衡常数______。
(3)氢气用于工业合成氨 ,一定温度下,在容积恒定的密闭容器中,一定量的和反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
下列说法正确的是______。
A.时刻改变的条件是增加反应物浓度,增加活化分子百分数,加快了反应速率
B.时刻改变的条件是加入催化剂,催化剂可降低活化能,加快了反应速率
C.时刻改变条件可能为降压
D.时刻的转化率最大
19.(10分)我国应对气候变化工作成效显著,北京冬奥会是首个实现“碳中和”的世界级体育盛会,我国承诺2030年前实现“碳达峰”,2060年前实现“碳中和”。如何高效利用是重要的研究课题。
Ⅰ.光合作用[]
(1)植物光合作用中能量的转化形式为______。
(2)“人工树叶”电化学装置如下图1所示(以稀硫酸为电解质溶液 ),该装置能将和转化为糖类(用表示 )和。
①Y为______极,该极上发生的电极反应式为______。
②室温下,该装置工作一段时间后,电解质溶液的pH______(填“升高”“降低”或“不变”)。
Ⅱ.电化学方法可将有效地转化为,装置如,上图2所示
(3)阴极电极反应式为______;电解时,H*通过质子交换膜向______移动(填“左”或“右”)。
20.(12分)生物炼铜技术是一种利用微生物开矿的湿式制铜技术,适用于从含铜量极低的矿石中冶炼出铜,具有环保、高效、低成本的优点。利用生物炼铜方法可以制备金属铜,同时生成副产品,相关转化过程如下图所示:
金属离子沉淀的pH如下表。
开始沉淀时的pH 1.5 4.2 6.3
完全沉淀时的pH 2.8 6.7 8.3
(1)请写出在硫化细菌作用下CuS转化生成的离子方程式______.
(2)请选择合适的试剂X______。
A.新制氯水 B.双氧水 C.稀硝酸 D.酸性高锰酸钾
(3)调节pH的范围在____________之间,试剂是______(写出一种即可 )。
(4)测定的纯度
Ⅰ.用分析天平称取6.000g 晶体,将其溶于硫酸后,加水稀释后用容量瓶配成100mL的待测液:
Ⅱ.取25.00mL的待测液置于锥形瓶中,用0.05000的标准液进行滴定,进行三次平行试验,消耗的标准液的体积如下表所示
实验组 第一次 第二次 第三次
滴定前溶液的体积/mL 0.05 0.20 1.10
滴定后溶液的体积/mL 19.95 20.30 22.10
①标准液盛放在______(填“酸式”或“碱式”)滴定管中。
②滴定终点的现象是______。
③该晶体的纯度是______%(保留2位小数 )。
④现测得该晶体纯度偏低,可能的原因是______。
A.在配制待测液定容时仰视
B.原锥形瓶中有水
C.待测液配制过程中被氧气氧化
D.滴定前盛放标准液的滴定管中滴定前有气泡,滴定后气泡消失
E.滴定终点时仰视读数
21.(14分)天然气经催化重整转化成合成气( )后再合成其他化工产品,既可降解能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下二个反应:
反应Ⅰ
反应Ⅱ
(1)反应Ⅰ可分为如下两步:
裂解:
重整:
则______。反应Ⅰ能够自发进行的条件是______,判断依据是______。
(2)T℃时,向4L容器中通入7mol 、6mol ,发生反应Ⅰ、Ⅱ。min后平衡,体系中,,压强为p。
①此温度下,反应Ⅰ的平衡常数______[对于气相反应,用某组分B的平衡压强代替物质的量浓度也可表示平衡常数,记作,如,p为平衡总压强,为平衡系统中B的物质的量分数]。
②请在图中画出时段,随时间变化曲线并标出CO的平衡浓度。
(3)二甲醚(DME )是重要的有机化工原料,可通过上述原料制备,反应方程式为:
。
①在恒温恒压条件进行此反应,下列能说明反应已达到平衡的是______。
A.、CO、、的反应速率之比为4∶2∶1∶1
B.、CO、、的物质的量之比为4∶2∶1∶1
C.混合气体的平均摩尔质量保持不变
D.容器中气体的密度保持不变
②T℃时,在容积为1L的恒容容器中按体积比2∶1充入总物质的量为3mol 和CO的混合物,发生上述制备反应,平衡时的体积分数对应下图甲中的a点,若调节起始时物质的量之比为3.5∶1,则的平衡体积分数可能对应下图甲中的______(填“b”“c”或“d”)点。
③某温度下,将2.0mol 和4.0mol 充入容积为2L的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中的物质的量分数变化情况如上图乙所示,关于温度和压强的关系判断正确的是______(填序号)。
A., B.,
C., D.,
答案
一、选择题(每小题3分,共48分)
题号 1 2 3 4 5 6 7 8
答案 A A C B C D A C
题号 9 10 11 12 13 14 15 16
答案 B D B C D D B D
二、填空题(5小题,共52分)
17.(8分)
(1)(1分)。
(2)ds(1分),或(1分),9(1分),(1分)。
(3)>(1分),和价层电子排布分别为、;前者属于全充满状态,再失去一个电子更难(2分)。
18.(8分)
(1) (2分,方程式正确得1分,焓变正确得1分)。
(2)( )(2分,第2个反应不写不扣分)。
(2分)。
(3)BD(2分,选对1个得1分,有错不得分)。
19.(10分)
(1)太阳能转化为化学能(2分)。
(2)①阳(1分),(2分)。 ②降低(2分)。
(3)(2分),右(1分)。
20.(12分)
(1)(2分)。
(2)B(1分)。
(3)2.8~4.2(1分)。等合理即可(1分)。
(4)①酸式(1分)。
②当滴入最后半滴标准液时,溶液由无色(浅绿色 )变为浅紫色,且半分钟内不变色(2分,说出半滴得1分,颜色变化得1分)。
③92.67(2分)。
④AC(2分,选对1个得1分,有错不得分)。
21.(14分)
(1)247.1(2分)。高温自发(1分)。该反应是放热反应,且为熵增,所以为高温自发反应(1分)。
(2)①(2分)。 ②(2分,趋势正确得1分,标出2.25得1分)。
(3)①CD(2分)。②d(2分)。③BD(2分)。
同课章节目录
