山东省青岛市即墨区2023-2024学年高二上学期期末教学质量检测化学试题(含答案)
文档属性
| 名称 | 山东省青岛市即墨区2023-2024学年高二上学期期末教学质量检测化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 685.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-22 15:48:15 | ||
图片预览



文档简介
青岛市即墨区2023-2024学年高二上学期期末教学质量检测
化学试题
注意事项:
1.答题前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 B11 C135.5 Zn65
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.下列关于原子结构的表述正确的是( )
A.基态铁原子价电子只有4个成对电子,基态铬原子有6个未成对电子
B.基态氮原子的轨道表示式:
C.基态碘原子价电子排布式:
D.基态原子电子排布式,违背了泡利不相容原理
2.钠 电池总反应式为,其两极材料之一为聚乙烯吡啶(简写为)与的复合物,电解质为固态薄膜状的碘化钠,主要传导钠离子。下列说法正确的是( )
A.放电过程中固态电解质薄膜的质量减小 B.和的复合物是绝缘体,不能导电
C.该电池放电时,碘离子移向复合物电极 D.放电时,负极的电极反应式为:
3.下列有关能级或原子轨道说法错误的是( )
A.能量逐渐升高,能级的轨道数逐渐增多
B.轨道形状均为哑 形,且相互垂直,但能量相等
C.能级能量不一定大于能级能量
D.从空间角度看,轨道比轨道大,其空间包围了轨道
4.水煤气变换反应是工业上的重要反应,可用于制氢。。下列说法正确的是( )
A.恒温恒容下,恒定水碳比,增加体系总压可提高的平衡产率
B.恒温恒容下,平衡后再通入可使平衡正向移动,增大平衡转化率
C.恒温恒容下,平衡后再通入情性气体增加体系总压,可提高反应速率
D.恒温恒容下,平衡后再通入,可使正反应速率增大,逆反应速率减小
5.高附加值产品的合成催化反应历程如图所示。下列说法错误的是( )
A.第一电离能和电负性均为:
B.反应物过程中,有键和键的断裂
C.甲乙过程吸收能量,且为该过程正向的活化能
D.该反应总反应的原子利用率为
6.神舟十三号航天员在中国空间站进行“天宫课堂”授课活动,其中太空“冰雪实验”演示的是过饱和醋酸钠溶液结晶现象。常温下,下列有关说法正确的是( )
A.的醋酸溶液中加入醋酸钠固体,溶液增大醋酸电离常数减小
B.相同浓度的醋酸钠溶液和氢氧化钠溶液等体积混合后,溶液中存在
C.相同浓度的醋酸溶液和醋酸钠溶液等体积混合后约为4.7,溶液中存在:
D.相同浓度的醋酸钠溶液和硫酸氢钠溶液等体积混合后,溶液中存在:
7.乙醇催化合成乙酸乙酯的新方法为:。在密闭容器中充入发生反应,乙醇的转化率变化如图所示。下列分析正确的是( )
A.降低温度,有利于提高乙醇的平衡转化率
B.,该反应的平衡常数
C.两点中,乙酸乙酯的浓度均为
D.反应在、恒压容器中进行,达平衡时,乙醇的转化率小于
阅读下列材料,完成8—10题。
碳酸钠俗称纯碱,是一种重要的化工原料。工业制备的碳酸钠产品中通常含有少量碳酸氢钠,某兴趣小组测定磞酸钠中碳酸氢钠含量的实验步骤如下:
步骤一:称取产品,用蒸馏水溶解,定容于容量瓶中;
步骤二:移取上述溶液于锥形瓶,加入2滴指示剂,用盐酸标准溶液滴定至终点(第一滴定终点),消耗盐酸;
步骤三:在上述锥形瓶中再加入2滴指示剂,继续用盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸;
平行测定三次,平均值为22.45,平均值为23.51。
8.下列关于滴定分析的操作,正确的是( )
A.滴定时应一直观察滴定管中溶液体积的变化
B.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以上某固定位置
C.滴定时自始至终应匀速滴加
D.读数时应捏住滴定管上端无刻度处,使管保持垂直
9.下列有关上述实验或滴定管的描述错误的是( )
A.指示剂M可能为酚酞,可能为甲基橙
B.酸性高锰酸钾溶液、碘水均需用酸式滴定管
C.碱式滴定管可以通过挤压玻璃球下方的乳胶管放液
D.滴定管中装液时,应由试剂瓶直接灌入,不得借用任何别的器皿
10.下列有关实验数据及误差分析错误的是( )
A.该产品中碳酸氢钠的含量约为
B.第一次滴定终点时俯视读数,测得实验数据偏小
C.第二次滴定终点结束后,迅速读数,测得实验数据偏大
D.滴定前滴定管尖嘴处有气泡,第一次滴定结束后气泡消失,测得实验数据偏小
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.时,草酸的。下列说法正确的是( )
A.溶液中:
B.向的溶液中通入气体(忽略溶液体积的变化)至,溶液
C.向溶液中加入溶液至,则
D.取的溶液,加蒸馏水稀释至,则该溶液
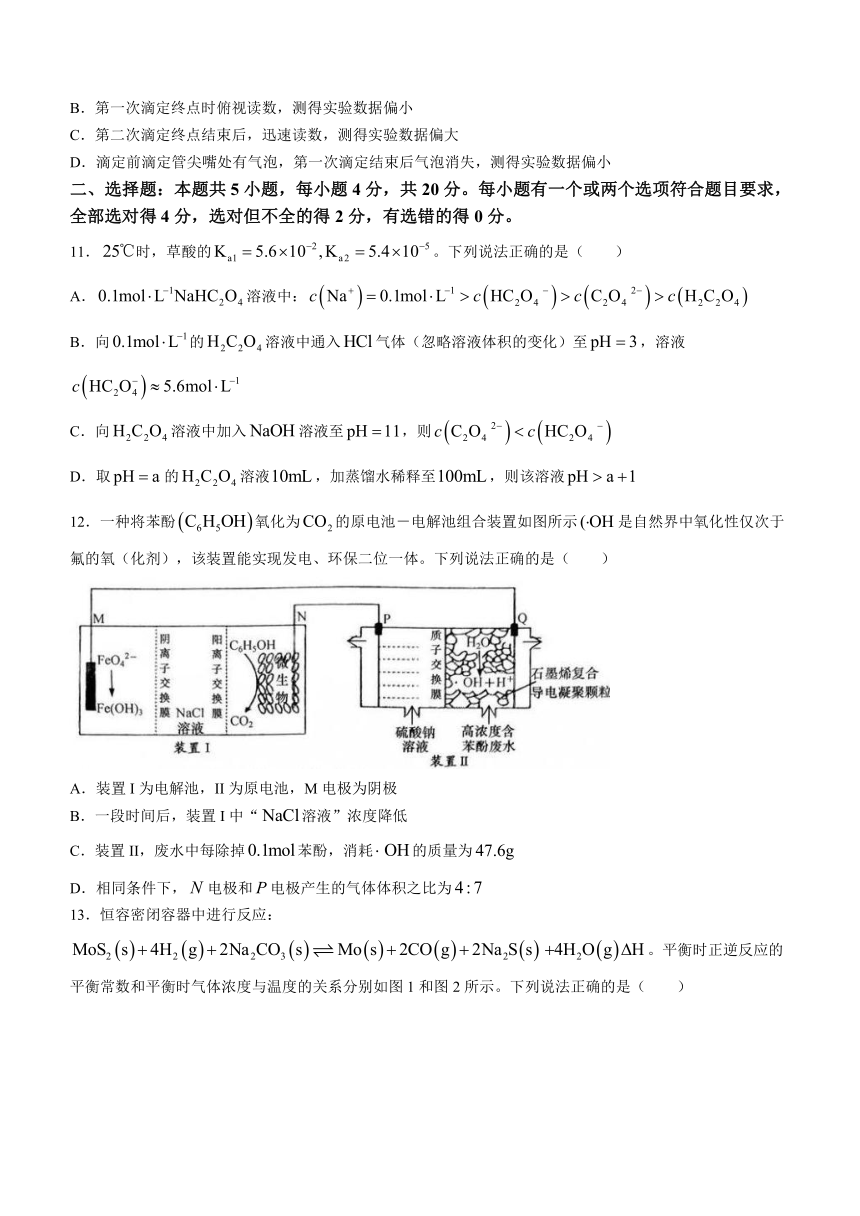
12.一种将苯酚氧化为的原电池-电解池组合装置如图所示是自然界中氧化性仅次于氟的氧(化剂),该装置能实现发电、环保二位一体。下列说法正确的是( )
A.装置I为电解池,II为原电池,M电极为阴极
B.一段时间后,装置I中“溶液”浓度降低
C.装置II,废水中每除掉苯酚,消耗的质量为
D.相同条件下,电极和电极产生的气体体积之比为
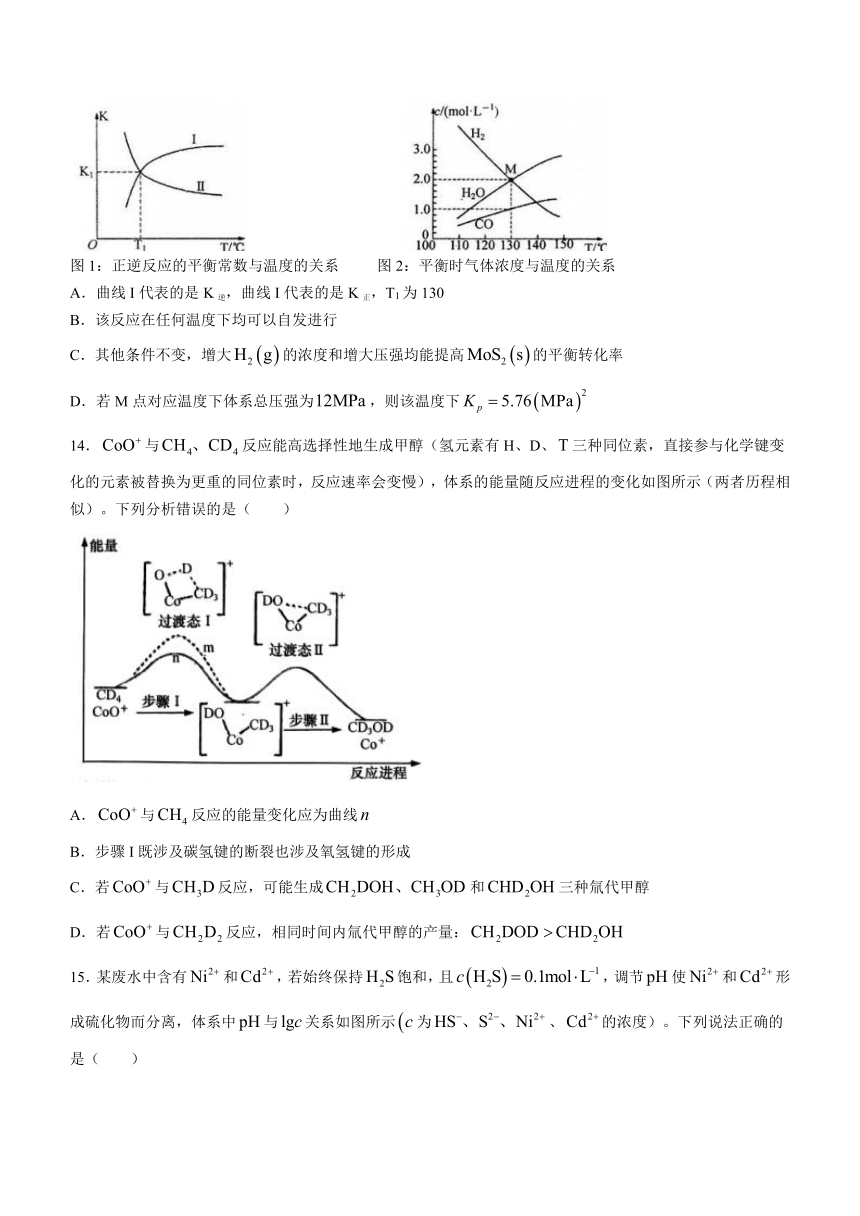
13.恒容密闭容器中进行反应:。平衡时正逆反应的平衡常数和平衡时气体浓度与温度的关系分别如图1和图2所示。下列说法正确的是( )
图1:正逆反应的平衡常数与温度的关系 图2:平衡时气体浓度与温度的关系
A.曲线I代表的是K逆,曲线I代表的是K正,T1为130
B.该反应在任何温度下均可以自发进行
C.其他条件不变,增大的浓度和增大压强均能提高的平衡转化率
D.若M点对应温度下体系总压强为,则该温度下
14.与反应能高选择性地生成甲醇(氢元素有H、D、三种同位素,直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢),体系的能量随反应进程的变化如图所示(两者历程相似)。下列分析错误的是( )
A.与反应的能量变化应为曲线
B.步骤I既涉及碳氢键的断裂也涉及氧氢键的形成
C.若与反应,可能生成和三种氚代甲醇
D.若与反应,相同时间内氚代甲醇的产量:
15.某废水中含有和,若始终保持饱和,且,调节使和形成硫化物而分离,体系中与关系如图所示为、的浓度)。下列说法正确的是( )
A.
B.
C.调节同时沉淀和时,
D.M点条件下能生成NiS沉淀,不能生成CdS沉淀
三、非选择题:本题共5小题,共60分。
16.(12分)短周期元素原子序数依次增大。基态原子均有两个单电子,简单离子在同周期离子中半径最小,与同主族。冰晶石的主要成分是由三种元素组成的。
(1)元素X在周期表中的位置为______,其位于______区。
(2)Z元素原子的轨道表示式为______。
(3)元素基态电子排布式为______。
(4)元素基态原子核外电子占据的最高能级为______,该能级能容纳的最多电子数为______。
(5)X、Y、Z、W第一电离由大到小的顺序为______(用元素符号表示,下同),Z、电负性由大到小的顺序为______,原子半径由大到小的顺序为______。
(6)原子序数为29和51的元素基态原子价电子排布式分别为______。
17.(12分)二氧化碳的捕集和利用是寻找双碳解决之策最重要的部分。
(1)室温下在的溶液中通入,溶液中含碳物种的浓度总(不考虑通入所引起的溶液体积变化和的挥发)。已知:电离常数分别为。
①恰好完全转化为时,溶液中所含离子浓度由小到大的顺序为______,______。(用含碳微粒和氢离子浓度表示)。
②若吸收,则溶液中填“>”“<”或“=”,原因是_____(用必要的计算数据和文字说明)。
③常温下,溶液的,则该溶液中______。
(2)时,催化加氢法合成乙烯反应为:。向的恒容密闭容器中加入和,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图所示。
①图中曲线代表乙烯的物质的量随温度的变化关系的是______。(填字母)。
②下,自初始状态达到平衡时,放热为______kJ,该反应的化学平衡常数______。的平衡转化率为______。
18.(12分)氮元素是维持动植物生命活动的必需元素。
(1)草木灰与铵态氮肥不能混合施用,其原因是______。
(2)国防工业中,氨气可用于制造火箭、导弹的推进剂。实验室在浓氨水中加入生石灰可以快速制备氨气,请从平衡移动角度解释其原理______。
(3)肼为二元弱碱,在水中的电离与氨类似。常温下,的第一步电离平衡:
。
①第二步电离平衡方程式为______。
②反应的平衡常数______。
(4)化学工作者以和纳米片作为电极催化材料,合成偶氮化合物的装置如图所示(其中表示烃基)。
①该“甲醇燃料电池”的负极反应式为______。
②电极反应式为______。
③每合成偶氮化合物,理论上消耗甲醇的质量为______g,消耗的物质的量为______mol。
19.(12分)采用选择性催化还原技术(SCR)可以有效脱除烟气中的氮氧化物。
图甲:倠化反应机理循环圈
图乙:物质的量之比对中脱除率的影响
(1)钒基催化剂催化剂)可用于,反应机理与催化剂表面的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
①脱除NO的总反应化学方程式为______,该反应的中间体有______种。
②若烟气中含有硫的氧化物,则会降低的速率,可能的原因是______。
(2)研究发现:当烟气中和的物质的量相同时,会发生快速SCR反应过程:
。臭氧对具有一定的辅助作用。臭氧先氧化,发生反应:。在不同温度下,经过相同时间后测得的物质的量之比与NO的脱除率关系如图乙所示。
①温度升高到一定程度后,中脱除率均有不同程度的降低,其原因是______(写两条)。
②温度低于物质的量之比为0.5时,脱除率较高的原因是______。
③实验发现,向烟气中先通入脱除率低于先通入,可能的原因是______。
(3)以为媒介的间接电化学氧化法可以同时除去烟气中的和,装置如图丙所示:
图丙:电催化氧化法装置图
则阳极的电极反应式为______,参与反应的离子方程式为______。
20.(12分)含碳化合物的合成与转化具有重要的研究价值。
(1)热力学规定,在标准压强和指定温度下,由元素最稳定的单质生成化合物时的反应热称为该化合物的标准摩尔生成焓。常温下,的标准摩尔生成焓分别为、,则表示标准摩尔生成焓的热化学反应方程式为______。
(2)与在某催化剂作用下的反应如图所示:
该反应的热化学反应方程式为______。
(3)汽车尾气中的和在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是______(填标号)。
(4)与可发生反应:密闭容器中通入和,在不同催化剂(A、B)作用下,进行相同时间后,的产率随反应温度的变化如图所示:
①在催化剂A、B作用下,正、逆反应活化能差值分别用表示,则______(填“>”、“<”或“=”,下同)。
②点对应的(逆)______点对应的(正)。
③若点的时间为,则的平均反应速率为______。此温度下的化学平衡常数为______。
高二化学试题参考答案
一、选择题(15个小题,共40分。1~10为单项选择题,每题2分,共20分;11~15为不定项选择题,每小题有一个或两个选项符合题意,全部选对的得4分,选对但不全的得2分,有选错的得0分,共20分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
A D A B C D B D C B AB BC D CD A
二、填空题(共60分)
16.(12分)
(1)第二周期第IVA族(1分),P(1分)
(2)
(3)(1分)
(4)(1分)6(1分)
(5)(1分)(1分)
(6)(1分)(1分)
17.(12分)
(1)①
②>(1分),所得溶液为溶液,由计算可知,水解平衡常数大于其电离平衡常数,所以
③6.25(2分)
(2)①q(1分)②64(1分)0.25(2分)(1分)
18.(12分)
(1)草木灰中的碳酸根离子与铵态氮肥中的铵根离子都能发生水解且相互促进,使铵根离子转化为氮气而逸出,降低铵态氮肥的肥效(1分)
(2)浓氮水中存在平衡:,生石灰与水反应生成氢氧化钙电离出增大,使上述平衡逆向移动,有利于氨气生成(2分)
(3)①(1分)②(1分
(4)①(1分)
②
③42.67(2分) 2(2分)
19.(12分)
(1)①(1分);3(1分)
②硫的氧化物与氨气反应,生成硫酸盐或亚硫酸盐,覆盖在催化剂表面的活性吸附位点上,导致催化剂活性降低(2分)
(2)①温度升高到一定程度后,臭氧迅速分解,臭氧的利用率降低(1分)温度升高,催化剂活性降低(1分)
②当物质的量之比为0.5时,生成的和剩余的的物质的量相同,发生快速反应过程,因此相同时间内脱除率较高(2分)
(3)先通入臭氧,部分被氧化为,有利于发生快速SCR反应过程;先通入氨气,后通入臭氧,部分氮气与臭氧发生氧化还原反应,降低了脱除率(2分)
(3)(1分)(1分)
20.(12分)
(1)(2分)
(2)(2分)
(3)BC(2分)
(4)①=(1分)②<(1分)③0.06(2分)3.24(2分)
化学试题
注意事项:
1.答题前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 B11 C135.5 Zn65
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.下列关于原子结构的表述正确的是( )
A.基态铁原子价电子只有4个成对电子,基态铬原子有6个未成对电子
B.基态氮原子的轨道表示式:
C.基态碘原子价电子排布式:
D.基态原子电子排布式,违背了泡利不相容原理
2.钠 电池总反应式为,其两极材料之一为聚乙烯吡啶(简写为)与的复合物,电解质为固态薄膜状的碘化钠,主要传导钠离子。下列说法正确的是( )
A.放电过程中固态电解质薄膜的质量减小 B.和的复合物是绝缘体,不能导电
C.该电池放电时,碘离子移向复合物电极 D.放电时,负极的电极反应式为:
3.下列有关能级或原子轨道说法错误的是( )
A.能量逐渐升高,能级的轨道数逐渐增多
B.轨道形状均为哑 形,且相互垂直,但能量相等
C.能级能量不一定大于能级能量
D.从空间角度看,轨道比轨道大,其空间包围了轨道
4.水煤气变换反应是工业上的重要反应,可用于制氢。。下列说法正确的是( )
A.恒温恒容下,恒定水碳比,增加体系总压可提高的平衡产率
B.恒温恒容下,平衡后再通入可使平衡正向移动,增大平衡转化率
C.恒温恒容下,平衡后再通入情性气体增加体系总压,可提高反应速率
D.恒温恒容下,平衡后再通入,可使正反应速率增大,逆反应速率减小
5.高附加值产品的合成催化反应历程如图所示。下列说法错误的是( )
A.第一电离能和电负性均为:
B.反应物过程中,有键和键的断裂
C.甲乙过程吸收能量,且为该过程正向的活化能
D.该反应总反应的原子利用率为
6.神舟十三号航天员在中国空间站进行“天宫课堂”授课活动,其中太空“冰雪实验”演示的是过饱和醋酸钠溶液结晶现象。常温下,下列有关说法正确的是( )
A.的醋酸溶液中加入醋酸钠固体,溶液增大醋酸电离常数减小
B.相同浓度的醋酸钠溶液和氢氧化钠溶液等体积混合后,溶液中存在
C.相同浓度的醋酸溶液和醋酸钠溶液等体积混合后约为4.7,溶液中存在:
D.相同浓度的醋酸钠溶液和硫酸氢钠溶液等体积混合后,溶液中存在:
7.乙醇催化合成乙酸乙酯的新方法为:。在密闭容器中充入发生反应,乙醇的转化率变化如图所示。下列分析正确的是( )
A.降低温度,有利于提高乙醇的平衡转化率
B.,该反应的平衡常数
C.两点中,乙酸乙酯的浓度均为
D.反应在、恒压容器中进行,达平衡时,乙醇的转化率小于
阅读下列材料,完成8—10题。
碳酸钠俗称纯碱,是一种重要的化工原料。工业制备的碳酸钠产品中通常含有少量碳酸氢钠,某兴趣小组测定磞酸钠中碳酸氢钠含量的实验步骤如下:
步骤一:称取产品,用蒸馏水溶解,定容于容量瓶中;
步骤二:移取上述溶液于锥形瓶,加入2滴指示剂,用盐酸标准溶液滴定至终点(第一滴定终点),消耗盐酸;
步骤三:在上述锥形瓶中再加入2滴指示剂,继续用盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸;
平行测定三次,平均值为22.45,平均值为23.51。
8.下列关于滴定分析的操作,正确的是( )
A.滴定时应一直观察滴定管中溶液体积的变化
B.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以上某固定位置
C.滴定时自始至终应匀速滴加
D.读数时应捏住滴定管上端无刻度处,使管保持垂直
9.下列有关上述实验或滴定管的描述错误的是( )
A.指示剂M可能为酚酞,可能为甲基橙
B.酸性高锰酸钾溶液、碘水均需用酸式滴定管
C.碱式滴定管可以通过挤压玻璃球下方的乳胶管放液
D.滴定管中装液时,应由试剂瓶直接灌入,不得借用任何别的器皿
10.下列有关实验数据及误差分析错误的是( )
A.该产品中碳酸氢钠的含量约为
B.第一次滴定终点时俯视读数,测得实验数据偏小
C.第二次滴定终点结束后,迅速读数,测得实验数据偏大
D.滴定前滴定管尖嘴处有气泡,第一次滴定结束后气泡消失,测得实验数据偏小
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.时,草酸的。下列说法正确的是( )
A.溶液中:
B.向的溶液中通入气体(忽略溶液体积的变化)至,溶液
C.向溶液中加入溶液至,则
D.取的溶液,加蒸馏水稀释至,则该溶液
12.一种将苯酚氧化为的原电池-电解池组合装置如图所示是自然界中氧化性仅次于氟的氧(化剂),该装置能实现发电、环保二位一体。下列说法正确的是( )
A.装置I为电解池,II为原电池,M电极为阴极
B.一段时间后,装置I中“溶液”浓度降低
C.装置II,废水中每除掉苯酚,消耗的质量为
D.相同条件下,电极和电极产生的气体体积之比为
13.恒容密闭容器中进行反应:。平衡时正逆反应的平衡常数和平衡时气体浓度与温度的关系分别如图1和图2所示。下列说法正确的是( )
图1:正逆反应的平衡常数与温度的关系 图2:平衡时气体浓度与温度的关系
A.曲线I代表的是K逆,曲线I代表的是K正,T1为130
B.该反应在任何温度下均可以自发进行
C.其他条件不变,增大的浓度和增大压强均能提高的平衡转化率
D.若M点对应温度下体系总压强为,则该温度下
14.与反应能高选择性地生成甲醇(氢元素有H、D、三种同位素,直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢),体系的能量随反应进程的变化如图所示(两者历程相似)。下列分析错误的是( )
A.与反应的能量变化应为曲线
B.步骤I既涉及碳氢键的断裂也涉及氧氢键的形成
C.若与反应,可能生成和三种氚代甲醇
D.若与反应,相同时间内氚代甲醇的产量:
15.某废水中含有和,若始终保持饱和,且,调节使和形成硫化物而分离,体系中与关系如图所示为、的浓度)。下列说法正确的是( )
A.
B.
C.调节同时沉淀和时,
D.M点条件下能生成NiS沉淀,不能生成CdS沉淀
三、非选择题:本题共5小题,共60分。
16.(12分)短周期元素原子序数依次增大。基态原子均有两个单电子,简单离子在同周期离子中半径最小,与同主族。冰晶石的主要成分是由三种元素组成的。
(1)元素X在周期表中的位置为______,其位于______区。
(2)Z元素原子的轨道表示式为______。
(3)元素基态电子排布式为______。
(4)元素基态原子核外电子占据的最高能级为______,该能级能容纳的最多电子数为______。
(5)X、Y、Z、W第一电离由大到小的顺序为______(用元素符号表示,下同),Z、电负性由大到小的顺序为______,原子半径由大到小的顺序为______。
(6)原子序数为29和51的元素基态原子价电子排布式分别为______。
17.(12分)二氧化碳的捕集和利用是寻找双碳解决之策最重要的部分。
(1)室温下在的溶液中通入,溶液中含碳物种的浓度总(不考虑通入所引起的溶液体积变化和的挥发)。已知:电离常数分别为。
①恰好完全转化为时,溶液中所含离子浓度由小到大的顺序为______,______。(用含碳微粒和氢离子浓度表示)。
②若吸收,则溶液中填“>”“<”或“=”,原因是_____(用必要的计算数据和文字说明)。
③常温下,溶液的,则该溶液中______。
(2)时,催化加氢法合成乙烯反应为:。向的恒容密闭容器中加入和,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图所示。
①图中曲线代表乙烯的物质的量随温度的变化关系的是______。(填字母)。
②下,自初始状态达到平衡时,放热为______kJ,该反应的化学平衡常数______。的平衡转化率为______。
18.(12分)氮元素是维持动植物生命活动的必需元素。
(1)草木灰与铵态氮肥不能混合施用,其原因是______。
(2)国防工业中,氨气可用于制造火箭、导弹的推进剂。实验室在浓氨水中加入生石灰可以快速制备氨气,请从平衡移动角度解释其原理______。
(3)肼为二元弱碱,在水中的电离与氨类似。常温下,的第一步电离平衡:
。
①第二步电离平衡方程式为______。
②反应的平衡常数______。
(4)化学工作者以和纳米片作为电极催化材料,合成偶氮化合物的装置如图所示(其中表示烃基)。
①该“甲醇燃料电池”的负极反应式为______。
②电极反应式为______。
③每合成偶氮化合物,理论上消耗甲醇的质量为______g,消耗的物质的量为______mol。
19.(12分)采用选择性催化还原技术(SCR)可以有效脱除烟气中的氮氧化物。
图甲:倠化反应机理循环圈
图乙:物质的量之比对中脱除率的影响
(1)钒基催化剂催化剂)可用于,反应机理与催化剂表面的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
①脱除NO的总反应化学方程式为______,该反应的中间体有______种。
②若烟气中含有硫的氧化物,则会降低的速率,可能的原因是______。
(2)研究发现:当烟气中和的物质的量相同时,会发生快速SCR反应过程:
。臭氧对具有一定的辅助作用。臭氧先氧化,发生反应:。在不同温度下,经过相同时间后测得的物质的量之比与NO的脱除率关系如图乙所示。
①温度升高到一定程度后,中脱除率均有不同程度的降低,其原因是______(写两条)。
②温度低于物质的量之比为0.5时,脱除率较高的原因是______。
③实验发现,向烟气中先通入脱除率低于先通入,可能的原因是______。
(3)以为媒介的间接电化学氧化法可以同时除去烟气中的和,装置如图丙所示:
图丙:电催化氧化法装置图
则阳极的电极反应式为______,参与反应的离子方程式为______。
20.(12分)含碳化合物的合成与转化具有重要的研究价值。
(1)热力学规定,在标准压强和指定温度下,由元素最稳定的单质生成化合物时的反应热称为该化合物的标准摩尔生成焓。常温下,的标准摩尔生成焓分别为、,则表示标准摩尔生成焓的热化学反应方程式为______。
(2)与在某催化剂作用下的反应如图所示:
该反应的热化学反应方程式为______。
(3)汽车尾气中的和在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是______(填标号)。
(4)与可发生反应:密闭容器中通入和,在不同催化剂(A、B)作用下,进行相同时间后,的产率随反应温度的变化如图所示:
①在催化剂A、B作用下,正、逆反应活化能差值分别用表示,则______(填“>”、“<”或“=”,下同)。
②点对应的(逆)______点对应的(正)。
③若点的时间为,则的平均反应速率为______。此温度下的化学平衡常数为______。
高二化学试题参考答案
一、选择题(15个小题,共40分。1~10为单项选择题,每题2分,共20分;11~15为不定项选择题,每小题有一个或两个选项符合题意,全部选对的得4分,选对但不全的得2分,有选错的得0分,共20分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
A D A B C D B D C B AB BC D CD A
二、填空题(共60分)
16.(12分)
(1)第二周期第IVA族(1分),P(1分)
(2)
(3)(1分)
(4)(1分)6(1分)
(5)(1分)(1分)
(6)(1分)(1分)
17.(12分)
(1)①
②>(1分),所得溶液为溶液,由计算可知,水解平衡常数大于其电离平衡常数,所以
③6.25(2分)
(2)①q(1分)②64(1分)0.25(2分)(1分)
18.(12分)
(1)草木灰中的碳酸根离子与铵态氮肥中的铵根离子都能发生水解且相互促进,使铵根离子转化为氮气而逸出,降低铵态氮肥的肥效(1分)
(2)浓氮水中存在平衡:,生石灰与水反应生成氢氧化钙电离出增大,使上述平衡逆向移动,有利于氨气生成(2分)
(3)①(1分)②(1分
(4)①(1分)
②
③42.67(2分) 2(2分)
19.(12分)
(1)①(1分);3(1分)
②硫的氧化物与氨气反应,生成硫酸盐或亚硫酸盐,覆盖在催化剂表面的活性吸附位点上,导致催化剂活性降低(2分)
(2)①温度升高到一定程度后,臭氧迅速分解,臭氧的利用率降低(1分)温度升高,催化剂活性降低(1分)
②当物质的量之比为0.5时,生成的和剩余的的物质的量相同,发生快速反应过程,因此相同时间内脱除率较高(2分)
(3)先通入臭氧,部分被氧化为,有利于发生快速SCR反应过程;先通入氨气,后通入臭氧,部分氮气与臭氧发生氧化还原反应,降低了脱除率(2分)
(3)(1分)(1分)
20.(12分)
(1)(2分)
(2)(2分)
(3)BC(2分)
(4)①=(1分)②<(1分)③0.06(2分)3.24(2分)
同课章节目录
