化学人教版(2019)选择性必修3 2.2.2炔烃(共67张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 2.2.2炔烃(共67张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 179.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-23 07:42:06 | ||
图片预览









文档简介
(共67张PPT)
谁和我一样用功,谁就会和我一样成功。
——莫扎特
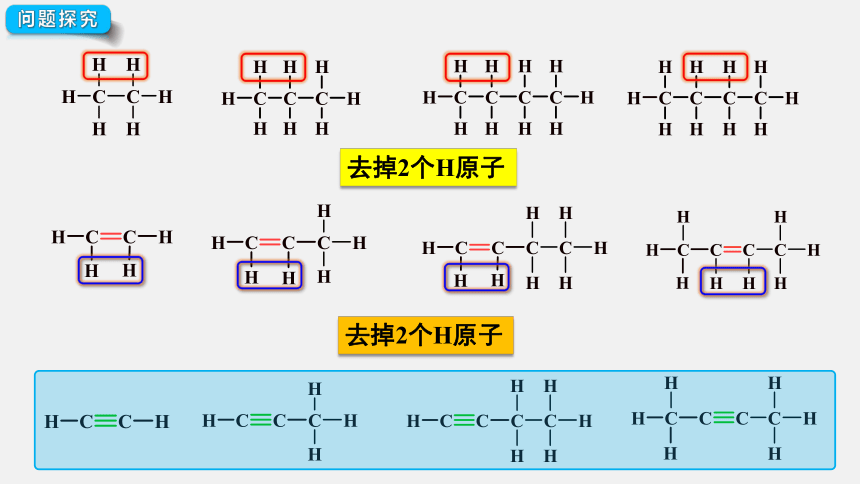
问题探究
去掉2个H原子
去掉2个H原子
乙炔与炔烃
05
04
03
02
01
炔烃
乙炔制备
学习目标
Learning Objectives
原理 原料
制备、收集及处理装置
乙炔结构
杂化 结构式 结构简式
球棍模型 空间填充模型
乙炔化学性质
氧化反应 加成反应 加聚反应
炔烃
概念 通式 化学性质
炔烃同分异构体
碳链异构
位置异构
官能团异构
1836年,英国皇家学院化学教授戴维·爱德蒙德在加热木炭和碳酸钾以制取金属钾过程中,将残渣(碳化钾)投进水中,产生一种气体,这一气体经研究是乙炔。
K2C+2H2O→C2H2↑+2KOH
化学趣史
乙炔发现史
01
乙炔的实验室制法
碳化钙
俗称:电石
英文名:Calcium Carbide
商品编号:28491000
CAS NO.:75-20-7
分子式:CaC2
物化性状:工业品是灰色,黄褐色或黑色固体,含碳化钙较高的呈紫色,比重2.22(18℃),熔点2300℃。
资料在线
碳化钙为何叫电石
CaCO3 CaO+CO2↑
高温
以焦炭、CaO为原料,在电弧炉中,高温下反应
2 500℃
CaO+3C CaC2+CO↑
乙炔实验室制备
1
1
CaC2 +2H2O → CH≡CH↑+ Ca(OH)2
反应原理
放出大量的热
反应十分剧烈
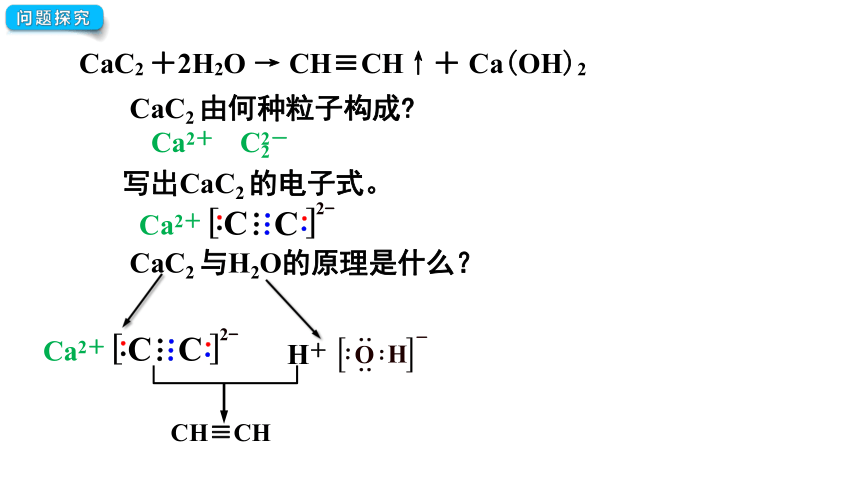
问题探究
CaC2 +2H2O → CH≡CH↑+ Ca(OH)2
CaC2 由何种粒子构成
Ca2+
C22-
写出CaC2 的电子式。
Ca2+
CaC2 与H2O的原理是什么?
Ca2+
H+
CH≡CH
CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,写出下列反应的有机产物:
A.ZnC2水解生成 ( )
B.Li2C2水解生成 ( )
C.Mg2C3水解生成( )
D.Al4C3水解生成 ( )
C2H2
CH4
C3H4
C2H2
深化理解
解后反思
碳的阴离子结合水电离H+,形成烃。
乙炔实验室制备
1
1
2
CaC2 +2H2O → CH≡CH↑+ Ca(OH)2
反应原理
电石
反应原料
减小反应速率
3
发生装置
固+液→气
放出大量的热
反应十分剧烈
饱和食盐水
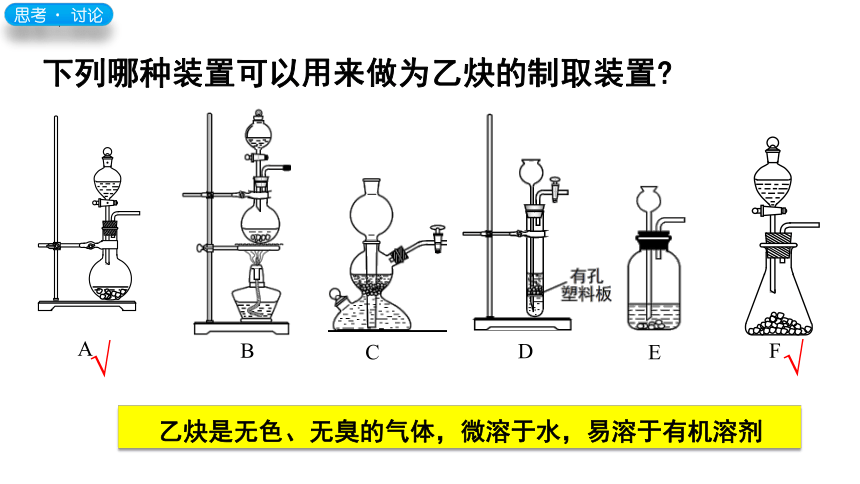
下列哪种装置可以用来做为乙炔的制取装置
C
D
E
F
√
√
A
B
思考﹒ 讨论
乙炔是无色、无臭的气体,微溶于水,易溶于有机溶剂
乙炔实验室制备
1
1
2
3
4
CaC2 +2H2O → CH≡CH↑+ Ca(OH)2
反应原理
电石
饱和食盐水
反应原料
固+液→气
发生装置
排水法
收集装置
减小反应速率
放出大量的热
反应十分剧烈
生成的乙炔有臭味,其原因是——夹杂着 H2S等特殊臭味的气体。
如何除去乙炔中的H2S气体?
可用 CuSO4 溶液或 NaOH 溶液除去杂质气体。
问题探究
CuSO4+H2S=CuS↓+H2SO4
2NaOH+H2S=Na2S↓+H2O
乙炔实验室制备
1
1
2
3
4
5
CaC2 +2H2O → CH≡CH↑+ Ca(OH)2
反应原理
电石、饱和食盐水
反应原料
固+液→气
发生装置
排水法
收集装置
用CuSO4溶液除杂
净化装置
减小反应速率
02
乙炔的分子结构
问题解决
已知乙炔的分子式为C2H2 ,请画出其电子式。
,
乙炔分子结构
2
1
电子式
2
结构式
3
结构简式
×
4
球棍模型与空间填充模型
-
-
-
有一个碳碳三键,其中一个σ键结合较牢固,另两个π键结合不牢固,易断裂。
乙炔分子结构
2
1
电子式
2
3
结构式
结构简式
×
4
5
球棍模型与空间填充模型
碳原子杂化:sp
结构特点
空间构型:直线形
对比乙烷、乙烯、乙炔的结构
烃 乙烷 乙烯 乙炔
分子式
结构简式
结构特点
C2H6 C2H4 C2H2
CH3CH3 CH2=CH2 CH≡CH
碳碳单键
(σ键)
饱和
碳碳双键
(1个σ键、1 个π键)
不饱和
碳碳三键
(1个σ键、两个π键)
不饱和
乙炔和乙烯结构上的相同和不同
相同:都含有不饱和键,都有σ键和π键
归纳与整理
不同:双键中含有一个σ键和一个π键,三键中含有一个σ键和两个π键
03
乙炔的化学性质
孙先辉
观察与思考
C—C >C=C< —C≡C—
键能/kJ·mol-1 348 615 812
碳碳单键、碳碳双键和碳碳三键的键能
请预测炔烃的化学性质
C≡C的键能和键长并不是C-C的三倍,也不是C=C和C—C之和
活泼
三键中有二个键不稳定,容易断裂,有一个键较稳定
类比乙烯的化学性质,推测乙炔的化学性质
不饱和烃 乙烯 乙炔
与O2反应
与酸性KMnO4溶液反应
加成反应 (与H2、Br2、HCl、H2O)
加聚反应
问题探究
问题探究
设计实验证明乙炔的化学性质。
同时产生了许多黑烟
1892年5月4日,美国炼铝厂主威尔森将石灰和煤焦油的混合物放在电炉中加热
期望用煤焦油中的碳还原出石灰中的钙
他将得到的暗黑色的固体放入水中,产生了大量气体
并点燃,结果不是淡蓝色
而是发出明亮的火焰
化学趣史
3.1 氧化反应
乙炔化学性质
3
1
O2
甲烷
乙烯
乙炔
观察与思考
氧炔焰焊接金属
2.1 氧化反应
乙炔化学性质
3
孙先辉
1
O2
2
KMnO4/H+
HC≡CH
CO2
KMnO4+H2SO4 +C2H2→MnSO4+MnSO4+CO2↑+H2O
2KMnO4+3H2SO4 +1C2H2→2MnSO4+1K2SO4+2CO2↑+3H2O
图片来自网络
图片来自网络
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷
总反应 CH≡CH+2Br2 → CHBr2CHBr2
感受﹒ 理解
图片来自网络
图片来自网络
3.2 加成反应
乙炔化学性质
3
X2、H2、HX、H2O
CH≡CH 与 HCl在一定条件下反应,可能的产物有哪些?
请你试一试
CH≡CH+HCl CH2=CHCl
催化剂
CH2=CHCl+HCl CH3CHCl2
催化剂
CH2=CHCl+HCl CH2ClCH2Cl
催化剂
CH3C≡CH 与 HCl在一定条件下以1∶1比例反应时,可能的产物有哪些?
请你试一试
CH3C≡CH+HCl CH3CCl=CH2
催化剂
CH3C≡CH+HCl CH3CH=CHCl
催化剂
请你试一试
写出CH≡CH 与 H2O发生加成反应的化学方程式。
CH≡CH+H2O CH2=CHOH
催化剂
CH≡CH+H2O CH3CHO
催化剂
不稳定
某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
“三键碳原子”加氢后的特点:
-C≡C-+2H2 →
碳碳三键与足量氢气完全反应:
秘诀:掌握“三键碳原子”加氢后的特点
考考你的智慧
每个碳原子至少有2个氢原子
步骤一:写出目标产物(2-甲基戊烷)的结构式
步骤二:从相邻碳原子上各去掉2个H原子
结构要求:相邻的碳原子上,每个碳原子至少有2个氢原子
某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
考考你的智慧
塑料
绝缘!
导电塑料
化学趣史
偶然的发现
一件废品与诺贝尔奖
艾伦教授面对着这一件“废品”,思索片刻后毅然停止了参观,坚持要求面见出“事故”的学生,详细询问了实验的全过程。当他得知这有机银光薄膜还真有些导电性能时,一个灵感的火火花迸发了出来:能不能发明一种能导电的塑料呢?
艾伦教授却独具慧眼,当即邀请白川教授和另一位教授马克迪尔米德到美国支共同研究。他们用先进的设备进行了大量研究试验,并且利用精密电脑记录分析。在经过无数次的失败后,当有一次将微量的碘加入到一种聚乙炔时(这是非常困难的),奇迹发生了,银光塑料的导电性能一下子提高了千万倍,真正成为了金属般的导电塑料。这一成果公布后,在全世界引起了巨大的反响,三位科学家共同获得了诺贝尔化学奖。
陪同的白川教授不以为然地说:“那是一件废品!”白川教授并介绍,这是一个外国留学生做高分子聚合实验时,由于没有听清楚要求而产生出这种莫名其妙的废品。白川教授把它展示在实验室的角落里已经5年,作为不按照导师要求而发生“事故”的见证。
1975年,美国费城的艾伦教授到日本访问,当他参观东京技术学院时,在一个实验室的角落里,看见一种奇异的薄膜,又像塑料但又闪着金属的银光。于是,艾伦教授停下来好奇地询问。
化学领域没有废物可言,
只要你肯探索和发现!
化学趣史
导电塑料发现史
图片来自网络
获2000年诺贝尔化学奖科学家
3.3 加聚反应
乙炔化学性质
3
孙先辉
04
炔烃的结构
炔烃
4
孙先辉
碳碳三键(-C≡C-)
官能团
结构特点
炔烃中含有和键,碳原子的杂化方式为sp3和sp
通式
CnH2n-2(n≥2)
物理性质
随碳原子数的增加,沸点逐渐升高,相对密度逐渐增大
(与烷烃和烯烃类似)
化学性质
氧化反应 加成反应 加聚反应
HC≡CH
CO2
RC≡CH
RCOOH+CO2
05
炔烃的同分异构体
请写出戊炔所有属于炔烃的同分异构体的结构简式。
请你试一试
秘诀:“思维有序”
碳架异构→官能团位置异构
步骤一:写出含5个碳原子的碳骨架的碳架异构
步骤二:确定碳碳三键可能的位置
↓
↓
2种
CH≡C-CH2-CH2-CH3
CH3-C≡C-CH2-CH3
↓
1种
无
步骤三:在碳骨架上补氢(满足“碳四价”)
同分异构体
5
孙先辉
构造异构
碳架异构
碳骨架不同
位置异构
官能团的位置架不同
官能团异构
官能团不同
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
四个原子共线
官能团
制备
CaC2 +2H2O → CH≡CH↑+ Ca(OH)2
用乙炔原料制取CH2Br-CHBrCl,可行的反应途径是
A. 先加Cl2,再加Br2
B. 先加Cl2,再加HBr
C. 先加HCl,再加HBr
D. 先加HCl,再加Br2
考考你自己
为含一个三键的炔烃氢化后的产物,则此炔烃可能有的结构有
A.1种 B.2种
C.3种 D.4种
考考你自己
某烃与溴的四氯化碳溶液反应生成 CHBr2CBr2CH2CH3,则下列物质与该烃属于不同类别的同分异构体的是
A.CH≡CCH2CH3
B.CH3C≡CH
C.CH3CH2CH=CH2
D.CH2=CH—CH=CH2
解析:由生成物的结构简式可知,该烃的结构简式为CH≡CCH2CH3,则与该烃属于不同类别的同分异构体的物质不再是炔烃,可能是二烯烃,选D项。
看我七十二变
某0.5 mol恰好与1 mol HCl加成,1mol生成物又可与6 molCl2发生取代反应,则此烃可能是
A. C2H2
B. CH2=CHCH=CH2
C. CH≡C-CH3
D. CH≡C-CH2-CH3
CxHy
1 mol
2 mol HCl
CxHy+2Cl2
6 mol Cl2
y+2=6
挑战自我
根据碳碳单键、双键和三键的结构特征推测,化合物
CH3-CH=CH-C≡C-CH3分子中位于同一平面内的碳原子最多有______个。
考考你的智慧
秘诀一 牢记典型分子的空间结构
典型分子 CH4 CH2=CH2 CH≡CH
空间结构
球棍模型
原子共面共线情况
正四面体形
平面形
直线形
有且只有3个原子共平面
6个原子共平面
4个原子共直线
秘诀二 将典型分子拓展
即氢原子部分或全部被其他原子或原子团替换
烃 烷烃 烯烃 炔烃
球棍模型
碳原子共面共线情况
5个碳原子构成正四面体,有且只有3个碳原子共平面
4个碳原子共平面
4个碳原子共直线
根据碳碳单键、双键和三键的结构特征推测,化合物
CH3-CH=CH-C≡C-CH3分子中位于同一平面内的碳原子最多有______个。
考考你的智慧
6
谁和我一样用功,谁就会和我一样成功。
——莫扎特
问题探究
去掉2个H原子
去掉2个H原子
乙炔与炔烃
05
04
03
02
01
炔烃
乙炔制备
学习目标
Learning Objectives
原理 原料
制备、收集及处理装置
乙炔结构
杂化 结构式 结构简式
球棍模型 空间填充模型
乙炔化学性质
氧化反应 加成反应 加聚反应
炔烃
概念 通式 化学性质
炔烃同分异构体
碳链异构
位置异构
官能团异构
1836年,英国皇家学院化学教授戴维·爱德蒙德在加热木炭和碳酸钾以制取金属钾过程中,将残渣(碳化钾)投进水中,产生一种气体,这一气体经研究是乙炔。
K2C+2H2O→C2H2↑+2KOH
化学趣史
乙炔发现史
01
乙炔的实验室制法
碳化钙
俗称:电石
英文名:Calcium Carbide
商品编号:28491000
CAS NO.:75-20-7
分子式:CaC2
物化性状:工业品是灰色,黄褐色或黑色固体,含碳化钙较高的呈紫色,比重2.22(18℃),熔点2300℃。
资料在线
碳化钙为何叫电石
CaCO3 CaO+CO2↑
高温
以焦炭、CaO为原料,在电弧炉中,高温下反应
2 500℃
CaO+3C CaC2+CO↑
乙炔实验室制备
1
1
CaC2 +2H2O → CH≡CH↑+ Ca(OH)2
反应原理
放出大量的热
反应十分剧烈
问题探究
CaC2 +2H2O → CH≡CH↑+ Ca(OH)2
CaC2 由何种粒子构成
Ca2+
C22-
写出CaC2 的电子式。
Ca2+
CaC2 与H2O的原理是什么?
Ca2+
H+
CH≡CH
CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,写出下列反应的有机产物:
A.ZnC2水解生成 ( )
B.Li2C2水解生成 ( )
C.Mg2C3水解生成( )
D.Al4C3水解生成 ( )
C2H2
CH4
C3H4
C2H2
深化理解
解后反思
碳的阴离子结合水电离H+,形成烃。
乙炔实验室制备
1
1
2
CaC2 +2H2O → CH≡CH↑+ Ca(OH)2
反应原理
电石
反应原料
减小反应速率
3
发生装置
固+液→气
放出大量的热
反应十分剧烈
饱和食盐水
下列哪种装置可以用来做为乙炔的制取装置
C
D
E
F
√
√
A
B
思考﹒ 讨论
乙炔是无色、无臭的气体,微溶于水,易溶于有机溶剂
乙炔实验室制备
1
1
2
3
4
CaC2 +2H2O → CH≡CH↑+ Ca(OH)2
反应原理
电石
饱和食盐水
反应原料
固+液→气
发生装置
排水法
收集装置
减小反应速率
放出大量的热
反应十分剧烈
生成的乙炔有臭味,其原因是——夹杂着 H2S等特殊臭味的气体。
如何除去乙炔中的H2S气体?
可用 CuSO4 溶液或 NaOH 溶液除去杂质气体。
问题探究
CuSO4+H2S=CuS↓+H2SO4
2NaOH+H2S=Na2S↓+H2O
乙炔实验室制备
1
1
2
3
4
5
CaC2 +2H2O → CH≡CH↑+ Ca(OH)2
反应原理
电石、饱和食盐水
反应原料
固+液→气
发生装置
排水法
收集装置
用CuSO4溶液除杂
净化装置
减小反应速率
02
乙炔的分子结构
问题解决
已知乙炔的分子式为C2H2 ,请画出其电子式。
,
乙炔分子结构
2
1
电子式
2
结构式
3
结构简式
×
4
球棍模型与空间填充模型
-
-
-
有一个碳碳三键,其中一个σ键结合较牢固,另两个π键结合不牢固,易断裂。
乙炔分子结构
2
1
电子式
2
3
结构式
结构简式
×
4
5
球棍模型与空间填充模型
碳原子杂化:sp
结构特点
空间构型:直线形
对比乙烷、乙烯、乙炔的结构
烃 乙烷 乙烯 乙炔
分子式
结构简式
结构特点
C2H6 C2H4 C2H2
CH3CH3 CH2=CH2 CH≡CH
碳碳单键
(σ键)
饱和
碳碳双键
(1个σ键、1 个π键)
不饱和
碳碳三键
(1个σ键、两个π键)
不饱和
乙炔和乙烯结构上的相同和不同
相同:都含有不饱和键,都有σ键和π键
归纳与整理
不同:双键中含有一个σ键和一个π键,三键中含有一个σ键和两个π键
03
乙炔的化学性质
孙先辉
观察与思考
C—C >C=C< —C≡C—
键能/kJ·mol-1 348 615 812
碳碳单键、碳碳双键和碳碳三键的键能
请预测炔烃的化学性质
C≡C的键能和键长并不是C-C的三倍,也不是C=C和C—C之和
活泼
三键中有二个键不稳定,容易断裂,有一个键较稳定
类比乙烯的化学性质,推测乙炔的化学性质
不饱和烃 乙烯 乙炔
与O2反应
与酸性KMnO4溶液反应
加成反应 (与H2、Br2、HCl、H2O)
加聚反应
问题探究
问题探究
设计实验证明乙炔的化学性质。
同时产生了许多黑烟
1892年5月4日,美国炼铝厂主威尔森将石灰和煤焦油的混合物放在电炉中加热
期望用煤焦油中的碳还原出石灰中的钙
他将得到的暗黑色的固体放入水中,产生了大量气体
并点燃,结果不是淡蓝色
而是发出明亮的火焰
化学趣史
3.1 氧化反应
乙炔化学性质
3
1
O2
甲烷
乙烯
乙炔
观察与思考
氧炔焰焊接金属
2.1 氧化反应
乙炔化学性质
3
孙先辉
1
O2
2
KMnO4/H+
HC≡CH
CO2
KMnO4+H2SO4 +C2H2→MnSO4+MnSO4+CO2↑+H2O
2KMnO4+3H2SO4 +1C2H2→2MnSO4+1K2SO4+2CO2↑+3H2O
图片来自网络
图片来自网络
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷
总反应 CH≡CH+2Br2 → CHBr2CHBr2
感受﹒ 理解
图片来自网络
图片来自网络
3.2 加成反应
乙炔化学性质
3
X2、H2、HX、H2O
CH≡CH 与 HCl在一定条件下反应,可能的产物有哪些?
请你试一试
CH≡CH+HCl CH2=CHCl
催化剂
CH2=CHCl+HCl CH3CHCl2
催化剂
CH2=CHCl+HCl CH2ClCH2Cl
催化剂
CH3C≡CH 与 HCl在一定条件下以1∶1比例反应时,可能的产物有哪些?
请你试一试
CH3C≡CH+HCl CH3CCl=CH2
催化剂
CH3C≡CH+HCl CH3CH=CHCl
催化剂
请你试一试
写出CH≡CH 与 H2O发生加成反应的化学方程式。
CH≡CH+H2O CH2=CHOH
催化剂
CH≡CH+H2O CH3CHO
催化剂
不稳定
某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
“三键碳原子”加氢后的特点:
-C≡C-+2H2 →
碳碳三键与足量氢气完全反应:
秘诀:掌握“三键碳原子”加氢后的特点
考考你的智慧
每个碳原子至少有2个氢原子
步骤一:写出目标产物(2-甲基戊烷)的结构式
步骤二:从相邻碳原子上各去掉2个H原子
结构要求:相邻的碳原子上,每个碳原子至少有2个氢原子
某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
考考你的智慧
塑料
绝缘!
导电塑料
化学趣史
偶然的发现
一件废品与诺贝尔奖
艾伦教授面对着这一件“废品”,思索片刻后毅然停止了参观,坚持要求面见出“事故”的学生,详细询问了实验的全过程。当他得知这有机银光薄膜还真有些导电性能时,一个灵感的火火花迸发了出来:能不能发明一种能导电的塑料呢?
艾伦教授却独具慧眼,当即邀请白川教授和另一位教授马克迪尔米德到美国支共同研究。他们用先进的设备进行了大量研究试验,并且利用精密电脑记录分析。在经过无数次的失败后,当有一次将微量的碘加入到一种聚乙炔时(这是非常困难的),奇迹发生了,银光塑料的导电性能一下子提高了千万倍,真正成为了金属般的导电塑料。这一成果公布后,在全世界引起了巨大的反响,三位科学家共同获得了诺贝尔化学奖。
陪同的白川教授不以为然地说:“那是一件废品!”白川教授并介绍,这是一个外国留学生做高分子聚合实验时,由于没有听清楚要求而产生出这种莫名其妙的废品。白川教授把它展示在实验室的角落里已经5年,作为不按照导师要求而发生“事故”的见证。
1975年,美国费城的艾伦教授到日本访问,当他参观东京技术学院时,在一个实验室的角落里,看见一种奇异的薄膜,又像塑料但又闪着金属的银光。于是,艾伦教授停下来好奇地询问。
化学领域没有废物可言,
只要你肯探索和发现!
化学趣史
导电塑料发现史
图片来自网络
获2000年诺贝尔化学奖科学家
3.3 加聚反应
乙炔化学性质
3
孙先辉
04
炔烃的结构
炔烃
4
孙先辉
碳碳三键(-C≡C-)
官能团
结构特点
炔烃中含有和键,碳原子的杂化方式为sp3和sp
通式
CnH2n-2(n≥2)
物理性质
随碳原子数的增加,沸点逐渐升高,相对密度逐渐增大
(与烷烃和烯烃类似)
化学性质
氧化反应 加成反应 加聚反应
HC≡CH
CO2
RC≡CH
RCOOH+CO2
05
炔烃的同分异构体
请写出戊炔所有属于炔烃的同分异构体的结构简式。
请你试一试
秘诀:“思维有序”
碳架异构→官能团位置异构
步骤一:写出含5个碳原子的碳骨架的碳架异构
步骤二:确定碳碳三键可能的位置
↓
↓
2种
CH≡C-CH2-CH2-CH3
CH3-C≡C-CH2-CH3
↓
1种
无
步骤三:在碳骨架上补氢(满足“碳四价”)
同分异构体
5
孙先辉
构造异构
碳架异构
碳骨架不同
位置异构
官能团的位置架不同
官能团异构
官能团不同
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
四个原子共线
官能团
制备
CaC2 +2H2O → CH≡CH↑+ Ca(OH)2
用乙炔原料制取CH2Br-CHBrCl,可行的反应途径是
A. 先加Cl2,再加Br2
B. 先加Cl2,再加HBr
C. 先加HCl,再加HBr
D. 先加HCl,再加Br2
考考你自己
为含一个三键的炔烃氢化后的产物,则此炔烃可能有的结构有
A.1种 B.2种
C.3种 D.4种
考考你自己
某烃与溴的四氯化碳溶液反应生成 CHBr2CBr2CH2CH3,则下列物质与该烃属于不同类别的同分异构体的是
A.CH≡CCH2CH3
B.CH3C≡CH
C.CH3CH2CH=CH2
D.CH2=CH—CH=CH2
解析:由生成物的结构简式可知,该烃的结构简式为CH≡CCH2CH3,则与该烃属于不同类别的同分异构体的物质不再是炔烃,可能是二烯烃,选D项。
看我七十二变
某0.5 mol恰好与1 mol HCl加成,1mol生成物又可与6 molCl2发生取代反应,则此烃可能是
A. C2H2
B. CH2=CHCH=CH2
C. CH≡C-CH3
D. CH≡C-CH2-CH3
CxHy
1 mol
2 mol HCl
CxHy+2Cl2
6 mol Cl2
y+2=6
挑战自我
根据碳碳单键、双键和三键的结构特征推测,化合物
CH3-CH=CH-C≡C-CH3分子中位于同一平面内的碳原子最多有______个。
考考你的智慧
秘诀一 牢记典型分子的空间结构
典型分子 CH4 CH2=CH2 CH≡CH
空间结构
球棍模型
原子共面共线情况
正四面体形
平面形
直线形
有且只有3个原子共平面
6个原子共平面
4个原子共直线
秘诀二 将典型分子拓展
即氢原子部分或全部被其他原子或原子团替换
烃 烷烃 烯烃 炔烃
球棍模型
碳原子共面共线情况
5个碳原子构成正四面体,有且只有3个碳原子共平面
4个碳原子共平面
4个碳原子共直线
根据碳碳单键、双键和三键的结构特征推测,化合物
CH3-CH=CH-C≡C-CH3分子中位于同一平面内的碳原子最多有______个。
考考你的智慧
6
