广东省茂名市化州市2023-2024学年高一上学期1月期末化学试题(无答案)
文档属性
| 名称 | 广东省茂名市化州市2023-2024学年高一上学期1月期末化学试题(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1003.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-22 16:36:54 | ||
图片预览


文档简介
2023—2024学年度第一学期期末教学质量监测
高中一年级化学试卷
说明:1.本试卷分为第Ⅰ卷和第Ⅱ卷(8页),答题卡(4页),共12页。
2.考试时间为75分钟,全卷满分100分。
3.考试开始前先在答题卡上填上学校,姓名、准考证号等相应的内容。
4.从第Ⅰ卷各小题答案选项中选择正确的答案编号涂写在答题卡相应位置上,答在试卷上无效;第Ⅱ卷必须用黑色钢笔或签字笔答在答题卡上,
5.可能用到的相对原子质量:H-1 O-16 C-12 N-14 Na-23 Mg-24 S-32 Cl-35.5 K-39 Ca-40 Mn-55 Fe-56
第Ⅰ卷
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项符合题目要求。
1.我国很多珍贵文物都记载着中华文明的灿烂成就,下列文物主要由合金材料制成的是( )
A.马踏飞燕 B.曜变天目茶碗
C.甲骨文 D.千里江山图
2.硫磺固体属于危险品,其运载交通工具上应贴的标识为( )
A.易燃固体 B.氧化剂
C.爆炸品 D.腐蚀品
3.目前,科学家发现在负压和超低温条件下,可将水在空气中形成像棉花糖一样的气凝胶的冰,该冰称为“气态冰”。下列说法正确的是( )
A.“常态冰”和“气态冰”结构不同,是同素异形体
B.“气态冰”因其特殊的结构而具有比“常态冰”更活泼的化学性质
C.“气态冰”具有丁达尔效应
D.改变温度使“气态冰”变成液态水时会破坏水分子内的共价键
4.月球土壤中含有Th(钍)元素,是一种天然的放射性核素。2022年,我国科研团队采用和(铪)熔合蒸发技术合成了新核素,下列说法不正确的是( )
A.、互为同位素 B.、分别含有142个和117个中子
C.化学性质不活泼 D.含有176个质子
5.下列化学用语正确的是( )
A.分子的结构式: B.的电离方程式:
C.KCl形成过程: D.还原CuO反应中电子的转移:
6.化学创造美好生活,下列化学知识解释对应生产生活情景不正确的是( )
选项 生产生活情景 化学知识
A 月饼的包装袋内加入一小袋铁粉 铁粉能与氧气反应,作为脱氧剂
B 紫菜食品袋内常装有小袋生石灰 生石灰可以和水反应,常用作干燥剂
C 用漂白粉漂白棉、麻、纸张 具有强氧化性
D 用氧化铁作涂料 是碱性氧化物
A.A B.B C.C D.D
7.数字化实验是利用传感器和信息处理终端进行数据采集与分析的实验手段。下图是利用数字化实验测定光照氯水过程中得到的图像,该图像表示的意义是( )
A.氯离子浓度随时间的变化 B.氧气体积分数随时间的变化
C.氯水的pH随时间的变化 D.氯水导电能力随时间的变化
8.在无色透明的强酸性溶液中能大量共存的离子组是( )
A.、、、 B.、、、
C.、、、 D.、、、
9.“类比推理”是化学中常用的思维方法。下列推理正确的是( )
A.能与HI发生置换反应,推测也能与HI发生置换反应
B.Fe和反应生成,推测Fe与反应生成
C.与水反应生成HCl和HClO,推测与水反应生成HF和HFO
D.Na保存在煤油中,推测Li也可保存中煤油中
10.2022年北京冬奥会上,我国短道速滑队所用冰刀材料是特殊的钢材料。下列说法中正确的是( )
A.该合金熔点比纯铁熔点高 B.该合金硬度比纯铁高
C.该合金碳含量比生铁高 D.该合金是化合物
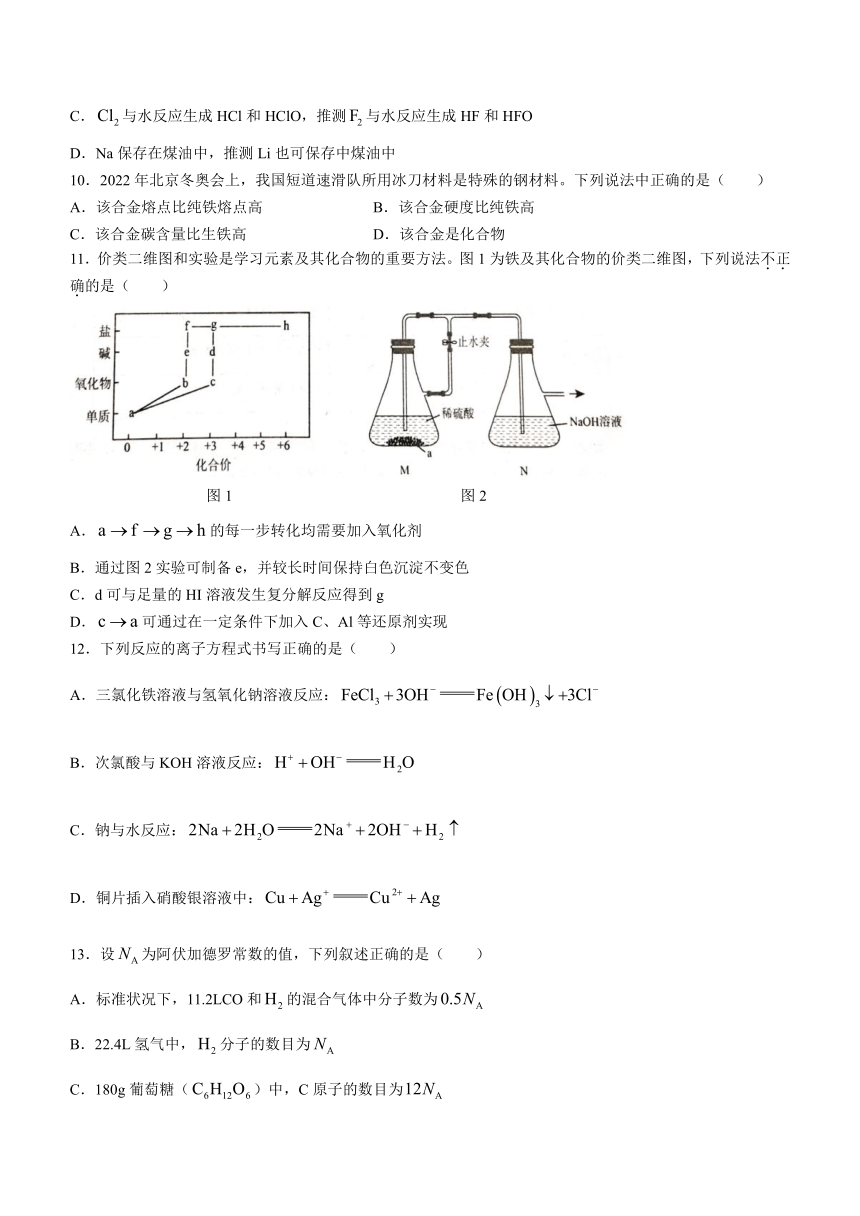
11.价类二维图和实验是学习元素及其化合物的重要方法。图1为铁及其化合物的价类二维图,下列说法不正确的是( )
图1 图2
A.的每一步转化均需要加入氧化剂
B.通过图2实验可制备e,并较长时间保持白色沉淀不变色
C.d可与足量的HI溶液发生复分解反应得到g
D.可通过在一定条件下加入C、Al等还原剂实现
12.下列反应的离子方程式书写正确的是( )
A.三氯化铁溶液与氢氧化钠溶液反应:
B.次氯酸与KOH溶液反应:
C.钠与水反应:
D.铜片插入硝酸银溶液中:
13.设为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,11.2LCO和的混合气体中分子数为
B.22.4L氢气中,分子的数目为
C.180g葡萄糖()中,C原子的数目为
D.溶液中,HCl分子的数目为
14.“天宫课堂”中,太空教师王亚平利用化学变化“变”出了奥运五环,其中一个环是由乙酸、KI、与淀粉溶液混合反应后变成的,涉及生成的反应为(未配平)。下列说法不正确的是( )
A.该环的颜色为蓝色 B.乙酸的作用是提供
C.在反应中做氧化剂 D.n(氧化产物):n(还原产物)=1:5
15.下列实验能够达到相应目的的是( )
A B C D
将饱和溶液滴入热NaOH溶液中制备氢氧化铁胶体 B装置用于配制一定物质的量浓度的NaOH溶液 C装置可用于固体碳酸氢钠加热分解 D装置可用于比较碳酸钠和碳酸氢钠的热稳定性
A.A B.B C.C D.D
16.下列实验目的、操作、现象及结论合理的是( )
实验目的 实验操作 现象及结论
A 检验CO还原的生成物中是否含有 取反应后的固体溶于稀盐酸,滴加NaOH溶液 若有红褐色沉淀生成,则还原产物中含有
B 比较和氧化性强弱 向溶液中滴加淀粉碘化钾溶液 若溶液变蓝色,则氧化性:
C 检验溶液中是否含有 向溶液中滴加酸性溶液 若紫红色退去,则溶液中含有
D 检验溶液中是否含有 取少量溶液于试管中,滴加稀盐酸 若产生的气体能使澄清石灰水变浑浊,则溶液中含有
A.A B.B C.C D.D
第Ⅱ卷
二、非选择题:本题共4小题,共56分。
17.(14分)某实验兴趣小组想在实验室用纯净的氯气和铁粉反应制取少量氯化铁固体,他们查阅资料得知是一种易潮解、易升华的物质,决定采取如下图的实验装置进行实验:
(1)仪器a使用前应该先__________。
(2)装置A烧瓶中发生反应的离子方程式是______________________________。
(3)装置C中盛放的试剂是__________,装置E的作用是______________________________。
(4)实验时,A、D两处中的酒精灯应先点燃__________(填“A”或“D”)处的酒精灯,理由是______________________________。
(5)准备开始实验时,一位组员提出这套装置设计还不完善,应该在最后加一个盛有NaOH溶液的气体吸收装置,请用化学方程式解析这个吸收装置的作用______________________________。
18.(14分)元素周期表是学习物质结构和性质的重要工具,下表是元素周期表的一部分,表中的每个编号代表一种元素。请根据要求回答问题:
(1)⑤元素在周期表中的位置是__________。
(2)②元素的单质的电子式是__________。
(3)③、④两种元素形成的淡黄色固体可在潜艇中作为氧气来源,其存在的化学键类型有__________,写出该固体在潜艇中供氧时发生的任意一个化学方程式______________________________。
(4)写出⑤的单质与氢氧化钠溶液反应的化学方程式:______________________________。
(5)元素③、⑥的简单氢化物稳定性比较:__________(用化学式)
(6)下列说法正确的是__________(填序号)。
A.元素④、⑤、⑨形成的简单离子,半径最小的是④形成的离子
B.由①、③、④三种元素一起形成的化合物含有共价键,属于共价化合物
C.⑧元素的单质与水反应比⑨元素的单质与水反应要激烈
D.⑥、⑦最高价氧化物对应的水化物中⑥对应的酸性更强
E.若要寻找高效催化剂可以考虑从上图区域的元素寻找
19.(14分)工业上以铝土矿(主要成分为,含少量、FeO、等杂质)为主要原料制备氧化铝,流程如下。
(1)酸浸:用稍过量的稀硫酸酸浸后溶液中存在的阳离子有__________。
(2)用溶液浸取铝土矿中的铝元素和铁元素,溶液的用量不宜过量太多,其原因是______________________________。
(3)氧化:溶液的作用是将二价铁转化为三价铁,反应的离子方程式为______________________________。
(4)沉淀:用溶液调节pH,将Al元素和Fc元素转化为沉淀析出。溶液中的pH对铝、铁沉淀率的影响如图所示。
①为获得较高的铝、铁沉淀率,应控制溶液pH为__________。
②检验沉淀完全的操作为______________________________。
(5)碱溶:用NaOH溶液溶解沉淀,分离出。下列措施中能提高单位时间内铝元素浸出率的有__________(填序号)。
A.适当增大NaOH溶液浓度
B.适当加快搅拌速率
C.适当降低温度
(6)碳分:“碱溶”后的溶液中Al元素主要以形式存在,通入足量气体,目的是使Al元素沉淀析出,该反应的离子方程式为______________________________。
20.(14分)在新型冠状病毒爆发期间,“84消毒液”发挥了重要作用。某同学购买了某品牌“84消毒液”,该消毒液通常稀释100倍(体积比)使用。查阅相关资料和消毒液包装说明,得到如下信息:
84消毒液 【有效成分】NaClO 【规格】1000mL 【质量分数】25% 【密度】
(1)该“84消毒液”溶液中__________。(结果保留2位小数)
(2)下列说法不正确的是__________。
A.“84消毒液”的有效成分是NaClO
B.“洁厕灵”(主要成分为盐酸)与“84消毒液”混用效果更好
C.“84消毒液”与酒精消毒液的消毒原理相同
D.盛装“84消毒液”的瓶子瓶盖忘盖,长时间后可能失效
(3)该同学参阅该“84消毒液”的配方,款用NaClO固体配制的消毒液。下列说法不正确的是__________。
A.如图所示的仪器在配制溶液时均需要使用
B.将称量好的NaClO固体在烧杯中溶解后应立即转入容量瓶中
C.定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量NaClO固体的质量为149.0g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,该反应的化学方程式为______________________________,某消毒小组人员用18.4mol/L的浓硫酸配制500mL2.5mol/L的稀硫酸用于增强“84消毒液”的消毒能力,需取用浓硫酸的体积为__________mL(结果保留1位小数),在配制过程中,下列操作中能使所配溶液的浓度偏高的有__________(填代号)。
①用量筒量取98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
(5)2016巴西奥运会期间,由于工作人员将“84消毒液”与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与反应产生促进藻类快速生长,该反应的离子方程式为______________________________。
高中一年级化学试卷
说明:1.本试卷分为第Ⅰ卷和第Ⅱ卷(8页),答题卡(4页),共12页。
2.考试时间为75分钟,全卷满分100分。
3.考试开始前先在答题卡上填上学校,姓名、准考证号等相应的内容。
4.从第Ⅰ卷各小题答案选项中选择正确的答案编号涂写在答题卡相应位置上,答在试卷上无效;第Ⅱ卷必须用黑色钢笔或签字笔答在答题卡上,
5.可能用到的相对原子质量:H-1 O-16 C-12 N-14 Na-23 Mg-24 S-32 Cl-35.5 K-39 Ca-40 Mn-55 Fe-56
第Ⅰ卷
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项符合题目要求。
1.我国很多珍贵文物都记载着中华文明的灿烂成就,下列文物主要由合金材料制成的是( )
A.马踏飞燕 B.曜变天目茶碗
C.甲骨文 D.千里江山图
2.硫磺固体属于危险品,其运载交通工具上应贴的标识为( )
A.易燃固体 B.氧化剂
C.爆炸品 D.腐蚀品
3.目前,科学家发现在负压和超低温条件下,可将水在空气中形成像棉花糖一样的气凝胶的冰,该冰称为“气态冰”。下列说法正确的是( )
A.“常态冰”和“气态冰”结构不同,是同素异形体
B.“气态冰”因其特殊的结构而具有比“常态冰”更活泼的化学性质
C.“气态冰”具有丁达尔效应
D.改变温度使“气态冰”变成液态水时会破坏水分子内的共价键
4.月球土壤中含有Th(钍)元素,是一种天然的放射性核素。2022年,我国科研团队采用和(铪)熔合蒸发技术合成了新核素,下列说法不正确的是( )
A.、互为同位素 B.、分别含有142个和117个中子
C.化学性质不活泼 D.含有176个质子
5.下列化学用语正确的是( )
A.分子的结构式: B.的电离方程式:
C.KCl形成过程: D.还原CuO反应中电子的转移:
6.化学创造美好生活,下列化学知识解释对应生产生活情景不正确的是( )
选项 生产生活情景 化学知识
A 月饼的包装袋内加入一小袋铁粉 铁粉能与氧气反应,作为脱氧剂
B 紫菜食品袋内常装有小袋生石灰 生石灰可以和水反应,常用作干燥剂
C 用漂白粉漂白棉、麻、纸张 具有强氧化性
D 用氧化铁作涂料 是碱性氧化物
A.A B.B C.C D.D
7.数字化实验是利用传感器和信息处理终端进行数据采集与分析的实验手段。下图是利用数字化实验测定光照氯水过程中得到的图像,该图像表示的意义是( )
A.氯离子浓度随时间的变化 B.氧气体积分数随时间的变化
C.氯水的pH随时间的变化 D.氯水导电能力随时间的变化
8.在无色透明的强酸性溶液中能大量共存的离子组是( )
A.、、、 B.、、、
C.、、、 D.、、、
9.“类比推理”是化学中常用的思维方法。下列推理正确的是( )
A.能与HI发生置换反应,推测也能与HI发生置换反应
B.Fe和反应生成,推测Fe与反应生成
C.与水反应生成HCl和HClO,推测与水反应生成HF和HFO
D.Na保存在煤油中,推测Li也可保存中煤油中
10.2022年北京冬奥会上,我国短道速滑队所用冰刀材料是特殊的钢材料。下列说法中正确的是( )
A.该合金熔点比纯铁熔点高 B.该合金硬度比纯铁高
C.该合金碳含量比生铁高 D.该合金是化合物
11.价类二维图和实验是学习元素及其化合物的重要方法。图1为铁及其化合物的价类二维图,下列说法不正确的是( )
图1 图2
A.的每一步转化均需要加入氧化剂
B.通过图2实验可制备e,并较长时间保持白色沉淀不变色
C.d可与足量的HI溶液发生复分解反应得到g
D.可通过在一定条件下加入C、Al等还原剂实现
12.下列反应的离子方程式书写正确的是( )
A.三氯化铁溶液与氢氧化钠溶液反应:
B.次氯酸与KOH溶液反应:
C.钠与水反应:
D.铜片插入硝酸银溶液中:
13.设为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,11.2LCO和的混合气体中分子数为
B.22.4L氢气中,分子的数目为
C.180g葡萄糖()中,C原子的数目为
D.溶液中,HCl分子的数目为
14.“天宫课堂”中,太空教师王亚平利用化学变化“变”出了奥运五环,其中一个环是由乙酸、KI、与淀粉溶液混合反应后变成的,涉及生成的反应为(未配平)。下列说法不正确的是( )
A.该环的颜色为蓝色 B.乙酸的作用是提供
C.在反应中做氧化剂 D.n(氧化产物):n(还原产物)=1:5
15.下列实验能够达到相应目的的是( )
A B C D
将饱和溶液滴入热NaOH溶液中制备氢氧化铁胶体 B装置用于配制一定物质的量浓度的NaOH溶液 C装置可用于固体碳酸氢钠加热分解 D装置可用于比较碳酸钠和碳酸氢钠的热稳定性
A.A B.B C.C D.D
16.下列实验目的、操作、现象及结论合理的是( )
实验目的 实验操作 现象及结论
A 检验CO还原的生成物中是否含有 取反应后的固体溶于稀盐酸,滴加NaOH溶液 若有红褐色沉淀生成,则还原产物中含有
B 比较和氧化性强弱 向溶液中滴加淀粉碘化钾溶液 若溶液变蓝色,则氧化性:
C 检验溶液中是否含有 向溶液中滴加酸性溶液 若紫红色退去,则溶液中含有
D 检验溶液中是否含有 取少量溶液于试管中,滴加稀盐酸 若产生的气体能使澄清石灰水变浑浊,则溶液中含有
A.A B.B C.C D.D
第Ⅱ卷
二、非选择题:本题共4小题,共56分。
17.(14分)某实验兴趣小组想在实验室用纯净的氯气和铁粉反应制取少量氯化铁固体,他们查阅资料得知是一种易潮解、易升华的物质,决定采取如下图的实验装置进行实验:
(1)仪器a使用前应该先__________。
(2)装置A烧瓶中发生反应的离子方程式是______________________________。
(3)装置C中盛放的试剂是__________,装置E的作用是______________________________。
(4)实验时,A、D两处中的酒精灯应先点燃__________(填“A”或“D”)处的酒精灯,理由是______________________________。
(5)准备开始实验时,一位组员提出这套装置设计还不完善,应该在最后加一个盛有NaOH溶液的气体吸收装置,请用化学方程式解析这个吸收装置的作用______________________________。
18.(14分)元素周期表是学习物质结构和性质的重要工具,下表是元素周期表的一部分,表中的每个编号代表一种元素。请根据要求回答问题:
(1)⑤元素在周期表中的位置是__________。
(2)②元素的单质的电子式是__________。
(3)③、④两种元素形成的淡黄色固体可在潜艇中作为氧气来源,其存在的化学键类型有__________,写出该固体在潜艇中供氧时发生的任意一个化学方程式______________________________。
(4)写出⑤的单质与氢氧化钠溶液反应的化学方程式:______________________________。
(5)元素③、⑥的简单氢化物稳定性比较:__________(用化学式)
(6)下列说法正确的是__________(填序号)。
A.元素④、⑤、⑨形成的简单离子,半径最小的是④形成的离子
B.由①、③、④三种元素一起形成的化合物含有共价键,属于共价化合物
C.⑧元素的单质与水反应比⑨元素的单质与水反应要激烈
D.⑥、⑦最高价氧化物对应的水化物中⑥对应的酸性更强
E.若要寻找高效催化剂可以考虑从上图区域的元素寻找
19.(14分)工业上以铝土矿(主要成分为,含少量、FeO、等杂质)为主要原料制备氧化铝,流程如下。
(1)酸浸:用稍过量的稀硫酸酸浸后溶液中存在的阳离子有__________。
(2)用溶液浸取铝土矿中的铝元素和铁元素,溶液的用量不宜过量太多,其原因是______________________________。
(3)氧化:溶液的作用是将二价铁转化为三价铁,反应的离子方程式为______________________________。
(4)沉淀:用溶液调节pH,将Al元素和Fc元素转化为沉淀析出。溶液中的pH对铝、铁沉淀率的影响如图所示。
①为获得较高的铝、铁沉淀率,应控制溶液pH为__________。
②检验沉淀完全的操作为______________________________。
(5)碱溶:用NaOH溶液溶解沉淀,分离出。下列措施中能提高单位时间内铝元素浸出率的有__________(填序号)。
A.适当增大NaOH溶液浓度
B.适当加快搅拌速率
C.适当降低温度
(6)碳分:“碱溶”后的溶液中Al元素主要以形式存在,通入足量气体,目的是使Al元素沉淀析出,该反应的离子方程式为______________________________。
20.(14分)在新型冠状病毒爆发期间,“84消毒液”发挥了重要作用。某同学购买了某品牌“84消毒液”,该消毒液通常稀释100倍(体积比)使用。查阅相关资料和消毒液包装说明,得到如下信息:
84消毒液 【有效成分】NaClO 【规格】1000mL 【质量分数】25% 【密度】
(1)该“84消毒液”溶液中__________。(结果保留2位小数)
(2)下列说法不正确的是__________。
A.“84消毒液”的有效成分是NaClO
B.“洁厕灵”(主要成分为盐酸)与“84消毒液”混用效果更好
C.“84消毒液”与酒精消毒液的消毒原理相同
D.盛装“84消毒液”的瓶子瓶盖忘盖,长时间后可能失效
(3)该同学参阅该“84消毒液”的配方,款用NaClO固体配制的消毒液。下列说法不正确的是__________。
A.如图所示的仪器在配制溶液时均需要使用
B.将称量好的NaClO固体在烧杯中溶解后应立即转入容量瓶中
C.定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量NaClO固体的质量为149.0g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,该反应的化学方程式为______________________________,某消毒小组人员用18.4mol/L的浓硫酸配制500mL2.5mol/L的稀硫酸用于增强“84消毒液”的消毒能力,需取用浓硫酸的体积为__________mL(结果保留1位小数),在配制过程中,下列操作中能使所配溶液的浓度偏高的有__________(填代号)。
①用量筒量取98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
(5)2016巴西奥运会期间,由于工作人员将“84消毒液”与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与反应产生促进藻类快速生长,该反应的离子方程式为______________________________。
同课章节目录
