广东省惠东县2023-2024学年高二下学期开学摸底考试化学试卷(PDF版含答案)
文档属性
| 名称 | 广东省惠东县2023-2024学年高二下学期开学摸底考试化学试卷(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 605.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-22 17:09:28 | ||
图片预览



文档简介
惠东县 2023-2024学年第二学期高二年级开学摸底考试试卷
化 学 2024.02
试卷共 8页,卷面满分 100分。考试用时 75分钟。
注意事项:
1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,并将准考证条形码粘贴在
答题卡上的指定位置。
2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,用签字笔直接将答案写在
答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3. 考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量是:H 1 C 12 N 14 O 16 Na 23 Al 27 Si 28 S 32 Cl 35.5
一、单选题(1-10题,每题 2分;11-16,每题 4分,共 44分)
1.能量与科学、技术、社会、环境关系密切。下列应用中能量转化关系不.正.确.
的是( )
A B C D
天然气燃气炉 水电站 太阳能电池 电解精炼铜
化学能→热能 化学能→电能 太阳能→电能 电能→化学能
2.神舟十五号 3名航天员顺利进驻中国空间站,两个航天员乘组首次实现“太空
会师”。发射火箭的燃料常用联氨(N2H4)、液氢(H2),氧化剂有液氧(O2)、液态 N2O4
等。下列叙述错误的是( )
A.液氢和液氧在气化过程中发生了吸热反应
B.发射场因液态 N2O4产生大量 NO2而呈红棕色
C.液氢和液氧燃烧放出大量热量,产物对环境友好
D.N2H4和 O2反应中产物总能量小于反应物总能量
3.下列依据热化学方程式得出的结论正确的是( )
A.已知 2C(s)+2O2(g)=2CO2(g) ΔH=a;2C(s)+O2(g)=2CO(g) ΔH=b,则 a>b
B.已知 2H2(g)+O2(g)=2H2O(g) ΔH= -483.6kJ·mol-1,则氢气的燃烧热为
241.8 kJ·mol-1
C.已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH= -57.3kJ·mol-1,则含 40.0 g
NaOH的稀溶液与稀醋酸完全中和,放出的热量小于 57.3 kJ
D.已知 P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定
第 1 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
4.某温度下,A和 B以物质的量之比为 2:1充入某密闭容器中,发生
2A(g) B(g) C(g)的反应。C的物质的浓度随反应时间(t)的变化如下表。下
列说法中正确的是( )
t/s 2 4 6 8 10 12
C的浓度/(mol L 1 ) 0.22 0.36 0.42 0.46 0.46 0.46
A.在 0~6s内,平均反应速率 v(A)为 0.07mol L 1 s 1
B.8s前正反应速率小于逆反应速率
C.8s后反应物消耗完,反应停止
D.在反应过程中转化率均有α(A)=α(B)
5.劳动有利于“知行合一”,下列劳动项目与所述的化学知识没.有.关联的是( )
选项 劳动项目 化学知识
A 环保行动:用 FeS除去废水中的 Hg2+ 溶度积:Ksp ( FeS)>Ksp (HgS)
B 学农活动:用小苏打作发泡剂烘焙面包 NaHCO3受热易分解产生气体
C 家务劳动:用食醋清洗水壶内的水垢 醋酸的酸性比碳酸强
D 帮厨活动:用热的纯碱溶液去除厨房的油污 油脂直接与纯碱发生化学反应
6.考古学家在江苏建湖发现一处钱币窖藏遗存,出土钱币约 1.5吨。除少量的
唐代开元通宝钱币外,大部分为宋代钱币。钱币主要成分是铜合金。下列叙述错
误的是( )
A.钱币表面绿色物质的主要成分是 Cu2(OH)2CO3
B.钱币中铜在地下主要发生析氢腐蚀
C.钱币在窖藏中发生电化学腐蚀时铜被氧化
D.保护钱币措施有保持干燥、涂保护层等
7.下列四组物质的溶液加热蒸干、灼烧、所得固体的成分不相同的是( )
①FeCl2、FeCl3 ②NaHCO3、Na2CO3 ③NaAlO2、AlCl3 ④CuCl2、CuSO4
A.①② B.②③ C.③④ D.①④
8.下列关于焓判据和熵判据的说法中,正确的是( )
A.吸热的自发过程一定为熵增加的过程
B.ΔH<0的反应均是自发进行的反应
C.碳酸钙分解为吸热反应,该反应在任何温度下都不能自发进行
D.ΔH-TΔS大于 0的反应一定不能发生
第 2 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
9.常温下,下列事实不能说明某一元酸 HX是弱酸的是( )
A.0.1mol·L-1HX溶液 pH=4
B.NaX和 H2CO3反应,生成 HX
C.0.1mol·L-1HX溶液比 0.1mol·L-1硝酸导电能力弱
D.10mL 0.1mol·L-1NaOH溶液与 10mL0.1mol·L-1HX溶液恰好中和
10.设 NA为阿伏加德罗常数的值,下列说法正确的是( )
A.一定条件下,1mol N2与足量 H2反应生成 NH3数目为 2NA
B.将 7.8g Na - -2S溶于水,溶液中 S2 与 HS 数目之和为 0.1NA
C.室温下,1L pH=1的 H2SO4溶液中 H+数目为 0.1NA
D -.室温下,pH=9的 NaClO溶液中水电离产生的 H+数目为 10 5NA
11.下列各离子组在指定的溶液中能够大量共存的是( )
A.无色溶液中:Fe3+、K+、SCN-、Cl-
B.含有 Al3+的溶液中:K+、HCO3-、SO42-、Cl-
C.pH=11的 NaOH溶液中:CO32-、K+、NO3-、SO42-
D.由水电离出的 c H 1.0 10 13mol L 1的溶液中:Fe2+、Al3+、Cl-、NO3-
12.利用金属 Al、海水及其中的溶解氧可组成电池, 如图所示。下列说法正确
的是( )
A.b 电极为电池正极
B.电池工作时,海水中的 Na +向 a电极移动
C.电池工作时,紧邻 a 电极区域的海水呈强碱性
D.每消耗 27gAl,就有 22.4L的溶解氧(已换算标准
状况)参与反应
13.某反应可有效降低汽车尾气污染物的排放,其反应热 H 620.9kJ / mol。
一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态),
下列说法不.正.确.的是( )
第 3 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
A.三个基元反应中只有①是吸热反应
B. 是该反应的中间产物
一定条件
C.该过程的总反应为2CO 2NO N2 2CO2
D.△E=306.6kJ·mol-1
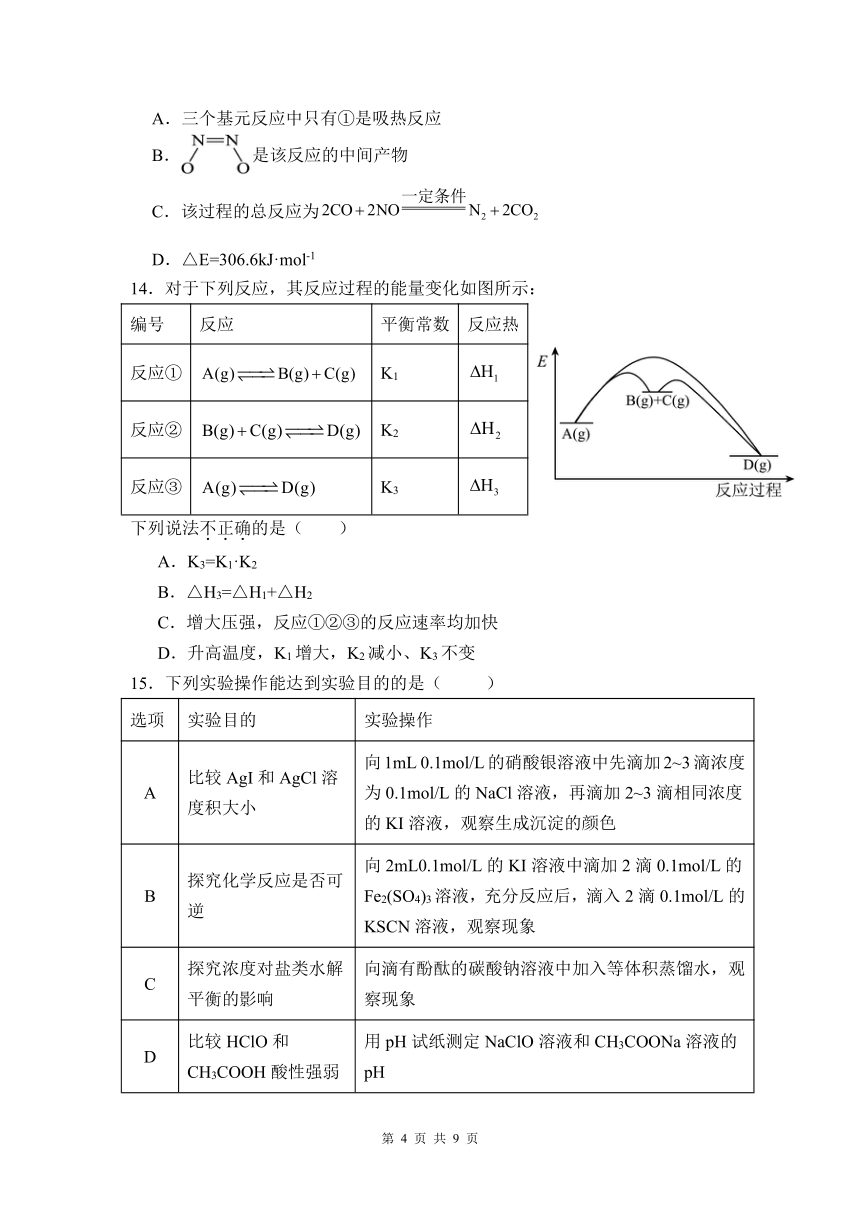
14.对于下列反应,其反应过程的能量变化如图所示:
编号 反应 平衡常数 反应热
反应① A(g) B(g) C(g) K1 H1
反应② B(g) C(g) D(g) K2 H2
反应③ A(g) D(g) K3 H3
下列说法不.正.确.的是( )
A.K3=K1·K2
B.△H3=△H1+△H2
C.增大压强,反应①②③的反应速率均加快
D.升高温度,K1增大,K2减小、K3不变
15.下列实验操作能达到实验目的的是( )
选项 实验目的 实验操作
向 1mL 0.1mol/L的硝酸银溶液中先滴加 2~3滴浓度
比较 AgI和 AgCl溶
A 为 0.1mol/L的 NaCl溶液,再滴加 2~3滴相同浓度
度积大小
的 KI溶液,观察生成沉淀的颜色
向 2mL0.1mol/L的 KI溶液中滴加 2滴 0.1mol/L的
探究化学反应是否可
B Fe2(SO4)3溶液,充分反应后,滴入 2滴 0.1mol/L的
逆
KSCN溶液,观察现象
探究浓度对盐类水解 向滴有酚酞的碳酸钠溶液中加入等体积蒸馏水,观
C
平衡的影响 察现象
比较 HClO和 用 pH试纸测定 NaClO溶液和 CH3COONa溶液的
D
CH3COOH酸性强弱 pH
第 4 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
16.Ka、Kw、Ksp分别表示酸的电离常数、水的离子积常数、溶度积常数,下
列判断正确的是( )
A.室温下Ka HCN Ka CH3COOH ,说明 CH3COOH的电离度一定比 HCN
的大
B.室温下向 10mLpH=3的醋酸溶液中加入水稀释后,溶液中
c CH3COO
c CH COOH c OH 不变3
C.25℃时,pH均为 4的盐酸和 NH4I溶液中 Kw不相等
D.两种难溶电解质做比较时,Ksp越小的电解质,其溶解度一定越小
二、非选择题:本题共 4小题,共 56分。
17.(14分)滴定实验是化学学科中最重要的定量实验之一。常见的滴定实验有酸
碱中和滴定、氧化还原反应滴定、沉淀滴定等等。
I.用 0.100mol·L-1 的 NaOH 溶液分别滴定 0.200mol·L-1 的盐酸和醋酸溶液各
20.00mL。滴定过程中溶液 pH随 NaOH溶液体积变化的两条滴定曲线如图所示:
(1)滴定醋酸的曲线是___________(填“Ⅰ”或“Ⅱ”)。
(2)V1和 V2的关系:V1_________V2(填“>”、“=”或“<”)。
Ⅱ.获取安全的饮用水一直以来都是人们关注的重要问题,自来水厂经常用氯气
进行杀菌,某化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态
氯(Cl2)的含量,实验步骤如下:
①取水样 50.00mL于锥形瓶中,加入 10.00mLKI 溶液(足量),滴入 2~3滴淀
粉溶液。
第 5 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
②将自己配制的 0.0010mol·L-1Na2S2O3标准溶液(显碱性)装入滴定管中,调整液
面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
试回答下列问题:
(3)①滴定前装有标准液的滴定管排气泡时,应选择下图中的________(填标号,
下同)。
A B C D
②若用 25.00mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体
的体积_____________。
A.=10.00mL B.=15.00mL C.<10.00mL D.>15.00mL
(4)步骤①发生反应的离子方程式为________________________________。
(5)达到滴定终点的现象是_________________________________________。
(6)实验测得游离态氯的浓度比实际浓度偏大,造成误差的原因可能是______。
A.锥形瓶水洗后直接装待测水样
B.配制 Na2S2O3标准溶液定容时,加水超过刻度线
C.装 Na2S2O3标准溶液的滴定管水洗后没有润洗
D.滴定到达终点时,俯视读出滴定管读数
18.(14分)NH4Cl是高中化学中常见铵盐,试运用所学相关的化学知识解答
下列问题。
已知:i.25℃ -时,NH3·H2O的 Kb=10 4.8
ii.氯化铵的抗碱容量是指用 NaOH溶液滴定 NH4Cl溶液至 pH=11 时,
单位质量的 NH4Cl所消耗 NaOH的物质的量,即σ=n(NaOH) / m(NH4Cl)
(1)NH4Cl的电子式______________。
(2)NH4Cl溶液呈______性(填“酸”或“碱”),现有 1mol·L-1NH4Cl溶液,则该
溶液在 25℃时的 pH为__________。
第 6 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
(3)某化学小组测定 NH4Cl固体抗碱容量(σ),实验步骤如下:
a.配置 100mL 0.4 mol·L-1 NaOH 溶液;
b.称取 x g NH4Cl 固体,溶于 20 mL水中,用上述 NaOH溶液滴定至 pH=11。
① 步骤 a需要称量 NaOH固体为________g
② 步骤 b需要用到下图所示仪器中的__________________________(填名称)。
③ 步骤 b消耗 NaOH 的体积为 y mL,则σ=________________mol·g-1
(4)NH4Cl-NH3·H2O混合溶液具有抗碱能力。向该溶液中加入少量 NaOH,溶
液的 pH变化不大。现有 NH4Cl-NH3·H2O混合溶液(物质的量之比为 1:1),对
于该混合溶液的下列叙述中正确的是_______________。
A.常温下,该混合溶液呈酸性
B -.溶液中离子浓度大小关系为: c(Cl ) >c(NH4+) > c(H+) > c(OH-)
C -.溶液中离子浓度存在恒等式:c(NH4+) + c(H+) = c(Cl ) + c(OH-)
D -.溶液中微粒间满足:2[c(NH4+) + c(NH3·H2O)] = c(Cl )
19.(14 分)甲烷在日常生活及有机合成中用途广泛,某实验小组研究甲烷在高温
下气相裂解反应的原理及其应用。
已知:①2CH4(g)+O2(g)=C2H4(g)+2H2O(l) ΔH1= -456.6 kJ·mol-1
② 2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
(1)裂解反应 2CH4(g) C2H4(g)+2H2(g)的 ΔH=______ kJ·mol-1 。
(2)在某密闭容器中投入 2 mol CH4(g),在不同条件下发生反应:
2CH4(g) C2H4(g)+2H2(g)。实验测得平衡时 C2H4(g)的物质的量随温度、压强
的变化如图 1所示。
①M点时,CH4的转化率为 ;
温度:T1 (填“>”、“<”或“=”)T2。
②M、N、Q 三点的平衡常数由大到小的顺序
为 。
③M点对应的压强平衡常数 Kp= _ (以分
压表示,分压=总压 ×物质的量分数,整理出含 p1的最
简表达式)。
④若向 M 点对应平衡体系中再充入 0.5 molCH4(g)、0.75mol C2H4(g)和 0.5mol
H2(g),此时平衡向 (填“正反应”或“逆反应”)方向移动。
第 7 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
(3)在恒温恒容条件下,充入一定量 CH4,发生反应
2CH4(g) C2H4(g)+2H2(g)。下列能判断该反应达到平衡状态的是____(填字母)。
a.v 正(C2H4)=v 逆(CH4)
b.C2H4的体积分数不再改变
c.混合气体的密度不再改变
d.同一时间内,消耗 0.04molH2,生成 0.02molC2H4
20.(14分)规范、科学处置废旧锂离子电池具有重要的环保意义和经济价值。废
旧锂离子电池的正极材料主要含有 LiCoO2及少量 Al、Fe等,处理该废料的一种
工艺流程如图所示。
已知:①LiCoO2难溶于水。②相关金属离子形成氢氧化物沉淀的 pH如下表所示。
Fe3+ Fe2+ Co2+
开始沉淀的 pH 2.7 7.6 7.0
完全沉淀的 pH 3.7 9.6 9.0
③Li2CO3的溶解度(S)随温度(T)的变化曲线如下图所示。
(1)化合物 LiCoO2中钴元素的化合价为_________价。
(2)“放电处理”有助于锂元素在正极的回收,电池放电时的总反应为
LixCy + Li1-xCoO2 = LiCoO2 + Cy,则此时正极的电极反应式为________________
(3)“碱溶”过程主要发生的离子方程式为__________________________________。
(4)为提高“酸溶”的速率,可采取的措施有_______________________(任写一条)。
(5)“调 pH”时,用氨水调节 pH的范围为____________________。
(6)“沉钴”过程中对产生的 CoCO3沉淀洗涤的实验操作为___________________
__________________________________________________________________。
(7) “沉锂”后,洗涤所得 Li2CO3沉淀要使用______________(填“热水”或“冷水”)。
第 8 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
惠东县 2023-2024学年第二学期高二年级开学摸底考试试卷
化学参考答案及评分标准
一.单选题(1-10题,每题 2分;11-16,每题 4分,共 44分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
B A C D D B C A D C C A D D B B
二.非选择题
17.(14分)
(1)I (2分) (2)< (2分) (3)① C (2分) ② D (2分)
(4)Cl2+ 2I-= I2 + 2Cl-(2分,未配平得 1分)
(5)滴入最后半滴标准液时,溶液蓝色褪去,且半分钟内不恢复颜色(2 分,
要点回答到位才得分,颜色变化错误不给分。)
(6)BC(2分)
18.(14分)
(1) (2分) (2)酸 (2分); 4.6 (2分)
(3)① 1.6 (2分) ② 锥形瓶、碱式滴定管 (2分,对一个得 1分)
③y/2500x (或 4y/x ×10-4) (2分,表达正确均得分)
(4)C (2分)
19.(14分)
(1)+115(2分,没有“+”得 1分)
(2)① 25%(2分); >(2分) ②KM>KN= KQ(2分,答 KN= KQ③p1/81 (2分) ④逆反应(2分)
(3)bd(2分,对一个 1分,写 BD不得分,错选不得分)
20.(14分)
(1)+3 (2分)
(2)Li1-xCoO2+ xLi++ xe—= LiCoO2(2分,书写正确,但未配系数得 1分。)
(3) 2Al + 2OH-+ 2H2O =2 AlO2- + 3H2↑(2分,物质正确未配平扣 1分)
(4)搅拌、适当升温、适当增大硫酸或双氧水的浓度(任写一种) (2分)
(5) 3.7 ≤ pH < 7.0 (2分,答 3.7~7.0也给分)
(6) 将沉淀放入到过滤器中,用玻璃棒引流加水浸没沉淀,然后让水自然流下,
重复操作 2~3次即可。 (2分,要点全答对才给分)
(7)热水(2分)
第 9 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
化 学 2024.02
试卷共 8页,卷面满分 100分。考试用时 75分钟。
注意事项:
1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,并将准考证条形码粘贴在
答题卡上的指定位置。
2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,用签字笔直接将答案写在
答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3. 考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量是:H 1 C 12 N 14 O 16 Na 23 Al 27 Si 28 S 32 Cl 35.5
一、单选题(1-10题,每题 2分;11-16,每题 4分,共 44分)
1.能量与科学、技术、社会、环境关系密切。下列应用中能量转化关系不.正.确.
的是( )
A B C D
天然气燃气炉 水电站 太阳能电池 电解精炼铜
化学能→热能 化学能→电能 太阳能→电能 电能→化学能
2.神舟十五号 3名航天员顺利进驻中国空间站,两个航天员乘组首次实现“太空
会师”。发射火箭的燃料常用联氨(N2H4)、液氢(H2),氧化剂有液氧(O2)、液态 N2O4
等。下列叙述错误的是( )
A.液氢和液氧在气化过程中发生了吸热反应
B.发射场因液态 N2O4产生大量 NO2而呈红棕色
C.液氢和液氧燃烧放出大量热量,产物对环境友好
D.N2H4和 O2反应中产物总能量小于反应物总能量
3.下列依据热化学方程式得出的结论正确的是( )
A.已知 2C(s)+2O2(g)=2CO2(g) ΔH=a;2C(s)+O2(g)=2CO(g) ΔH=b,则 a>b
B.已知 2H2(g)+O2(g)=2H2O(g) ΔH= -483.6kJ·mol-1,则氢气的燃烧热为
241.8 kJ·mol-1
C.已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH= -57.3kJ·mol-1,则含 40.0 g
NaOH的稀溶液与稀醋酸完全中和,放出的热量小于 57.3 kJ
D.已知 P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定
第 1 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
4.某温度下,A和 B以物质的量之比为 2:1充入某密闭容器中,发生
2A(g) B(g) C(g)的反应。C的物质的浓度随反应时间(t)的变化如下表。下
列说法中正确的是( )
t/s 2 4 6 8 10 12
C的浓度/(mol L 1 ) 0.22 0.36 0.42 0.46 0.46 0.46
A.在 0~6s内,平均反应速率 v(A)为 0.07mol L 1 s 1
B.8s前正反应速率小于逆反应速率
C.8s后反应物消耗完,反应停止
D.在反应过程中转化率均有α(A)=α(B)
5.劳动有利于“知行合一”,下列劳动项目与所述的化学知识没.有.关联的是( )
选项 劳动项目 化学知识
A 环保行动:用 FeS除去废水中的 Hg2+ 溶度积:Ksp ( FeS)>Ksp (HgS)
B 学农活动:用小苏打作发泡剂烘焙面包 NaHCO3受热易分解产生气体
C 家务劳动:用食醋清洗水壶内的水垢 醋酸的酸性比碳酸强
D 帮厨活动:用热的纯碱溶液去除厨房的油污 油脂直接与纯碱发生化学反应
6.考古学家在江苏建湖发现一处钱币窖藏遗存,出土钱币约 1.5吨。除少量的
唐代开元通宝钱币外,大部分为宋代钱币。钱币主要成分是铜合金。下列叙述错
误的是( )
A.钱币表面绿色物质的主要成分是 Cu2(OH)2CO3
B.钱币中铜在地下主要发生析氢腐蚀
C.钱币在窖藏中发生电化学腐蚀时铜被氧化
D.保护钱币措施有保持干燥、涂保护层等
7.下列四组物质的溶液加热蒸干、灼烧、所得固体的成分不相同的是( )
①FeCl2、FeCl3 ②NaHCO3、Na2CO3 ③NaAlO2、AlCl3 ④CuCl2、CuSO4
A.①② B.②③ C.③④ D.①④
8.下列关于焓判据和熵判据的说法中,正确的是( )
A.吸热的自发过程一定为熵增加的过程
B.ΔH<0的反应均是自发进行的反应
C.碳酸钙分解为吸热反应,该反应在任何温度下都不能自发进行
D.ΔH-TΔS大于 0的反应一定不能发生
第 2 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
9.常温下,下列事实不能说明某一元酸 HX是弱酸的是( )
A.0.1mol·L-1HX溶液 pH=4
B.NaX和 H2CO3反应,生成 HX
C.0.1mol·L-1HX溶液比 0.1mol·L-1硝酸导电能力弱
D.10mL 0.1mol·L-1NaOH溶液与 10mL0.1mol·L-1HX溶液恰好中和
10.设 NA为阿伏加德罗常数的值,下列说法正确的是( )
A.一定条件下,1mol N2与足量 H2反应生成 NH3数目为 2NA
B.将 7.8g Na - -2S溶于水,溶液中 S2 与 HS 数目之和为 0.1NA
C.室温下,1L pH=1的 H2SO4溶液中 H+数目为 0.1NA
D -.室温下,pH=9的 NaClO溶液中水电离产生的 H+数目为 10 5NA
11.下列各离子组在指定的溶液中能够大量共存的是( )
A.无色溶液中:Fe3+、K+、SCN-、Cl-
B.含有 Al3+的溶液中:K+、HCO3-、SO42-、Cl-
C.pH=11的 NaOH溶液中:CO32-、K+、NO3-、SO42-
D.由水电离出的 c H 1.0 10 13mol L 1的溶液中:Fe2+、Al3+、Cl-、NO3-
12.利用金属 Al、海水及其中的溶解氧可组成电池, 如图所示。下列说法正确
的是( )
A.b 电极为电池正极
B.电池工作时,海水中的 Na +向 a电极移动
C.电池工作时,紧邻 a 电极区域的海水呈强碱性
D.每消耗 27gAl,就有 22.4L的溶解氧(已换算标准
状况)参与反应
13.某反应可有效降低汽车尾气污染物的排放,其反应热 H 620.9kJ / mol。
一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态),
下列说法不.正.确.的是( )
第 3 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
A.三个基元反应中只有①是吸热反应
B. 是该反应的中间产物
一定条件
C.该过程的总反应为2CO 2NO N2 2CO2
D.△E=306.6kJ·mol-1
14.对于下列反应,其反应过程的能量变化如图所示:
编号 反应 平衡常数 反应热
反应① A(g) B(g) C(g) K1 H1
反应② B(g) C(g) D(g) K2 H2
反应③ A(g) D(g) K3 H3
下列说法不.正.确.的是( )
A.K3=K1·K2
B.△H3=△H1+△H2
C.增大压强,反应①②③的反应速率均加快
D.升高温度,K1增大,K2减小、K3不变
15.下列实验操作能达到实验目的的是( )
选项 实验目的 实验操作
向 1mL 0.1mol/L的硝酸银溶液中先滴加 2~3滴浓度
比较 AgI和 AgCl溶
A 为 0.1mol/L的 NaCl溶液,再滴加 2~3滴相同浓度
度积大小
的 KI溶液,观察生成沉淀的颜色
向 2mL0.1mol/L的 KI溶液中滴加 2滴 0.1mol/L的
探究化学反应是否可
B Fe2(SO4)3溶液,充分反应后,滴入 2滴 0.1mol/L的
逆
KSCN溶液,观察现象
探究浓度对盐类水解 向滴有酚酞的碳酸钠溶液中加入等体积蒸馏水,观
C
平衡的影响 察现象
比较 HClO和 用 pH试纸测定 NaClO溶液和 CH3COONa溶液的
D
CH3COOH酸性强弱 pH
第 4 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
16.Ka、Kw、Ksp分别表示酸的电离常数、水的离子积常数、溶度积常数,下
列判断正确的是( )
A.室温下Ka HCN Ka CH3COOH ,说明 CH3COOH的电离度一定比 HCN
的大
B.室温下向 10mLpH=3的醋酸溶液中加入水稀释后,溶液中
c CH3COO
c CH COOH c OH 不变3
C.25℃时,pH均为 4的盐酸和 NH4I溶液中 Kw不相等
D.两种难溶电解质做比较时,Ksp越小的电解质,其溶解度一定越小
二、非选择题:本题共 4小题,共 56分。
17.(14分)滴定实验是化学学科中最重要的定量实验之一。常见的滴定实验有酸
碱中和滴定、氧化还原反应滴定、沉淀滴定等等。
I.用 0.100mol·L-1 的 NaOH 溶液分别滴定 0.200mol·L-1 的盐酸和醋酸溶液各
20.00mL。滴定过程中溶液 pH随 NaOH溶液体积变化的两条滴定曲线如图所示:
(1)滴定醋酸的曲线是___________(填“Ⅰ”或“Ⅱ”)。
(2)V1和 V2的关系:V1_________V2(填“>”、“=”或“<”)。
Ⅱ.获取安全的饮用水一直以来都是人们关注的重要问题,自来水厂经常用氯气
进行杀菌,某化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态
氯(Cl2)的含量,实验步骤如下:
①取水样 50.00mL于锥形瓶中,加入 10.00mLKI 溶液(足量),滴入 2~3滴淀
粉溶液。
第 5 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
②将自己配制的 0.0010mol·L-1Na2S2O3标准溶液(显碱性)装入滴定管中,调整液
面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
试回答下列问题:
(3)①滴定前装有标准液的滴定管排气泡时,应选择下图中的________(填标号,
下同)。
A B C D
②若用 25.00mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体
的体积_____________。
A.=10.00mL B.=15.00mL C.<10.00mL D.>15.00mL
(4)步骤①发生反应的离子方程式为________________________________。
(5)达到滴定终点的现象是_________________________________________。
(6)实验测得游离态氯的浓度比实际浓度偏大,造成误差的原因可能是______。
A.锥形瓶水洗后直接装待测水样
B.配制 Na2S2O3标准溶液定容时,加水超过刻度线
C.装 Na2S2O3标准溶液的滴定管水洗后没有润洗
D.滴定到达终点时,俯视读出滴定管读数
18.(14分)NH4Cl是高中化学中常见铵盐,试运用所学相关的化学知识解答
下列问题。
已知:i.25℃ -时,NH3·H2O的 Kb=10 4.8
ii.氯化铵的抗碱容量是指用 NaOH溶液滴定 NH4Cl溶液至 pH=11 时,
单位质量的 NH4Cl所消耗 NaOH的物质的量,即σ=n(NaOH) / m(NH4Cl)
(1)NH4Cl的电子式______________。
(2)NH4Cl溶液呈______性(填“酸”或“碱”),现有 1mol·L-1NH4Cl溶液,则该
溶液在 25℃时的 pH为__________。
第 6 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
(3)某化学小组测定 NH4Cl固体抗碱容量(σ),实验步骤如下:
a.配置 100mL 0.4 mol·L-1 NaOH 溶液;
b.称取 x g NH4Cl 固体,溶于 20 mL水中,用上述 NaOH溶液滴定至 pH=11。
① 步骤 a需要称量 NaOH固体为________g
② 步骤 b需要用到下图所示仪器中的__________________________(填名称)。
③ 步骤 b消耗 NaOH 的体积为 y mL,则σ=________________mol·g-1
(4)NH4Cl-NH3·H2O混合溶液具有抗碱能力。向该溶液中加入少量 NaOH,溶
液的 pH变化不大。现有 NH4Cl-NH3·H2O混合溶液(物质的量之比为 1:1),对
于该混合溶液的下列叙述中正确的是_______________。
A.常温下,该混合溶液呈酸性
B -.溶液中离子浓度大小关系为: c(Cl ) >c(NH4+) > c(H+) > c(OH-)
C -.溶液中离子浓度存在恒等式:c(NH4+) + c(H+) = c(Cl ) + c(OH-)
D -.溶液中微粒间满足:2[c(NH4+) + c(NH3·H2O)] = c(Cl )
19.(14 分)甲烷在日常生活及有机合成中用途广泛,某实验小组研究甲烷在高温
下气相裂解反应的原理及其应用。
已知:①2CH4(g)+O2(g)=C2H4(g)+2H2O(l) ΔH1= -456.6 kJ·mol-1
② 2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
(1)裂解反应 2CH4(g) C2H4(g)+2H2(g)的 ΔH=______ kJ·mol-1 。
(2)在某密闭容器中投入 2 mol CH4(g),在不同条件下发生反应:
2CH4(g) C2H4(g)+2H2(g)。实验测得平衡时 C2H4(g)的物质的量随温度、压强
的变化如图 1所示。
①M点时,CH4的转化率为 ;
温度:T1 (填“>”、“<”或“=”)T2。
②M、N、Q 三点的平衡常数由大到小的顺序
为 。
③M点对应的压强平衡常数 Kp= _ (以分
压表示,分压=总压 ×物质的量分数,整理出含 p1的最
简表达式)。
④若向 M 点对应平衡体系中再充入 0.5 molCH4(g)、0.75mol C2H4(g)和 0.5mol
H2(g),此时平衡向 (填“正反应”或“逆反应”)方向移动。
第 7 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
(3)在恒温恒容条件下,充入一定量 CH4,发生反应
2CH4(g) C2H4(g)+2H2(g)。下列能判断该反应达到平衡状态的是____(填字母)。
a.v 正(C2H4)=v 逆(CH4)
b.C2H4的体积分数不再改变
c.混合气体的密度不再改变
d.同一时间内,消耗 0.04molH2,生成 0.02molC2H4
20.(14分)规范、科学处置废旧锂离子电池具有重要的环保意义和经济价值。废
旧锂离子电池的正极材料主要含有 LiCoO2及少量 Al、Fe等,处理该废料的一种
工艺流程如图所示。
已知:①LiCoO2难溶于水。②相关金属离子形成氢氧化物沉淀的 pH如下表所示。
Fe3+ Fe2+ Co2+
开始沉淀的 pH 2.7 7.6 7.0
完全沉淀的 pH 3.7 9.6 9.0
③Li2CO3的溶解度(S)随温度(T)的变化曲线如下图所示。
(1)化合物 LiCoO2中钴元素的化合价为_________价。
(2)“放电处理”有助于锂元素在正极的回收,电池放电时的总反应为
LixCy + Li1-xCoO2 = LiCoO2 + Cy,则此时正极的电极反应式为________________
(3)“碱溶”过程主要发生的离子方程式为__________________________________。
(4)为提高“酸溶”的速率,可采取的措施有_______________________(任写一条)。
(5)“调 pH”时,用氨水调节 pH的范围为____________________。
(6)“沉钴”过程中对产生的 CoCO3沉淀洗涤的实验操作为___________________
__________________________________________________________________。
(7) “沉锂”后,洗涤所得 Li2CO3沉淀要使用______________(填“热水”或“冷水”)。
第 8 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
惠东县 2023-2024学年第二学期高二年级开学摸底考试试卷
化学参考答案及评分标准
一.单选题(1-10题,每题 2分;11-16,每题 4分,共 44分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
B A C D D B C A D C C A D D B B
二.非选择题
17.(14分)
(1)I (2分) (2)< (2分) (3)① C (2分) ② D (2分)
(4)Cl2+ 2I-= I2 + 2Cl-(2分,未配平得 1分)
(5)滴入最后半滴标准液时,溶液蓝色褪去,且半分钟内不恢复颜色(2 分,
要点回答到位才得分,颜色变化错误不给分。)
(6)BC(2分)
18.(14分)
(1) (2分) (2)酸 (2分); 4.6 (2分)
(3)① 1.6 (2分) ② 锥形瓶、碱式滴定管 (2分,对一个得 1分)
③y/2500x (或 4y/x ×10-4) (2分,表达正确均得分)
(4)C (2分)
19.(14分)
(1)+115(2分,没有“+”得 1分)
(2)① 25%(2分); >(2分) ②KM>KN= KQ(2分,答 KN= KQ
(3)bd(2分,对一个 1分,写 BD不得分,错选不得分)
20.(14分)
(1)+3 (2分)
(2)Li1-xCoO2+ xLi++ xe—= LiCoO2(2分,书写正确,但未配系数得 1分。)
(3) 2Al + 2OH-+ 2H2O =2 AlO2- + 3H2↑(2分,物质正确未配平扣 1分)
(4)搅拌、适当升温、适当增大硫酸或双氧水的浓度(任写一种) (2分)
(5) 3.7 ≤ pH < 7.0 (2分,答 3.7~7.0也给分)
(6) 将沉淀放入到过滤器中,用玻璃棒引流加水浸没沉淀,然后让水自然流下,
重复操作 2~3次即可。 (2分,要点全答对才给分)
(7)热水(2分)
第 9 页 共 9 页
{#{QQABZYCAogAoABJAAQhCAwFYCkEQkBGAAIoGxEAAIAABCRFABAA=}#}
同课章节目录
