湖北省荆门市2023-2024学年高二上学期期末学业水平检测化学试题(含答案)
文档属性
| 名称 | 湖北省荆门市2023-2024学年高二上学期期末学业水平检测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 694.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-22 19:13:52 | ||
图片预览




文档简介
荆门市2023-2024学年高二上学期期末学业水平检测
化学
本试卷共6页,19题。全卷满分100分。考试用时75分钟。
祝考试顺利
注意事项:
1.答题前,先将自己的姓名、准考证号、考场号、座位号填写在答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。写在试卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试卷和答题卡一并上交。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16
一、选择题:本题共15小题,每小题3分,共45分。在给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活、生产密切相关。下列说法错误的是( )
A.青铜器上的铜锈,可用溶液除去
B.洗发时用的护发素,能够调节头发的pH
C.锅炉水垢中含有,可先用溶液处理,后用酸除去
D.可溶性的铝盐、铁盐均可用于自来水的消毒杀菌
2.下列有关化学用语表示正确的是( )
A.的结构示意图:
B.的电子式:
C.Na的最高能级的电子云轮廓图:
D.基态铜原子的价层电子排布图:
3.下列关于原子结构说法中,正确的是( )
A.p能级能量一定比s能级的能量高 B.3d、4d能级容纳的电子数依次增多
C.2p和3p轨道的形状均为哑铃形 D.电子从较低能级跃迁到较高能级将释放能量
4.下列关于电化学腐蚀、防护与利用的说法中,正确的是( )
A.铜板打上铁铆钉后,铜板更易被腐蚀 B.暖气片表面刷油漆可防止金属腐蚀 C.连接锌棒后,电子由铁管道流向锌 D.阴极的电极反应式为:
A.A B.B C.C D.D
5.下列变化过程的且的是( )
A. B.
C. D.
6.在一定条件下的密闭容器中发生反应: ,当达到平衡时,下列各项措施,不能提高转化率的是( )
A.升高反应的温度 B.增大容器的容积 C.恒容下通入稀有气体 D.分离出部分
7.下列实验的反应原理用离子方程式表示正确的是( )
A.室温下,测得氯化铵溶液:
B.用铁氰化钾检验:
C.用金属铜作为电极电解硫酸铜溶液:
D.用酸性高锰酸钾标准溶液滴定草酸:
8.2022年诺贝尔化学奖授予开发“点击化学”的科学家。分子R称为“点击化学试剂”,其结构如图所示。下列说法错误的是( )
A.基态O原子价电子排布式为: B.离子半径:
C.F原子核外有7种空间运动状态不同的电子 D.分子R中四种元素都位于元素周期表p区
9.实验室用标准盐酸测定NaOH溶液的浓度,下列操作中可能使测定结果偏低的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.盛装NaOH溶液的锥形瓶未干燥
C.开始滴定时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
10.液氨与纯水类似,也存在微弱的电离:,T℃时,液氨的离子积常数,若用定义pH的方式来规定,则下列叙述正确的是( )
A.T℃时的液氨中,pN=15
B.液氨达到电离平衡时
C.其他条件不变,增加液氨的量,电离平衡正向移动
D.一定温度下,向液氨中加入氯化铵固体,电离平衡逆向移动,K值减小
11.下列实验装置可以达到实验目的或描述正确的是( )
A.测定锌与稀硫酸反应速率(计时器未画出) B.使Fe表面腐蚀电流降至零或接近于零 C.制备无水氯化镁 D.测定中和反应的反应热
A.A B.B C.C D.D
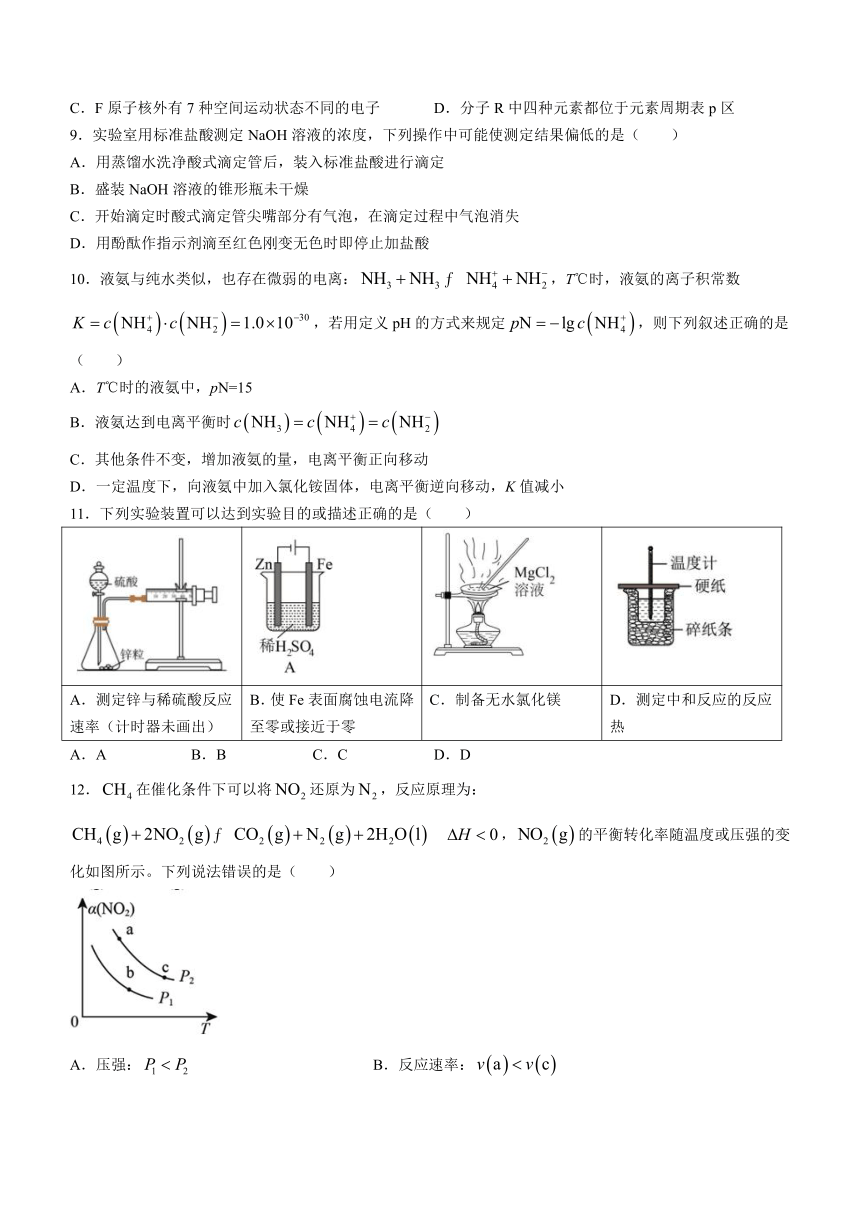
12.在催化条件下可以将还原为,反应原理为: ,的平衡转化率随温度或压强的变化如图所示。下列说法错误的是( )
A.压强: B.反应速率:
C.平衡常数: D.气体的颜色:b深,c浅
13.常温下,四种溶液:①的氨水 ②的氢氧化钠溶液 ③的醋酸 ④的盐酸,下列说法错误的是( )
A.将溶液①、④等体积混合,所得溶液显碱性
B.分别取1 mL稀释至10 mL,四种溶液的pH:②>①>④>③
C.向溶液③、④中分别加入适量的醋酸钠晶体后,两种溶液的pH均增大
D.将a L溶液②和b L溶液④混合后,若所得溶液,则
14.中国科学家开发出的新型电解质能使电池在90℃稳定工作,模拟装置如图所示。已知该电池的总反应为:,当该电池放电时,下列说法错误的是( )
A.a极发生还原反应 B.向b极附近迁移
C.b极的电极反应式为: D.a极的质量净增14 g时转移2 mol电子
15.T℃时,在20.00 mL 的一元酸HR溶液中滴入 NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。下列说法错误的是( )
A.T℃时,HR电离常数
B.M点所示溶液中
C.N点所示溶液中:
D.P点与Q点所示溶液中水的电离程度:Q>P
二、非选择题(本大题共4小题,共55分)
16.(11分)
有机物A的产量通常用来衡量一个国家的石油化工水平。以A物质为原料合成部分有机物的流程如下。
回答下列问题:
(1)写出A的名称______,A→B的化学方程式为______。
(2)有机物C的分子式为,C和E的官能团相同,写出C的结构简式______。
(3)A→D的反应类型为______。
(4)将组成有机物D和E的元素按电负性由小到大排序为______,其中基态的O原子最多有______个自旋相同的p电子。
(5)下列说法正确的是______。
A.第一电离能:N>O>C B.HCN的电子式为:
C.有机物A可通过加成聚合形成高分子 D.有机物B和E都可以与反应
17.(14分)
某科研人员从含镍废料(主要含有NiO和少量的、、CaO、CuO、BaO)中回收镍元素的流程如下。
已知:①实验条件下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
氢氧化物
开始沉淀的pH 1.5 6.5 7.7 3.0
沉淀完全的pH 3.7 9.7 9.2 5.0
②常温下,。
请回答下列问题:
(1)“含镍废料”需要粉碎,目的是______。
(2)“滤渣I”的成分是______(填化学式)。
(3)写出“操作A”中生成S的离子方程式______。
(4)“滤渣Ⅱ”的主要成分是和。考虑最终产品的纯度,“试剂A”和“试剂B”应选择(填标号)______。“调节pH”的范围是______。
a. b. NaOH c.
(5)为防止生成,调节pH后所得滤液和溶液的混合方式是______。有人建议将该步骤使用的用代替并进行了尝试,结果无沉淀生成,其可能的原因是______。
(6)“操作B”可分离出含的沉淀,如果使滤液中的,则滤液中的浓度至少为______。
18.(14分)
醋酸(用HAc表示)是生活中常见的有机弱酸,某小组欲借助传感器探究醋酸的电离过程。已知:稀溶液中, 。回答下列问题:
(1)配制0.10 mol/L HAc溶液
①配制0.10 mol/L的HAc溶液,需用量筒量取4.0 mol/L HAc溶液的体积为_____mL。
②配制250 mL 0.10 mol/L HAc溶液,下列操作正确的是______。
(2)探究电离程度
量取20.00 mL所配HAc溶液于锥形瓶中,加入指示剂,用0.1000 mol/L NaOH溶液滴定,恰好完全反应时消耗NaOH溶液21.00 mL,用pH传感器测滴定过程的pH(部分数据如表所示)。
V(NaOH)/mL 0.00 10.00 15.00 19.00 20.00
pH 2.87 4.70 5.12 5.70 6.02
①指示剂适宜选用______(填“酚酞”或“甲基橙”)。
②该HAc溶液的精确浓度为______mol/L。
③根据查阅资料:一定条件下,按配制的溶液中,的值等于HAc的,推测______(填“>”、“<”或“=”)。
(3)探究电离过程热效应
取上述HAc和NaOH溶液各100 mL于量热装置中反应,测得反应前后体系的温度值变化,重复操作3次,记录实验数据如表所示:
实验 I Ⅱ Ⅲ
0.59 0.61 0.60
①重复操作3次的目的是______。
②平均每次HAc和NaOH溶液反应放出的热量为______J(已知水的比热容,ρ取1.0 g/mL计算,忽略溶液以外各物质吸收的热量,结果保留一位小数,下同)
③根据所学原理,可推知的热效应______kJ/mol。
19.(16分)氨气是化肥工业和有机化工的重要原料,在合成氨的理论可行性、工业化及机理等方面的研究上产生过三位诺贝尔奖得主。回答下列问题:
(1)科学家提出了合成氨反应吸附解离的机理,通过实验测得合成氨反应势能如图1所示:
图1
在合成氨吸附解离的过程中,状态最稳定的是______;与制备的热化学方程式为________________________。
(2)合成氨反应中,正反应速率,逆反应速率,、为速率常数。正反应和逆反应的平衡常数与温度的关系如图2所示:
图2
①表示正反应的平衡常数与温度变化关系的曲线为______(填“”或“”),理由为____________。
②时,______的关系是(填“>”、“<”和“=”)。
(3)以氨、丙烯、氧气为原料,在催化剂存在下生成丙烯腈()和副产物丙烯醛()的热化学方程式如下:
主反应: ;
副反应: 。
已知:丙烯腈的产率,丙烯腈的选择性,某气体分压=总压强×该气体物质的量分数。
①一定条件下,平衡时丙烯腈的选择性与温度、压强的关系如图3所示,则、、由大到小的顺序为______。原因是____________。
图3
②某温度下,向压强恒为100 kPa的密闭容器中通入1 mol 、1 mol 、1.5 mol 和0.1 mol Ar发生上述反应。平衡时测得转化率为90%,的物质的量为2.5 mol,此温度下副反应的______(为平衡气体组分分压表示的平衡常数)。
(4)我国科学家实现了在室温下电催化制取和,装置如图所示,其中双极膜复合层之间的水能解离成和,双极膜能实现、的定向移动。
①电解时,双极膜产生的向______(填“A”或“B”)极移动。
②电解的阴极反应式为:______。
荆门市2023-2024学年高二上学期期末学业水平检测
化学参考答案及评分细则
一、选择题:本题共15小题,每小题3分,共45分。
题号 1 2 3 4 5 6 7 8
答案 D C C B B C B C
题号 9 10 11 12 13 14 15
答案 D A A D B B D
二、非选择题(本大题共4小题,共55分)
16.(11分,除标注外,每空2分)
(1)乙烯(1分) (2)(1分)
(3)加成反应(1分) (4)H17.(14分,每空2分)
(1)增大接触面积(给1分),提高酸浸的速率,使酸浸更充分(给1分)。
(2)、
(3) (4)ac 5≤pH<7.7
(5)向滤液中缓慢滴加溶液 (6)0.096
18.(14分,除标注外,每空2分)
(1)①6.3 ②C (2)①酚酞(1分) ②0.1050 ③<
(3)①减少实验误差,提高实验结果准确性(1分) ②501.60 ③+7.1
19.(16分,除标注外,每空2分)
(1)N(ad)+3H(ad)(1分)
(2)①(1分),正反应为放热反应,升高温度平衡逆向移动,正反应平衡常数减小,则表示正反应的平衡常数与温度变化关系。 ②(1分)
(3)(1分);生成丙烯腈的反应是气体分子总数增大的反应,而副反应为气体分子总数不变的反应,压强增大,生成丙烯腈的反应平衡逆向移动,丙烯腈选择性降低。 ②12.5
(4)A(1分)
化学
本试卷共6页,19题。全卷满分100分。考试用时75分钟。
祝考试顺利
注意事项:
1.答题前,先将自己的姓名、准考证号、考场号、座位号填写在答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。写在试卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试卷和答题卡一并上交。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16
一、选择题:本题共15小题,每小题3分,共45分。在给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活、生产密切相关。下列说法错误的是( )
A.青铜器上的铜锈,可用溶液除去
B.洗发时用的护发素,能够调节头发的pH
C.锅炉水垢中含有,可先用溶液处理,后用酸除去
D.可溶性的铝盐、铁盐均可用于自来水的消毒杀菌
2.下列有关化学用语表示正确的是( )
A.的结构示意图:
B.的电子式:
C.Na的最高能级的电子云轮廓图:
D.基态铜原子的价层电子排布图:
3.下列关于原子结构说法中,正确的是( )
A.p能级能量一定比s能级的能量高 B.3d、4d能级容纳的电子数依次增多
C.2p和3p轨道的形状均为哑铃形 D.电子从较低能级跃迁到较高能级将释放能量
4.下列关于电化学腐蚀、防护与利用的说法中,正确的是( )
A.铜板打上铁铆钉后,铜板更易被腐蚀 B.暖气片表面刷油漆可防止金属腐蚀 C.连接锌棒后,电子由铁管道流向锌 D.阴极的电极反应式为:
A.A B.B C.C D.D
5.下列变化过程的且的是( )
A. B.
C. D.
6.在一定条件下的密闭容器中发生反应: ,当达到平衡时,下列各项措施,不能提高转化率的是( )
A.升高反应的温度 B.增大容器的容积 C.恒容下通入稀有气体 D.分离出部分
7.下列实验的反应原理用离子方程式表示正确的是( )
A.室温下,测得氯化铵溶液:
B.用铁氰化钾检验:
C.用金属铜作为电极电解硫酸铜溶液:
D.用酸性高锰酸钾标准溶液滴定草酸:
8.2022年诺贝尔化学奖授予开发“点击化学”的科学家。分子R称为“点击化学试剂”,其结构如图所示。下列说法错误的是( )
A.基态O原子价电子排布式为: B.离子半径:
C.F原子核外有7种空间运动状态不同的电子 D.分子R中四种元素都位于元素周期表p区
9.实验室用标准盐酸测定NaOH溶液的浓度,下列操作中可能使测定结果偏低的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.盛装NaOH溶液的锥形瓶未干燥
C.开始滴定时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
10.液氨与纯水类似,也存在微弱的电离:,T℃时,液氨的离子积常数,若用定义pH的方式来规定,则下列叙述正确的是( )
A.T℃时的液氨中,pN=15
B.液氨达到电离平衡时
C.其他条件不变,增加液氨的量,电离平衡正向移动
D.一定温度下,向液氨中加入氯化铵固体,电离平衡逆向移动,K值减小
11.下列实验装置可以达到实验目的或描述正确的是( )
A.测定锌与稀硫酸反应速率(计时器未画出) B.使Fe表面腐蚀电流降至零或接近于零 C.制备无水氯化镁 D.测定中和反应的反应热
A.A B.B C.C D.D
12.在催化条件下可以将还原为,反应原理为: ,的平衡转化率随温度或压强的变化如图所示。下列说法错误的是( )
A.压强: B.反应速率:
C.平衡常数: D.气体的颜色:b深,c浅
13.常温下,四种溶液:①的氨水 ②的氢氧化钠溶液 ③的醋酸 ④的盐酸,下列说法错误的是( )
A.将溶液①、④等体积混合,所得溶液显碱性
B.分别取1 mL稀释至10 mL,四种溶液的pH:②>①>④>③
C.向溶液③、④中分别加入适量的醋酸钠晶体后,两种溶液的pH均增大
D.将a L溶液②和b L溶液④混合后,若所得溶液,则
14.中国科学家开发出的新型电解质能使电池在90℃稳定工作,模拟装置如图所示。已知该电池的总反应为:,当该电池放电时,下列说法错误的是( )
A.a极发生还原反应 B.向b极附近迁移
C.b极的电极反应式为: D.a极的质量净增14 g时转移2 mol电子
15.T℃时,在20.00 mL 的一元酸HR溶液中滴入 NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。下列说法错误的是( )
A.T℃时,HR电离常数
B.M点所示溶液中
C.N点所示溶液中:
D.P点与Q点所示溶液中水的电离程度:Q>P
二、非选择题(本大题共4小题,共55分)
16.(11分)
有机物A的产量通常用来衡量一个国家的石油化工水平。以A物质为原料合成部分有机物的流程如下。
回答下列问题:
(1)写出A的名称______,A→B的化学方程式为______。
(2)有机物C的分子式为,C和E的官能团相同,写出C的结构简式______。
(3)A→D的反应类型为______。
(4)将组成有机物D和E的元素按电负性由小到大排序为______,其中基态的O原子最多有______个自旋相同的p电子。
(5)下列说法正确的是______。
A.第一电离能:N>O>C B.HCN的电子式为:
C.有机物A可通过加成聚合形成高分子 D.有机物B和E都可以与反应
17.(14分)
某科研人员从含镍废料(主要含有NiO和少量的、、CaO、CuO、BaO)中回收镍元素的流程如下。
已知:①实验条件下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
氢氧化物
开始沉淀的pH 1.5 6.5 7.7 3.0
沉淀完全的pH 3.7 9.7 9.2 5.0
②常温下,。
请回答下列问题:
(1)“含镍废料”需要粉碎,目的是______。
(2)“滤渣I”的成分是______(填化学式)。
(3)写出“操作A”中生成S的离子方程式______。
(4)“滤渣Ⅱ”的主要成分是和。考虑最终产品的纯度,“试剂A”和“试剂B”应选择(填标号)______。“调节pH”的范围是______。
a. b. NaOH c.
(5)为防止生成,调节pH后所得滤液和溶液的混合方式是______。有人建议将该步骤使用的用代替并进行了尝试,结果无沉淀生成,其可能的原因是______。
(6)“操作B”可分离出含的沉淀,如果使滤液中的,则滤液中的浓度至少为______。
18.(14分)
醋酸(用HAc表示)是生活中常见的有机弱酸,某小组欲借助传感器探究醋酸的电离过程。已知:稀溶液中, 。回答下列问题:
(1)配制0.10 mol/L HAc溶液
①配制0.10 mol/L的HAc溶液,需用量筒量取4.0 mol/L HAc溶液的体积为_____mL。
②配制250 mL 0.10 mol/L HAc溶液,下列操作正确的是______。
(2)探究电离程度
量取20.00 mL所配HAc溶液于锥形瓶中,加入指示剂,用0.1000 mol/L NaOH溶液滴定,恰好完全反应时消耗NaOH溶液21.00 mL,用pH传感器测滴定过程的pH(部分数据如表所示)。
V(NaOH)/mL 0.00 10.00 15.00 19.00 20.00
pH 2.87 4.70 5.12 5.70 6.02
①指示剂适宜选用______(填“酚酞”或“甲基橙”)。
②该HAc溶液的精确浓度为______mol/L。
③根据查阅资料:一定条件下,按配制的溶液中,的值等于HAc的,推测______(填“>”、“<”或“=”)。
(3)探究电离过程热效应
取上述HAc和NaOH溶液各100 mL于量热装置中反应,测得反应前后体系的温度值变化,重复操作3次,记录实验数据如表所示:
实验 I Ⅱ Ⅲ
0.59 0.61 0.60
①重复操作3次的目的是______。
②平均每次HAc和NaOH溶液反应放出的热量为______J(已知水的比热容,ρ取1.0 g/mL计算,忽略溶液以外各物质吸收的热量,结果保留一位小数,下同)
③根据所学原理,可推知的热效应______kJ/mol。
19.(16分)氨气是化肥工业和有机化工的重要原料,在合成氨的理论可行性、工业化及机理等方面的研究上产生过三位诺贝尔奖得主。回答下列问题:
(1)科学家提出了合成氨反应吸附解离的机理,通过实验测得合成氨反应势能如图1所示:
图1
在合成氨吸附解离的过程中,状态最稳定的是______;与制备的热化学方程式为________________________。
(2)合成氨反应中,正反应速率,逆反应速率,、为速率常数。正反应和逆反应的平衡常数与温度的关系如图2所示:
图2
①表示正反应的平衡常数与温度变化关系的曲线为______(填“”或“”),理由为____________。
②时,______的关系是(填“>”、“<”和“=”)。
(3)以氨、丙烯、氧气为原料,在催化剂存在下生成丙烯腈()和副产物丙烯醛()的热化学方程式如下:
主反应: ;
副反应: 。
已知:丙烯腈的产率,丙烯腈的选择性,某气体分压=总压强×该气体物质的量分数。
①一定条件下,平衡时丙烯腈的选择性与温度、压强的关系如图3所示,则、、由大到小的顺序为______。原因是____________。
图3
②某温度下,向压强恒为100 kPa的密闭容器中通入1 mol 、1 mol 、1.5 mol 和0.1 mol Ar发生上述反应。平衡时测得转化率为90%,的物质的量为2.5 mol,此温度下副反应的______(为平衡气体组分分压表示的平衡常数)。
(4)我国科学家实现了在室温下电催化制取和,装置如图所示,其中双极膜复合层之间的水能解离成和,双极膜能实现、的定向移动。
①电解时,双极膜产生的向______(填“A”或“B”)极移动。
②电解的阴极反应式为:______。
荆门市2023-2024学年高二上学期期末学业水平检测
化学参考答案及评分细则
一、选择题:本题共15小题,每小题3分,共45分。
题号 1 2 3 4 5 6 7 8
答案 D C C B B C B C
题号 9 10 11 12 13 14 15
答案 D A A D B B D
二、非选择题(本大题共4小题,共55分)
16.(11分,除标注外,每空2分)
(1)乙烯(1分) (2)(1分)
(3)加成反应(1分) (4)H
(1)增大接触面积(给1分),提高酸浸的速率,使酸浸更充分(给1分)。
(2)、
(3) (4)ac 5≤pH<7.7
(5)向滤液中缓慢滴加溶液 (6)0.096
18.(14分,除标注外,每空2分)
(1)①6.3 ②C (2)①酚酞(1分) ②0.1050 ③<
(3)①减少实验误差,提高实验结果准确性(1分) ②501.60 ③+7.1
19.(16分,除标注外,每空2分)
(1)N(ad)+3H(ad)(1分)
(2)①(1分),正反应为放热反应,升高温度平衡逆向移动,正反应平衡常数减小,则表示正反应的平衡常数与温度变化关系。 ②(1分)
(3)(1分);生成丙烯腈的反应是气体分子总数增大的反应,而副反应为气体分子总数不变的反应,压强增大,生成丙烯腈的反应平衡逆向移动,丙烯腈选择性降低。 ②12.5
(4)A(1分)
同课章节目录
