山东省滨州市2023-2024学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 山东省滨州市2023-2024学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-22 19:18:40 | ||
图片预览



文档简介
试卷类型:A
滨州市2023-2024学年高二上学期期末考试化学试题
2024.1
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共10页,满分100分,考试时间90分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。将条形码横贴在答题卡对应位置“条形码粘贴处”。
2.第Ⅰ卷每小题选出答案后,用2B铅笔在答题卡上将对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试卷上。
3.第Ⅱ卷所有题目的答案,考生须用0.5毫米黑色签字笔答在答题卡规定的区域内,在试卷上答题不得分。
4.考试结束,监考人员将答题卡收回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 V 51 I 127
第Ⅰ卷 选择题(共40分)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与生产、生活密切相关。下列说法正确的是( )
A.明矾可用于自来水的净化,其作用原理与漂白粉不同
B.泡沫灭火器内玻璃筒中盛放浓溶液,铁筒中盛放浓溶液
C.误服可溶性钡盐后应尽快用5%的溶液洗胃
D.基于界面效应的新型开关中含有的碲元素和钛元素都属于过渡元素
2.观微知宏,万物皆备。下列说法错误的是( )
A.烟花绚丽的颜色与电子跃迁有关
B.舞台上干冰升华与共价键断裂有关
C.美丽溶洞的形成与沉淀溶解平衡有关
D.苯分子的正六边形完美对称结构与大键有关
3.下列化学用语表示正确的是( )
A.的VSEPR模型:
B.NaCl的电子式:
C.甲醛分子中键的电子云轮廓图:
D.基态价电子排布式:
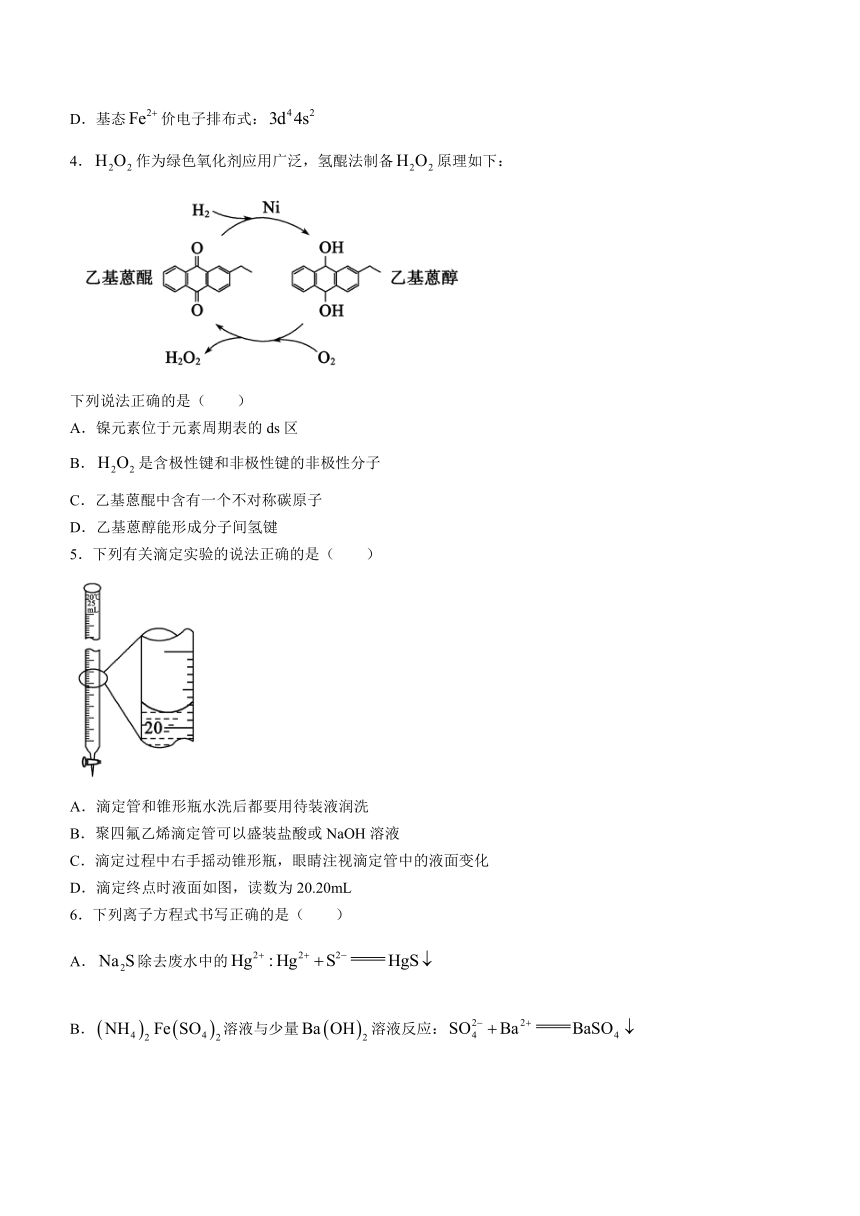
4.作为绿色氧化剂应用广泛,氢醌法制备原理如下:
下列说法正确的是( )
A.镍元素位于元素周期表的ds区
B.是含极性键和非极性键的非极性分子
C.乙基蒽醌中含有一个不对称碳原子
D.乙基蒽醇能形成分子间氢键
5.下列有关滴定实验的说法正确的是( )
A.滴定管和锥形瓶水洗后都要用待装液润洗
B.聚四氟乙烯滴定管可以盛装盐酸或NaOH溶液
C.滴定过程中右手摇动锥形瓶,眼睛注视滴定管中的液面变化
D.滴定终点时液面如图,读数为20.20mL
6.下列离子方程式书写正确的是( )
A.除去废水中的
B.溶液与少量溶液反应:
C.向溶液中滴加溶液:
D.向溶液中加入过量浓氨水:
7.下列装置或操作能达到实验目的的是( )
A.模拟侯氏制碱法获得
B.探究催化剂对反应速率的影响
C.检验溶液是否变质
D.测定NaClO溶液的pH
8.软包电池的关键组件是一种离子化合物,其结构如图。X、Y、Z、W、M、Q为原子序数依次增大的短周期元素,X元素基态原子最外层电子数是次外层电子数的一半,W和Q同主族。下列说法错误的是( )
A.简单离子半径:
B.简单氢化物的稳定性:
C.第一电离能:
D.相同条件下,在水中的溶解度:
9.、、、都是重要的含氮微粒。下列说法错误的是( )
A.与互为等电子体 B.中心原子采取杂化
C.键角: D.的空间结构为角形
10.一定条件下 。向2L恒温恒容密闭容器中充入1mol和3mol,在两种不同催化剂作用下建立平衡,的转化率随时间的变化曲线如图。下列说法错误的是( )
A.该反应的活化能:过程Ⅱ>过程Ⅰ
B.过程Ⅰ,时刻改变的反应条件可能是升高温度
C.过程Ⅱ,时段的化学反应速率
D.过程Ⅱ,时刻向容器中再充入1mol和3mol,平衡后的转化率大于80%
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.室温下,用含少量的溶液制备的过程如图。
已知:①室温下,,;
②当,可认为离子沉淀完全。
下列说法正确的是( )
A.配制溶液时需加盐酸抑制水解
B.溶液中:
C.为确保沉淀完全,除钙后的溶液中氟离子浓度至少为
D.“沉铁”时发生反应的离子方程式:
12.由实验操作和现象所得结论正确的是( )
选项 实验操作和现象 结论
A 等量的柠檬酸钠分别加入等体积的盐酸和水中,用温度传感器测得前者温度更低 柠檬酸钠与盐酸的反应为吸热反应
B 将盐酸酸化的溶液加水稀释,溶液颜色由黄绿色变为绿色,最终变为蓝色 溶液中浓度减小,浓度增大
C 压缩和的混合气体,气体颜色变深 反应的平衡逆向移动
D 向溶液中加入溶液,产生白色沉淀;再加入溶液,产生红褐色沉淀
13.氮氧化物是一类污染物,对生态系统和人体健康可造成危害。一种以沸石笼为载体对氮氧化物进行催化还原的原理如图。下列说法正确的是( )
A.过程Ⅰ中有键和键形成 B.过程Ⅱ中只做还原剂
C.沸石笼可降低该反应的 D.总反应:
14.丙烯可以在催化剂作用下由丙烷直接脱氢制备: 。若总压恒定为100kPa,向密闭容器中通入和的混合气体(不参与反应),时,的平衡转化率与通入气体中物质的量分数的关系如图。下列说法正确的是( )
A.当混合气体密度不随时间变化时,该反应达到化学平衡状态
B.平衡后,通入可提高的平衡转化率
C.选择高效催化剂可提高丙烷的脱氢速率和丙烯的平衡产率
D.时,丙烷脱氢反应的平衡常数(用平衡分压代替平衡浓度,分压总压物质的量分数)
15.已知是难溶于水、可溶于酸的盐。常温下用HCl调节浊液的pH,测得体系中(X为或)与的关系如图。
下列说法错误的是( )
A.代表与的变化曲线
B.的数量级为
C.a点,
D.c点,
第Ⅱ卷 非选择题(共60分)
三、非选择题:本题共5小题,共60分。
16.(12分)含碳化合物对环境、生产和人类生命活动有很大影响。回答下列有关问题:
(1)在催化剂作用下,可实现如下转化:
基态锌原子价电子轨道表示式为______,其在周期表中的位置为______,乙中碳原子的杂化方式有______种。
(2)工业上以为碳源可以合成乙醇和二甲醚,乙醇的沸点高于二甲醚,试解释原因______。
(3)光气是一种有毒气体,其组成元素的电负性由大到小的顺序为______;若把光气分子中的氯原子换成氟原子,推测键角______键角(填“>”“<”或“=”)。
(4)甲基咪唑()的离子液体有利于水合物生成,该物质中大键可表示为______(大键可用表示,m、n分别代表参与形成大键的电子数和原子数);甲基咪唑()中______(填“①”或“②”)号N原子更容易形成配位键。
17.(12分)含氮物质种类繁多,实验小组对不同含氮物质做了相关研究。
(1)能与形成具有对称空间结构的。若中两个分别被取代,能得到a、b两种不同结构的:
①a、b在水中的溶解度a______b(填“>”“<”或“=”)。
②的空间结构为______,1mol中含有配位键的数目为______(用表示)。
(2)乙二胺是二元弱碱,分步电离,在水中的电离类似于氨。25℃时,乙二胺溶液中各含氮微粒的物质的量分数与溶液的关系如图。
①在水中的第二步电离方程式为______;乙二胺一级电离平衡常数______。
②C点的______。
③将盐酸滴入乙二胺溶液中,pOH由4.9增大到7.9的过程中,水的电离程度______(填“增大”“减小”“先增大后减小”或“先减小后增大”);时,溶液中______(填“>”“<”或“=”)。
18.(12分)二氯异氰尿酸钠是一种高效广谱杀菌消毒剂,常温下为白色固体,难溶于冷水。实验室中,先向NaOH溶液通入产生高浓度NaClO溶液,再与氰尿酸吡啶溶液反应制备二氯异氰尿酸钠并测其纯度。
已知:,该反应为放热反应。
回答下列问题:
(1)装置A中a的作用为______,装置C中试剂可选用______。
(2)装置存在一处缺陷,会导致装置B中NaOH的利用率降低,改进方法是______。
(3)三颈烧瓶液面上方出现黄绿色气体时,由上口加入的吡啶溶液,反应过程中仍需不断通入,原因是______。
(4)反应结束后,B中浊液经过滤、______、干燥得到粗产品。
(5)利用碘量法测定粗产品中二氯异氰尿酸钠的纯度,原理为:
。
准确称取粗产品,溶于无氧蒸馏水配成100mL溶液;取25.00mL溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;加入淀粉溶液作指示剂,用标准溶液滴定至终点,消耗标准溶液。
①滴定终点的现象是:当滴入最后半滴标准溶液时,______。
②粗产品中二氯异氰尿酸钠的纯度为______%(用含m、c、V的代数式表示)。
③若碘量瓶中加入稀硫酸的量过少,将导致粗产品中二氯异氰尿酸钠的纯度______(填“偏低”“偏高”或“无影响”)。
19.(12分)是接触法制硫酸的催化剂。工业上用钒炉渣(主要含有,还含有少量、等杂质)制备的流程如图。
回答下列问题:
(1)为加快钒炉渣的焙烧速率,可采取的措施有______(写一条即可),“焙烧”的目的是将转化为可溶性的,写出该反应的化学方程式______。
(2)“水浸”后,浸出渣的主要成分为______(填化学式)。
(3)“除硅、磷”时,滤渣的主要成分是、,常温下,、的沉淀溶解平衡曲线如图。
①若混合溶液中和的浓度相等,则滴加溶液时,先产生的沉淀为______(填化学式)。
②“除硅、磷”后,若滤液中,则该滤液中______。
(4)“沉钒”时的离子方程式为______。
(5)在焙烧的过程中,固体残留率()随温度变化的曲线如图。210℃时,剩余固体物质的化学式为______;产生气体的空间结构为______。
20.(12分)乙烯产量是衡量一个国家石油化工发展水平的重要标志,制备方法有多种。
回答下列问题:
Ⅰ.甲烷催化制乙烯
反应ⅰ:
反应ⅱ:
反应ⅲ:
(1)反应ⅲ的平衡常数______(用、表示)。
(2)某温度下,反应ⅰ的,,、为速率常数。升高温度,______(填“增大”“减小”或“不变”)。
(3)一定温度下,向恒容密闭容器中充入一定量发生反应,体系中含碳气体平衡分压的对数随温度降低的变化曲线如图,曲线乙表示的物质为______(填化学式)。
Ⅱ.二氧化碳加氢制乙烯
反应ⅰ(主反应):
反应ⅱ(副反应):
向密闭容器中通入2mol和6mol发生反应,在不同压强下,的平衡转化率随温度的变化如图。
(4)、、由小到大的顺序为______。
(5)压强下,650℃后的平衡转化率随温度升高而增大的原因是______。
(6)A点,乙烯的选择性,则的转化率为______(保留两位有效数字)。该温度下,反应ⅱ的平衡常数______(用平衡分压代替平衡浓度,分压总压物质的量分数,保留两位有效数字)。
高二化学试题参考答案
2024.1
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.A 2.B 3.C 4.D 5.B 6.A 7.B 8.C 9.D 10.C
二、选择题:本题包括5小题,每小题4分,共20分。每小题有1个或2个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.CD 12.A 13.AD 14.AB 15.C
三、非选择题:本题共5小题,共60分。
16.(12分,除标注外,每空2分)
(1) 第4周期ⅡB族 2
(2)乙醇能形成分子间氢键
(3)
(4) ②
17.(12分,除标注外,每空2分)
(1)① ②平面正方形
(2)①
②6.4 ③增大
18.(12分,除标注外,每空2分)
(1)平衡气压,使浓盐酸顺利滴下 氢氧化钠溶液
(2)在装置A、B之间增加盛有饱和食盐水的洗气瓶
(3)使生成的NaOH转化为NaClO继续参与反应,以提高原料利用率
(4)冷水洗涤
(5)①锥形瓶内溶液的蓝色恰好褪去,且半分钟不恢复原色
② ③偏低
19.(12分,除标注外,每空2分)
(1)将钒炉渣粉碎
(2)
(3)① ②
(4)
(5) 三角锥形
20.(12分,除标注外,每空2分)
(1)
(2)增大
(3)
(4)
(5)反应ⅰ为放热反应、反应ⅱ为吸热反应,650℃以后,升高温度对反应ⅱ平衡正向移动的影响大于对反应ⅰ平衡逆向移动的影响,使得的平衡转化率随着温度的升高而增大。
(6)63% 0.39
滨州市2023-2024学年高二上学期期末考试化学试题
2024.1
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共10页,满分100分,考试时间90分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。将条形码横贴在答题卡对应位置“条形码粘贴处”。
2.第Ⅰ卷每小题选出答案后,用2B铅笔在答题卡上将对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试卷上。
3.第Ⅱ卷所有题目的答案,考生须用0.5毫米黑色签字笔答在答题卡规定的区域内,在试卷上答题不得分。
4.考试结束,监考人员将答题卡收回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 V 51 I 127
第Ⅰ卷 选择题(共40分)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与生产、生活密切相关。下列说法正确的是( )
A.明矾可用于自来水的净化,其作用原理与漂白粉不同
B.泡沫灭火器内玻璃筒中盛放浓溶液,铁筒中盛放浓溶液
C.误服可溶性钡盐后应尽快用5%的溶液洗胃
D.基于界面效应的新型开关中含有的碲元素和钛元素都属于过渡元素
2.观微知宏,万物皆备。下列说法错误的是( )
A.烟花绚丽的颜色与电子跃迁有关
B.舞台上干冰升华与共价键断裂有关
C.美丽溶洞的形成与沉淀溶解平衡有关
D.苯分子的正六边形完美对称结构与大键有关
3.下列化学用语表示正确的是( )
A.的VSEPR模型:
B.NaCl的电子式:
C.甲醛分子中键的电子云轮廓图:
D.基态价电子排布式:
4.作为绿色氧化剂应用广泛,氢醌法制备原理如下:
下列说法正确的是( )
A.镍元素位于元素周期表的ds区
B.是含极性键和非极性键的非极性分子
C.乙基蒽醌中含有一个不对称碳原子
D.乙基蒽醇能形成分子间氢键
5.下列有关滴定实验的说法正确的是( )
A.滴定管和锥形瓶水洗后都要用待装液润洗
B.聚四氟乙烯滴定管可以盛装盐酸或NaOH溶液
C.滴定过程中右手摇动锥形瓶,眼睛注视滴定管中的液面变化
D.滴定终点时液面如图,读数为20.20mL
6.下列离子方程式书写正确的是( )
A.除去废水中的
B.溶液与少量溶液反应:
C.向溶液中滴加溶液:
D.向溶液中加入过量浓氨水:
7.下列装置或操作能达到实验目的的是( )
A.模拟侯氏制碱法获得
B.探究催化剂对反应速率的影响
C.检验溶液是否变质
D.测定NaClO溶液的pH
8.软包电池的关键组件是一种离子化合物,其结构如图。X、Y、Z、W、M、Q为原子序数依次增大的短周期元素,X元素基态原子最外层电子数是次外层电子数的一半,W和Q同主族。下列说法错误的是( )
A.简单离子半径:
B.简单氢化物的稳定性:
C.第一电离能:
D.相同条件下,在水中的溶解度:
9.、、、都是重要的含氮微粒。下列说法错误的是( )
A.与互为等电子体 B.中心原子采取杂化
C.键角: D.的空间结构为角形
10.一定条件下 。向2L恒温恒容密闭容器中充入1mol和3mol,在两种不同催化剂作用下建立平衡,的转化率随时间的变化曲线如图。下列说法错误的是( )
A.该反应的活化能:过程Ⅱ>过程Ⅰ
B.过程Ⅰ,时刻改变的反应条件可能是升高温度
C.过程Ⅱ,时段的化学反应速率
D.过程Ⅱ,时刻向容器中再充入1mol和3mol,平衡后的转化率大于80%
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.室温下,用含少量的溶液制备的过程如图。
已知:①室温下,,;
②当,可认为离子沉淀完全。
下列说法正确的是( )
A.配制溶液时需加盐酸抑制水解
B.溶液中:
C.为确保沉淀完全,除钙后的溶液中氟离子浓度至少为
D.“沉铁”时发生反应的离子方程式:
12.由实验操作和现象所得结论正确的是( )
选项 实验操作和现象 结论
A 等量的柠檬酸钠分别加入等体积的盐酸和水中,用温度传感器测得前者温度更低 柠檬酸钠与盐酸的反应为吸热反应
B 将盐酸酸化的溶液加水稀释,溶液颜色由黄绿色变为绿色,最终变为蓝色 溶液中浓度减小,浓度增大
C 压缩和的混合气体,气体颜色变深 反应的平衡逆向移动
D 向溶液中加入溶液,产生白色沉淀;再加入溶液,产生红褐色沉淀
13.氮氧化物是一类污染物,对生态系统和人体健康可造成危害。一种以沸石笼为载体对氮氧化物进行催化还原的原理如图。下列说法正确的是( )
A.过程Ⅰ中有键和键形成 B.过程Ⅱ中只做还原剂
C.沸石笼可降低该反应的 D.总反应:
14.丙烯可以在催化剂作用下由丙烷直接脱氢制备: 。若总压恒定为100kPa,向密闭容器中通入和的混合气体(不参与反应),时,的平衡转化率与通入气体中物质的量分数的关系如图。下列说法正确的是( )
A.当混合气体密度不随时间变化时,该反应达到化学平衡状态
B.平衡后,通入可提高的平衡转化率
C.选择高效催化剂可提高丙烷的脱氢速率和丙烯的平衡产率
D.时,丙烷脱氢反应的平衡常数(用平衡分压代替平衡浓度,分压总压物质的量分数)
15.已知是难溶于水、可溶于酸的盐。常温下用HCl调节浊液的pH,测得体系中(X为或)与的关系如图。
下列说法错误的是( )
A.代表与的变化曲线
B.的数量级为
C.a点,
D.c点,
第Ⅱ卷 非选择题(共60分)
三、非选择题:本题共5小题,共60分。
16.(12分)含碳化合物对环境、生产和人类生命活动有很大影响。回答下列有关问题:
(1)在催化剂作用下,可实现如下转化:
基态锌原子价电子轨道表示式为______,其在周期表中的位置为______,乙中碳原子的杂化方式有______种。
(2)工业上以为碳源可以合成乙醇和二甲醚,乙醇的沸点高于二甲醚,试解释原因______。
(3)光气是一种有毒气体,其组成元素的电负性由大到小的顺序为______;若把光气分子中的氯原子换成氟原子,推测键角______键角(填“>”“<”或“=”)。
(4)甲基咪唑()的离子液体有利于水合物生成,该物质中大键可表示为______(大键可用表示,m、n分别代表参与形成大键的电子数和原子数);甲基咪唑()中______(填“①”或“②”)号N原子更容易形成配位键。
17.(12分)含氮物质种类繁多,实验小组对不同含氮物质做了相关研究。
(1)能与形成具有对称空间结构的。若中两个分别被取代,能得到a、b两种不同结构的:
①a、b在水中的溶解度a______b(填“>”“<”或“=”)。
②的空间结构为______,1mol中含有配位键的数目为______(用表示)。
(2)乙二胺是二元弱碱,分步电离,在水中的电离类似于氨。25℃时,乙二胺溶液中各含氮微粒的物质的量分数与溶液的关系如图。
①在水中的第二步电离方程式为______;乙二胺一级电离平衡常数______。
②C点的______。
③将盐酸滴入乙二胺溶液中,pOH由4.9增大到7.9的过程中,水的电离程度______(填“增大”“减小”“先增大后减小”或“先减小后增大”);时,溶液中______(填“>”“<”或“=”)。
18.(12分)二氯异氰尿酸钠是一种高效广谱杀菌消毒剂,常温下为白色固体,难溶于冷水。实验室中,先向NaOH溶液通入产生高浓度NaClO溶液,再与氰尿酸吡啶溶液反应制备二氯异氰尿酸钠并测其纯度。
已知:,该反应为放热反应。
回答下列问题:
(1)装置A中a的作用为______,装置C中试剂可选用______。
(2)装置存在一处缺陷,会导致装置B中NaOH的利用率降低,改进方法是______。
(3)三颈烧瓶液面上方出现黄绿色气体时,由上口加入的吡啶溶液,反应过程中仍需不断通入,原因是______。
(4)反应结束后,B中浊液经过滤、______、干燥得到粗产品。
(5)利用碘量法测定粗产品中二氯异氰尿酸钠的纯度,原理为:
。
准确称取粗产品,溶于无氧蒸馏水配成100mL溶液;取25.00mL溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;加入淀粉溶液作指示剂,用标准溶液滴定至终点,消耗标准溶液。
①滴定终点的现象是:当滴入最后半滴标准溶液时,______。
②粗产品中二氯异氰尿酸钠的纯度为______%(用含m、c、V的代数式表示)。
③若碘量瓶中加入稀硫酸的量过少,将导致粗产品中二氯异氰尿酸钠的纯度______(填“偏低”“偏高”或“无影响”)。
19.(12分)是接触法制硫酸的催化剂。工业上用钒炉渣(主要含有,还含有少量、等杂质)制备的流程如图。
回答下列问题:
(1)为加快钒炉渣的焙烧速率,可采取的措施有______(写一条即可),“焙烧”的目的是将转化为可溶性的,写出该反应的化学方程式______。
(2)“水浸”后,浸出渣的主要成分为______(填化学式)。
(3)“除硅、磷”时,滤渣的主要成分是、,常温下,、的沉淀溶解平衡曲线如图。
①若混合溶液中和的浓度相等,则滴加溶液时,先产生的沉淀为______(填化学式)。
②“除硅、磷”后,若滤液中,则该滤液中______。
(4)“沉钒”时的离子方程式为______。
(5)在焙烧的过程中,固体残留率()随温度变化的曲线如图。210℃时,剩余固体物质的化学式为______;产生气体的空间结构为______。
20.(12分)乙烯产量是衡量一个国家石油化工发展水平的重要标志,制备方法有多种。
回答下列问题:
Ⅰ.甲烷催化制乙烯
反应ⅰ:
反应ⅱ:
反应ⅲ:
(1)反应ⅲ的平衡常数______(用、表示)。
(2)某温度下,反应ⅰ的,,、为速率常数。升高温度,______(填“增大”“减小”或“不变”)。
(3)一定温度下,向恒容密闭容器中充入一定量发生反应,体系中含碳气体平衡分压的对数随温度降低的变化曲线如图,曲线乙表示的物质为______(填化学式)。
Ⅱ.二氧化碳加氢制乙烯
反应ⅰ(主反应):
反应ⅱ(副反应):
向密闭容器中通入2mol和6mol发生反应,在不同压强下,的平衡转化率随温度的变化如图。
(4)、、由小到大的顺序为______。
(5)压强下,650℃后的平衡转化率随温度升高而增大的原因是______。
(6)A点,乙烯的选择性,则的转化率为______(保留两位有效数字)。该温度下,反应ⅱ的平衡常数______(用平衡分压代替平衡浓度,分压总压物质的量分数,保留两位有效数字)。
高二化学试题参考答案
2024.1
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.A 2.B 3.C 4.D 5.B 6.A 7.B 8.C 9.D 10.C
二、选择题:本题包括5小题,每小题4分,共20分。每小题有1个或2个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.CD 12.A 13.AD 14.AB 15.C
三、非选择题:本题共5小题,共60分。
16.(12分,除标注外,每空2分)
(1) 第4周期ⅡB族 2
(2)乙醇能形成分子间氢键
(3)
(4) ②
17.(12分,除标注外,每空2分)
(1)① ②平面正方形
(2)①
②6.4 ③增大
18.(12分,除标注外,每空2分)
(1)平衡气压,使浓盐酸顺利滴下 氢氧化钠溶液
(2)在装置A、B之间增加盛有饱和食盐水的洗气瓶
(3)使生成的NaOH转化为NaClO继续参与反应,以提高原料利用率
(4)冷水洗涤
(5)①锥形瓶内溶液的蓝色恰好褪去,且半分钟不恢复原色
② ③偏低
19.(12分,除标注外,每空2分)
(1)将钒炉渣粉碎
(2)
(3)① ②
(4)
(5) 三角锥形
20.(12分,除标注外,每空2分)
(1)
(2)增大
(3)
(4)
(5)反应ⅰ为放热反应、反应ⅱ为吸热反应,650℃以后,升高温度对反应ⅱ平衡正向移动的影响大于对反应ⅰ平衡逆向移动的影响,使得的平衡转化率随着温度的升高而增大。
(6)63% 0.39
同课章节目录
