浙江省杭州市2023-2024学年高二上学期期末学业水平测试化学试题(含答案)
文档属性
| 名称 | 浙江省杭州市2023-2024学年高二上学期期末学业水平测试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-22 19:21:29 | ||
图片预览



文档简介
杭州市2023-2024学年高二上学期期末学业水平测试
化学试题卷
考生须知:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题),满分100分。考试时间90分钟;
2.答题前,在答题卷指定区域内填写学校、班级、姓名、考号、准考证号等相关信息;
3.所有答案必须写在答题卷上,写在试题卷上无效;
4,可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 K-39 Cl-35.5 Fe-56
Ⅰ卷
一、选择题(本题共16小题,每小题3分,共48分。每个小题只有一个正确答案)
1.下列职业与化学关联最小的是( )
A.机械工程师 B.水质检验员 C.科技考古工作 D.环境保护工程师
2,下列物质不属于新型无机非金属材料的是( )
A.玻璃纤维 B.光导纤维 C.金刚砂 D.碳纳米管
3.下列化学用语描述不正确的是( )
A.中子数为20的氯原子:
B.二氧化碳的空间填充模型:
C.的形成过程:
D.磷基态原子价层电子排布违背了洪特规则
4.硫酸亚铁应用广泛,有关其说法不正确的是( )
A.缺铁性贫血可服用硫酸亚铁片
B.的价层电子排布式为
C.铁元素位于元素周期表第四周期第Ⅷ族
D.硫酸亚铁可用作净水剂
5.物质的性质决定用途,下列两者对应关系不正确的是( )
A.溶液呈碱性,其热溶液可用于去除厨房油渍
B.难溶于水和酸且不能被射线穿透,可用作人体造影剂
C.具有强氧化性,可用作自来水消毒剂
D.钠、钾具有很强还原性,钠钾合金可用作核反应堆的传热介质
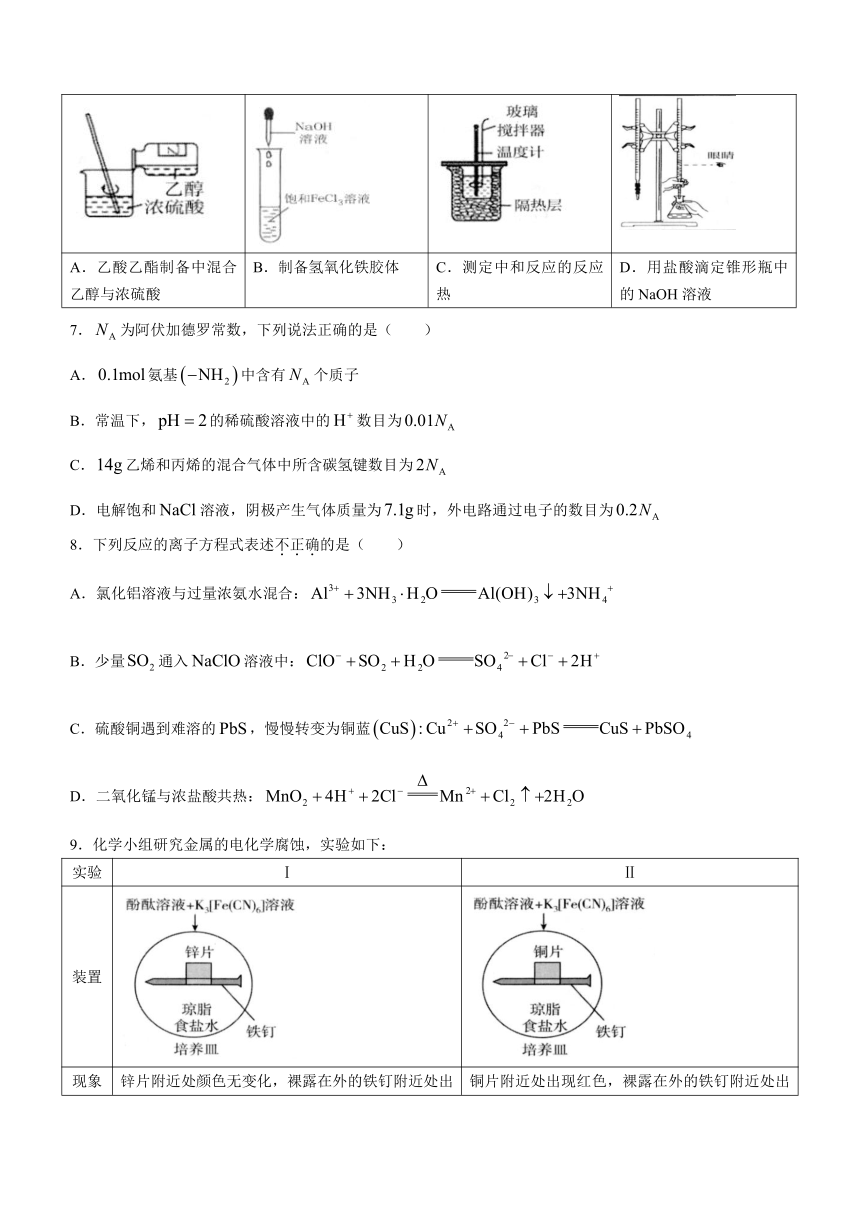
6.利用下列装置进行相关实验,其中方案设计与操作合理的是( )
A.乙酸乙酯制备中混合乙醇与浓硫酸 B.制备氢氧化铁胶体 C.测定中和反应的反应热 D.用盐酸滴定锥形瓶中的NaOH溶液
7.为阿伏加德罗常数,下列说法正确的是( )
A.氨基中含有个质子
B.常温下,的稀硫酸溶液中的数目为
C.乙烯和丙烯的混合气体中所含碳氢键数目为
D.电解饱和溶液,阴极产生气体质量为时,外电路通过电子的数目为
8.下列反应的离子方程式表述不正确的是( )
A.氯化铝溶液与过量浓氨水混合:
B.少量通入溶液中:
C.硫酸铜遇到难溶的,慢慢转变为铜蓝
D.二氧化锰与浓盐酸共热:
9.化学小组研究金属的电化学腐蚀,实验如下:
实验 Ⅰ Ⅱ
装置
现象 锌片附近处颜色无变化,裸露在外的铁钉附近处出现红色。 铜片附近处出现红色,裸露在外的铁钉附近处出现蓝色
下列说法正确的是( )
A.实验Ⅰ和Ⅱ中铁钉均为负极
B.实验Ⅰ和Ⅱ中均发生吸氧腐蚀,且铁钉腐蚀速度实验Ⅰ>实验Ⅱ
C.一段时间后,实验Ⅰ铁钉附近也出现了蓝色,可能是氧化了单质
D.一段时间后,实验Ⅰ和实验Ⅱ中均出现红褐色
10.是原子序数依次增大的前四周期元素,元素原子最高能级的不同轨道都有电子且自旋方向相同;元素原子的价层电子排布式是;其中元素的部分电离能如下表;含D元素的化合物焰色试验火焰呈紫色(透过蓝色钴玻璃)。下列说法不正确的是( )
元素 电离能
578 1817 2745 11575
A.离子半径大小:
B.C的最高价氧化物对应水化物可溶于D的最高价氧化物对应水化物的水溶液
C.化合物中含离子键和共价键
D.元素D的核外电子运动具有10种不同的空间运动状态
11.我国科研人员设计将脱除的反应与制备相结合的协同转化装置如图。在电场作用下,双极膜中间层的解离为和,并向两极迁移。
已知:①单独制备:,不能自发进行;
②单独脱除:,能自发进行。
下列说法不正确的是( )
A.②单独脱除反应的
B.协同转化工作时,透过双极膜向左侧移动
C.正极的电极反应式:
D.协同转化总反应:
12.葡萄中含有一种二元有机弱酸酒石酸,下列关于酒石酸钠钾的说法不正确的是( )
A.属于正盐
B.向水中加入固体,可促进水的电离
C.将溶液中加水稀释10倍,增大
D.溶液中:
13.已知:气态分子中化学键解离成气态原子所吸收的能量叫键能。恒容密闭容器中发生反应:。有关数据如下:
化学键
键能 436 391 946
下列叙述正确的是( )
A.
B.当容器中压强不再变化时,反应到达平衡状态
C.增大的浓度和使用催化剂均可提高的平衡转化率
D.增大浓度可增大活化分子百分数,使反应速率增大
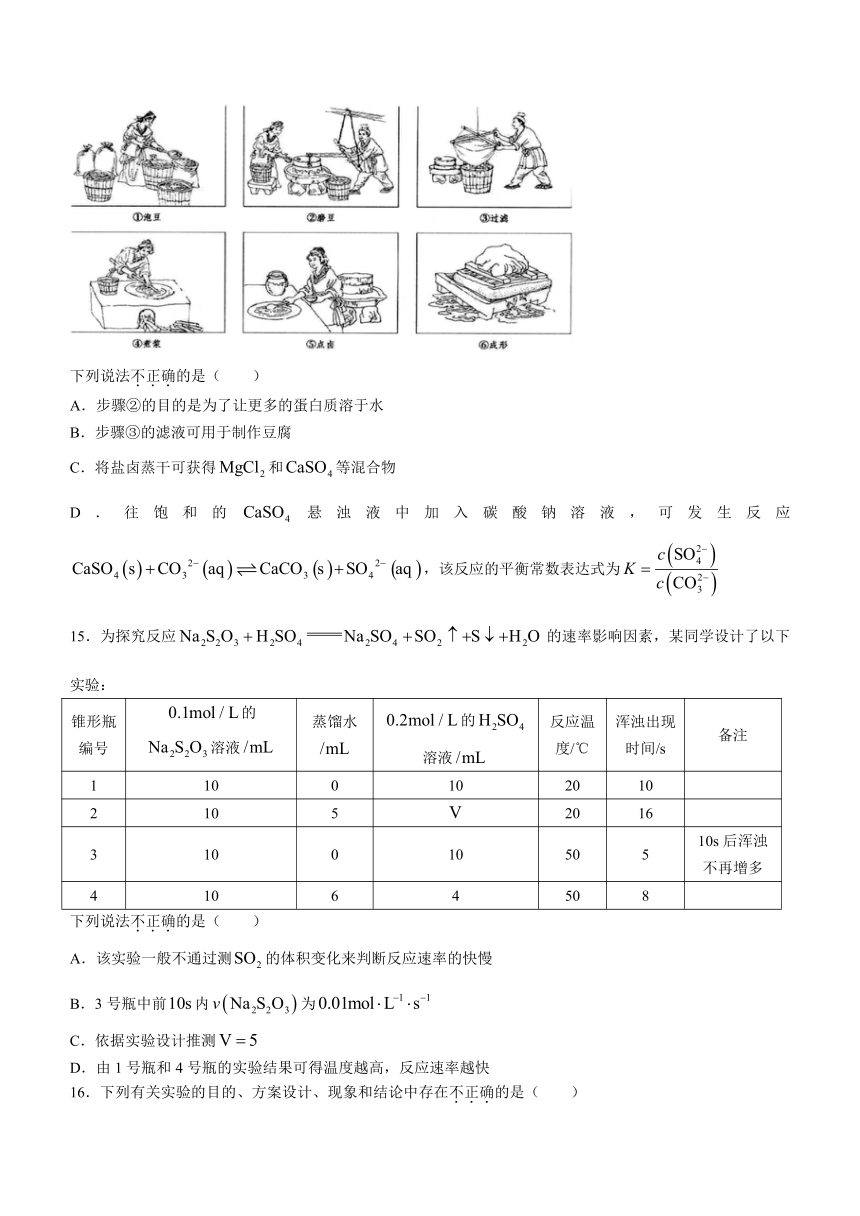
14.豆腐是我国具有悠久历史的传统美食,其制作流程如下,步骤⑤利用盐卤(氯化镁、硫酸钙等)使豆浆中的蛋白质聚沉。
下列说法不正确的是( )
A.步骤②的目的是为了让更多的蛋白质溶于水
B.步骤③的滤液可用于制作豆腐
C.将盐卤蒸干可获得和等混合物
D.往饱和的悬浊液中加入碳酸钠溶液,可发生反应,该反应的平衡常数表达式为
15.为探究反应的速率影响因素,某同学设计了以下实验:
锥形瓶编号 的溶液 蒸馏水 的溶液 反应温度/℃ 浑浊出现时间/s 备注
1 10 0 10 20 10
2 10 5 20 16
3 10 0 10 50 5 10s后浑浊不再增多
4 10 6 4 50 8
下列说法不正确的是( )
A.该实验一般不通过测的体积变化来判断反应速率的快慢
B.3号瓶中前内为
C.依据实验设计推测
D.由1号瓶和4号瓶的实验结果可得温度越高,反应速率越快
16.下列有关实验的目的、方案设计、现象和结论中存在不正确的是( )
选项 实验目的 方案设计 现象和结论
A 探究淀粉能否在酸性条件下水解 在试管中加淀粉和溶液,加热,再加少量新制,加热 无明显现象,说明淀粉未发生水解。
B 探究硅、硫元素的非金属性强弱 在试管中加入的溶液,然后向溶液滴加稀硫酸 试管中出现白色胶状沉淀,说明硫的非金属性比硅强
C 探究与的大小 向等浓度的、 混合溶液中滴入少量稀溶液 有黄色沉淀生成,说明
D 探究温度对下列平衡的影响: 取两支试管,分别加入的溶液,将其中一支先加热,然后置于冷水中,与另一支试管进行对比 加热时溶液变为黄色,置于冷水中后溶液由黄色变为蓝色,说明升高温度,平衡向吸热方向移动
Ⅱ卷
二、非选择题(本大题共5小题,共52分)
17.(10分)为庆祝“国际化学元素周期表年”,中国化学会面向会员遴选118名青年化学家,作为118个化学元素的“代言人”,吕华、田振玉、翟天佑分别成为N、O、S元素的代言人。回答下列问题:
(1)N、O、S三种元素的第一电离能由小到大排序为______。
(2)氮化铬在现代工业中发挥着重要的作用。基态铬、氮原子的未成对电子数之比为______。
(3)下列说法正确的是( )
A.元素的电负性大于元素,中元素显负价
B.的键能强于的键能,的热稳定性强于
C.与化合通常需要高温高压催化剂,而与化合一般只需要点燃,说明元素的非金属性强于元素
D.在冰醋酸中的酸性强于,说明的非金属强于元素
(4)已知与的结构相同,在中的化合价为______,的化合价为______。
(5)N、O和S元素位于周期表的______区,此区元素的价层电子排布特点是______。
18.(10分)燃煤火电厂产生的尾气(主要成分为)可以按如下流程脱除或利用已知:混合气体可直接排入空气请回答:
(1)写出过程Ⅰ中转化成反应的化学方程式______.
(2)下列说法正确的是( )
A.煤的主要成分是碳单质
B.过程Ⅰ中的作用是还原剂
C.将副产品硫酸锌送往浸出车间电解可回收金属锌和产生可循环使用的硫酸
D.过程Ⅱ中的也可用代替
(3)写出过程Ⅱ中与混合液反应的化学反应方程式______。
(4)的水溶液可以使品红褪色,其褪色原理如下
该反应的反应类型为______.
(5)设计实验方案检验过程中硫元素是否完全被氧化______。
19.(10分)磷是重要的元素,能形成多种含氧酸和含氧酸盐。请回答下列问题:
(1)已知(次磷酸)是一元中强酸,写出溶液与足量溶液反应的离子方程式:______。
(2)25℃时,向一定体积的亚磷酸溶液中滴加等物质的量浓度的溶液,混合液中含磷粒子的物质的量分数与溶液的关系如图所示。
①代表含磷粒子为______。
②的为______。
(3)过量含磷物质的排放会致使水体富营养化,因此发展水体除磷技术非常重要。磷酸铵镁结晶法回收废水中的磷是近几年的研究热点。其原理为:。
①时,磷去除率与初始溶液中的关系如题图1所示。为达到最佳除磷效果,并节约试剂,______。
②一定,磷去除率随溶液初始变化如图2所示。则最佳除磷效果的范围是______*,并说明原因______。
20.(12分)氢能是一种极具发展潜力的清洁能源,水煤气变换是一种常用的制氢方法,
其反应原理为:
已知:(ⅰ)
(ⅱ)
(ⅲ)
(1)反应的______。
(2)恒定总压和水碳比投料,在不同条件下达到平衡时和的分压(某成分分压总压该成分的物质的量分数)如下表:
条件1 0.30 0.30 0
条件2 0.32 0.26 0.02
①在条件1下,水煤气变换反应的分压平衡常数______。
②对比条件1,条件2中产率下降是因为发生了一个不涉及的副反应,写出该反应方程式______。
(3)科学家在水煤气变换中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。该反应历程图如下,其中吸附在催化剂表面的物种用“*”标注,TS指过渡态,部分产物用球棍模型表示。
与反应历程对应的微观示意图部分如下:
①该历程的决速步骤方程式为______。
②下列说法正确的是( )
A.过程Ⅱ既有化学键的断裂也有化学键的形成
B.过程Ⅲ的熵变为零
C.低温下实现高反应速率是因为该催化过程降低了水煤气变换反应的
D.过程Ⅳ的微观图示为:
(4)实验发现,其他条件不变,在相同时间内,向反应体系中投入一定量的可以增大的体积分数,其实验结果如图所示:
投入等质量的纳米比微米使的体积分数增大的原因可能是______。
21.(10分)三草酸合铁酸钾晶体一种感光剂和高效的污水处理剂。其制备流程如下
已知:易溶于水,难溶于乙醇
请回答下列问题:
(1)过程Ⅱ、Ⅲ在如下图所示装置中进行,过程Ⅱ中发生的反应为
。
①装置中盛放溶液的仪器名称为______。
②该过程需控制反应溶液温度不高于40℃的原因是______。
③制备过程中始终通入的主要作用是______。
(2)可用酸性标准液滴定样品中含量来测定晶体样品纯度。
①标准溶液滴定样品溶液前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏蒸馏水洗涤____________排除滴定管中气泡____________开始滴定
a.用标准溶液润洗2至3次
b.记录起始读数
c.调整标准液液面至零刻度或零刻度以下
d.装入标准液至碱式滴定管零刻度以上
e.装入标准液至酸式滴定管零刻度以上
f.用溶液润洗2至3次
②滴定终点的现象为:滴入最后半滴标准溶液,锥形瓶内溶液颜色______具半分钟内不变色。
③准确称取三草酸合铁酸钾晶体,配制成溶液,每次量取待测液,用浓度为的酸性溶液滴定,三次平行实验记录溶液数据如下:
序号 1 2 3
滴定前读数 0.98 1.26 1.01
滴定后读数 21.00 20.12 20.99
则该次实验制得的三草酸合铁酸钾晶体纯度为______%。
(3)下列有关上述实验说法正确的是______。
A.过程Ⅰ中的系列操作为过滤、洗涤、烘干
B.过程Ⅱ中若氧化不充分,会导致测定的样品纯度偏低
C.过程Ⅴ中加入乙醇的目的是降低的溶解度
D.滴定过程发现,开始滴入标准液,紫红色褪去慢,滴入一定量后,紫红色很快褪去,原因可能是反应生成的对滴定反应起催化作用
杭州市2023-2024学年高二上学期期末学业水平测试
化学参考答案
一、选择题(本题共16小题,每小题3分,共48分。每个小题只有一个正确答案)
题号 1 2 3 4 5 6 7 8
答案 A A C B D C C B
题号 9 10 11 12 13 14 15 16
答案 C A D C B C B A
二、非选择题(本大题共5小题,共52分)
17.(共10分)
(1)S(5),价层电子排布通式为
18.(共10分)
(1)
(2)BCD (3)
(4)加成或者化合。
(5)取少量固体溶于水配成溶液,取该溶液滴入适量酸性溶液,若溶液褪色,则未完全氧化;若不褪色,则说明完全氧化。(2分,其他合理方案均可)
19.(共10分)
(1)
(2)① ②
(3)①
②9~10或者9.5左右;过小,溶液与结合,导致溶解,磷去除下降;过大,溶液中与和反应,导致溶解,磷去除率下降;
20.(共12分)
(1)
(2)①0.5 ②
(3)①或者
②AD
(4)纳米具有更大的表面积,与气体反应速度更快,可以促使反应平衡右移,更快的空出催化剂的吸附位点(表面),加快化学反应。
21.(共10分)
(1)①分液漏斗 ②防止分解
③搅拌反应体系,增大反应物的接触面,加快反应速率或者防止浓度局部过高,氧化
(2)①ae(1分,错排不给分)cb(1分,错排不给分)
②由无色变浅红色
③81.83%
(3)CD
化学试题卷
考生须知:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题),满分100分。考试时间90分钟;
2.答题前,在答题卷指定区域内填写学校、班级、姓名、考号、准考证号等相关信息;
3.所有答案必须写在答题卷上,写在试题卷上无效;
4,可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 K-39 Cl-35.5 Fe-56
Ⅰ卷
一、选择题(本题共16小题,每小题3分,共48分。每个小题只有一个正确答案)
1.下列职业与化学关联最小的是( )
A.机械工程师 B.水质检验员 C.科技考古工作 D.环境保护工程师
2,下列物质不属于新型无机非金属材料的是( )
A.玻璃纤维 B.光导纤维 C.金刚砂 D.碳纳米管
3.下列化学用语描述不正确的是( )
A.中子数为20的氯原子:
B.二氧化碳的空间填充模型:
C.的形成过程:
D.磷基态原子价层电子排布违背了洪特规则
4.硫酸亚铁应用广泛,有关其说法不正确的是( )
A.缺铁性贫血可服用硫酸亚铁片
B.的价层电子排布式为
C.铁元素位于元素周期表第四周期第Ⅷ族
D.硫酸亚铁可用作净水剂
5.物质的性质决定用途,下列两者对应关系不正确的是( )
A.溶液呈碱性,其热溶液可用于去除厨房油渍
B.难溶于水和酸且不能被射线穿透,可用作人体造影剂
C.具有强氧化性,可用作自来水消毒剂
D.钠、钾具有很强还原性,钠钾合金可用作核反应堆的传热介质
6.利用下列装置进行相关实验,其中方案设计与操作合理的是( )
A.乙酸乙酯制备中混合乙醇与浓硫酸 B.制备氢氧化铁胶体 C.测定中和反应的反应热 D.用盐酸滴定锥形瓶中的NaOH溶液
7.为阿伏加德罗常数,下列说法正确的是( )
A.氨基中含有个质子
B.常温下,的稀硫酸溶液中的数目为
C.乙烯和丙烯的混合气体中所含碳氢键数目为
D.电解饱和溶液,阴极产生气体质量为时,外电路通过电子的数目为
8.下列反应的离子方程式表述不正确的是( )
A.氯化铝溶液与过量浓氨水混合:
B.少量通入溶液中:
C.硫酸铜遇到难溶的,慢慢转变为铜蓝
D.二氧化锰与浓盐酸共热:
9.化学小组研究金属的电化学腐蚀,实验如下:
实验 Ⅰ Ⅱ
装置
现象 锌片附近处颜色无变化,裸露在外的铁钉附近处出现红色。 铜片附近处出现红色,裸露在外的铁钉附近处出现蓝色
下列说法正确的是( )
A.实验Ⅰ和Ⅱ中铁钉均为负极
B.实验Ⅰ和Ⅱ中均发生吸氧腐蚀,且铁钉腐蚀速度实验Ⅰ>实验Ⅱ
C.一段时间后,实验Ⅰ铁钉附近也出现了蓝色,可能是氧化了单质
D.一段时间后,实验Ⅰ和实验Ⅱ中均出现红褐色
10.是原子序数依次增大的前四周期元素,元素原子最高能级的不同轨道都有电子且自旋方向相同;元素原子的价层电子排布式是;其中元素的部分电离能如下表;含D元素的化合物焰色试验火焰呈紫色(透过蓝色钴玻璃)。下列说法不正确的是( )
元素 电离能
578 1817 2745 11575
A.离子半径大小:
B.C的最高价氧化物对应水化物可溶于D的最高价氧化物对应水化物的水溶液
C.化合物中含离子键和共价键
D.元素D的核外电子运动具有10种不同的空间运动状态
11.我国科研人员设计将脱除的反应与制备相结合的协同转化装置如图。在电场作用下,双极膜中间层的解离为和,并向两极迁移。
已知:①单独制备:,不能自发进行;
②单独脱除:,能自发进行。
下列说法不正确的是( )
A.②单独脱除反应的
B.协同转化工作时,透过双极膜向左侧移动
C.正极的电极反应式:
D.协同转化总反应:
12.葡萄中含有一种二元有机弱酸酒石酸,下列关于酒石酸钠钾的说法不正确的是( )
A.属于正盐
B.向水中加入固体,可促进水的电离
C.将溶液中加水稀释10倍,增大
D.溶液中:
13.已知:气态分子中化学键解离成气态原子所吸收的能量叫键能。恒容密闭容器中发生反应:。有关数据如下:
化学键
键能 436 391 946
下列叙述正确的是( )
A.
B.当容器中压强不再变化时,反应到达平衡状态
C.增大的浓度和使用催化剂均可提高的平衡转化率
D.增大浓度可增大活化分子百分数,使反应速率增大
14.豆腐是我国具有悠久历史的传统美食,其制作流程如下,步骤⑤利用盐卤(氯化镁、硫酸钙等)使豆浆中的蛋白质聚沉。
下列说法不正确的是( )
A.步骤②的目的是为了让更多的蛋白质溶于水
B.步骤③的滤液可用于制作豆腐
C.将盐卤蒸干可获得和等混合物
D.往饱和的悬浊液中加入碳酸钠溶液,可发生反应,该反应的平衡常数表达式为
15.为探究反应的速率影响因素,某同学设计了以下实验:
锥形瓶编号 的溶液 蒸馏水 的溶液 反应温度/℃ 浑浊出现时间/s 备注
1 10 0 10 20 10
2 10 5 20 16
3 10 0 10 50 5 10s后浑浊不再增多
4 10 6 4 50 8
下列说法不正确的是( )
A.该实验一般不通过测的体积变化来判断反应速率的快慢
B.3号瓶中前内为
C.依据实验设计推测
D.由1号瓶和4号瓶的实验结果可得温度越高,反应速率越快
16.下列有关实验的目的、方案设计、现象和结论中存在不正确的是( )
选项 实验目的 方案设计 现象和结论
A 探究淀粉能否在酸性条件下水解 在试管中加淀粉和溶液,加热,再加少量新制,加热 无明显现象,说明淀粉未发生水解。
B 探究硅、硫元素的非金属性强弱 在试管中加入的溶液,然后向溶液滴加稀硫酸 试管中出现白色胶状沉淀,说明硫的非金属性比硅强
C 探究与的大小 向等浓度的、 混合溶液中滴入少量稀溶液 有黄色沉淀生成,说明
D 探究温度对下列平衡的影响: 取两支试管,分别加入的溶液,将其中一支先加热,然后置于冷水中,与另一支试管进行对比 加热时溶液变为黄色,置于冷水中后溶液由黄色变为蓝色,说明升高温度,平衡向吸热方向移动
Ⅱ卷
二、非选择题(本大题共5小题,共52分)
17.(10分)为庆祝“国际化学元素周期表年”,中国化学会面向会员遴选118名青年化学家,作为118个化学元素的“代言人”,吕华、田振玉、翟天佑分别成为N、O、S元素的代言人。回答下列问题:
(1)N、O、S三种元素的第一电离能由小到大排序为______。
(2)氮化铬在现代工业中发挥着重要的作用。基态铬、氮原子的未成对电子数之比为______。
(3)下列说法正确的是( )
A.元素的电负性大于元素,中元素显负价
B.的键能强于的键能,的热稳定性强于
C.与化合通常需要高温高压催化剂,而与化合一般只需要点燃,说明元素的非金属性强于元素
D.在冰醋酸中的酸性强于,说明的非金属强于元素
(4)已知与的结构相同,在中的化合价为______,的化合价为______。
(5)N、O和S元素位于周期表的______区,此区元素的价层电子排布特点是______。
18.(10分)燃煤火电厂产生的尾气(主要成分为)可以按如下流程脱除或利用已知:混合气体可直接排入空气请回答:
(1)写出过程Ⅰ中转化成反应的化学方程式______.
(2)下列说法正确的是( )
A.煤的主要成分是碳单质
B.过程Ⅰ中的作用是还原剂
C.将副产品硫酸锌送往浸出车间电解可回收金属锌和产生可循环使用的硫酸
D.过程Ⅱ中的也可用代替
(3)写出过程Ⅱ中与混合液反应的化学反应方程式______。
(4)的水溶液可以使品红褪色,其褪色原理如下
该反应的反应类型为______.
(5)设计实验方案检验过程中硫元素是否完全被氧化______。
19.(10分)磷是重要的元素,能形成多种含氧酸和含氧酸盐。请回答下列问题:
(1)已知(次磷酸)是一元中强酸,写出溶液与足量溶液反应的离子方程式:______。
(2)25℃时,向一定体积的亚磷酸溶液中滴加等物质的量浓度的溶液,混合液中含磷粒子的物质的量分数与溶液的关系如图所示。
①代表含磷粒子为______。
②的为______。
(3)过量含磷物质的排放会致使水体富营养化,因此发展水体除磷技术非常重要。磷酸铵镁结晶法回收废水中的磷是近几年的研究热点。其原理为:。
①时,磷去除率与初始溶液中的关系如题图1所示。为达到最佳除磷效果,并节约试剂,______。
②一定,磷去除率随溶液初始变化如图2所示。则最佳除磷效果的范围是______*,并说明原因______。
20.(12分)氢能是一种极具发展潜力的清洁能源,水煤气变换是一种常用的制氢方法,
其反应原理为:
已知:(ⅰ)
(ⅱ)
(ⅲ)
(1)反应的______。
(2)恒定总压和水碳比投料,在不同条件下达到平衡时和的分压(某成分分压总压该成分的物质的量分数)如下表:
条件1 0.30 0.30 0
条件2 0.32 0.26 0.02
①在条件1下,水煤气变换反应的分压平衡常数______。
②对比条件1,条件2中产率下降是因为发生了一个不涉及的副反应,写出该反应方程式______。
(3)科学家在水煤气变换中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。该反应历程图如下,其中吸附在催化剂表面的物种用“*”标注,TS指过渡态,部分产物用球棍模型表示。
与反应历程对应的微观示意图部分如下:
①该历程的决速步骤方程式为______。
②下列说法正确的是( )
A.过程Ⅱ既有化学键的断裂也有化学键的形成
B.过程Ⅲ的熵变为零
C.低温下实现高反应速率是因为该催化过程降低了水煤气变换反应的
D.过程Ⅳ的微观图示为:
(4)实验发现,其他条件不变,在相同时间内,向反应体系中投入一定量的可以增大的体积分数,其实验结果如图所示:
投入等质量的纳米比微米使的体积分数增大的原因可能是______。
21.(10分)三草酸合铁酸钾晶体一种感光剂和高效的污水处理剂。其制备流程如下
已知:易溶于水,难溶于乙醇
请回答下列问题:
(1)过程Ⅱ、Ⅲ在如下图所示装置中进行,过程Ⅱ中发生的反应为
。
①装置中盛放溶液的仪器名称为______。
②该过程需控制反应溶液温度不高于40℃的原因是______。
③制备过程中始终通入的主要作用是______。
(2)可用酸性标准液滴定样品中含量来测定晶体样品纯度。
①标准溶液滴定样品溶液前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏蒸馏水洗涤____________排除滴定管中气泡____________开始滴定
a.用标准溶液润洗2至3次
b.记录起始读数
c.调整标准液液面至零刻度或零刻度以下
d.装入标准液至碱式滴定管零刻度以上
e.装入标准液至酸式滴定管零刻度以上
f.用溶液润洗2至3次
②滴定终点的现象为:滴入最后半滴标准溶液,锥形瓶内溶液颜色______具半分钟内不变色。
③准确称取三草酸合铁酸钾晶体,配制成溶液,每次量取待测液,用浓度为的酸性溶液滴定,三次平行实验记录溶液数据如下:
序号 1 2 3
滴定前读数 0.98 1.26 1.01
滴定后读数 21.00 20.12 20.99
则该次实验制得的三草酸合铁酸钾晶体纯度为______%。
(3)下列有关上述实验说法正确的是______。
A.过程Ⅰ中的系列操作为过滤、洗涤、烘干
B.过程Ⅱ中若氧化不充分,会导致测定的样品纯度偏低
C.过程Ⅴ中加入乙醇的目的是降低的溶解度
D.滴定过程发现,开始滴入标准液,紫红色褪去慢,滴入一定量后,紫红色很快褪去,原因可能是反应生成的对滴定反应起催化作用
杭州市2023-2024学年高二上学期期末学业水平测试
化学参考答案
一、选择题(本题共16小题,每小题3分,共48分。每个小题只有一个正确答案)
题号 1 2 3 4 5 6 7 8
答案 A A C B D C C B
题号 9 10 11 12 13 14 15 16
答案 C A D C B C B A
二、非选择题(本大题共5小题,共52分)
17.(共10分)
(1)S
18.(共10分)
(1)
(2)BCD (3)
(4)加成或者化合。
(5)取少量固体溶于水配成溶液,取该溶液滴入适量酸性溶液,若溶液褪色,则未完全氧化;若不褪色,则说明完全氧化。(2分,其他合理方案均可)
19.(共10分)
(1)
(2)① ②
(3)①
②9~10或者9.5左右;过小,溶液与结合,导致溶解,磷去除下降;过大,溶液中与和反应,导致溶解,磷去除率下降;
20.(共12分)
(1)
(2)①0.5 ②
(3)①或者
②AD
(4)纳米具有更大的表面积,与气体反应速度更快,可以促使反应平衡右移,更快的空出催化剂的吸附位点(表面),加快化学反应。
21.(共10分)
(1)①分液漏斗 ②防止分解
③搅拌反应体系,增大反应物的接触面,加快反应速率或者防止浓度局部过高,氧化
(2)①ae(1分,错排不给分)cb(1分,错排不给分)
②由无色变浅红色
③81.83%
(3)CD
同课章节目录
